Method Article
형광 기반의 칼슘 동원 분석에 의해 G 단백질 결합 수용체의 특성
요약
여기에 설명 된 형광 기반의 칼슘 동원 분석은 고아 G 단백질 결합 수용체 (GPCR에)의 기능 활성화 리간드 (들)의 식별을위한 중간 처리 역 약리학 심사 시스템입니다.
초록
20 년 이상, 역 약리학 고아 G 단백질 결합 수용체 (GPCR에)의 활성화 리간드를 발견 할 수있는 탁월한 전략이었다. 역 약리학 분석의 시작은 세포 발현 시스템에 대한 관심이 GPCR의 복제 및 후속 형질이다. 이종 수용체 발현이어서 수용체 활성화 리간드 (들)을 식별하는 후보 리간드 화합물 라이브러리와 도전. 수용체의 활성화는 칼슘이나 캠프 같은 두 번째 메신저 기자 분자의 농도의 변화를 측정하여 평가 될 수있다. 여기에 설명 된 형광 기반의 칼슘 동원 분석은 자주 사용하는 중간 처리는 약리학 분석을 역입니다. 고아 GPCR은 일시적으로 인간 배아 신장 293T (HEK293T) 세포에서 발현하고 무차별 Gα 16 구조는 공동 형질이다. 리간드 결합에 따라, Gα 16 서브 유닛의 활성화는 칼슘 F의 출시를 유도소포체를 롬. 이전 리간드 검사로, 수용체를 발현하는 세포는 형광 칼슘 지표, 플루오 (Fluo)-4 아세로드됩니다. 플루오 (Fluo) -4의 형광 신호는 휴식 조건 하에서 세포에서 무시할 만 수용체 활성화 후에 릴리스 된 칼슘 이온과의 상호 작용에 따라 100 배 이상 증폭 될 수있다. 설명 된 기술은 형질의 유전 물질은 숙주 세포 게놈에 통합되는 안정하게 형질 감염된 세포주의 시간 소모적 확립을 필요로하지 않는다. 대신에, 일시적 형질 감염은, 표적 유전자의 일시적 발현을 생성 스크리닝 검사를 수행하기에 충분하다. 설정은 화합물의 수백의 중간 처리량 검사를 할 수 있습니다. 대부분의 GPCR에 결합에 관계없이 내생 정의 기본 신호 전달 경로의 세포 내 신호 전달 경로는 칼슘의 출시로 리디렉션 할 수 있습니다 무차별 Gα (16)의 공동 형질INGS. HEK293T 세포는 취급이 용이하고 수용체 deorphanization의 분석에 수년에 걸쳐 그 효능을 입증했다. 그러나, 특정 수용체에 대한 분석의 최적화가 필요 남아있을 수 있습니다.
서문
G 단백질 결합 수용체 (GPCR에)는 모든 세포 표면 단백질 중 가장 규모가 크고 다양한 가족 중 하나를 구성한다. 척추 동물의 존재는, 무척추 동물, 식물, 효모, 및 점액 금형뿐만 아니라, 원생 동물 및 초기 diploblastic에서 후생 동물은 GPCR에 신호 전달 1과 연결 오래된 분자 사이에 있음을 나타냅니다. 자연 활성화 리간드는 펩티드, 생체 아민, 방향제, 당 단백질, 광자 2 등의 외부 자극의 넓은 다양성을 포함한다. 따라서, 이러한 수용체 리간드 신호 전달 시스템은 생리 학적 과정의 중대한 다양성에 참여하고 있습니다. 광범위한 기능적 스펙트럼은 인간 질병의 넓은 범위를 커버 치료 약물의 개발을 위해 그들에 매우 적합한다. 현재 약물 표적의 약 50 ~ 60 %가 GPCR에 3,4로 표시됩니다. 제약 산업에서의 중요성 외에,의 GPCR은 개발에 대한 주목도 있습니다일반적으로 종 특이 살충제 5,6와 살충제의 새로운 세대. 많은의 GPCR의 자연 리간드는 여전히 미확인이기 때문에, 그들은 고아 GPCR에로 분류됩니다. 이 수용체의 deorphanization은 생물의 생리 학적 역할에 대한 이해를 개선하고 새로운 약물 응용 프로그램 7 추정되는 목표를 발견 할 수 있습니다.
게놈 시대 이후, 역방향 약리학 전략은 광범위의 GPCR 8 deorphanization 적용된다. 접근 방식은 고아 수용체는 '물고기 중'에 '훅'생물학적 추출물에서 합성 화합물 라이브러리에서의 활성화 리간드로 사용되는 것을 의미한다. 관심의 GPCR 따라서 복제 된 이후에 세포 발현 시스템에 형질 전환됩니다. 가장 일반적으로 사용되는 방법에서, 수용체 활성화는 제 메신저 분자의 농도의 변화를 측정함으로써 결정된다 9 . 주요 수용체 심사 분석 (예를 들어, 애큐 오린) 10 형광 칼슘 지표 (예를 들면, 플루오 (Fluo)-4) 11 칼슘에 민감한 생물 발광 단백질에 의존하고 있습니다. 수용체 발현 세포는 종래 리간드 스크리닝에 형광 칼슘 지표와 함께로드되는 형광 계 분석은, 그들이 의한 사용, 짧은 판독 시간의 용이성을 고 처리량 스크리닝을 할 수있는 장점과 스크리닝의 유연성을 가지고 하나의 판 (12)에 다수의 고아 수용체.
여기서, 형광 계 칼슘 이동 분석법 철저히 설명 및 초파리 melanogaster의 짧은 신경 펩티드 F (sNPF) 수용체 deorphanization 공정에 의해 도시된다. 이 neuropeptidergic 시그널링 시스템은 원래 메르 탕 등에 의해 분석되었다. 2002 중국 햄스터 난소 (CHO) 세포에서 수행 칼슘 생물 발광 분석법으로 1314으로는 펭 등. 2003 년에 사용하는 전기 생리학 분석에 Xenopus의 15을 난자. sNPF 시그널링 시스템의 존재는 그것이 수유, 성장, 스트레스 반응, 운동, 및 16 시간주기 리듬의 조절을 포함하여 다양한 프로세스에 연루되어 절지의 문에 한정되는 것으로 보인다.
곤충 neuropeptidergic 신호 시스템에 대한 연구는 살충제의 개발을위한 새로운 표적으로 이어질하지 않을 수 있습니다, 그러나 그들의 기능에 대한 지식도 많은 신호 시스템은 일반적으로 잘 발전 17에 걸쳐 보존 된 다른 유기체으로 추정 할 수있다. 지난 10 년, 큰 진전은 곤충의 신경 펩타이드의 GPCR의 deorphanization 과정에서했다. 이러한 노력에도 불구하고, 수용체의 단지 소수 그들의 동족 리간드에 일치하고, 서열 정보의 부하되었습니다새로운 고아 GPCR에 의한 게놈 (18)의 호황에 사용할 수있게되었다. 널리 적용 기술 9,18 것으로 입증되었습니다 형광 기반의 칼슘 이동 분석 등 중간 / 높은 처리량 검사 방법의 가용성은, 따라서 매우 중요한 이점입니다.
여기에서 설명한 바와 같이 형광 계 칼슘 동원 분석은 인간 배아 신장 293T (HEK293T) 세포주에서 수행 및 수용체 활성화에 따라 세포 내 칼슘 농도의 변화를 결정하기 위해 형광성 프로브를 사용한다. 고 발현 및 수용체의 번역 수준을 보장하기 위해, 코작 컨센서스 서열 (19)이어서, 발현 벡터 (포유 동물 세포주 예컨대, pcDNA 벡터 벡터 시리즈)에 복제되고 수용체 - 코딩 서열의 5 '말단에 첨가된다. 그것은 순서 정보에 기초 고아 GPCR의 내생 G 단백질 - 커플 링을 예측하기 어렵 기 때문에혼자, 수용체 활성화 한 후 변조 된 두 번째 메신저 분자 (예를 들면, 칼슘 또는 캠프)는 종종 이전의 리간드 식별 알 수없는 남아 있습니다. 이 문제를 회피하기 위해 대부분의 GPCR과 상호 작용 G의 Q 제품군 (예를 들어, 쥐의 Gα 15 [여기에 사용] 인간의 Gα 16) 또는 키메라 G 단백질 (예를 들어, Gα의 qi5)의 무차별 G 단백질은 칼슘의 방출을 유도 할 수있다 20,21,22 공동으로 표현 될 수있다. 그 수용체에 대한 리간드의 결합시, GPCR은 특정 세포 내 경로의 활성화에 이르게 형태 적 변화를 겪는다. Gα 16 서브 유닛에 휴식 상태에서 바인딩 구아노 신이 인산 (GDP) 분자는, 구아노 신 삼인산 (GTP) 분자에 의해 대체 될 것이다. 이것은 Gα 16 Gβγ 서브 유닛 heterotrimeric G 단백질의 해리를 유발. Gα 16 서브 유닛은 포스 포 리파제 C &를 활성화# 946; 다시 막 결합 디아 실 글리세롤의 결과로 포스파티딜 이노시톨의 비스 포스페이트 (PIP 2) (DAG)과 이노시톨 트리스 포스페이트 (IP 3) 가수 분해 (PLCβ). IP 3는 세포질에 걸쳐 확산과 세포질에 칼슘의 방출을 유도 소포체의 막에 존재하는 IP 3 의존적 칼슘 채널을 활성화합니다.
수용체 활성화에 따라 칼슘 릴리스 초 이내에 발생 플루오 (Fluo)-4 아세 (AM) 11처럼 칼슘에 민감한 염료로 심사 분석하기 전에 세포를로드하여 검출 할 수있다. AM 에스테르 그룹은 세포막을 통과 할 수 있도록 형광을 일단 셀 내부의 세포질 에스 테라 제에 의해 분해 오프된다. 결과적으로, 형광 염료의 음전하가 세포 밖으로 확산 해 칼슘 이온과 상호 작용할 수 있도록에서 예방, 마스크 해제된다. 형광 신호 O플루오 (Fluo) 4-F는 나노 몰 범위의 칼슘 농도를 함유 휴식 조건 하에서 세포에서 무시할 수있다. 칼슘 수용체 활성화에 놓으면 그러나, 신호는 이로써 큰 신호 대 잡음비를 보장 이상 100 배 농도에 의존적으로 증가 할 수있다. FLUO-4는 또한 세포의 광범위한 생리 학적으로 중요한 칼슘의 변화를 측정하기에 적합하게, 345 ㎚의 K에 D (칼슘)의 주위 [칼슘]를보고하기위한 큰 동적 범위를 나타낸다. 플루오 (Fluo) -4의 여진은 488 nm에서 발생 및 방출 525 nm의 형광 (11)에서 측정된다. 형광 이미징 플레이트 판독기 (FLIPR) 23 NOVOstar, 또는 FlexStation (스테이션 장치) (12) 등 Fluorimeters마다 잘 동시 화합물의 추가 및 수용체 활성화에 따라 플루오 (Fluo)-4 신호의 검출을 허용 중간 / 높은 처리량 시스템입니다 분석 플레이트에. 여기에 설명 된 칼슘 동원 분석은 역에 의존장치 96 - 웰 마이크로 플레이트 시스템.
소프트 맥스 프로 소프트웨어 (소프트웨어) 데이터 분석뿐만 아니라 기지국 장치를 작동하기 위해 사용된다. 이 프로그램은 바로 96 - 웰 형식의 그래프로 결과를 표시합니다. 다중 웰은 동일한 그래프 상에있는 웰의 결과를 비교하는 동시에 선택 될 수있다. 각 열에있는 웰의 상대적인 형광 단위 (RFU) 값은 동시에 웰에 화합물의 첨가 전에 시작 및 수용체 활성화 다음 형광 신호의 측정을 계속 한 후, 2 분 동안 측정된다. 활성화 화합물은 형광 신호의 급격한 증가의 결과로, 세포에 첨가 될 때까지 일반적으로 작용제 커브의 경향은 기준선과 정렬. 피크 높이가 잘 최종 작용제 농도와 상관된다. 피크 후, 형광 신호는 천천히 기준선 수준으로 떨어진다. RFU 측정 캘리포니아N 리간드의 EC 값을 50 (반 최대 유효 농도)을 결정하는 농도 - 반응 곡선으로 변환 될 수있다. 일반적으로, 적어도 세 개의 독립된 화면, 농축 일련의 세 개의 복제본을 포함하여 각각 안정적인 농도 - 반응 곡선을 작성하도록 수행되어야한다.
그것은 실험 설계에 몇 가지 긍정적이고 부정적인 컨트롤을 포함하는 것이 좋습니다. 우선, 형질 전환 제어는, 공지 리간드와 수용체의 이행 즉, 테스트되어야한다. 이는 형질 에이전트가 작동되었는지 여부를 검증한다. 세포주 및 음성 대조군 (예를 들어, 세척 완충액)의 내생 수용체 작용제와 대조 실험의 혼입은 또한 세포의 건강과 생존을 모니터링하고 세척 버퍼가 오염되었음을 가능성을 배제하기 위해 권장 자동 fluore을 유도 할 수있는 요인향기 응답. 자주 사용하는 작용제는 아세틸 콜린 수용체를 활성화 PAR 1 선택적 작용제, 또는 카바 콜, 역할을하는 단백질 분해 효소 활성화 수용체 1 (PAR 1)에서 파생 된 펩타이드이다. 비어있는 발현 벡터로 형질 전환 된 세포는 또한 활성 화합물은 세포의 내생 적 수용체와 상호 작용하는 것을 제외하도록 테스트되어야한다. 아래의 프로토콜에 설명 된 여러 매개 변수의 최적화는 다른 신호 시스템에 요구 될 수있다. 완전한 형광 계 칼슘 동원 분석의 개략도는도 1에 도시된다.
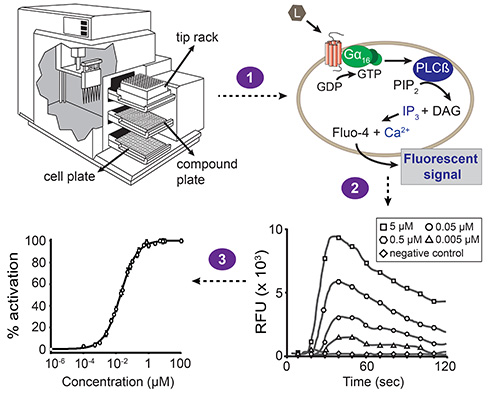
형광 기반의 칼슘 동원 분석의 그림 1. 전체 계획. 자동화 된 액체 취급과 동시에 형광 측정은 역으로 수행소프트웨어에 의해 구동되는 장치 마이크로 플레이트 리더. 셀 플레이트 하나, 복합 플레이트와 팁 랙 : 역 장치는 세 개의 서랍이 포함되어 있습니다. 빌드 - 피펫 전송 복합 플레이트의 한 열에서 셀 플레이트 (1 단계)의 해당 열에 화합물. 셀 플레이트의 각 웰 관심의 GPCR과 무차별 Gα 16 서브 유닛과 협력 형질 전환 된 HEK293T 세포의 단층이 포함되어 있습니다. 화합물이 수용체를 활성화하면, Gα 16 바인딩 GDP가 GTP로 대체됩니다. Gα 16 서브 유닛은 이후 Gβγ 복잡한에서 해리 차례로 포스파티딜 이노시톨의 비스 포스페이트 (PIP 2) 디아 실 글리세롤 (DAG)과 이노시톨 트리스 포스페이트 (IP 3)의 결과로 가수 분해 포스 포 리파제 Cβ (PLCβ)를 활성화합니다. IP 3는 칼슘 INT의 방출을 유도, 소포체의 막에 존재하는 IP 3 의존적 칼슘 채널을 활성화세포질 오. 플루오 (Fluo) -4 (세포가 첨가 화합물을 사전로드되는)과 함께 칼슘의 상호 작용은 형광 신호 (단계 2) 초래한다. 소프트웨어는 상대적 형광 단위의 시간의 함수 (RFU) 값과 같은 결과를 제시하고, 피크 높이가 농도 의존적으로 리간드의 농도와 상관 관계. 이러한 데이터는 리간드 - 수용체 쌍 (단계 3)의 EC (50)의 값을 결정하는 농도 - 반응 곡선으로 변환 될 수있다.
프로토콜
주 : 세포가 관여되는 모든 동작은 층류에서 작동하여 무균 환경에서 수행되어야한다.
HEK293T 세포 라인의 1. 유지 보수
- 5 % CO 2 배양기에서 37 ° C에서 T-75 플라스크에 HEK293T 세포를 성장.
- 통로 80 % 합류점에 도달 한 세포. 참고 :이 일반적으로 3 4 일이 소요된다. 연속 배양 세포는 검사에 대한 20 ~ 25 사용할 수있는 통로를 허용합니다.
- 칼슘, 염화 마그네슘, PBS-트립신-에틸렌 디아민 테트라 아세트산 (EDTA)없이 둘 베코 인산염 완충 식염수 (PBS)를 넣고 성장 배지 (500 ㎖ (500 ㎖ PBS 10 ml의 트립신-EDTA 용액 및 4.5 ml의 4 % EDTA로 보충) 둘 베코의 수정 독수리의 매체 - 높은 포도당 [DMEM] 미리 실온에서 10 % 소 태아 혈청 [FBS] 1 mM의 페니실린 - 스트렙토 마이신 [PS]) 반 시간으로 보충.
- 제거세포에서 기존의 성장 매체. 3 ㎖ PBS와 죽은 세포를 씻어 다시 PBS를 제거합니다.
- , 3 ㎖ PBS-트립신-EDTA를 추가 실온에서 1 분 동안 배양 및 솔루션 제거 참고 : 세포의 형태가 변경됩니다 별 모양의 구상 할 수 있습니다.
- 부드러운 터치하여 플라스크의 바닥에서 세포를 풀고 새로운 성장 배지 10 ㎖로 바닥을 여러 번 세척하여 세포를 수집합니다.
- 14 ML에게 신선한 성장 매체를 포함하고, 5 % CO 2 배양기에서 37 ° C에서 부화 새로운 T-75 플라스크에 전송 세포 배양 1 ㎖.
HEK293T 세포의 2. 과도 형질
- 삼일 실제 칼슘 동원 분석하기 전에 T-75 플라스크에 HEK293T 세포를 성장 일어난다. 반드시 세 개의 T-75 플라스크, 수용체의 구조, 빈 발현 벡터, 부정적인 제어, O를 가진 형질 전환을위한 하나 형질 전환을 위해 하나를 사용할 수 있도록형질 제어 네브라스카. 주의 : 단계 1.2에 설명 된대로 세포의 계대가 수행된다. 여러 개의 96 - 웰 플레이트가 상영 할 때, T-150 플라스크 (단계 1.2.5, 2.3, 3.1.3 및 3.1.4에서이 작업을 수행하는 두 번 나열된 모든 수량) 세포의 높은 수율을 얻을하는 데 사용할 수 있습니다 .
- 세포 배양은 50-70% 합류에 접근 할 때까지 20 ~ 24 시간 동안 5 % CO 2 배양기에서 37 ° C에서 플라스크를 품어.
- 그와 Gα (16) 구조의 GPCR, 빈 벡터와 Gα 16 구성체 제 플라스크 및 형질 제어 및 Gα 16 구성체 제를 코딩하는 발현 벡터로 세포의 공동 형질 한 인구. 참고 :이 프로토콜에서는, 초파리 sNPF 수용체는 한 pcDNA3.1 포유 동물 발현 벡터 (13)에 클로닝 하였다. JetPRIME은 형질 감염을 수행하는데 사용되었지만, 다른 형질 감염 시약도 이용 될 수있다.
- 에 추가7.8 μg DNA (3.9 μg 수용체의 구조 또는 빈 벡터, 3.9 μg Gα 16 식 구조) 1.5 ML microcentrifuge 관 및 JetPRIME 버퍼 500 μl를 추가의 전 체. 튜브를 소용돌이로 교반하여 잘 혼합, 곧 스핀 다운.
- JetPRIME 시약, 소용돌이의 37.5 μl를 추가하고 X g 14,000에서 1 분 동안 스핀 다운. 실온에서 10 분간 혼합 형질을 배양한다.
- 세포 배양 배지에 형질 혼합 적하을 추가하고 문화 플라스크의 벽과의 접촉을 피하고 매체에 직접 피펫해야합니다. 20 ~ 24 시간 동안 5 % CO 2 배양기에서 37 ° C에서 플라스크를 품어.
3. 칼슘 동원 분석
- 형질 전환 세포를 수집하고 96 - 웰 블랙 벽, 분명 바닥 판에 그 씨앗.
- PBS, PBS-트립신-EDTA 및 DMEM 전달 매체 10 % 투석 된 FBS로 보충 (500 ㎖ DMEM 배치사전에 1 %의 PS) 실온에서 반 시간.
- 코트 96 - 웰 (플레이트 당 5.85 ㎖의 PBS 150 μL 피브로넥틴 [0.1 %]) 물론 당 피브로넥틴 (0.0025 %)과 PBS의 60 μl의 검은 벽, 분명 바닥 판. 에 뚜껑을 실온에서 1 시간 동안 플레이트를 배양한다. 우물에서 솔루션을 제거하고 상온에서 뚜껑없이 1 시간 동안 다시 번호판을 품어. 대안으로, 개선 된 세포 부착에 대해 미리 코팅 된 플레이트를 사용하는 것이 가능하다.
- 세포에서 기존의 성장 매체를 타고 3 ㎖ PBS와 죽은 세포를 씻어하고 PBS를 제거합니다.
- , 3 ㎖ PBS-트립신-EDTA 추가 1 분 동안 배양 한 후 솔루션을 제거합니다. 참고 :하는 구체 모양의 별 모양의 세포 변화의 형태를.
- 부드러운 터치하여 플라스크의 바닥에서 세포를 풀고 DMEM 전달 매체의 10 ㎖로 여러 번 세척하여 그들을 수집합니다. 50 ML 팔콘 튜브에 세포를 전송합니다.
- 계산ML 당 세포의 수 (여기 NucleoCounter 수행하지만, Burker의 챔버는 수락 가능하다). 1.5 ML의 microcentrifuge 관에서 세포 배양 100 μl를 추가합니다. 100 ㎕의 용해 버퍼를 추가하고 튜브를 활용하여 혼합한다. 100 ㎕의 안정화 버퍼를 추가하고 눌러 섞는다.
- 세포 현탁액으로 NucleoCassette 채우고 카운터 세포를 센다. 용해를 추가하고, 단계 3.1.6에서 버퍼를 안정화 할 때 셀이 세 개의 인자에 의해 희석 된 것처럼, 세하여 세포의 수를 곱한다.
- 600,000 세포 / ㎖의 최종 농도로 희석하고 세포 / 웰 당 약 90,000 세포의 세포 밀도를 구하는 코팅 된 플레이트에 웰 당 150 ㎕의 세포를 시드. 공기 방울을 방지하고 연속 된 세포층을 얻기 위해 균일하게 세포를 확산 판을 누릅니다. 16 ~ 24 시간 동안 5 % CO 2 배양기에서 37 ° C에서 접시를 품어.
- 형광 염료와 세포를로드하고 공동 준비mpound 판.
- 행크의 균형 소금 솔루션 (HBSS)를 준비 / HEPES / CA 2 + / 소 혈청 알부민 (BSA) 버퍼 (증류수 1 M 염화칼슘 [dH보다 2 O] - 실온에서 보관) 165 μL 염화칼슘 재고 솔루션을 추가, 500 μL의 HEPES 원액 (1 M HEPES dH보다 2 O, pH를 7.4 - 실온에서 저장), 50 ㎖의 HBSS에 0.05 g의 BSA. 지방산은 그 수용체의 칼슘 신호를 손상, 특정 수용체를 활성화 할 수있는 그 지방산 무료 BSA는, 칼슘 분석에 사용됩니다.
- 프로 베네 시드 용액 (100 배, 250 mm)를 준비 5 ㎖의 수산화 나트륨 (1 M)에 0.71 g의 프로 베네 시드를 녹여 50 μL의 HEPES 원액과 HBSS / HEPES / CA 2 + / BSA 버퍼의 5 ML을 추가합니다 - 항상 신선한 솔루션을 준비합니다. 주 : 프로 베네 시드함으로써 형광 신호를 감소 세포질 플루오 (Fluo) -4을 제거 할 수 무기 음이온 트랜스 포터를 억제한다. 그것은 염료 로딩을 수행하는 것이 좋습니다프로 베네 시드의 존재와 부재는 프로 베네 시드도 효능 - 매개 신호를 줄 수있는 무기 음이온 트랜스, 조사중인 특정 세포 라인에 잠재적 인 문제를 발생 여부를 확인합니다.
- 세척 버퍼를 준비, 50 ㎖의 HBSS / HEPES / CA 2 + / BSA 버퍼 500 μL 프로 베네 시드 솔루션을 추가 7.4로 pH를 조정하고 완충 용액을 여과. 항상 신선한 버퍼를 준비하고, 플레이트가 필요합니다 당 50 ㎖의 버퍼.
- 10 % 플루로 닉 산의 솔루션을 준비 : 50 μL의 DMSO 50 μl를 혼합 플루로 닉 산 (디메틸 설폭 사이드의 20 % W / V [DMSO]) - 결정화가 발생하는 경우, 열이 37 ° C에 항상 신선한 솔루션을 준비합니다.
- 플루오 (Fluo) - 오전 4 용액 (1mM의를) 준비가 완전히 용해 될 때까지 50 μg 플루오 (Fluo) -4 오전 소용돌이가 들어있는 유리 병에 44 ㎕의 10 % 플루로 닉 산 용액을 추가합니다. 형광 표백을 방지하기 위해 빛에 노출을 피하십시오.
- 로딩 버퍼를 준비 추가 8.8 ML DMEM supplemente10 mM의 HEPES 및 플루오 (Fluo) - 오전 4 용액 (44 μL)와 소용돌이에 2.5 밀리미터 프로 베네 시드 (산도 7.4)와 D. 항상 신선한 버퍼를 사용합니다.
- 세포에서 배지를 버리고, 웰 당 200 ㎕의 PBS로 세포를 씻어 PBS를 제거합니다.
- 물론 당 55 μL 로딩 버퍼를 추가하고 실온에서 1 시간 동안 배양한다. 빛에 대한 판의 노출을 방지하기 위해 알루미늄 호일 접시를 감싸십시오.
- 그들은 세포 발현 시스템에 대한 손해 (예를 들면, 아세토 니트릴) 솔벤트에 용해하는 경우 화면 전에 화합물을 건조해야합니다.
- 실리콘 처리 1.5 밀리리터의 microcentrifuge 튜브 세척 버퍼에 펩티드를 가용화. 농도 - 반응 분석을 수행하고, 리간드의 EC (50)의 값을 결정하기 위하여 일련의 희석을 준비한다. 복합 플레이트 (V-모양의 96 - 웰 플레이트)의 잘 대응에 리간드의 70 μl를 추가하고 각 접시에 긍정적 인 (내인성 작용제) 및 음성 대조군 (세척 버퍼) 등이 있습니다. 아니 E : 화합물을 세척 완충액에 용해되지 않으면, 하나는 물이나 기름 등 불용성 물질 (예 Kolliphor EL)를 유화 및 가용화 용액으로서 조사중인 셀에 대해 유해하지 않은 다른 용매를 시도 할 수있다 .
- 세중의 모든 샘플을 측정한다. 복합 플레이트에서 리간드의 50 μL가 분석하는 동안 셀 플레이트 100 μL 세척 버퍼로 잘으로 전송됩니다 것을 명심하십시오, 그래서 자신의 원하는 최종 농도를 3 배에서 화합물을 제조.
- 휴대 판에서 로딩 버퍼를 취소하고 각 웰에 100 μL 세척 버퍼를 추가합니다. 실온에서 15 분간 플레이트를 부화 및 빛에 노출되는 것을 방지.
- 셀 플레이트에서 세척 버퍼를 취소하고 각 웰에 100 ㎕의 새로운 세척 버퍼를 추가합니다.
- 37 ℃에서 15 분 동안 세포 판, 복합 판 및 팁 랙 (96 - 웰, 역 장치 피펫 팁을) 품다
- 만들고 소프트웨어로 원하는 프로토콜 파일을로드하고 판독 챔버위한 온도 제어 장치를 활성화. 다음, 525 nm에서 (전체 96 - 웰 플레이트 약 25 분 소요 측정) 연속 측정 값 사이에 1.52 초 간격으로 한 번에 2 분 하나의 행에 대해 37 ° C에서 칼슘 반응을 측정한다. 488 nm의 플루오 (Fluo)-4의 여기를 설정하고 26 μL / 초 설정 분배 속도와 135 μL의 피펫 높이, 셀 플레이트, 읽기 시작 후 18 초에 화합물의 50 μL의 총 부피를 전송합니다.
- 역 장치의 적절한 서랍의 화합물과 세포 플레이트 및 팁 랙을 배치합니다.
- FLEX 모드에서 실제 화면을 시작하기 전에, ENDPOINT 모드에서 동일한 여기 및 방출 파장에서 셀 플레이트의 단일 읽기를 수행한다. 참고 :이 측정은 상대 형광 단위에게 (RFU) 값을 제공하고 우리 사이의 변화를 감지 할 수 있습니다판의 LLS. 20,000 40,000 사이의 값은 허용으로 간주됩니다.
- 분석을 시작하고 소프트웨어를 사용하여 데이터를 분석 할 수 있습니다.
결과
50 μM에서 0.001 nm의에 이르기까지 집중 시리즈는 네 초파리의 sNPF 펩티드 (: AQRSPSLRLRFamide 스, Drome-sNPF-2 : SPSLRLRFamide, 드롬 - sNPF-3 : PQRLRWamide 스, Drome-sNPF-4 : PMRLRWamide 드롬-sNPF-1)에 대한 검사를했다 일시적으로 초파리의 sNPF 수용체와 무차별 Gα 16 서브 유닛을 표현 HEK293T 세포에. GPCR은 0.1 ㎚에 최대 최종 농도에서 모든 네 펩티드에 의해 활성화 및 수용체 활성화는 농도 의존적이었다.도 2 드롬-sNPF-1 농도의 일련의 세 개의 복제본 중 하나에 대응하는 그래프를 도시한다. (- 1 μM PAR 1)의 강력한 활성화를 유도 내인성 단백질 분해 효소 활성 (30,000 RFU ±) 높은 형광 신호로 이어지는 수용체 1을 음성 대조군 (버퍼를 씻어) 양성 대조군 반면, 형광 신호를 유도하지 않았다. 유의할 그 편차일반적인 곡선 이상을 나타낼 수 있습니다. 예를 들어, 기준선으로 돌아 가지 않고 곡선의 지속적인 상승 칼슘 ionophores의 존재, 또는 칼슘 누액 중단 지질 이중층과 같은 비 - 수용체 - 매개 신호들에 관련이있을 수있다.
이 소프트웨어는 활성화의 비율이나 다른 사람의 사이에서 서로 다른 농도의 표준 오차를 결정하는 수식을 입력 할 수 있습니다. 도 3에서 4 개의 드롬-sNPF 펩티드 대해 도시 된 바와 같이 생성 된 데이터는, EC (50)의 값을 추정하기 위해 예비 농도 - 반응 곡선을 작성하는 데 사용된다.도 3의 곡선은 또한 대조군 농도 시리즈에 대한 데이터를 포함 드롬 - sNPF 펩티드 빈 한 pcDNA3.1 벡터로 형질 전환 된 HEK293T 세포에서 테스트되었습니다. 결과는 이들 세포에 대한 펩티드의 첨가가 내인성 수용체에 대해서는 효과가 없다는 것을 나타낸다 있지만 실제로 액티브관심의 수용체를 먹었다. 형광 기반의 칼슘 동원 분석은 다음 세 번 독립적으로 반복되었다. 초기 화면의 예비 농도 - 반응 곡선에 따라, 시험 된 농도 곡선의 동적 범위 (도 4)를 커버하도록 하였다. 드롬-sNPF-1 (2.04 ± 1.48 nM의 95 % 신뢰 구간), 드롬 - sNPF-2 (5.89 ± 3.74 NM), 드롬 - sNPF-3 (5.55 ± 3.95 NM)와 드롬 - sNPF -의 EC50 값 4 (0.50 ± 1.01 NM)가 수용체를 활성화 동등하게 강력한 것을 나타내는 유사하다.
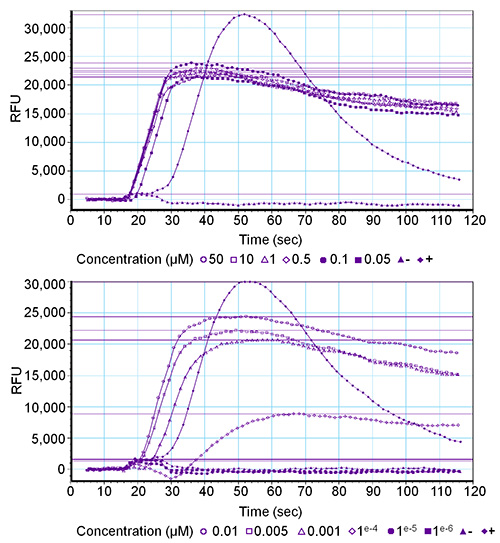
농도 시리즈 (50 μM에서 0.001 nm의에 이르기까지). 십이 최종 농도 O의 수용체 매개 형광 반응에 대한 소프트웨어의 그림 2. 그래픽 출력F 드롬-sNPF-1 펩티드 드롬 - sNPF 수용체에서 테스트되었다. 정품 인증은 상대 형광 단위 (RFU) 값으로 표현된다. 상부 그래프는 여섯 높은 농도의 결과 및 육 낮은 농도의 하부 그래프를 제공한다. (-) 세척 버퍼입니다 양성 대조군 (+)의 1 항 (1 μM) 및 음성 대조군입니다.
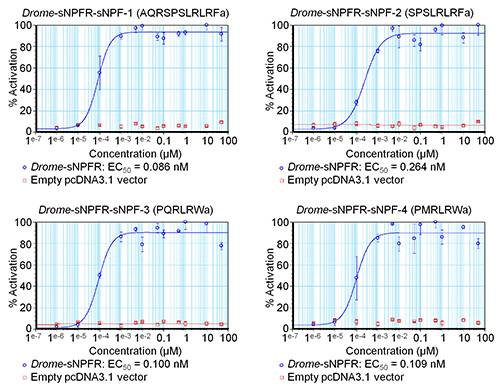
도 3. 단일 형광 계 칼슘 이동 분석에 의해 결정 초파리 sNPF 펩티드 예비 농도 - 반응 곡선. 일시적 네 초파리 sNPF 펩티드위한 HEK293T 세포에서 발현 초파리 sNPF 수용체의 농도 - 반응 곡선은 파란색으로 나타내었다. (빨간색으로 표시) 음성 대조군의 경우, 펩티드 HEK293T에서 테스트되었습니다빈 한 pcDNA3.1 벡터로 형질 세포. 형광 반응은 가장 높은 값 (100 % 정품 인증)를 기준으로 (%)로 표시됩니다. 곡선은 각 농도 일련 중으로 측정되는 한 실험의 결과이다. 수직 막대는 (그 경우에만 심볼이 도시된다), 때로는 사용 된 기호보다 작은 평균 (SEM)의 표준 오차를 나타낸다.
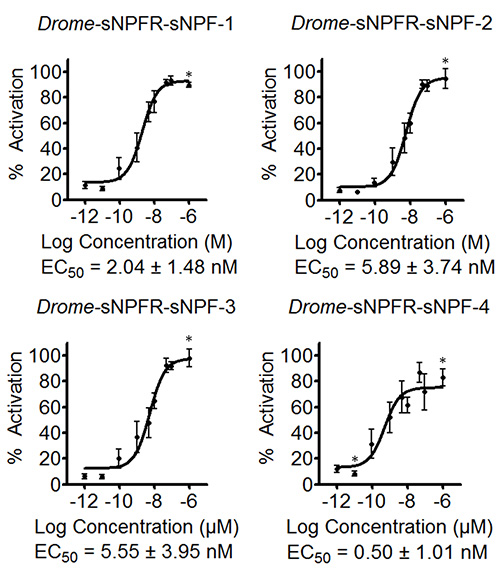
도 4. 농도 - 반응 곡선 및 세 개의 독립적 인 형광 계 칼슘 이동 분석법에 의해 결정 초파리 sNPF 펩티드의 EC 50 대응 값. 일시적 네 초파리 sNPF 펩티드위한 HEK293T 세포에서 발현 Drosopihla sNPF 수용체의 농도 반응 곡선은 결과이다 세 개의 독립된 날asurements 각 세중 수행 (N ≥ 9). 형광 반응은 가장 높은 값 (100 % 정품 인증)를 기준으로 (%)로 표시됩니다. 별표 N ≤ 9. 오차 막대는 때때로 (그 경우에만 기호가 그려져있다) 사용되는 기호보다 작은 SEM을 표시하는 농도를 나타냅니다. EC 50 값은 자신의 95 % 신뢰 구간으로 표시됩니다.
토론
형광 계 칼슘 동원 분석은 성공적 이미 메르 탕 등에 의해 수행 된 초파리 sNPF peptidergic 시그널링 시스템의 기능적 특성을 확인하기 위하여 적용되었다. 생물 발광 분석과 및 펭 외 의해. 전기 생리학 분석 13, 15과. 드롬-sNPF-; FLUO = 2.04 nm의 르미 = 51 nM의 : HEK293T 세포의 형광 분석으로 수득 EC 50 값에 대한 CHO 세포 (드롬-sNPF-1에서 수행 생물 발광 분석법으로 얻어진 것 이상을 10 배량 아르 2 : 형광 측정법 = 5.89 nm의, 루미 = 42 nm의; 드롬 - sNPF-3 : 형광 측정법 = 5.55 nm의, 루미 = 31 nm의; 드롬 - sNPF-4 : 형광 측정법 = 0.50 nm의, 루미 = 75 NM). 이러한 변화는 사용 된 발현 시스템의 하나가 주어진 수용체의 기능적 발현에보다 적합 할 수도 있고, 몇몇 수용체의 폴딩 C에서 비효율적 일 수 있다는 사실을 포함한 여러 요인에 의해 설명 될 수있다ertain의 세포 유형. 일반적으로 생체 내에서 그들의 펩티드 - 수용체 상호 작용의 생리 학적 관련성을 지원하고, 형광 및 생물 발광 분석법 둘 다 그들의 수용체에서 시험했을 때 네 드롬 sNPF-펩티드의 EC 값은 50 나노 몰 범위이다.
초파리의 sNPF 신호 시스템은 일반적으로 실험 설정의 형질 조절 때문에 활성화 리간드 알려져있는 수용체를 가진 형질 전환 제어, 여기에 제시된 화면에 포함되지 않았 음을 확인합니다. HEK293T 세포 (PAR 1) 및 음성 대조군 (세척 버퍼)의 내인성 리간드와 긍정적 인 컨트롤이 화면에 포함되었다. PAR 1의 결과는 셀이 좋은 상태에있는 것으로 나타났다. 음성 대조군 (버퍼를 씻어) 펩타이드가 용해 된 매체가 inf를 수있는 모든 오염 물질을 나타냅니다하는 형광 신호를 유도하지 않았다결과 luence.
이전 특징으로 초파리 sNPF 시그널링 시스템은 형광 계 칼슘 이동 분석을 설명하기 위해 여기에 사용 하였다. 이를 위해, 활성화 리간드의 농도 시리즈는 즉시 테스트 하였다. 고아 수용체 화합물의 수백을 포함하는 라이브러리를 테스트하기 위해 심사 분석에서 과발현를 데려 그러나, 그것은 리간드 (예., 10, 1 μM)의 상대적으로 높은 최종 농도가 초기 화면으로 추천합니다. 활성화 화합물의 검출 이후에, 그 화합물의 일련의 희석은 농도 - 반응 곡선을 작성하고 EC (50)의 값을 결정하기 위해서 스크리닝 될 수있다.
수용체의 활성화 리간드가 결정되면, 세포 내 신호 전달 경로는 상기 프로토콜을 적용하여 조사 할 수있다. 분석은 전술 한 바와 같이 수행하지만, G를 공동 형질 감염 될 수없는 ^5, 16 서브 유닛. 칼슘 응답을 측정 할 때, 즉, 수용체의 세포 발현 시스템의 내인성 Gα Q의 서브 유닛 커플. 제공된 형광 신호가 관찰되지 않으면, 다른 이차 메신저 (예. 캠프)의 농도 변화를 측정하기 위해 프로토콜이 적용될 수있다.
구조 - 활성 관계 (SAR)의 연구는 수용체 활성화에 필요한 펩티드의 코어 서열을 정의하기 위해 수행 될 수있다. 우선, 절단 된 서열은 여전히 수용체를 활성화 할 수있는 펩티드의 최소한의 아미노산 서열을 정의하기 위해 평가된다. 다음에, 펩티드는 체계적 모든 아미노산이 알라닌 잔기로 대체되어있는 시험 될 수있다. 수용체 상 합성 알라닌 - 치환 시리즈를 시험하면 수용체 활성화를위한 24, 25 아미노산의 각각의 중요도를 결정한다.
의 빈번한 사용과 검증 된 effi에도 불구하고cacy, 그것은 여기에 설명 된 분석이 관심있는 특정 수용체에 대한 최적의 결과를 얻기 위해 약간의 적응을해야 할 수도 있음을 강조해야합니다. Gα 16 서브 유닛은 대부분의 GPCR에 결합하는 장점이 있고, 또한 수용체에 지배적 인 부정적인 영향을 미칠 수 내생 Gα의 Q (22)을 통해 커플. 이 경우, 신규 한 칼슘 분석의 최적화 동안 G 단백질의 상이한 조합을 테스트하고 Gα (16)의 부재 또는 존재하에 Gα의 Q-결합 수용체에 대한 결과와 비교하는 것이 유용 할 수있다. 수용체 활성화를 감지하기 위해 상호 작용하는 G 단백질의 독립적 대체 분석법은 또한 GFP-표지 arrestin는의 전좌 또는 막 전위 (예., FLIPR 막 전위 분석 키트에 의해) 변화의 검출로서 수행 될 수있다. 플루오 (Fluo) -4 오전, 여기에 다른 칼슘에 민감한 형광의 다양한 배열, 자신의 스펙트럼과 Chemic의 각을 사용하는 외에알의 속성은 사용할 수 있습니다. 가장 적합한 형광체는 GPCR 세포 분류와 가능한 플레이트 판독기에 기초하여 선택 될 수 있지만, 실험적인 검증이 필요하다. 형질 감염된 DNA와 각 수용체 형질 감염 시약 세포주 조합을 결정하는 DNA / 형질 전환 시약 비율 필요성의 양. 마지막으로, 연속 배양 세포는 20 ~ 25 사용할 수있는 통로가 심사 분석을 수행 할 수 있음을 명심해야한다.
공개
저자가 공개하는 게 없다.
감사의 말
저자는 연구 재단 플랑드르 (FWO - 데런, 벨기에, G.0601.11) 및 KU 루뱅 연구 재단 GOA/11/002을 인정합니다. FWO - 데런에서 교제 IB, TJ와 LT 혜택을 누릴 수 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| HEK293T cells | |||
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Trypsin-EDTA solution (0.25%) | Sigma-Aldrich | T4049 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | MP Biomedicals | 195173 | |
| Dulbecco's Modified Eagle's Medium - high glucose (DMEM) | Sigma-Aldrich | D5796 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| Penicillin-Streptomycin (P-S) | Sigma-Aldrich | P4333 | |
| jetPRIME | Polyplus transfection | 114-01 | FuGENE HD Transfection Reagent (Promega); Lipofectamine LTX & Plus Reagent (Life technologies) |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392 | |
| Fibronectin from human plasma | Sigma-Aldrich | F0895 | |
| Reagent A100, Lysis buffer | Chemometec | 910-0003 | |
| Reagent B, Stabilizing buffer | Chemometec | 910-0002 | |
| CaCl2 | Sigma-Aldrich | C3881 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| HBSS buffer: Hank's Balanced Salt Solution | Sigma-Aldrich | H8264 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| NaOH (1 M) | Vel | 2781 | |
| Pluronic acid | Invitrogen | P-3000MP | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Fluo-4 AM | Invitrogen | F14201 | Fluo-3, Rhod-2, Fluo-5, Calcium Green-1, ... (Invitrogen) |
| TPP tissue culture flasks (T-75 and T-150) | Sigma-Aldrich | Z707503 and Z707554 | |
| FlexStation device | Molecular Devices | NOVOstar (BMG Labtechnologies); FLIPR (Fluorometric Imaging Plate Reader) (Molecular Devices) | |
| Black-walled polystyrene plates (96 wells) with clear bottom | Greiner Bio-One | 655090 | Corning 96-well flat clear bottom black polystyrene poly-D-lysine coated microplates |
| NucleoCassette | Chemometec | 941-0001 | |
| NucleoCounter NC-100 | Chemometec | ||
| Microcentrifuge tubes, siliconized | BioCision | BCS-2470 | |
| Polystyrene V-shaped 96-well plates | Greiner Bio-One | 651101 | |
| 96-Well, FlexStation pipette tips | Molecular Devices | 9000-0912 | |
| Soft Max Pro software | Molecular Devices |
참고문헌
- Bockaert, J., Pin, J. P. Molecular tinkering of G protein-coupled receptors an evolutionary success. EMBO J. 18 (7), 1723-1729 (1999).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21 (1), 90-113 (2000).
- Drews, J. Drug discovery a historical perspective. Science. 287 (5460), 1960-1964 (2000).
- Marinissen, M. J., Gutkind, J. S. G-protein-coupled receptors and signaling networks emerging paradigms. Trends Pharmacol Sci. 22 (7), 368-376 (2001).
- Bendena, W. G. Neuropeptide physiology in insects. Adv Exp Med Biol. 692, 166-191 (2010).
- Van Hiel, M. . B., et al. Neuropeptide receptors as possible targets for development of insect pest control agents. Adv Exp Med Biol. 692, 211-226 (2010).
- Tang, X. . L., Wang, Y., Li, D. . L., Luo, J., Liu, M. . Y. Orphan G protein-coupled receptors (GPCRs): biological functions and potential drug targets. Acta Pharmacol Sin. 33 (3), 363-371 (2012).
- Civelli, O., Reinscheid, R. K., Zhang, Y., Wang, Z., Fredriksson, R., Schiöth, H. B. G protein-coupled receptor deorphanizations. Annu Rev Pharmacol Toxicol. 53, 127-146 (2013).
- Mertens, I., Vandingenen, A., Meeusen, T., De Loof, A., Schoofs, L. Postgenomic characterization of G-protein-coupled receptors. Pharmacogenomics. 5 (6), 657-672 (2004).
- Brough, S. J., Shah, P. Use of aequorin for G protein-coupled receptor hit identification and compound profiling. Methods Mol Biol. 552, 181-198 (2009).
- Gee, K. R., Brown, K. A., Chen, W. N. U., Bishop-Stewart, J., Gray, D., Johnson, I. Chemical and physiological characterization of fluo-4 Ca2+-indicator dyes. Cell Calcium. 27 (2), 97-106 (2000).
- Beets, I., Lindemans, M., Janssen, T., Verleyen, P. Deorphanizing G protein-coupled receptors by a calcium mobilization assay. Methods Mol Biol. 789, 377-391 (2011).
- Mertens, I., Meeusen, T., Huybrechts, R., De Loof, A., Schoofs, L. Characterization of the short neuropeptide F receptor from Drosophila melanogaster. Biochem Biophys Res Commun. 297 (5), 1140-1148 (2002).
- Lu, H. -. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. J. Vis. Exp. (50), e2732 (2011).
- Feng, G., et al. Functional characterization of a neuropeptide F-like receptor from Drosophila melanogaster. Eur. J. Neurosci. 18 (2), 227-238 (2003).
- Nässel, D. R., Wegener, C. A comparative review of short and long neuropeptide F signaling in invertebrates any similarities to vertebrate neuropeptide Y signaling. Peptides. 32 (6), 1335-1355 (2011).
- Grimmelikhuijzen, C. J. P., Hauser, F. Mini-review The evolution of neuropeptide signaling. Regul Pept. 177, S6-S9 (2012).
- Caers, J., Verlinden, H., Zels, S., Vandersmissen, H. P., Vuerinckx, K., Schoofs, L. More than two decades of research on insect neuropeptide GPCRs an overview. Front Endocrinol (Lausanne. 3 (151), 1-30 (2012).
- Kozak, M. An analysis of 5’-noncoding sequences from 699 vertebrate messenger RNAs). Nucleic Acids Res. 15 (20), 8125-8148 (1987).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase. CJ Biol Chem. 270 (25), 15175-15180 (1995).
- Ral Conklin, B., et al. Carboxyl-terminal mutations of Gqα and Gsα that alter the fidelity of receptor activation. Mol Pharmacol. 50 (4), 885-890 (1996).
- Kostenis, E. Is Gα16 the optimal tool for fishing ligands of orphan G-protein-coupled receptors. Trends Pharmacol Sci. 22 (11), 560-564 (2001).
- Robas, N. M., Fidock, M. D. Identification of orphan G protein-coupled receptor ligands using FLIPR assays. Methods Mol Biol. 306, 17-26 (2005).
- Caers, J., Peeters, L., Janssen, T., De Haes, W., Gäde, G., Schoofs, L. Structure-activity studies of Drosophila adipokinetic hormone (AKH) by a cellular expression system of dipteran AKH receptors. Gen Comp Endocrinol. 177 (3), 332-337 (2012).
- Peeters, L., et al. A pharmacological study of NLP-12 neuropeptide signaling in free-living and parasitic nematodes. Peptides. 34 (1), 82-87 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유