需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
适用于鼠标机关高精度锌同位素测量
摘要
We present the technique to measure with high precision zinc isotope ratios in mouse organs.
摘要
我们提出一个过程,在小鼠器官高精度锌同位素比值来衡量。锌是由5稳定同位素(64锌,66的Zn,67的Zn,68 Zn和70的Zn),这些小鼠器官之间自然分级。我们首先说明如何以溶解,以释放所述锌原子的不同器官;这个步骤是通过HNO 3和H 2 O 2的混合物中实现。然后,我们从所有其他元素净化锌原子,特别是从等压干扰( 例如 ,镍),通过阴离子交换色谱法中的稀的HBr / HNO 3介质。前两个步骤都在一个干净的实验室使用高纯度的化学品进行。最后,同位素比率通过使用多集电极感应耦合等离子体质谱仪,在低分辨率测量。将样品使用喷雾室和同位素分馏诱导质谱仪是correc注入泰德通过样品的比与一个标准(标准包围技术)的比例。这充分典型的过程产生的同位素的比例与50ppm的(2 SD)的重现性。
引言
高精度的测量(较好100ppm以下/原子质量单位)锌稳定同位素组合物只可能为大约15年由于多集电极等离子体源质谱仪的发展,至今在地球被主要应用于与行星科学。应用到医疗领域是新颖的,并具有很强的潜力作为生物标志物用于修改锌的代谢( 例如,阿尔茨海默病)的疾病。本文报道一种测量高精度锌的天然稳定同位素比率在各脏器鼠标的方法。同样的情况也适用于人类样本。该方法包括器官,锌从原子的其余部分的化学提纯,然后在一个质谱仪同位素比率分析的溶解。
锌同位素测量的质量取决于化学纯化的质量(锌的纯度,低空白排版ARED到的锌存在于样品中的量,该过程的高化学产率)和在仪器偏差的控制。最终锌馏分的高纯度是需要删除这两个同量异序的干扰和非等压干扰创建矩阵的效果。等压核素创建直接干扰( 例如,64镍)。非等压干扰产生的所谓"基质"的效果,并通过改变电离相比,纯锌标准到的样本进行比较,以1的条件改变的测量值的分析精度。低空白(<10毫微克)表明不存在由外部锌污染的样品是将偏压测量同位素组成。以Zn同位素可以在离子交换层析2被分馏,所有的锌原子的集合确保没有同位素分馏发生时,这意味着该化学过程应当有充分的产率。最后,质谱测量时的器乐同位素分馏的校正是通过"标准包围"的方法进行。
因此,存在的主要困难,以获得精确的测量结果控制外部污染( 即低空白),生产全收率化学纯化的洁净的任何其他原子或分子,并校正在质谱仪器乐同位素分馏。在本文中,我们将介绍我们的分析协议锌从小鼠器官以及在质谱测量分开。
提取是使用稀释的酸的低量(的HBr / HNO 3介质)上的阴离子交换树脂的微柱(0.5微升和0.1微升)。它有一个完整的产量和测量有一个外部的可重复性优于50 ppm的在66锌/锌64的比例。冰毒的另一个优点外径是,它是非常快的。该方法因此很好地适应于医学,其中一个需要分析大量的样品相比,地球科学,在那里被开发这些分析方法。
研究方案
注:程序涉及动物已被批准的机构动物护理和使用委员会(IACUC)在巴黎大学狄德罗。
1.准备材料
- 亚沸腾馏1升的酸(HNO 3,氢溴酸),以从杂质纯化它们。
- 清洁烧杯和尖端适配器在热(〜100℃)浓HNO 3酸浴中至少两天。
- 洗冷3 N HNO 3浴室的枪头数天,单独漂洗三次去离子水。
2.样品制备
- 麻醉小鼠腹腔注射氯胺酮和甲苯噻嗪。由脚趾捏法评估麻醉。
- 收集的血液在肝素1.5 mL管存在一个心脏穿刺。
- 分离的血细胞通过离心(10分钟,1500×g离心)等离子体和等离子体转移到性聚丙烯C使用聚丙烯提示ryogenic小瓶。
- 通过在心脏切肝静脉和注射DPBS取下器官剩余的血液。颈椎脱位评估鼠标死亡。
- 收获用无菌不锈钢器械的器官,释放周围脂肪,如果任何的他们,在聚丙烯瓶低温管理单元冻结他们。
3.化学提纯
- 首先,溶解样品中的约1毫升浓(30%) 的 H 2 O 2和〜1ml浓(〜15 M),HNO 3的混合。做一个通风橱内的所有这些步骤。
- 放置整个感兴趣的器官入15ml特氟隆烧杯中。然后,将H 2 O 2 / HNO 3添加到烧杯5。保持烧杯公开了几分钟,以避免由于有机物的氧化,反应的 CO 2的释放飞溅。
- 最后,把烧杯在热板上在ABO血型UT 100℃几个小时或直到溶液是十分清楚的。
- 打开烧杯和干燥的热板上将溶液在约100℃。
- 一旦样品是干,加入1毫升1.5N的HBr的到样本;关闭烧杯并让它溶解在热板上在100℃下进行几个小时。
- 同时准备500微升列。
- 加入500μl的AG1X8 200-400目树脂为列,并把它与它下面的一个垃圾桶烧杯中柱架。通过交替洗涤树脂:5毫升MΩ⋅厘米水,5毫升0.5N的HNO 3,第 5毫升水,5毫升0.5N的HNO 3 18.2,然后加入5毫升水。调节所述树脂用5ml的1.5N的HBr。
- 从热板上取下烧杯中,并把它们在超声波浴中约30分钟,然后让烧杯冷却至RT。
- 一旦烧杯冷却,洗涤树脂,打开烧杯。把末端适配器到t他注射器,加枪头;吸取1ml的样品,并将其加载到树脂(非常缓慢,为了不搅动树脂)。
- 一旦所有的液体通过柱,加入5毫升的1.5N的HBr。
- 一旦5毫升的1.5N的HBr通过柱子,用干净的15毫升烧杯更换垃圾桶烧杯中。
- 加入5毫升的0.5N的HNO 3 2.5混合物在一个时间。在此阶段,锌从树脂洗脱。
- 一旦5毫升HNO 3的穿过柱,取出烧杯,并放置在热板上,在100℃,直至干燥。
- 取下柱夹列;垃圾桶树脂(用于每个样品的新树脂)。
- 一旦样品是干的,重复的协议与在一个较小的塔的酸(100微升)相同的体积,然后将其放置在热板上,直至干燥。该样本是现在准备质谱。
4.质谱测量
- 分析锌同位素康波习得在多集电极 - 电感耦合等离子体质谱仪(MC-ICP-MS)。
- 使用表1中总结的机器参数。
- 放置法拉第筒收集在62镍,铜63,64锌,铜65,66锌,锌67和68的Zn质量(m / z)。
- 制备含有500ppb的锌在0.1M HNO 3为同位素分析的溶液。
- 通过使用喷雾室结合100μl/ min的聚四氟乙烯喷雾器分析Zn中500ppb的溶液。对于每个样品,测量30扫描(1块30个循环),其中每一个扫描的积分时间是8.389秒。
- 通过从空白溶液(用于重新溶解的样品的0.1M HNO 3溶液)中减去上峰零强度校正的背景。
- 控制和纠正可能64镍通过测量62镍峰的强度等压干扰。假设镍64/62 Ni比自然(0.2548),从正确的工具质量偏差此值,然后取出64镍的质量为64:
64 真正的锌= 64 测定锌-镍64 = 64锌测定 - (64镍/镍62), 自然 x 62镍测量 。 - 通过与江铃里昂锌标准的500 ppb的标准溶液(或其他可用的标准,例如IRMM-3702)包围每个样品更正仪器质量偏差。通过将样品的66锌/ 64 Zn的比率由之前和样品减去1之后测定并乘以1000这两个标准的66的Zn / 64 Zn的比率的平均值执行标准的包围(见公式1)。在江铃里昂锌标准典型的外部精度为0.05 permil / AMU(2个标准差,2 SD)。
结果
在1.5N的HBr的,主要锌物种(ZnBr3-)形式非常强配合物与阴离子交换树脂,而大多数其他元素不与树脂相互作用。锌,然后,通过改变介质稀释的HNO 3,改变Zn构成的形态至Zn 2+这是从树脂6,7释放回收。
同位素比通常表示为每1000个的偏差相对于标准部分:
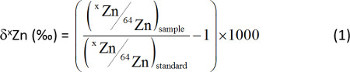
讨论
测量的再现性,通过在不同的分析会话进行同一样品重复分析评价。例如如图6所示 ,我们已复制同一陆地岩石7倍,我们获得了记录在表2中的结果。
正如预期的那样从同位素分馏10的理论和测量任何太阳系材料至今( 如陨石11-13,3-5植物,深海沉积物中14,动物15-17),结果遵循质量-依赖法(参见图1)。
披露声明
作者什么都没有透露。
致谢
FM通过chaire D'IDEX卓越巴黎的索邦大学太阳城确认来自ANR资助下,INSU通过PNP赠款,研究所区大学法国以及在巴黎的索邦大学太阳城(ANR-10-的LabX-0023和ANR的Labex UniverEarth程序-11-IDEX-0005-02)。我们也感谢来自欧洲研究委员会的资助下,欧洲共同体的H2020框架方案/ ERC赠款协议#637503(精粹)。
材料
| Name | Company | Catalog Number | Comments |
| Multi-collection inductively-coupled-plasma mass-spectromter | Thermo-Fisher | ||
| Anion-exchange resin AG1 X8 200-400 | Bio-Rad | 140-1443-MSDS | |
| Teflon beakers | Savillex | 200-015-12 | |
| In-house-made teflon colunms made with shrinkable teflon |
参考文献
- Marechal, C. N., Telouk, P., Albarede, F. Precise analysis of copper and zinc isotopic compositions by plasma-source mass spectrometry. Chemical Geology. 156 (1), 251-273 (1999).
- Marechal, C. N., Albarede, F. Ion-exchange fractionation of copper and zinc isotopes. Geochim. Cosmochim. Acta. 66 (9), 1499-1509 (2001).
- Weiss, D. J., Mason, T. F. D., Zhao, F. J., Kirk, G. J. D., Coles, B. J. Isotopic discrimination of zinc in higher plants. New Phytologist. 165 (3), 703-710 (2005).
- Jouvin, D., Louvat, P., N, M. F. C. Zinc isotopic fractionation: why organic matters. Environ Sci Technol. 43 (15), 5747-5754 (2009).
- Moynier, F., et al. Isotopic fractionation and transport mechanisms of Zn in plants. Chemical Geology. 267 (3-4), 125-130 (2009).
- Moynier, F., Herzog, G., Albarede, F. Isotopic composition of zinc, copper, and iron in lunar samples. Geochim. Cosmochim. Acta. 70 (24), 6103-6117 (2006).
- Moynier, F., et al. Isotopic fractionation of zinc in tektites. Earth Planet. Sci. Lett. 277 (3-4), 482-489 (2009).
- Chen, H., Savage, P., Teng, F. Z., Helz, R., Moynier, F. Zinc isotope fractionation during magmatic differentiation and the isotopic composition of the bulk Earth. Earth Planet. Sci. Lett. 369-370, 34-42 (2013).
- Moeller, K., et al. Calibration of the new certified materials ERM-AE633 and ERM-AE6447 for copper and IRMM 3702 for zinc isotope amount ratio determination. Geostd. Geoan. Res. 36 (2), 177-199 (2012).
- Bigeleisen, J., Mayer, M. Calculation of equilibrium constants for isotopic exchange reactions. J. Chem. Phys. 15, 261-267 (1947).
- Luck, J. M., Ben Othman, D., Albarede, F. Zn and Cu isotopic variations in chondrites and iron meteorites: Early solar nebula reservoirs and parent-body processes. Geochim. Cosmochim. Acta. 69 (22), 5351-5363 (2005).
- Moynier, F., Dauphas, N., Podosek, F. A Search for 70Zn Anomalies in Meteorites. Astrophys. J. 700 (2), L92-L95 (2009).
- Paniello, R., Day, J., Moynier, F. Zn isotope evidence for the origin of the Moon. Nature. 490 (7420), 376-380 (2012).
- Pichat, S., Douchet, C., Albarede, F. Zinc isotope variations in deep-sea carbonates from the eastern equatorial Pacific over the last 175 ka. Earth and Planetary Science Letters. 210 (1-2), 167-178 (2003).
- Moynier, F., Fujii, T., Shaw, A., Le Borgne, M. Heterogeneous of natural Zn isotopes in mice. Metallomics. 5 (6), 693-699 (2013).
- Balter, V., et al. Bodily variability of zinc natural isotope abundance in sheep. Rapid Com. Mass. Spec. 24, 605-612 (2010).
- Balter, V., et al. Contrasting Cu, Fe, and Zn isotopic patterns in organs and body fluids of mice and sheep, with emphasis on cellular fractionation. Metallomics. 5 (11), 1470-1482 (2010).
- Urgast, D. S., et al. Zinc isotope ratio imaging of rat brain thin sections from stable isotope tracer by LA-MC-ICP-MS. Metallomics. 4, 1057-1063 (2012).
- Marin-Carbonne, J., Rollion-Bard, C., Luais, B. In-situ measurements of iron isotopes by SIMS: MC-ICP-MS intercalibration and application to a magnetite crystal from the Gunflint chert. Chem. Geol. 285 (1-4), 50-61 (2011).
- Fietzke, J., et al. Boron isotope ratio determination in carbonates via LA-MC-ICP-MS using soda-lime glass standards as reference material. J. Anal. Atom. Spec. 25, 1953-1957 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。