Method Article
生成和多表型高内涵筛选
摘要
贝氏柯克斯体是专性细胞内革兰阴性细菌负责对人畜共患病Q热。在这里,我们描述了用于Coxiella荧光转座子突变体的产生,以及自动识别和所得内化,复制和细胞毒性表型分析的方法。
摘要
侵袭和宿主细胞由细菌病原体的定植依赖于大量的原核蛋白质,其定义为毒力因子,其可颠覆和操纵键主机函数的活性。宿主/病原体相互作用的研究,因此非常重要的是了解细菌感染和开发替代战略来对付传染病。这种方法但是,需要新的高通量分析的发展为细菌毒力因子的偏见,自动识别和鉴定。在这里,我们描述了GFP标记的突变体库的生成方法,通过转座子诱变和高内涵筛选的发展途径的同时识别多个转座子相关的表型。我们的工作模式是胞内细菌病原体贝氏柯克斯体 ,人畜共患病Q热的病原体,它与本身相关联韦雷暴发与随之而来的卫生和经济负担。这种病菌的专性细胞内性质,直到最近,严重阻碍了参与宿主病原体相互作用细菌因素的识别,使Coxiella的高通量/高含量的方法实施的理想模式。
引言
新兴的,地方性的细菌贝氏柯克斯体是负责大爆发Q热,一个衰弱的流感样人畜共患病有严重的健康和经济影响1。 Coxiella的主要宿主是家畜和农场动物,据估计,在美国90%以上的奶牛进行C.贝氏柯克斯 2。人类被感染吸入污染气溶胶意外的主机。人类Q热表现或是作为急性或慢性疾病,这可能会产生致命的并发症的死亡率达到65%1,3-。为1的感染剂量- 10有机体,Coxiella是最传染性病原体已知的,并且已经研究作为一种潜在的生物武器4。最近爆发的爆炸Q热荷兰(2007 - 2010),用例从182升级到2000多个,每年,代表作为该病原体的毒力严重的一个例子5。
Coxiella感染的显着的效率可能与它的抗环境应力,并结合其独特的适应宿主细胞相关联。的确,Coxiella存在于环境中的代谢不活跃小细胞变体(SCV),这是几个苛刻条件(干燥,温度等 )显着性的形式。的SCV被向上取由吞噬细胞经由素αvβ3整联6而侵入非吞噬细胞是由Coxiella粘附/入侵的OmpA 7和尚未确定的受体介导的。下面的摄取,Coxiella位于紧身空泡,积极争取早日内涵体标志物Rab5的和EEA1 8。细菌内含体酸化通过转换为代谢活跃的大细胞变异(轻型商用车)和激活点/ ICM型4分泌系统(T4SS)9回应,高度同源的嗜肺军团菌 10。的点/ Icm的效应的分泌允许Coxiella以产生一个大的,LAMP1阳性含酸性活性的溶酶体酶,细菌可以茁壮成长并积极保护感染细胞凋亡11隔室。因此,Coxiella的细胞内循环由细菌效应12的点/ Icm的介导转控制,然而,涉及在宿主细胞的侵袭,细菌复制和传播感染的微生物因素仍然知之甚少。
组合转座子诱变和基于荧光的测定法,我们正在开发无偏方法用于同时鉴定参与Coxiella感染的主要步骤细菌因素:1)在宿主细胞内的内化,2)胞内复制,3)细胞至细胞的传播和4)持久性。到目前为止,我们已经筛选过千米utations在500 Coxiella编码序列,这为我们提供了前所未有的见解调节Coxiella发病7宿主-病原体相互作用。值得注意的是,这种方法可以应用到其他细胞内病原体共享与Coxiella细胞生物学特性的研究。
研究方案
1.产生的绿色荧光蛋白标记的Coxiella座子突变体库
处理贝氏柯克斯体 RSA439 NMII在生物安全防护水平2(BSL-2)的微生物安全柜(MSC)符合当地规则。如果与所使用的细菌模型兼容,重复步骤从1.4.1至1.4.4增加获得克隆的突变体的可能性。一个典型的突变体文库是由许多突变体,它等于编码注解中所使用的生物体的基因组序列的三倍的数量(至少)。
- 制备电感受态Coxiella RSA439 NMII:
- 制备1×ACCM-2 13:13.4 mM柠檬酸,16.1 mM柠檬酸钠,3.67毫磷酸钾,1mM氯化镁,0.02 1mM氯化钙,0.01mM的硫酸铁,125.4毫氯化钠,1.5mM的L-半胱氨酸0.1克/升细菌用胰蛋白胨,2.5克/升酪蛋白氨基酸,1g / L的甲基的β环糊精125 30ml / L的RPMI。调节pH值至4.75和过滤消毒(不要高压)。注意:液体ACCM-2是稳定的,在4℃下进行约1个月。
- 接种百毫升ACCM-2的2×10 6个基因组当量(GE)的Coxiella RSA439 NMII / ml的(从先前产生并在步骤1.5定量为细菌股票)-80℃储存和分发细菌悬液在75 cm 2的细胞培养瓶与瓶盖排放(10 - 15毫升菌悬液每烧瓶)。在5%CO 2和2.5%O 2的潮湿气氛中生长7天,在37℃。
- 汇集所得的细菌悬浮液在50毫升管和离心机在3900×g离心1小时,在4℃。
- 弃上清,重悬沉淀在30ml 10%的甘油。离心机在3900 XG 1小时,4℃。
- 重悬沉淀,在10%甘油(通常为2毫升)和等分试样加入50μl于500μl管的足够体积。请再悬浮b在整个过程中acteria冰上。注:在此阶段,细菌是电感受和一个等份足以执行一个电穿孔。该细菌悬浮液可以储存在-80℃下6个月或直接用于质粒DNA的电穿孔。
- 电穿孔transposon-和转座编码质粒主管Coxiella的:
注:以下协议中,转座子与转座由两个不同的质粒(PITR-CAT-GFP和pUC19-Himar1C9,分别)进行编码7。两个质粒缺乏Coxiella特定复制起点,使他们自杀质粒时Coxiella电。这可确保稳定的转座子插入。转座因子含有下Coxiella子p1169进行选择而根据Coxiella启动子P311标记用GFP产生的突变体的调节的gfp基因的调控中氯霉素抗性盒。- 镨电子冷却0.1厘米电比色皿在冰上10分钟。混合50微升电感受Coxiella的用10μg转座子的质粒和10微克转座质粒7。确保质粒浓度高于500微克/毫升,以减少稀释甘油。
- 电穿孔使用以下设置:18千伏,500Ω,25μF。确保所得到的时间常数是由9和13毫秒之间。
- 立即加入950微升的RPMI,悬浮电细菌和转移到螺旋盖管中并保持在室温下。
- 取200微升电细菌,并添加至3ml ACCM-2的补充有1%热灭活的胎牛血清(FBS)的入6孔板中。添加88微升的DMSO至电穿孔细菌的剩余量在-80℃下(以达到10%的DMSO终浓度),并存储。
- 选择转座子突变体:
- Incuba德在5%CO 2和2.5%O 2的潮湿气氛上述(1.2.4),为描述的接种的6孔板过夜,在37℃。添加适当的抗生素(375微克/毫升卡那霉素或3微克/毫升氯霉素)。孵育细菌培养在上述条件下3个额外的天。
- 单个孤立的突变体:
- 固体ACCM-2板的制备Coxiella座子突变体和镀层
注:以下说明适用于1培养皿,细菌培养的几个稀释度都进行测试,以评估最佳的接种量为菌落分离。- 热火10.5毫升0.5%琼脂糖在微波炉,让它在55℃水浴中冷却。加热11.25毫升2×ACCM-2(pH值为4.75),在37℃。
- 准备底部琼脂糖:
- 将10毫升融化的0.5%琼脂糖,用10 2×ACCM-2中并加入适当的抗生素(375微克/毫升卡那霉素或3微克/毫升氯霉素)。
- 立即倒入培养皿。保持培养皿unlidded,让介质凉30分钟,并风干20分钟。
- 准备顶琼脂糖:
- 混合1.25毫升2×ACCM-2的0.75毫升水在5ml的聚苯乙烯管中,加入合适的抗生素(375微克/毫升卡那霉素或3微克/毫升氯霉素)和在37℃。
- 添加细菌培养(通常为1至100微升)和涡旋5秒。
- 0.5毫升融化的琼脂糖,混匀并立即倒在底部琼脂糖。
- 让冷却20分钟,更换盖培养皿上,并孵育在4℃下20分钟,以促进琼脂糖固化。
- 空气干燥unlidded在MSC 20分钟。生长板在37℃在5%CO 2和2.5%O 2的潮湿气氛为6至7天。
- 添加DMSO中的其余的细菌升培养物中,以达到10%的DMSO的最终浓度,并储存在-80℃。
- 评估最佳稀释度如下:确保菌落是0.5到1毫米的直径和被适当隔离,以避免交叉污染。解冻作为1.4.1.2 1.4.1.3和上描述ACCM-2琼脂其余由点及1.4.2平板细菌培养,在适当的稀释。如在1.4.1.3.5中所述孵育6至7天。
- 一旦菌落检测的,通过切割1毫升尖的端部,采摘插头含有分离菌落并在1.5 ACCM-2毫升含有适当抗生素(375微克分散的菌落通过移液收集它们/ ml卡那霉素或3微克/ ml氯霉素)在一个24孔板中。扩增单个菌落6天在1.3.1中描述的条件。在培养的第3天,吹打每一种文化驱散细菌团块。
- 存储每个突变体悬浮液中的2D条形码螺旋盖试管中的96孔板中10%DMSO中于-80℃。
- 固体ACCM-2板的制备Coxiella座子突变体和镀层
- 评价细菌浓度的:
注意:下面的协议可以被应用以获得细菌的突变体复制在无菌培养基(参见1.4.4)的生长曲线。- 标准曲线的制备:
- 制备双链DNA的2微克/ ml储备溶液(通常是随机的质粒已知大小和浓度的)在1×的Tris-EDTA(TE)。制备10倍系列从原液稀释,得到浓度为2微克/ ml至2纳克/毫升。分配50μl的各浓度,以单个井96孔微孔板用黑色壁和底部的( 见表材料 )。
- 稀释的dsDNA定量试剂1:200于1×TE缓冲液,并添加55微升的稀释试剂的每个样品在96孔微量。拌匀使用板摇床孵育2至5分钟,在室温下,在黑暗中。
- 使用发出荧光测量荧光的样品NCE酶标仪和过滤器标准的荧光波长(激发〜480纳米,发射520〜纳米)。
- 暗算的荧光强度读数质粒浓度范围。
- 菌悬液定量:
- 分配5微升10%的Triton X-100,每孔在96孔微量培养板用黑色壁和底部( 见表材料 )。加入50微升的细菌悬浮液的每个孔中,在室温下孵育10分钟,在板振荡器上。
- 稀释的dsDNA定量试剂1:200于1×TE缓冲液,并添加55微升的稀释试剂的每个样品在96孔微量。拌匀使用板摇床孵育2至5分钟,在室温下,在黑暗中。
- 衡量使用荧光酶标仪和过滤器标准荧光波长(激发〜480纳米,发射〜520纳米)的样品荧光。
- 为了获得细菌DN的浓度,绘制荧光读数点1.5.1.4在得到的图。由Coxiella基因组(2.2蛋白原)的质量除以所述DNA浓度以获得细菌的浓度。结果表达基因组中当量/毫升。
- 放弃参展的突变体在ACCM-2显著生长缺陷。
- 标准曲线的制备:
2.单引物菌落PCR,测序和注释
注意:下面的协议是96个样品的DNA扩增,多道移液器推荐用于以下步骤。使用磁珠和DNA测序用的转座子特异性引物(2.3)PCR产物的柱纯化分包给外部公司。
- 确保扩增引物设计,以100和200个碱基对的反向串联重复序列(ITR),上游获得的PCR产物覆盖上Coxiell转座子插入位点之间杂交的基因组。制备3毫升PCR混合物中(1×高保真缓冲液,200μM的的dNTPs,1μM的扩增引物,20U / ml的高保真DNA聚合酶)和分配,每孔29微升,在96孔PCR板在冰上进行设置。转移1μl的各突变体的稳定期在ACCM-2到PCR混合物。
- 运行的PCR与初始变性(98℃,1分钟),20高严紧循环(98℃,10秒; 50℃,30秒; 72℃,90秒),30低严格循环(98℃, 10秒; 30℃,30秒; 72℃,90秒)和30高严紧循环(98℃,10秒; 50℃,30秒; 72℃,90秒),随后在72最终延伸°加热7分钟。
- 纯化使用磁珠和序列的DNA与转座子特异性引物的PCR产物。用介于50℃和75℃,40%和60%之间的GC含量,18和25个核苷酸和退火SI之间的长度的预测熔解温度设计转座子特异性引物德扩增引物杂交位点的下游和至少100个碱基对的第一个碱基对转座子ITR的上游。
- 使用序列分析软件,加载贝氏柯克斯体493 NMI的完整的带有注释的基因组。使用"对齐参考"函数来加载和对准(BLASTN)的测序结果,并确定换位的部位。丢弃与非匹配和/或显示双reads.To监视突变体文库的饱和突变体,保持的多个转座子插入的发生的一个记录在相同的位点。
3.真核细胞挑战,Coxiella突变体的细胞内生长监测
注:多道移液器建议以下步骤。感染实验重复3次在无菌的96孔微孔板用黑色墙壁和平坦的透明底部。重量贝氏柯克斯体表达GFP14瓦特由罗伯特·海因岑博士提供。
- 生长的Vero细胞在RPMI无补充有10%胎牛血清(FBS),酚红在缺乏抗生素(完全RPMI培养基)。
- 感染前一天,洗Vero细胞从汇合或亚汇合细胞培养瓶中,用10ml PBS中。
- 分离Vero细胞中加入1毫升的胰蛋白酶EDTA溶液向细胞培养烧瓶中,并在5%CO 2的潮湿气氛下孵育3至5分钟,在37℃。
- 重悬的细胞在10ml完全RPMI培养基中。计数细胞并制备每毫升10 5个细胞的细胞悬浮液。
- 分配100μl的细胞悬浮液在黑色96孔板与平坦的透明底的每个孔中。
- 离心5分钟,在400×g离心在RT以促进细胞粘附在孔的底部,并在5%CO 2的潮湿气氛中孵育过夜,在37℃。
- 解冻含钴的96孔板在RT xiella突变体和稀释150μl的细菌悬浮液中加入300微升的RPMI的不含酚红和FBS在深孔96孔平板。
- 从含有Vero细胞微孔板除去介质和分配100μl/孔的稀释Coxiella突变体(MOI为100)。使用A1孔作为阴性(非感染细胞)的控制和孔A2和A3作为阳性对照(细胞感染重量Coxiella表达GFP 14在100和200的感染复数(MOI)的多重)。
- 使用气密性离心机板保持离心板10分钟,400×g离心在RT。
- 在5%的CO 2的潮湿气氛中在37℃进行2小时,然后更换含细菌的培养基用100μl/孔的新鲜的完全RPMI培养基。
- 测量GFP荧光日常使用荧光酶标仪和过滤器标准的荧光波长(激发〜480纳米,发射〜520纳米)7天。避免干扰由于缩合和信号分散在培养基中,使用底激发和发射记录在酶标仪。
4.准备样品的自动图像采集
注意:程序是一个96孔板中,相应地扩展卷。从4.2的步骤可能采取洗板机的优势。
- 在第 7天感染后,从板除去培养基并用50μl替换/孔的新鲜完全培养基含有细胞可渗透荧光染料在适当的稀释液(通常为1:1000,以根据所使用的细胞系进行优化)。在5%CO 2的潮湿气氛中60分钟,在37℃ -孵育细胞30。
- 用50μl/孔的4%低聚甲醛(PFA)的PBS替换培养基,孵育30分钟,在室温(RT),然后除去含PFA缓冲液和洗3次,用PBS洗涤。
- 删除PBS和dispens的孔的封闭液(0.5%牛血清白蛋白,50mM的氯化铵在PBS,pH 7.4)中补充有0.05%皂苷ë50微升/。在室温下孵育30分钟。
- 500稀释:用40微升/孔的补充有皂苷新鲜阻断溶液(如上)和用抗LAMP1抗体以1更换封闭液。孵育板30分钟,在室温。
- 除去阻断溶液并用100μl/ PBS中的孔洗涤96孔板5次。
- 分配40微升/孔封闭溶液补充有皂苷(如上述),适当的荧光标记的第二抗体(稀释度1:1000),以揭示施加在步骤4.4抗LAMP1抗体,并用Hoechst 33258在5微克/毫升。孵育板30分钟,在室温。
- 除去阻断溶液并用100μl/ PBS中的孔洗涤96孔板5次。离开PBS中对应于96孔板的最后一次洗涤的体积,作为固定细胞不应该干。
- 图像立即将板或存储板在4℃,避光,用于随后的分析。
5.图像采集
- 获得在GFP图像(488纳米,细菌),赫斯特33258(350纳米,宿主细胞核),红色(〜555nm处,细胞膜标记物)和远红光(约615纳米,LAMP1)使用落射荧光自动显微镜频道配用20倍的目标。收购每孔21个独立的字段,以图像的最小每个样品5000细胞。申请使用的宿主细胞的细胞核信道作为参考自动对焦。当用细菌病原体感染宿主细胞的低百分比的工作,用户可以调整每孔成像独立字段的数量,以便获得最小500感染的细胞的分析。
6.图像处理
注:以下步骤是特定的使用图像分析软件CellProfiler的。在所有情况下,最佳algoritHM为分割必须通过实验确定和触摸图像的边界的对象应具有合适功能来消除。
- 加载所有图像CellProfiler。
- 使用模块"ImageMath"从Hoechst的通道中减去使用GFP通道,以避免检测Coxiella菌落(也被标识由Hoechst),为在下面的步骤的宿主细胞的细胞核。
- 从得到的步骤6.2的图像使用该模块"IdentifyPrimaryObjects"分割宿主细胞的细胞核。命名分段对象"核"。
- 使用步骤6.3种子检测到的核555纳米图像使用模块"IdentifySecondaryObjects"分割宿主细胞。命名分段对象"细胞"。
- (可选)使用该模块"IdentifyTertiaryObjects"减去确定从确定在6.4步步细胞细胞核6.3。命名分段对象"细胞质221 ;.
- 使用在615纳米图像模块"EnhanceOrSuppressFeatures"删除背景和促进LAMP1阳性车厢下面的标识。
- 使用在步骤6.6中得到的图像上的模块"IdentifyPrimaryObjects"来标识LAMP1阳性隔间。命名分段对象"溶酶体"。
- 使用488纳米图像模块"IdentifyPrimaryObjects"来标识Coxiella殖民地。命名分段对象"殖民地"。
- 使用在615纳米图像模块"IdentifySecondaryObjects"来标识使用步骤6.8种子检测Coxiella菌落含Coxiella-空泡。命名分段对象"校准检验"。
- 使用模块"MaskObjects"以选择在细胞上检测到的CCVs(如细胞触摸图像的边界已被淘汰,一些的CCVs可以检测"外"细胞)。命名水库ulting对象"过滤校准检验"。
- 使用模块"MaskObjects"以选择在细胞上检测到的菌落(如细胞触摸图像的边界已被淘汰,一些菌落可被检测的"外部"细胞)。命名结果对象"过滤的殖民地"。
- 使用该模块"MaskObjects"溶酶体关联到细胞。命名结果对象"过滤溶酶体"。
- 使用该模块"MaskObjects"选择包含Coxiella克隆细胞。命名结果对象"感染细胞"。
- 使用该模块"相关对象"设置对象"过滤的校准检验"作为父对象"细胞"的孩子。这将允许计数的CCVs /细胞的数目。
- 使用该模块"相关对象"设置对象"过滤的殖民地"的父对象"细胞"的孩子。这将允许计数菌落/细胞的数目。
- 使用该模块"相关对象"设置对象"过滤溶酶体"作为父对象"细胞"的孩子。这将允许计数溶酶体/细胞的数目。
- 使用该模块"MeasureObjectSizeShape"获得核,细胞,过滤校准检验,过滤殖民地过滤溶酶体的形态分析
- 使用模块"MeasureObjectIntensity"量化与筛选的CCVs关联的GFP荧光,并估计内的CCVs Coxiella复制的效率。
- 使用模块"OverlayOutlines"和"SaveImages"叠加分割结果和用于质量控制的原始图像。
- 使用模块"ExportToSpreadsheet"导出全部或选择的图像分析结果。
- (可选)使用该模块"ExportToDatabase"分析结果使用该软件CellProfiler分析师。
7.数据分析
- 对于每个参数获得,识别和消除异常值(由于在图像分割错误)然后每突变体计算的平均值。
- 利用Z分数来确定显著的表型。考虑表型与Z值> -2非显著,表型-2和-4为轻度和表型之间的Z值与Z分数≤-4强。
- 根据实验需要情节的参数组合。
结果
在转座子突变体的分离,单引物菌落PCR是一个强大的,高通量的方法,以确定转座子插入位点的每个突变体。该方法源于典型巢式PCR的协议,但这里的单个引物杂交特异性和/或非特异性的模板DNA取决于退火温度( 图1A)的严格性。典型的PCR产物包含多个DNA片段,其中大部分是特定的( 图1B)。使用了不同的测序引物退火的转座子的ITR的权利上游,并且通过所述扩增引物识别的序列的下游提供特异性的测序步骤( 图1C)。自动化软件进行序列分析对齐获得的序列的Coxiella基因组提供的转座子插入( 图1C)的确切位点。所有的转座子插入可以再安otated上Coxiella基因组( 图1D)。
每个Coxiella突变体分离并axenically在ACCM-2培养基之前任一存储或筛选扩增。 图2示出了在16 点/ ICM Coxiella基因( 图2A)的38转座子突变体的一个例子。为了评估Coxiella突变体的活力,无菌生长曲线是通过抽样细菌培养7天接种后和应用在1.5(Figurie 2B)描述的细菌浓度测定法中获得。扩增的突变体,然后用上皮细胞孵育,一式三份的96孔板7天。产生的所有Coxiella突变体被GFP标记,细胞内的生长曲线是通过测量每一个的GFP荧光强度良好,每24小时,并绘制出的测量值作为时间( 图2C)的函数获得的。
INTR无细胞生长曲线提供了Coxiella基因组每转座子插入相关联的表型的定量分析。添加大约相同的转座子突变体的定性信息,我们选择了自动图像采集和分析。七天感染后,板被固定,如在4所描述和使用如在第5的自动图像分析软件描述如CellProfiler(Broad研究所,自动化,落射荧光显微镜进行分析处理以用于免疫荧光www.cellprofiler.com )处理所获取的信道独立的段确定用于比较分析( 图3)的对象。这允许宿主细胞的细胞核,细胞轮廓,溶酶体和Coxiella菌落( 图3上图)的鉴定和形态学特征。相关Coxiella菌落细胞和溶酶体允许identificati并Coxiella含空泡(这是LAMP1积极的, 图3左下图)的具体形态分析。相关Coxiella菌落与宿主细胞的轮廓允许鉴定和感染细胞的具体形态学分析( 图3底部中心面板)。最后,4个通道被合并为了说明和质量控制的目的( 图3右下图)。
从自动图像分析获得的数据可以绘制相互获得"多表型散点图"。作为一个例子,在图4A Coxiella菌落的平均面积(以平方微米)绘制针对每个细胞( 图4A)集落的数目,以识别影响Coxiella(复制表型)和/或细胞内复制的突变细菌侵入宿主细胞的能力(INTERNA补肾中药型)。统计分析用于在相应于轻度(-4 图 ( 图4A,粉和红点)的最左边的部分;这影响了细胞内部Coxiella突变分为剧情的底部( 图4A,光明与黑暗的蓝点),最后,绿点的情节最右边的区域对应产生非显著表型变异( Z值> -2)。重要的是,不能进行复制,但仍然能够侵入宿主细胞的突变体,7天后感染的单细菌,或小菌落,毗邻宿主细胞核( 图4C,第二面板)进行检测。因此,Coxiella大小"科洛国家实体"将被显著影响,但受感染的细胞的数目将不会发生变化与WT相比Coxiella -感染细胞。相反,影响Coxiella的侵入宿主细胞的能力的突变导致菌落/细胞的数目减少。当这个数是显著低于1,则表明,平均来说,有在感染的细胞的总数量的减少。可替代地,平均面积(以平方微米)Coxiella菌落可以绘制针对宿主细胞存活的感染( 图4B),数量,以识别对细胞毒性Coxiella(细胞毒性表型)的突变。如上述,统计分析被用于在对应于轻度(-4 图3B绿点)。 37突变轻度影响宿主细胞的存活( 图3B,光红点),以及7个突变是特别有害于宿主细胞的存活( 图3B,暗红色圆点)。请注意,由自动化图像分析的方法得到的其他参数可以被用来推导其它图表,根据实验的需要。
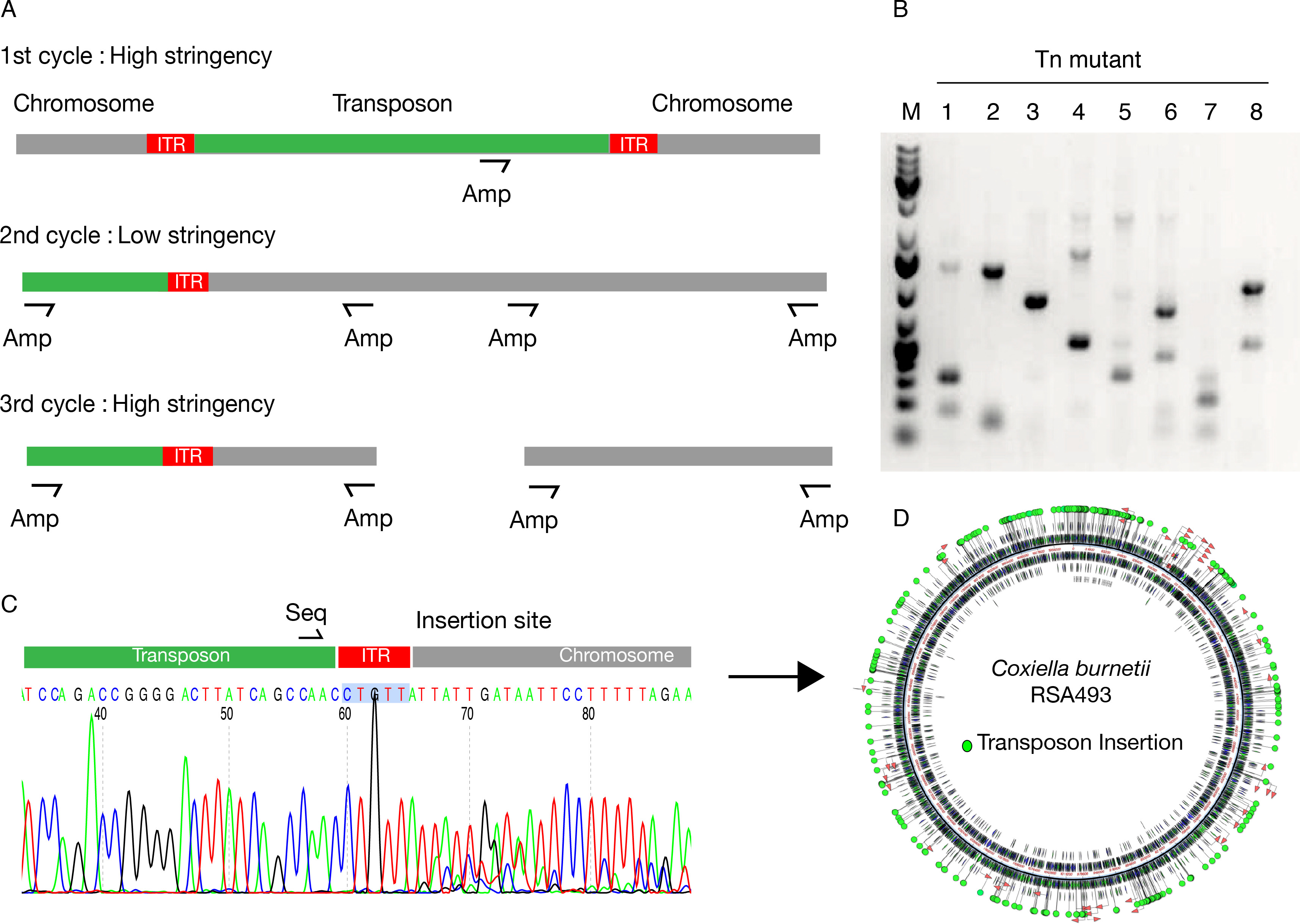
图1:测序和Coxiella座子突变体注释 (A) 的单引物菌落PCR被用于扩增含有转座子插入位点的DNA片段。的扩增引物(安培)被用来作为取决于退火温度的严格的特定和非特异性引物。 ( 二)单引物PCR克隆的典型结果。每个reacti上产生若干可变大小的片段,其中一些含有转座子插入位点的;一些其它的随机扩增作为副产物的低严紧PCR循环。 (C)使用的测序引物(序列)杂交的转座子序列允许感兴趣的片段的测序。 ( 四)序列分析软件允许对细菌基因组转座子插入的自动标注。 请点击此处查看该图的放大版本。

图2:无菌和Coxiella转座子突变体的胞内生长(A)在所述导频画面,我们已经分离,测序和筛选38转座子突变体在16核g在Coxiella点/ ICM分泌系统的埃内斯(以红色表示)。 (B)为了评估每个座子突变体的活力,每个生长隔离在无菌培养基中监测通过使用荧光标记的DNA嵌入剂8天。 (C)的每一个的突变体,然后用来感染上皮细胞。由于转座子拥有GFP卡带,胞内细菌的生长是由以下与Coxiella复制有关绿色荧光的变化,用酶标仪监测7天以上的感染。 请点击此处查看该图的放大版本。
图3:自动图像Coxiella感染的分析的自动。插配落射荧光显微镜被用于图像每一式三份的96孔平板的孔21的位置。图像分析软件段进行定量分析的每个获取的信道的对象。在所有的情况下,对象触摸的图像的边界被排除在外。 (A)中的Hoechst的信道被用于识别宿主细胞的细胞核(圆圈中绿色)。 (B)的这些被用作种子,以确定在所述的Cy3通道的宿主细胞的轮廓(核的位置被圈在蓝色,细胞轮廓绿色)。 (C)中的Cy5通道用于识别LAMP1阳性隔间(绿色圆圈);仅包含在先前识别的小区的轮廓(红色)中的对象被保留用于图像分析。 (D)中的GFP通道用于识别Coxiella菌落(圆圈中绿色)。 ( 五)关联Coxiella菌落LAMP1阳性车厢允许Coxiella鉴定含空泡(校准检验);仅包含在先前识别的小区的轮廓中的对象(绿色)被保留用于图像分析。 (F)的相关Coxiella菌落细胞轮廓允许感染的细胞(伪彩色)的鉴定。在4荧光通道获取(G)的图像(对应于Coxiella菌落(绿色),宿主细胞的细胞核(蓝色),宿主细胞的质膜(灰色),LAMP1阳性隔间(红色))被合并,并用于说明和质量控制。比例尺10微米。 请点击此处查看该图的放大版本。
图4:所涉及的宿主Coxiella因素大规模识别/病原体相互作用离子。(A) 的平均面积(μm2以下)Coxiella菌落绘制针对每个细胞集落的相对数,识别感兴趣的复制和内化的表型。绿点表示,从WT Coxiella偏离由Z评分> -2(不显著)的表型。粉色和淡蓝色圆点代表的复制和内表型分别用-2和-4(轻度表现型)之间的Z值。红色和深蓝色圆点代表表型与Z分数≤-4(强表型)。 Coxiella菌落(B)的平均面积(μm2以下)中作图细胞(感染和未感染),该成活7天后就感染来估计从座子插入引起的细胞毒性作用的总数。绿点表示,从WT Coxiella偏离由Z评分> -2(不显著)的表型。粉红色圆点代表细胞毒性pH值enotypes用-2和-4(轻度表现型)之间的Z值。红点代表表型的细胞毒性与Z分数≤-4(强表型)。箭头指示在C(C)用相应的小写字母表示突变的复制,内化和细胞毒性表型的代表性图像。在所有情况下,宿主细胞中核是在红,Coxiella菌落为绿色。比例尺50微米。 请点击此处查看该图的放大版本。
讨论
的宿主/病原体相互作用的研究已被证明是一个显着的方法,以了解细菌感染和开发替代策略,以对抗传染病。然而,由于由不同的细菌病原体阐述的策略的多样性,细菌毒力因子的和被在感染期间目标主机信号通路的鉴定和表征代表一个真正的挑战。这要求对关键主机/病原体相互作用枢纽的大型识别新方法的发展。创新,高通量和高内涵筛选技术的最新发展表示可以适应于细胞内的细菌病原体15研究中的一个非常宝贵的资源。在这里,我们使用了人畜共患细菌病原体贝氏柯克斯体作为模型来开发结合转座子诱变和基于荧光的测定法筛选的方法。 ImportanTLY,该筛选方法允许同时监测多个步骤Coxiella细胞内循环,提供由这种细菌开发的侵入,复制和持续感染细胞内的策略全球概览。
这里所描述的方法是基于两个成熟的技术,转座子诱变和基于荧光的测定法,已成功地应用到细菌病原体的研究。在高通量/高含量的屏幕的背景下结合这些技术允许我们通过分析一个非常高的数量的事件(通常15000感染每细菌突变细胞成像和分析)来评估的高数量的细菌的突变的影响。这提供了事件的一个重要的统计分析,如细菌侵入宿主细胞和细胞内的复制,它是由自然,受到高变异性。要注意的比EP其他该细胞系是很重要ithelial可用于这种类型的筛选。然而,扁平和大的上皮细胞是最适合的图像分析作为宿主细胞器更容易被检测到。因为大多数的自动显微镜可以自动处理大量板材,有几乎没有限制,可以同时进行筛选突变体的数量。取决于病原体,用户可以特权使用落射荧光或共焦显微镜的。图像采集的时间将主要取决于在显微镜摄像机的灵敏度,每个井和每个视场获得的信道数目获得字段数。用户可以决定如何调整这些因素来优化筛选方案。作为一个例子,我们使用点5.1处指示的条件下成像的1 96孔板/小时。图像分析在很大程度上取决于所使用的机器(或机器集群)上。我们使用12芯(2 x 3.06 GHz的6核),48 GB内存的工作站。这台机器需要approxi三方共同40分钟来分析从一个板获得图像。
一个重要的方面要考虑到当显影这些测定是新设定的(或现有的优化)的协议,以允许对大量样品的操作和处理。一个典型的例子是单引物菌落PCR方法,这使我们能够迅速扩增并发展含有插入每个座子的部位,从非常小的样本序列Coxiella DNA片段。根据我们的经验,高保真聚合酶必须仔细选择并为了获得可再现的结果进行测试。这种方法的唯一限制可能隐藏在观察的是,在大多数情况下,约30%经处理的样品是不可利用,无论是由于在PCR或测序步骤。然而,考虑到新Coxiella转座子突变体的分离不是限速步骤,这并不下列国家代表发送一个重大问题。同样,一个可靠测定以量化突变体种群的细菌浓度的发展一直键为这种方法。由于Coxiella的聚集在悬浮液时的倾向,使用光密度读数是不适用计算Coxiella文化和现有的唯一的替代的浓度为定量PCR(qPCR的)。这里,使用荧光标记的DNA嵌入剂的显著加快细菌定量。
这种方法还可以采取使用表达为根据所用的病原体的几个细胞内区室的荧光标记物的稳定细胞系的优点。另一个重要的方面是使用细胞培养基缺乏酚红的。我们观察到,该pH指示剂具有天然荧光横跨红色和绿色光谱饱和记录在自动荧光读取器的信号。
Ť他在这里的战略提出了依靠随机转座子突变。针对感兴趣的突变体,我们建议验证独特换位(和克隆)使用Southern印迹和转座子插入位点的PCR扩增。
除了在协议部分中所述的设备,有兴趣的使用这里提出的筛选方法队,需要付出极大的优势在关系数据库中的该组向上进行数据收集,服务器数据存储和快速图像分析的工作站。
重要的是,这里描述的适用于其它胞内细菌病原体研究中的方法提供了一种随机诱变方法存在的病原体,细胞系可以由病原体感染和感染期间这一个显示一个特定的表型。
披露声明
The authors declare that they have no competing financial interests.
致谢
This work was supported by an Avenir/ATIP grant to Matteo Bonazzi and a Marie Curie CIG (N° 293731) to Eric Martinez. The authors would like to thank Dr. Robert Heinzen for sharing C. burnetii strains, antibodies and tools, Virginie Georget and Sylvain DeRossi (Montpellier Rio Imaging-MRI, 1919 route de Mende, 34293 Montpellier) for their technical assistance and data analysis.
材料
| Name | Company | Catalog Number | Comments |
| Citric acid | Sigma | C0759-500G | ACCM-2 medium component |
| Sodium citrate | Sigma | S4641-500G | ACCM-2 medium component |
| Potassium phosphate | Sigma | 60218-100G | ACCM-2 medium component |
| Magnesium chloride | Sigma | M2670-100G | ACCM-2 medium component |
| Calcium chloride | Sigma | C5080-500G | ACCM-2 medium component |
| Iron sulfate | Sigma | F8633-250G | ACCM-2 medium component |
| Sodium chloride | Sigma | S9625-500G | ACCM-2 medium component |
| L-cysteine | Sigma | C6852-25G | ACCM-2 medium component |
| Bacto Neopeptone | BD (Beckton-Dickinson) | 211681 | ACCM-2 medium component |
| Casamino acids | BD (Beckton-Dickinson) | 223050 | ACCM-2 medium component |
| Methyl-B-cyclodextrin | Sigma | C4555-10G | ACCM-2 medium component |
| RPMI w/glutamax | Gibco | 61870-010 | ACCM-2 medium component |
| RPMI w/glutamax, without phenol red | Gibco | 32404-014 | For cell culture and infection |
| Fetal bovine serum | GE healthcare | SH30071 | For cell culture |
| Trypsin EDTA (0.25%) | Life Technologies | 25200-056 | For cell culture |
| Saponin | Sigma | 47036 | For immunofluorescence staining |
| Ammonium chloride | Sigma | A9434 | For immunofluorescence staining |
| Bovine serum albumin | Sigma | A2153 | For immunofluorescence staining |
| Electroporation cuvette 0.1 cm | Eurogentec | ce0001-50 | For Coxiella transformation |
| Trackmates screw top tubes with caps | Thermo Scientific | 3741 | 2D barcoded screwcap |
| 96-well microplate with black walls and bottom | Greiner | 655076 | Flat dark bottom, for dsDNA quantitation |
| 96-well PCR microplate | Biorad | 2239441 | DNAse/RNAse free |
| 96-well plate, deepwell | Labcon | 949481 | For Coxiella mutants infections |
| PicoGreen | Life Technologies | P7581 | For dsDNA quantitation |
| Triton X-100 | Sigma | T9284-500ML | For dsDNA quantitation |
| Phusion high fidelity DNA polymerase | New England Biolabs | M0530L | For single primer colony PCR |
| Celltracker Red CMTPX | Life Technologies | C34552 | For imaging |
| Anti-LAMP1 antibody | Sigma | 94403-1ML | For immunofluorescence staining |
| Hoechst 33258 | Sigma | L1418 | For imaging |
| Fluorescence microplate reader Infinite 200 Pro | Tecan | ||
| Epifluorescence automated microscope Cellomics | Thermo Scientific |
参考文献
- Maurin, M., Raoult, D. Q fever. Clinical microbiology reviews. 12 (4), 518-553 (1999).
- Kim, S. G., Kim, E. H., Lafferty, C. J., Dubovi, E. Coxiella burnetii. in bulk tank milk samples, United States. Emerging infectious diseases. 11, 619-621 (2005).
- Kazar, J. Coxiella burnetii. infection. Annals of the New York Academy of Sciences. 1063, 105-114 (2005).
- Madariaga, M. G., Rezai, K., Trenholme, G. M., Weinstein, R. A. Q fever: a biological weapon in your backyard. The Lancet infectious diseases. 3, 709-721 (2003).
- Der Hoek, W. V. a. n., et al. Epidemic Q fever in humans in the Netherlands. Advances in Experimental Medicine and Biology. 984, 329-364 (2012).
- Capo, C., et al. Subversion of monocyte functions by Coxiella burnetii.: impairment of the cross-talk between alphavbeta3 integrin and CR3. Journal of immunology. 163 (11), 6078-6085 (1999).
- Martinez, E., Cantet, F., Fava, L., Norville, I., Bonazzi, M. Identification of OmpA, a Coxiella burnetii. protein involved in host cell invasion, by multi-phenotypic high-content screening. PLoS pathogens. 10 (3), e1004013 (2014).
- Romano, P. S., Gutierrez, M. G., Berón, W., Rabinovitch, M., Colombo, M. I. The autophagic pathway is actively modulated by phase II Coxiella burnetii. to efficiently replicate in the host cell. Cellular microbiology. 9 (4), 891-909 (2007).
- Newton, H. J., Mcdonough, J. a., Roy, C. R. Effector protein translocation by the Coxiella burnetii. Dot/Icm type IV secretion system requires endocytic maturation of the pathogen-occupied vacuole. PloS one. 8 (1), e54566 (2013).
- Vogel, J. P. Turning a tiger into a house cat: using Legionella pneumophila. to study Coxiella burnetii.. Trends in microbiology. 12 (3), 103-105 (2004).
- Van Schaik, E. J., Chen, C., Mertens, K., Weber, M. M., Samuel, J. E. Molecular pathogenesis of the obligate intracellular bacterium Coxiella burnetii. Nature reviews. Microbiology. 11, 561-573 (2013).
- Beare, P. A., et al. Dot/Icm type IVB secretion system requirements for Coxiella burnetii growth in human macrophages. mBio. 2, (2011).
- Omsland, A., et al. Isolation from animal tissue and genetic transformation of Coxiella burnetii. are facilitated by an improved axenic growth medium. Applied and environmental microbiology. 77 (11), 3720-3725 (2011).
- Beare, P. a., Sandoz, K. M., Omsland, A., Rockey, D. D., Heinzen, R. a Advances in genetic manipulation of obligate intracellular bacterial pathogens. Frontiers in microbiology. 2 (May), 97 (2011).
- Brodin, P., Christophe, T. High-content screening in infectious diseases. Current opinion in chemical biology. 15 (4), 534-539 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。