需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
的ELISA基结合和竞争法快速测定配体 - 受体相互作用
摘要
The presented protocols describe two enzyme-linked immunosorbent assay (ELISA) based techniques for the rapid investigation of ligand-receptor interactions: The first assay allows the determination of dissociation constant between ligand and receptor. The second assay enables a rapid screening of blocking peptides for ligand-receptor interactions.
摘要
A comprehensive understanding of signaling pathways requires detailed knowledge regarding ligand-receptor interaction. This article describes two fast and reliable point-by-point protocols of enzyme-linked immunosorbent assays (ELISAs) for the investigation of ligand-receptor interactions: the direct ligand-receptor interaction assay (LRA) and the competition LRA. As a case study, the ELISA based analysis of the interaction between different lambda interferons (IFNLs) and the alpha subunit of their receptor (IL28RA) is presented: the direct LRA is used for the determination of dissociation constants (KD values) between receptor and IFN ligands, and the competition LRA for the determination of the inhibitory capacity of an oligopeptide, which was designed to compete with the IFNLs at their receptor binding site. Analytical steps to estimate KD and half maximal inhibitory concentration (IC50) values are described. Finally, the discussion highlights advantages and disadvantages of the presented method and how the results enable a better molecular understanding of ligand-receptor interactions.
引言
信号通路的全面了解需要有关配体 - 受体相互作用的详细知识。评估其特异性受体的特定配体的相互作用的大多数方法是昂贵的,耗时的,劳动密集型的,并且需要特定的设备和专门知识1。
本文介绍了两个快速和可靠的逐点的协议来调查的基础上的一种酶的配体 - 受体相互作用酶联免疫吸附测定(ELISA):直接配体 - 受体相互作用测定(LRA)和竞争LRA。 ELISA是一个高度敏感的,具体的和随时可用的技术,几乎在每一个实验室常规使用。 ELISA可以执行并适于各种方式。所提出的协议对不同的λ干扰素(INFLs)和它们的受体之间的相互作用的调查进行了优化。
直接LRA允许一个quantificati关于配体 - 受体的相对于配体浓度结合和由此产生的结合曲线。使用适当的型号为配体-受体相互作用,可以将数据进一步分析以估计的解离常数(K D)。
在所提出的协议,通常使用希尔方程被施加到该配体 - 受体结合建模。尽管其它方法,例如表面等离子共振技术2,3-允许两个蛋白之间的结合亲和力的测定,这种技术常常是劳动密集型的,昂贵的,并且需要特殊的实验室设备。
竞争LRA能够抑制肽的筛选:在配体 - 受体结合相对于肽浓度定量。这产生描述的肽的抑制作用的剂量 - 反应曲线。数据可以被进一步分析以估计半数最大抑制浓度(IC 50 )阻断肽。
两者的ELISA协议是易于使用,并且可以适合于广泛的研究问题。任何形式的重组蛋白可以用于可靠地并快速确定相互作用的部件。此外,竞争LRA可用于通过使用阻断肽,其目的是为了模仿或配体或受体,以确定配体和受体的关键相互作用位点。如果封闭肽显示有效和特异性抑制,肽占据配体的关键相互作用位点(如肽模拟物的受体)或配体(如肽模拟物的配位体)。
第一个协议描述不同INFLs的在K D值的决心和其受体α亚基, 即使用直接LRA白细胞介素28受体(IL28RA)。接着,第二协议显示如何确定一个20个氨基酸长的肽的能力抑制INFL-IL28RA相互作用。肽被设计成在其受体结合位点与IFNLs竞争,从而使相互作用的分子的理解。此外,该肽可以用于阻止在体外实验IL28RA以确定对下游信号效应4的影响。
研究方案
1.试剂准备
- 以制备碳酸包被缓冲液,溶解0.36克Na 2 CO 3和0.84克的NaHCO 3在100毫升蒸馏水;无菌过滤器通过使用真空从动0.22μm的聚醚砜(PES)膜过滤器,并存储在RT之前使用的缓冲区。
- 通过在磷酸盐中加入0.05%体积/体积的吐温20制备洗涤溶液缓冲盐水(PBS)。
- 通过在100毫升PBS中5克BSA(≥98%),并存储溶解在4℃下制备的5%牛血清白蛋白(BSA)的PBS溶液(封闭溶液)。
- 重组受体,配体和阻止肽
- Reconstitutethe重组人白介素受体α亚基(IL28RA),并根据制造商的说明,并储存于-80℃的重组人干扰素(IFNL1-3)的His标记的配体。 Synthetize阻断肽和如先前所述4中使用。使用PBS中制备不同浓度的配体的秒和在测定中使用的肽。
- 为了制备第一抗体,稀释在PBS中的0.1%BSA的6倍他小鼠单克隆抗体以1:1000稀释。为了制备第二抗体,稀释辣根过氧化物酶(HRP)的PBS缀合的山羊抗小鼠IgG(H + L)含有1 0.1%BSA的1:10,000稀释。
- 通过根据制造商的说明混合试剂A和B制备TMB溶液。
- 通过在RT加入在蒸馏水和商店5 N硫酸(H 2 SO 4)准备终止溶液。
2.酶联免疫测定(ELISA)
注:直接配体-受体相互作用的ELISA(直接LRA, 图1)可以被用于测量受体-配体的解离常数(K D),作为受体-配体结合亲和力的量度。竞争配体-受体相互作用的ELISA(竞争LRA, 图2)的所有流入的肽(和其他阻断化合物),其作用与配体和受体之间的相互作用来干扰的筛选。先前公布5的基本协议进一步优化。
注意:在这两种ELISA方法使用多道移液器用于添加解决方案,以在每一个步骤96孔板的孔中。在溶液澄清或洗涤步骤,直接扔出去的解决方案整合到水槽。
- 直接配体 - 受体相互作用测定(直接LRA)
注意:对于该工作流的示图( 见图1)。- 涂层板的重组受体
- 稀释在碳酸盐缓冲液的重组受体至100毫微克/微升的最终浓度。通过使用多道移液器以及移液100微升到每个具有固定的受体浓度(100毫微克/微升)96孔微量滴定板的涂层的孔中。排除板外墙面,以免以及边缘神器。覆盖有盖板,孵育的板在4°CO / N。
- 阻塞和配体的加入
- 第二天,通过倾斜靠在水槽板除去涂层溶液和3次洗涤液(PBS + 0.05%体积/体积的吐温20)洗涤该板。
- 用200微升的5%BSA溶液到每个用多道移液器井框在涂板的游离受体结合位点和孵育所述板在室温2小时。
- 弃去封闭溶液(见步骤2.1.2.1)和3次洗涤液洗涤该板。
- 制备重组His-标记的配体在不同浓度( 例如,8微克/毫升,4微克/毫升,2微克/毫升,1微克/毫升,0.5微克/毫升,0.25微克/毫升,0.125微克/毫升,0.063微克/毫升,0.031微克/毫升,0.0微克/毫升)的PBS。仅添加PBS的空白孔。
- 加入100微升每配体浓度向孔中一式两份,并在室温孵育2小时的板允许受体 - 配体相互作用。
- 孵化与抗体
- 与配体孵育后,3次洗涤平板用洗涤溶液。
- 吸取100μl的初级抗His小鼠单克隆抗体溶液(1:1,000)的每个孔中。
- 孵育在室温下2小时的板;温育后,弃去抗体溶液(见步骤2.1.2.1)和3次洗涤液洗涤该板。
- 添加100微升HRP偶联的山羊抗小鼠IgG二抗溶液(1:10,000)到每个孔中。将培养板在室温下45分钟。
- 弃去抗体溶液(见步骤2.1.2.1)和3次洗涤液洗涤该板。
- 基材与发展加成
- 使TMB底物溶液到室温,并在1制备TMB底物溶液A和B:1的比例。添加新鲜制备的衬底以每孔100μl,并保持在室温的板15-30分钟。经过充分的山坳或开发加入50微升一站式解决方案。
- 读板和数据分析
注意:所述的协议是基于所测量的信号从特异性结合升起的假定。它可能是估算非特异性结合到该信号的贡献必要的,但是这是出于这个协议的范围。- 直接读取450nm处的吸光度(光密度,OD值)。
- 减去从测量OD值的背景信号和正常化它们。变换的所有值的配位体浓度为对数标度的(基座10,日志10)。
- 积归一化和背景校正OD值(Y轴,对应于被占领受体结合位点的分数)抗配体浓度的对数(X轴,对数10的范围)。
- 为了估计在K D值,拟合数据到Hill方程的形式如下:
tp_upload / 53575 / 53575eq1.jpg"/>
注意:这里Y代表占据受体结合位点和Y 最大最大结合的部分; [L]表示游离配位体和希尔系数的浓度。如果只有一个用于配体结合位点,希尔系数为n = 1,对于具有多于一个的配位体结合位点的系统中,结合展品正协同如果n> 1,负协同如果n <1和没有协同如果n = 1,微观解离常数被称为并对应于半数最大有效浓度EC 50 6。表观解离常数为K D =(K D)ñ。在最简单的,其中n = 1的情况下,解离常数对应于该受体结合位点的一半被占用和KÐ= K D中的配体浓度。这个模型假定质量作用在平衡条件下的结合,以及,只有一小部分加入的配位体与受体结合, 即,[L] >> [RL]。
- 涂层板的重组受体
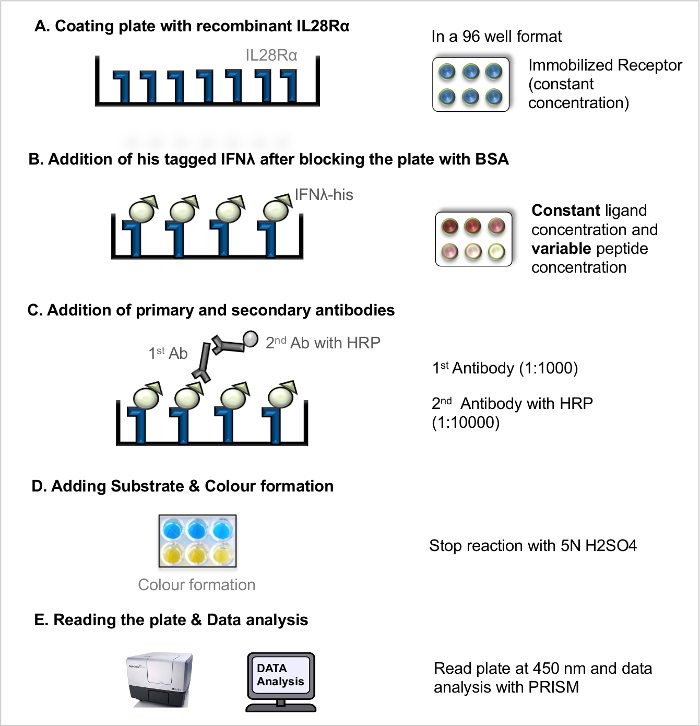
图1. 直接配体-受体相互作用测定(直接LRA)。直接LRA一步一步的协议。 请点击此处查看该图的放大版本。
- 竞争配体 - 受体相互作用测定(竞争LRA)
注意:对于该工作流的示意图参见图2中的竞争LRA程序遵循作为直接LRA除了在配体的重要变化相同的步骤(涂布板,抗体孵育,板发展)和肽加成步骤。合适的阴性对照是用于该测定是必不可少的。在以前的筛选研究如图4所示,加扰的封闭肽没有表现出拮抗作用。- 阻塞 - 配体和阻止肽加成
- 第二天,除去涂层溶液和洗涤所述板(见2.1.2.1)。
- 通过加入200微升的5%BSA溶液,以每孔阻挡涂板,孵育该板在RT 2小时。
- 在固定的浓度(2×20毫微克/毫升)的PBS制备重组His-标记的配体(IFNL1-3)。
- 制备具有不同浓度范围从10nM至100μM的在PBS中,以保证一个剂量-反应曲线的阻塞肽(参照表3)。
注:此启用阻断肽的IC 50值的连续测定。在对照孔,只加固定的配位体浓度没有肽获得最大(100%)的结合。在一片空白,只添加PBS没有配体或肽。 - 加的配位体的50微升(IFNL1-3)和50微升各PE的ptide集中在重复的井。
- 将培养板在室温2小时。
- 读板和数据分析
注意:所述的协议是基于所测量的信号从特异性结合升起的假定。它可能是估算非特异性结合到该信号的贡献必要的,但是这是出于这个协议的范围。- 直接读取450nm处的吸光度(光密度,OD值)。
- 减去从测量OD值的背景信号和正常化它们。变换的所有值的肽浓度对数标度的(基座10,日志10)。
- 积归一化和背景校正OD值(Y轴,对应于被占领受体结合位点的分数)抗配体浓度的对数(X轴,对数10的范围)。
- 来估计IC 50值,与数据拟合到以下公式:
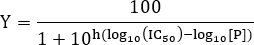
注:此处[P]为肽浓度和Hill斜率。 Hill斜率描述了剂量 - 反应曲线的陡度。将IC 50对应于被观察到的配体和受体之间的结合的50%抑制的抑制剂浓度。
- 阻塞 - 配体和阻止肽加成

图2.竞争配体-受体相互作用测定(竞争LRA)。竞争LRA一步一步的协议。 请点击此处查看该图的放大版本。
结果
使用直接LRA确定INFL1-3及其受体α亚基IL28RA之间的解离常数。结果示于图3:所占据的结合位点的小数值靠着相应的IFN浓度的对数作图。数据的Scatchard作图示于右下角。的结果表明,直接LRA产生一个结合曲线,其可以被进一步分析,以估计在K D值。在K D值,通过拟合数据至希尔方程(方程1)测定。
IFNL...
讨论
ELISA是许多实验室标准和行之有效的方法。我们进一步修改和完善了先前公布的方法5,7。所表现出的一步一步的协议说明了如何能够以简单的方式被用于确定配体-受体相互作用的K个D取值。此外,阻挡肽,与配体 - 受体相互作用干扰的IC 50可被确定。
主要优点是快速安装,易于制备的试剂和熟悉的操作,因为大多数研究人员以前使用的ELISA协议。直接LRA协议是...
披露声明
A.E. was supported by a research grants from the "SNSF Ambizione Score" program (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" University of Basel, Stiftungsinfektionskrankheiten Basel, and Bangeter Rhyner Stiftung. J.L. acknowledges support by an iPhD fellowship of the SystemsX.ch initiative in systems biology program (9th call).
致谢
We thank Prof. J. Stelling (Department of Biosystems Science and Engineering, ETH Zurich and Swiss Institute for Bioinformatics, Basel, Switzerland) for his critical review of the manuscript.
材料
| Name | Company | Catalog Number | Comments |
| Nunc-Immunoplate (F96 Maxi sorp) | Thermo Scientific | 442404 | ELISA plate |
| Sodium carbonate (Na2CO3) | Merck | 497-19-8 | For ELISA plate coating buffer |
| Sodium hydrogen carbomnate(NaHCO3) | Merck | 144-55-8 | For ELISA plate coating buffer |
| Bovine Serum Albumin (BSA) | Sigma | A7030-100G | 5% BSA in PBS for Blocking |
| rhIL-28Rα/IFNλR1 | R&D systems | 5260-MR | Recombinant human interlukin-28 Receptor alpha |
| rhIL-29/IFNλ1 | R&D systems | 1598-IL/CF | Recombinant human interlukin-29/Carrier free/C-terminal 10-His tag |
| rhIL-28A/IFNλ2 | R&D systems | 1587-IL/CF | Recombinant human interlukin-28A/Carrier free/C-terminal 6-His tag |
| rhIL-28B/IFNλ3 | R&D systems | 5259-IL/CF | Recombinant human interlukin-28B/Carrier free/C-terminal 6-His tag |
| 6x His Monoclonal antibody (Mouse) | Clontech | 631212 | Primary antiboy to capture His tagged Ligands |
| Goat anti-Mouse igG (H+L) | Jackson Immuno Research | 115-035-166 | Horseradish Peroxidase conjucated secondary antibody |
| BDoptEIA TMB reagent set | BD Biosciences | 555214 | ELISA - TMB substrate solution |
| Sulfuric acid (H2SO4) | Fulka | 84720 | 5 N H2SO4 (Enzyme reaction stop solution) |
| Synergy/H1 - Microplate reader | BioTeK | ELISA plate reader |
参考文献
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods in enzymology. 545, 103-125 (2014).
- Rossi, G., et al. Biosensor analysis of anti-citrullinated protein/peptide antibody affinity. Analytical biochemistry. 465, 96-101 (2014).
- van der Merwe, P. A., Barclay, A. N. Analysis of cell-adhesion molecule interactions using surface plasmon resonance. Curr Opin Immunol. 8, 257-261 (1996).
- Egli, A., et al. IL-28B is a key regulator of B- and T-cell vaccine responses against influenza. PLoS Pathog. 10, e1004556 (2014).
- Rosenbluh, J., et al. Positively charged peptides can interact with each other, as revealed by solid phase binding assays. Analytical biochemistry. 352, 157-168 (2006).
- Goutelle, S., et al. The Hill equation: a review of its capabilities in pharmacological modelling. Fundamental & clinical pharmacology. 22, 633-648 (2008).
- Levin, A., et al. Peptides derived from HIV-1 integrase that bind Rev stimulate viral genome integration. PLoS One. 4, e4155 (2009).
- Egli, A., Santer, M. D., O'Shea, D., Tyrrell, D. L., Houghton, M. The impact of the interferon-lambda family on the innate and adaptive immune response to viral infections. Emerging infectious diseases. , e51 (2014).
- Gad, H. H., Hamming, O. J., Hartmann, R. The structure of human interferon lambda and what it has taught us. J Interferon Cytokine Res. 30, 565-571 (2010).
- Folch, B., Rooman, M., Dehouck, Y. Thermostability of salt bridges versus hydrophobic interactions in proteins probed by statistical potentials. Journal of chemical information and modeling. 48, 119-127 (2008).
- Yuzlenko, O., Lazaridis, T. Interactions between ionizable amino acid side chains at a lipid bilayer-water interface. The journal of physical chemistry. B. 115, 13674-13684 (2011).
- Tissot, A. C., Vuilleumier, S., Fersht, A. R. Importance of two buried salt bridges in the stability and folding pathway of barnase. Biochemistry. 35, 6786-6794 (1996).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。