このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ELISAベースの結合と競争法は急速にリガンド - 受容体相互作用を決定するために、
要約
The presented protocols describe two enzyme-linked immunosorbent assay (ELISA) based techniques for the rapid investigation of ligand-receptor interactions: The first assay allows the determination of dissociation constant between ligand and receptor. The second assay enables a rapid screening of blocking peptides for ligand-receptor interactions.
要約
A comprehensive understanding of signaling pathways requires detailed knowledge regarding ligand-receptor interaction. This article describes two fast and reliable point-by-point protocols of enzyme-linked immunosorbent assays (ELISAs) for the investigation of ligand-receptor interactions: the direct ligand-receptor interaction assay (LRA) and the competition LRA. As a case study, the ELISA based analysis of the interaction between different lambda interferons (IFNLs) and the alpha subunit of their receptor (IL28RA) is presented: the direct LRA is used for the determination of dissociation constants (KD values) between receptor and IFN ligands, and the competition LRA for the determination of the inhibitory capacity of an oligopeptide, which was designed to compete with the IFNLs at their receptor binding site. Analytical steps to estimate KD and half maximal inhibitory concentration (IC50) values are described. Finally, the discussion highlights advantages and disadvantages of the presented method and how the results enable a better molecular understanding of ligand-receptor interactions.
概要
シグナル伝達経路の包括的な理解は、リガンド - 受容体相互作用についての詳細な知識が必要です。その特定の受容体と特定のリガンドとの相互作用を評価するためのほとんどの方法は、高価な、時間がかかり、労働集約的であり、特定の機器と専門知識1を必要とします 。
直接リガンド - 受容体相互作用アッセイ(LRA)と競争LRA:この記事では、酵素結合免疫吸着検定法(ELISA)に基づいて、リガンド - 受容体相互作用を調査するために、2つの高速かつ信頼性の高いポイントバイポイントプロトコルについて説明します。 ELISAは、日常的にほとんどすべての研究室で使用される高度に敏感な特定の、容易に入手できる技術です。 ELISAを実施し、様々な様式で適合させることができます。提示プロトコルは異なるラムダインターフェロン(INFLs)とその受容体との間の相互作用の調査のために最適化されています。
直接LRAはquantificatiを可能にしますリガンド - 受容体のリガンド濃度に対して結合し、従って、結合曲線が得られます。リガンド-受容体相互作用のための適切なモデルを使用して、データは、さらに、解離定数(K D)を推定するために分析することができます。
提示されたプロトコルでは、一般的に使用されるHillの式は、リガンド - 受容体結合をモデル化するために適用されます。このような表面プラズモン共鳴技術2,3のような他の方法は、2つのタンパク質間の結合親和性の決意を可能にするが、この技術は、しばしば、労働集約的で、高価であり、特別な実験装置を必要とします。
競争LRAは、阻害ペプチドのスクリーニングを可能にします:リガンド - 受容体結合は、ペプチド濃度に対して定量化されます。これは、ペプチドの阻害効果を説明する用量応答曲線をもたらします。データはさらに、半最大阻害濃度(IC 50を推定するために分析することができます)ブロッキングペプチド。
両方のELISAプロトコルを使用するのは簡単であり、研究課題の広い範囲に適合させることができます。任意の種類の組換えタンパク質は、確実かつ迅速な相互作用部分を決定することができます。また、競争LRAは、リガンドまたは受容体のいずれかを模倣するように設計されたブロッキングペプチドを用いて、リガンドと受容体の重要な相互作用部位を決定するために用いることができます。ブロッキングペプチドが効率的かつ特異的阻害を示した場合、ペプチドは、リガンド(ペプチド模倣受容体の場合)またはリガンド(ペプチド模倣リガンドの場合)のの重要な相互作用部位を占めています。
最初のプロトコルが異なるINFLsのK D値の決意と直接LRAを使用して、それらの受容体、 すなわち、インターロイキン28受容体(IL28RA)のαサブユニットを説明します。次に、第二のプロトコルは、20アミノ酸長のペプチドの能力を決定する方法を示していますINFL-IL28RAの相互作用を阻害します。ペプチドは、それらの受容体結合部位でIFNLsと競合するように設計され、したがって、相互作用の分子的理解を可能にします。さらに、このペプチドは、下流のシグナル伝達の効果4への影響を決定するためのin vitro実験においてIL28RAをブロックするために使用することができます。
プロトコル
1.試薬の調製
- 炭酸塩コーティング緩衝液を調製するために、蒸留水100ml中のNa 2 CO 3 0.84 gでのNaHCO 3 0.36グラム溶解します。滅菌フィルター使用するまで室温で0.22μmのポリエーテルスルホン(PES)膜フィルターとストアを駆動真空を使用してバッファ。
- リン酸0.05%(v / v)のトゥイーン20を添加することにより、洗浄溶液を調製するには、緩衝生理食塩水(PBS)。
- 4°Cで100 mlのPBSとストアに5gのBSA(≥98%)を溶解させて、PBS溶液中の5%ウシ血清アルブミン(BSA)(ブロッキング溶液)を準備します。
- 組み換え受容体、リガンドと遮断ペプチド
- Reconstitutethe組換えヒトインターロイキン受容体αサブユニット(IL28RA)および-80℃でのメーカーの指示や店舗に従って、ヒトIFN(IFNL1-3)の組換えHisタグ付きリガンド。 Synthetizeは、ペプチドを遮断し、以前4に記載されているように使用します。リガンドの種々の濃度を調製するためにPBSを使用してsおよびアッセイにおける使用のためのペプチド。
- 一次抗体を調製する1において、0.1%BSAを含むPBSで6×彼のマウスモノクローナル抗体を希釈する:1,000希釈。 :10,000希釈した二次抗体を調製するために、1に0.1%BSAを含むPBS中の西洋ワサビペルオキシダーゼ(HRP)結合ヤギ抗マウスIgG(H + L)を希釈します。
- 製造業者の指示に従って試薬A及びBを混合しTMB溶液を調製します。
- 室温で蒸留水と店舗5 N硫酸(H 2 SO 4)を添加することにより停止溶液を調製します。
2.酵素免疫測定法(ELISA)
注:ELISA(直接的LRA、 図1)は、受容体-リガンド結合親和性の測定値として、受容体-リガンドの解離定数(K D)を測定するために使用することができる直接リガンド-受容体相互作用。競争リガンド-受容体相互作用をELISA(競争LRA、 図2)すべてリガンドと受容体との間の相互作用を妨害するように作用するペプチド(および他のブロッキング化合物)、のスクリーニングOWS。以前は5公開された基本的なプロトコルをさらに最適化しました。
注:方法は、各工程において、96ウェルプレートのウェルに溶液を添加するためのマルチチャンネルピペットを使用するELISAの両方で。ソリューションのデカントまたは洗浄工程では、シンクに直接ソリューションを捨てます。
- 直接リガンド - 受容体相互作用アッセイ(直接LRA)
注:ワークフローの説明のために( 図1を参照)。- 組換え受容体を有するコーティングプレート
- 100 ngの/μlの最終濃度になるように炭酸緩衝液中の組換え受容体を希釈します。よくマルチチャンネルピペットを使用して、それぞれに100μlのピペッティングすることによって固定された受容体濃度(100 ngの/μl)を96ウェルマイクロタイタープレートのコートウェル。よくエッジアーチファクトを回避するために、プレートの外側の壁を除外します。蓋付きのプレートをカバーし、インキュベート4°CO / Nでプレート。
- ブロッキングとリガンドの追加
- 翌日、シンクに対してプレートを傾けることによってコーティング溶液を除去し、洗浄溶液(PBS + 0.05%(v / v)のツイーン20)でプレートを3回洗浄します。
- よくマルチチャンネルピペットを使用して、それぞれに5%BSA溶液200μlを使用してコーティングされたプレート中の遊離受容体結合部位をブロックし、室温で2時間静置します。
- ブロッキング溶液を捨て(ステップ2.1.2.1を参照してください。)及び洗浄液でプレートを3回洗浄します。
- 異なる濃度( 例えば、8 / mlの、4 / mlの、2 / mlの、1 / mlの、0.5μgの/ mlの、0.25μgの/ mlで、0.125μgの/ mlで、0.063μgので組換えHisタグリガンドを準備/ PBS mlの、0.031 / mlの、0.0 / mlの)。ブランクウェルにPBSのみを追加します。
- 二連のウェルに各リガンド濃度の100μlを添加して、受容体 - リガンドを可能に室温で2時間プレートをインキュベートインタラクション。
- 抗体とのインキュベーション
- リガンドとのインキュベーション後、洗浄溶液でプレートを3回洗浄します。
- ピペット一次抗Hisマウスモノクローナル抗体溶液(1:1,000)を100μl各ウェルに。
- 室温で2時間プレートをインキュベートします。インキュベーション後、(ステップ2.1.2.1を参照)。抗体溶液を捨て、洗浄溶液でプレートを3回洗浄します。
- HRPの100μlのを追加したヤギ抗マウスIgG二次抗体溶液(1:10,000)連結された各ウェルに。 RTで45分間プレートをインキュベートします。
- 抗体溶液を捨てる(ステップ2.1.2.1を参照してください。)及び洗浄液でプレートを3回洗浄します。
- 基板開発の追加
- RTにTMB基質溶液を持参し、1でTMB基質溶液AとBを準備:1の比率。各ウェルに100μlのを新しく調製した基質を加え、15〜30分間、室温でプレートを保持します。十分COL後または開発は、50μlの停止溶液を追加します。
- プレートおよびデータ分析を読みます
注:記載されたプロトコルは、測定された信号は、特異的な結合から上昇するという仮定に基づいています。信号に非特異的結合の寄与を推定する必要があるかもしれませんが、これは、このプロトコルの範囲外です。- 直接450nmでの吸光度(光学密度、OD)を読みます。
- 測定されたOD値からバックグラウンド信号を減算し、それらを正規化します。対数目盛(ベース10、10をログに記録)にリガンド濃度のすべての値を変換します。
- (X軸、10 logスケール)リガンド濃度の対数に対して正規化し、バックグラウンドOD値(Y軸は、占有受容体結合部位の割合に相当する)を補正プロット。
- K D値を推定するために、Hillの式の次の形式にデータをフィット:
tp_upload / 53575 / 53575eq1.jpg "/>
注:ここでYは、占有受容体結合部位およびY maxの最大結合の割合を示し、 [L]は遊離リガンドとヒル係数の濃度を意味します。リガンドのための唯一の結合部位が存在する場合は、ヒル係数nは、複数のリガンド結合部位を備えたシステムの場合= 1、結合展示正の協同である場合はN> 1、負の協同場合はN <1かつnがない場合は、協同= 1微視的解離定数と呼ばれ、最大半減有効濃度EC 50 6に相当します。見かけの解離定数K D =(K D)nです。最も簡単な場合はn = 1で、受容体結合部位の半分が占有及びK D = K Dされるときのリガンド濃度の解離定数に相当します。このモデルは平衡条件下で結合質量作用を想定し、同様のごく一部こと追加されたリガンドは、受容体に結合している、すなわち、[L] >> [RL]。
- 組換え受容体を有するコーティングプレート
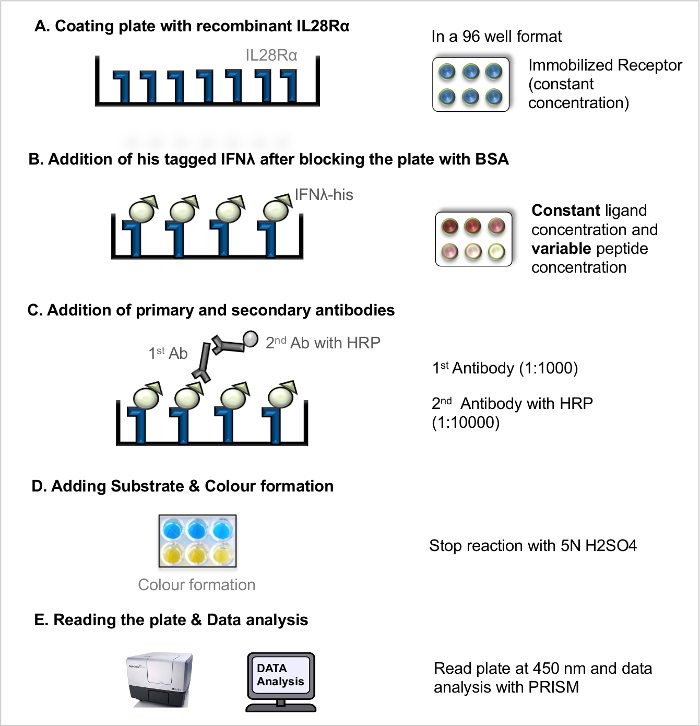
図1. 直接リガンド-受容体相互作用アッセイ(直接LRA)。直接LRAのためのステップバイステップのプロトコル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 競争リガンド - 受容体相互作用アッセイ(競争LRA)
注:ワークフローの図については、 図2を参照してください競争LRA手順は、リガンドにおける重要な変更点を除いて直接LRA(プレートをコーティングし、抗体インキュベーション、プレートの開発)と同じ手順に従っており、追加のステップをペプチド。適切なネガティブコントロールは、このアッセイのために不可欠です。前のスクリーニング研究では 4、スクランブルブロッキングペプチドは拮抗作用を示しませんでした。- ブロッキング - リガンドと遮断ペプチドの追加を
- 翌日、コーティング溶液を除去し、(2.1.2.1を参照)、プレートを洗浄します。
- 各ウェルに、5%BSA溶液200μlを加えることによって、コーティングされたプレートをブロックし、室温で2時間、プレートをインキュベートします。
- PBS中の固定濃度(2X-20 ngの/ mlの)で組換えHisタグ付きリガンド(IFNL1-3)を準備します。
- 用量反応曲線を保証するために10 nMでから、PBS中100μMの範囲の異なる濃度のブロッキングペプチド( 表3参照)を準備します。
注:これは、ブロッキングペプチドのIC 50値のその後の決意を可能にします。対照ウェルでは、最大(100%)の結合を誘導するためにペプチドなしのみ固定リガンド濃度を追加します。ブランクでは、リガンドまたはペプチドなしでPBSのみを追加します。 - リガンド(IFNL1-3)50μlの各PEの50μLを追加重複のウェルにptide濃度。
- RTで2時間静置します。
- プレートおよびデータ分析を読みます
注:記載されたプロトコルは、測定された信号は、特異的な結合から上昇するという仮定に基づいています。信号に非特異的結合の寄与を推定する必要があるかもしれませんが、これは、このプロトコルの範囲外です。- 直接450nmでの吸光度(光学密度、OD)を読みます。
- 測定されたOD値からバックグラウンド信号を減算し、それらを正規化します。対数目盛(ベース10、10をログに記録)にペプチド濃度のすべての値を変換します。
- (X軸、10 logスケール)リガンド濃度の対数に対して正規化し、バックグラウンドOD値(Y軸は、占有受容体結合部位の割合に相当する)を補正プロット。
- IC 50値を推定するために、以下の式にデータをフィットします。
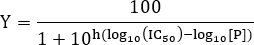
注:ここでは[P]ペプチド濃度及びヒル勾配です。ヒルスロープは、用量反応曲線の勾配を記述する。 IC 50は、リガンドと受容体との結合の50%阻害が観察された阻害剤濃度に相当します。
- ブロッキング - リガンドと遮断ペプチドの追加を

図2.競争リガンド-受容体相互作用アッセイ(競争LRA)。競技LRAのためのステップバイステップのプロトコル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
結果
INFL1-3とその受容体αサブユニットIL28RA間の解離定数は、直接LRAを用いて決定しました。結果を図3に示されている:占有結合部位の割合は、各IFN濃度の対数に対してプロットしました。データのスキャッチャードプロットは、右下隅に表示されます。結果は、直接LRAは、さらにK D値を推定するために分析することができる結合曲線を生じることを?...
ディスカッション
ELISAは多くの研究室のための標準的かつ十分に確立された方法です。我々はさらに修正され、以前に発表された方法5,7を改善しています。実証ステップバイステップのプロトコルは、リガンド-受容体相互作用のK D値を決定するための簡単な方法で使用することができる方法を示しています。また、リガンド - 受容体相互作用を妨害するブロッキングペプチドのIC50を決定する?...
開示事項
A.E. was supported by a research grants from the "SNSF Ambizione Score" program (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" University of Basel, Stiftungsinfektionskrankheiten Basel, and Bangeter Rhyner Stiftung. J.L. acknowledges support by an iPhD fellowship of the SystemsX.ch initiative in systems biology program (9th call).
謝辞
We thank Prof. J. Stelling (Department of Biosystems Science and Engineering, ETH Zurich and Swiss Institute for Bioinformatics, Basel, Switzerland) for his critical review of the manuscript.
資料
| Name | Company | Catalog Number | Comments |
| Nunc-Immunoplate (F96 Maxi sorp) | Thermo Scientific | 442404 | ELISA plate |
| Sodium carbonate (Na2CO3) | Merck | 497-19-8 | For ELISA plate coating buffer |
| Sodium hydrogen carbomnate(NaHCO3) | Merck | 144-55-8 | For ELISA plate coating buffer |
| Bovine Serum Albumin (BSA) | Sigma | A7030-100G | 5% BSA in PBS for Blocking |
| rhIL-28Rα/IFNλR1 | R&D systems | 5260-MR | Recombinant human interlukin-28 Receptor alpha |
| rhIL-29/IFNλ1 | R&D systems | 1598-IL/CF | Recombinant human interlukin-29/Carrier free/C-terminal 10-His tag |
| rhIL-28A/IFNλ2 | R&D systems | 1587-IL/CF | Recombinant human interlukin-28A/Carrier free/C-terminal 6-His tag |
| rhIL-28B/IFNλ3 | R&D systems | 5259-IL/CF | Recombinant human interlukin-28B/Carrier free/C-terminal 6-His tag |
| 6x His Monoclonal antibody (Mouse) | Clontech | 631212 | Primary antiboy to capture His tagged Ligands |
| Goat anti-Mouse igG (H+L) | Jackson Immuno Research | 115-035-166 | Horseradish Peroxidase conjucated secondary antibody |
| BDoptEIA TMB reagent set | BD Biosciences | 555214 | ELISA - TMB substrate solution |
| Sulfuric acid (H2SO4) | Fulka | 84720 | 5 N H2SO4 (Enzyme reaction stop solution) |
| Synergy/H1 - Microplate reader | BioTeK | ELISA plate reader |
参考文献
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods in enzymology. 545, 103-125 (2014).
- Rossi, G., et al. Biosensor analysis of anti-citrullinated protein/peptide antibody affinity. Analytical biochemistry. 465, 96-101 (2014).
- van der Merwe, P. A., Barclay, A. N. Analysis of cell-adhesion molecule interactions using surface plasmon resonance. Curr Opin Immunol. 8, 257-261 (1996).
- Egli, A., et al. IL-28B is a key regulator of B- and T-cell vaccine responses against influenza. PLoS Pathog. 10, e1004556 (2014).
- Rosenbluh, J., et al. Positively charged peptides can interact with each other, as revealed by solid phase binding assays. Analytical biochemistry. 352, 157-168 (2006).
- Goutelle, S., et al. The Hill equation: a review of its capabilities in pharmacological modelling. Fundamental & clinical pharmacology. 22, 633-648 (2008).
- Levin, A., et al. Peptides derived from HIV-1 integrase that bind Rev stimulate viral genome integration. PLoS One. 4, e4155 (2009).
- Egli, A., Santer, M. D., O'Shea, D., Tyrrell, D. L., Houghton, M. The impact of the interferon-lambda family on the innate and adaptive immune response to viral infections. Emerging infectious diseases. , e51 (2014).
- Gad, H. H., Hamming, O. J., Hartmann, R. The structure of human interferon lambda and what it has taught us. J Interferon Cytokine Res. 30, 565-571 (2010).
- Folch, B., Rooman, M., Dehouck, Y. Thermostability of salt bridges versus hydrophobic interactions in proteins probed by statistical potentials. Journal of chemical information and modeling. 48, 119-127 (2008).
- Yuzlenko, O., Lazaridis, T. Interactions between ionizable amino acid side chains at a lipid bilayer-water interface. The journal of physical chemistry. B. 115, 13674-13684 (2011).
- Tissot, A. C., Vuilleumier, S., Fersht, A. R. Importance of two buried salt bridges in the stability and folding pathway of barnase. Biochemistry. 35, 6786-6794 (1996).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved