Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir ELISA Tabanlı Bağlama ve Rekabet Yöntemi Hızla Ligand-reseptör Etkileşimleri belirleme
Bu Makalede
Özet
The presented protocols describe two enzyme-linked immunosorbent assay (ELISA) based techniques for the rapid investigation of ligand-receptor interactions: The first assay allows the determination of dissociation constant between ligand and receptor. The second assay enables a rapid screening of blocking peptides for ligand-receptor interactions.
Özet
A comprehensive understanding of signaling pathways requires detailed knowledge regarding ligand-receptor interaction. This article describes two fast and reliable point-by-point protocols of enzyme-linked immunosorbent assays (ELISAs) for the investigation of ligand-receptor interactions: the direct ligand-receptor interaction assay (LRA) and the competition LRA. As a case study, the ELISA based analysis of the interaction between different lambda interferons (IFNLs) and the alpha subunit of their receptor (IL28RA) is presented: the direct LRA is used for the determination of dissociation constants (KD values) between receptor and IFN ligands, and the competition LRA for the determination of the inhibitory capacity of an oligopeptide, which was designed to compete with the IFNLs at their receptor binding site. Analytical steps to estimate KD and half maximal inhibitory concentration (IC50) values are described. Finally, the discussion highlights advantages and disadvantages of the presented method and how the results enable a better molecular understanding of ligand-receptor interactions.
Giriş
sinyal yollarının kapsamlı bir anlayış ligand-reseptör etkileşimi hakkında detaylı bilgi gerektirir. Spesifik reseptör ile belirli bir ligandın etkileşiminin değerlendirmek için en yöntemleri zaman alıcı, emek yoğun, pahalı ve özel ekipman ve uzmanlık 1 gerektirir.
doğrudan ligand-reseptör etkileşimi deneyi (LRA) ve rekabet LRA: Bu makale immünosorbent deneyi (ELISA) ile bağlantılı bir enzimin göre ligand-reseptör etkileşimi araştırmak için iki hızlı ve güvenilir bir nokta-nokta protokollerini tasvir eder. ELISA rutin hemen hemen her laboratuvarda kullanılan yüksek, duyarlı özel ve hazır bir tekniktir. ELISA yapıldı ve çeşitli usullerde uyarlanabilir. sunulan protokoller farklı lambda interferonlar (INFLs) ve reseptörü arasındaki etkileşimin araştırılması için optimize edilmiştir.
Doğrudan LRA bir quantificati sağlarLigand-reseptör ligand konsantrasyonuna göre bağlanma ve böylece bağlanma eğrisini verir. Ligand-reseptör etkileşimi için uygun bir model kullanılarak veriler ayrıca ayrılma sabiti (KD) tahmin etmek için analiz edilebilir.
Sunulan protokol olarak, yaygın olarak kullanılan, Hill denklemi ligand-reseptör modeli uygulanır. Bu tür yüzey plazmon rezonans tekniği 2,3 gibi diğer yöntemler, iki protein arasındaki bağlanma afiniteleri tespitine imkan da, bu teknoloji, emek-yoğun, pahalı ve özel laboratuar donanımına ihtiyaç duymaktadır.
Yarışma LRA önleyici peptidlerin taranmasını sağlar: bağlayıcı ligand-reseptör peptit konsantrasyonuna göre ölçülür. Bu peptid inhibitör etkisini açıklayan bir doz-yanıt eğrisi elde edilir. Veriler bundan başka, 50 IC (yarım maksimal inhibisyon konsantrasyonunu tahmin etmek için analiz edilebilir ) bloke peptid.
Hem ELISA protokolleri kullanımı kolay ve araştırma soruları geniş bir şekilde adapte edilebilir. herhangi bir rekombinant proteinler, güvenilir ve hızlı iletişim düzenlemelerini belirlemek için kullanılır. Buna ek olarak, rekabet LRA ligand veya reseptör, ya taklit edecek şekilde tasarlanmıştır bloke peptidler kullanılarak ligand ve reseptör kritik etkileşim bölgelerine belirlemek için kullanılabilir. bloke peptid etkin ve spesifik inhibisyonunu gösteriyorsa, peptid kritik bir etkileşim ligandın sitesi (peptid taklit halinde reseptör) veya ligand (peptit taklit halinde ligandı) kaplar.
İlk protokol farklı INFLs K D değeri belirlenmesi ve bunların reseptörünün alfa alt birimini, yani açıklar, direkt LRA kullanarak interlökin-28 reseptör (IL28RA). Daha sonra, ikinci protokol bir 20 amino asit uzunluğunda bir peptid kapasitesini belirlemek için gösterilmiştirINFL-IL28RA etkileşimi inhibe eder. peptid reseptör bağlanma yerinde IFNLs ile rekabet etmek için tasarlanmış olup bir etkileşimin moleküler bir anlayış mümkün kılar. Bundan başka, bu peptidin aşağı akış sinyalleme etkileri 4 üzerindeki etkisini belirlemek için in vitro deneylerde IL28RA engellemek için kullanılabilir.
Protokol
1. Reaktif Hazırlama
- Karbonat kaplama tamponu hazırlamak 0.36 g Na 2 CO 3 ve 3 100 ml saf su 0.84 gr NaHCO çözmek için; steril filtre kullanımına kadar oda sıcaklığında 0.22 um polietersülfon (PES) zar filtresi ve mağaza tahrik edilen bir vakum kullanılarak tamponu.
- Fosfat% 0.05 h / h Tween 20 eklenerek yıkama çözeltisi hazırlayın tuz (PBS) tamponlu.
- 4 ° C 'de 5 g, 100 mi, PBS içinde BSA (≥98%) ve mağaza eritilmesi ile% 5 bovin serum albümini (BSA) PBS çözeltisi içinde (bloke çözelti) hazırlayın.
- Rekombinant bir reseptörü ligandları ve Bloklama peptitler
- Reconstitutethe rekombinant insan interlökin reseptörü alfa alt-birimi (IL28RA) ve -80 ° C 'de, üreticinin talimatlarına ve saklamak için uygun olarak insan IFN (IFNL1-3) rekombinant His-etiketli ligandlar. Sentezini peptidleri engelleme ve daha önce 4 tarif edildiği şekilde kullanıldı. ligandın farklı konsantrasyonlarda hazırlamak için PBS kullanarakS ve tahlillerde kullanılmak için peptidler.
- Primer antikor hazırlamak için, 1 ile% 0.1 BSA ile PBS içinde 6X His fare monoklonal antikoru seyreltilmiş: 1,000 seyreltme. seyreltik ikincil antikor hazırlamak için yaban turpu peroksidazı (HRP) 1% 0.1 BSA ile PBS içinde konjuge keçi anti-fare IgG (H + L): 10,000 seyreltme.
- üreticinin talimatlarına uygun olarak belirteç, A, karıştırma ve B ile TMB çözeltisi hazırlayın.
- Oda sıcaklığında damıtılmış su ve mağaza 5N sülfürik asit (H 2 SO4) ekleyerek durdurma çözeltisi hazırlayın.
2. immünosorbent deneyleri (ELISA) Enzim bağlantılı
NOT: Doğrudan ligand-reseptör etkileşimi ELISA (doğrudan LRA, Şekil 1) reseptör-ligand bağlanma afınitesinin bir ölçüsü olarak, sabit bir reseptör-ligand ayrışma (KD) ölçülmesi için kullanılabilir. Yarışma ligand-reseptör etkileşimi ELISA (rekabet LRA, Şekil 2) Bütünligand ve reseptör arasındaki etkileşime müdahale etmek hareket peptidler (ve diğer bloke edici bileşiklerin), elenmesi akımları. Daha önce 5 yayımlandı temel protokol daha da optimize edildi.
Not: Yöntemler, her adımda 96-kuyulu plakanın kuyularına çözüm eklemek için çok kanallı pipet kullanın ELISA hem de. Çözelti tortusundan ayırma veya yıkama adımlarında, lavabo doğrudan çözüm dışarı atmak.
- Doğrudan ligand-reseptör-etkileşim deneyi (doğrudan LRA)
NOT: iş akışı bir örnek için (Şekil 1).- Rekombinan reseptör ile kaplama Plaka
- 100 ng / ul nihai konsantrasyona kadar karbonat tamponu içerisinde yeniden birleştirici alıcısını seyreltilir. de çok kanallı bir pipet kullanılarak her 100 ul pipetleme sabit reseptör konsantrasyonu (100 ng / ml) ile 96-çukurlu mikrotitre plakasının Coat kuyu. iyi kenar artifakı önlemek için plakanın dış duvarları hariç. Bir kapak ile plaka Kapak ve inkübe4 ° CO / N plaka.
- Engelleme ve Ligand eklenmesi
- Sonraki gün, lavaboya plaka eğerek Kaplama çözeltisini çıkarın ve yıkama çözeltisi (PBS +% 0.05 hac / hac Tween 20) ile plaka 3 kez yıkayın.
- de çok kanallı bir pipet kullanılarak her% 5 BSA çözeltisi 200 ul kullanılarak kaplanmış bir tabak üzerinde serbest reseptör bağlanma sitesi engelleme ve oda sıcaklığında 2 saat boyunca plaka inkübe edin.
- Engelleme çözüm atın (. adım 2.1.2.1) ve yıkama solüsyonu ile plaka 3 kez yıkayın.
- Farklı konsantrasyonlarda (rekombinant His-etiketli ligandları hazırlayın, örneğin, 8 ug / ml, 4 mg / ml, 2 ug / ml, 1 ug / ml, 0.5 ug / ml, 0.25 ug / ml, 0.125 ng / ml, 0.063 ng / ml'lik son yoğunluğa seyreltildi, 0.031 ug / ml, 0.0 ug / ml). boş kuyularda sadece PBS ekleyin.
- Kopya halinde kuyulara her bir ligand konsantrasyonu 100 ul ilave edin ve reseptör-ligand sağlayan oda sıcaklığında 2 saat süre ile inkübe levhasınıetkileşimi.
- Antikorları ile inkübasyon
- lejandlarla kuluçkaya yatırmayı takiben, yıkama çözeltisi plaka 3 kez yıkayın.
- Pipet birincil anti-His fare monoklonal antikoru çözeltisi (1: 1000), 100 ul her bir göze.
- 2 saat oda sıcaklığında inkübe levhasını; İnkübasyondan sonra antikor çözeltisi (adım 2.1.2.1 bkz.) iptal ve yıkama çözeltisi plaka 3 kez yıkayın.
- Her bir oyuğa: HRP 100 ul keçi anti-fare IgG ikincil antikor çözeltisi (10.000 1) bağlanmış ekleyin. Oda sıcaklığında, 45 dakika boyunca inkübasyona bırakılır.
- antikor çözüm atın (. adım 2.1.2.1) ve yıkama solüsyonu ile plaka 3 kez yıkayın.
- Substrat ve Kalkınma eklenmesi
- Oda sıcaklığına TMB substrat çözüm getirmek ve 1 TMB substrat çözeltisi A ve B hazırlanması: 1 oranında. Taze her çukuruna substrat hazırlanan 100 ul ilave edin ve 15-30 dakika boyunca oda sıcaklığında plaka tutun. Yeterli col sonra veya geliştirme 50 ul durdurma çözüm ekleyin.
- Plaka ve Veri Analizi Okuma
Not: Açıklanan protokol ölçülen sinyal spesifik bağlanma yükselir varsayımına dayanır. Sinyale belirsiz bağlama katkısını tahmin etmek gerekli olabilir ama bu protokol kapsamı dışındadır.- şirketinden 450 nm'de absorbansı (optik yoğunluk, OD) okuyun.
- ölçülen OD değerleri arka plan sinyalini çıkarma ve bunları normalleştirmek. (10 günlük, tabanı 10) logaritmik ölçeğe ligand konsantrasyonunun tüm değerleri Transform.
- Normalize ve arka plan OD değerleri düzeltilmiş arsa (10 ölçek log, X ekseni) ligand konsantrasyonunun logaritmasının karşı (Y-ekseni, işgal reseptör bağlanma sitelerinin fraksiyonu karşılık gelir).
- K D değerini tahmin etmek Hill denkleminin aşağıdaki forma veri sığdırmak:
tp_upload / 53575 / 53575eq1.jpg "/>
NOT: Burada Y, işgal reseptör bağlanma siteleri ve Y max bağlayıcı maksimal bölümünü gösterir; [L] serbest ligand ve Hill katsayısı konsantrasyonunu ifade eder. ligand için tek bağlanma sahası varsa, Hill katsayısı n birden fazla ligand birleşme alanından sistemler için = 1, bağlayıcı sergileyen pozitif bir birliktelik olup eğer n> 1, negatif kooperativiteye eğer n <1 ve n Hayır kooperativiteye = 1 mikroskopik ayrışma sabiti olarak adlandırılır ve yarı maksimal etkili konsantrasyon EC50 6 karşılık gelir. Görünen ayrışma sabiti Kd = (KD) n. En basit durumda n = 1, bağlanma yerleri reseptör yarısı işgal ve Kd = Kd hangi ligand konsantrasyonu ayrışma sabiti tekabül. Bu model sadece küçük bir kısmını bu yanı sıra, denge koşulları altında bağlayıcı kitle eylemi varsayarilave ligand reseptöre bağlanır, yani [L] >> [rj].
- Rekombinan reseptör ile kaplama Plaka
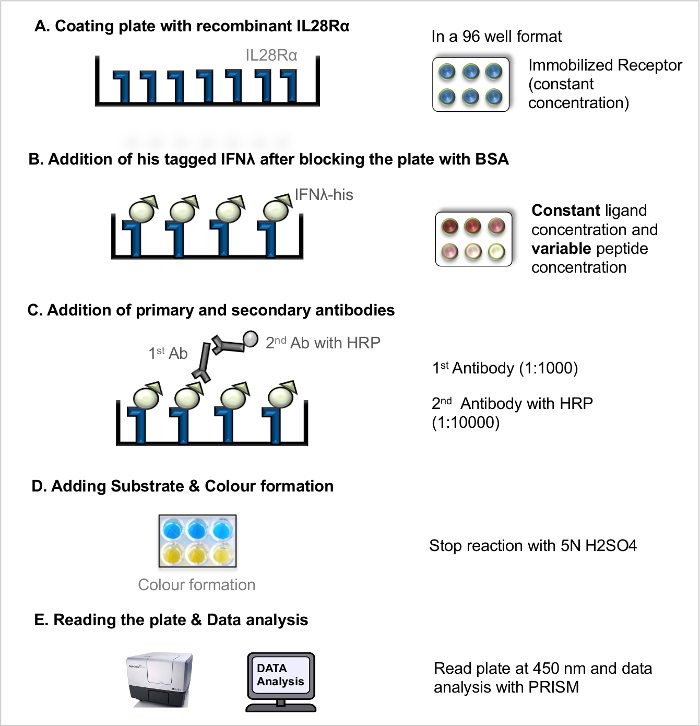
Şekil 1. Doğrudan ligand-reseptör-etkileşim deneyi (doğrudan LRA). Direkt LRA için adım-adım protokolü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Rekabet Ligand-Reseptör-Etkileşim Analizi (rekabet LRA)
NOT:. Iş akışının bir illüstrasyon bakınız Şekil 2 için rekabet LRA prosedürü ligand önemli değişiklikler dışında aynı direkt LRA adımları (plaka kaplama, antikor inkübasyon, plaka geliştirme) izler ve ilave adımını peptidierinin. Uygun negatif kontroller Bu deney için gereklidir. Bir önceki tarama çalışmasında 4, şifreli engelleme peptid antagonistik etki göstermemiştir.- Engelleme - Ligand ve Engelleme Peptidlerin eklenmesi
- Ertesi gün, kaplama çözüm kaldırmak ve (2.1.2.1 bakınız) plakayı yıkayın.
- her çukuruna% 5 BSA çözeltisi 200 ul ekleyerek kaplanmış bir tabak üzerinde bloke edin ve oda sıcaklığında 2 saat boyunca plaka inkübe edin.
- PBS içinde sabit bir konsantrasyonu (2x-20 ng / ml) yeniden birleştirici His-etiketli ligandları (IFNL1-3) hazırlayın.
- Bir doz-tepki eğrisi garanti etmek için 10 nM ila 100, PBS içinde uM arasında değişen farklı konsantrasyonlarda bloke peptidi (bakınız Tablo 3) hazırlanır.
NOT: Bu bloklama peptidi için IC50 değeri daha sonra belirlenmesini mümkün kılar. Kontrol kuyuları, en fazla (% 100) bağlanma elde etmek için peptit olmayan tek sabit bir ligand konsantrasyonu ekleyin. Boş olarak, ligand veya peptid olmayan tek PBS ilave edin. - ligandlar, 50 ul (IFNL1-3) ve her bir PE 50 ul eklekopyalar halinde çukurlara ptide konsantrasyonu.
- Oda sıcaklığında 2 saat boyunca plaka inkübe edin.
- Plaka ve veri analizi Okuma
Not: Açıklanan protokol ölçülen sinyal spesifik bağlanma yükselir varsayımına dayanır. Sinyale belirsiz bağlama katkısını tahmin etmek gerekli olabilir ama bu protokol kapsamı dışındadır.- şirketinden 450 nm'de absorbansı (optik yoğunluk, OD) okuyun.
- ölçülen OD değerleri arka plan sinyalini çıkarma ve bunları normalleştirmek. (10 günlük, tabanı 10) logaritmik ölçeğe peptid konsantrasyonu tüm değerlerini dönüştürmek.
- Normalize ve arka plan OD değerleri düzeltilmiş arsa (10 ölçek log, X ekseni) ligand konsantrasyonunun logaritmasının karşı (Y-ekseni, işgal reseptör bağlanma sitelerinin fraksiyonu karşılık gelir).
- IC50 değerini belirlemek için, aşağıdaki eşitliğe uygun verileri:
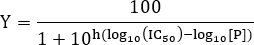
NOT: Burada [P] peptid konsantrasyonu ve Tepesi eğimi. Doruk eğim doz-yanıt eğrisinin dikliği açıklanmaktadır. IC50 ligand ve reseptör arasındaki bağlanmanın% 50 inhibisyonu gözlemlenirse edildiği inhibitör konsantrasyonuna tekabül etmektedir.
- Engelleme - Ligand ve Engelleme Peptidlerin eklenmesi

Şekil 2. Yarışma ligand-reseptör etkileşim deneyi (yarışma LRA). Rekabet LRA için adım-adım protokolü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Sonuçlar
INFL1-3 ve reseptör alfa alt birimi IL28RA arasındaki ayrılma sabitleri doğrudan LRA kullanılarak belirlenmiştir. Sonuçlar Şekil 3'te gösterilmektedir: bağlantı konumları fraksiyonu ilgili IFN konsantrasyonu logaritmasına karşı grafiği çizilir. verilerinin Scatchard çizimi sağ alt köşesinde gösterilir. Sonuçlar doğrudan LRA daha KD değerini tahmin etmek için analiz edilebilir bir bağlama eğrisi, verir olduğunu göstermektedir. ...
Tartışmalar
ELISA birçok laboratuvar için standart ve köklü bir yöntemdir. Biz daha değiştirilebilir ve daha önce yayınlanan bir yöntem, 5,7 iyileştirilmiştir. Gösterilen adım adım protokolü ligand-reseptör etkileşimlerinin KD değerlerinin belirlenmesi için basit bir şekilde nasıl kullanılabileceğini göstermektedir. Buna ek olarak, ligand-reseptör etkileşimi engelleyen bir bloke edici peptidin IC50 belirlenebilir.
En araştırmacılar daha önce bir ELISA...
Açıklamalar
A.E. was supported by a research grants from the "SNSF Ambizione Score" program (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" University of Basel, Stiftungsinfektionskrankheiten Basel, and Bangeter Rhyner Stiftung. J.L. acknowledges support by an iPhD fellowship of the SystemsX.ch initiative in systems biology program (9th call).
Teşekkürler
We thank Prof. J. Stelling (Department of Biosystems Science and Engineering, ETH Zurich and Swiss Institute for Bioinformatics, Basel, Switzerland) for his critical review of the manuscript.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Nunc-Immunoplate (F96 Maxi sorp) | Thermo Scientific | 442404 | ELISA plate |
| Sodium carbonate (Na2CO3) | Merck | 497-19-8 | For ELISA plate coating buffer |
| Sodium hydrogen carbomnate(NaHCO3) | Merck | 144-55-8 | For ELISA plate coating buffer |
| Bovine Serum Albumin (BSA) | Sigma | A7030-100G | 5% BSA in PBS for Blocking |
| rhIL-28Rα/IFNλR1 | R&D systems | 5260-MR | Recombinant human interlukin-28 Receptor alpha |
| rhIL-29/IFNλ1 | R&D systems | 1598-IL/CF | Recombinant human interlukin-29/Carrier free/C-terminal 10-His tag |
| rhIL-28A/IFNλ2 | R&D systems | 1587-IL/CF | Recombinant human interlukin-28A/Carrier free/C-terminal 6-His tag |
| rhIL-28B/IFNλ3 | R&D systems | 5259-IL/CF | Recombinant human interlukin-28B/Carrier free/C-terminal 6-His tag |
| 6x His Monoclonal antibody (Mouse) | Clontech | 631212 | Primary antiboy to capture His tagged Ligands |
| Goat anti-Mouse igG (H+L) | Jackson Immuno Research | 115-035-166 | Horseradish Peroxidase conjucated secondary antibody |
| BDoptEIA TMB reagent set | BD Biosciences | 555214 | ELISA - TMB substrate solution |
| Sulfuric acid (H2SO4) | Fulka | 84720 | 5 N H2SO4 (Enzyme reaction stop solution) |
| Synergy/H1 - Microplate reader | BioTeK | ELISA plate reader |
Referanslar
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods in enzymology. 545, 103-125 (2014).
- Rossi, G., et al. Biosensor analysis of anti-citrullinated protein/peptide antibody affinity. Analytical biochemistry. 465, 96-101 (2014).
- van der Merwe, P. A., Barclay, A. N. Analysis of cell-adhesion molecule interactions using surface plasmon resonance. Curr Opin Immunol. 8, 257-261 (1996).
- Egli, A., et al. IL-28B is a key regulator of B- and T-cell vaccine responses against influenza. PLoS Pathog. 10, e1004556 (2014).
- Rosenbluh, J., et al. Positively charged peptides can interact with each other, as revealed by solid phase binding assays. Analytical biochemistry. 352, 157-168 (2006).
- Goutelle, S., et al. The Hill equation: a review of its capabilities in pharmacological modelling. Fundamental & clinical pharmacology. 22, 633-648 (2008).
- Levin, A., et al. Peptides derived from HIV-1 integrase that bind Rev stimulate viral genome integration. PLoS One. 4, e4155 (2009).
- Egli, A., Santer, M. D., O'Shea, D., Tyrrell, D. L., Houghton, M. The impact of the interferon-lambda family on the innate and adaptive immune response to viral infections. Emerging infectious diseases. , e51 (2014).
- Gad, H. H., Hamming, O. J., Hartmann, R. The structure of human interferon lambda and what it has taught us. J Interferon Cytokine Res. 30, 565-571 (2010).
- Folch, B., Rooman, M., Dehouck, Y. Thermostability of salt bridges versus hydrophobic interactions in proteins probed by statistical potentials. Journal of chemical information and modeling. 48, 119-127 (2008).
- Yuzlenko, O., Lazaridis, T. Interactions between ionizable amino acid side chains at a lipid bilayer-water interface. The journal of physical chemistry. B. 115, 13674-13684 (2011).
- Tissot, A. C., Vuilleumier, S., Fersht, A. R. Importance of two buried salt bridges in the stability and folding pathway of barnase. Biochemistry. 35, 6786-6794 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır