JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
ELISA 기반 바인딩과 경쟁 방법은 신속 리간드 - 수용체 상호 작용을 확인하는 방법
요약
The presented protocols describe two enzyme-linked immunosorbent assay (ELISA) based techniques for the rapid investigation of ligand-receptor interactions: The first assay allows the determination of dissociation constant between ligand and receptor. The second assay enables a rapid screening of blocking peptides for ligand-receptor interactions.
초록
A comprehensive understanding of signaling pathways requires detailed knowledge regarding ligand-receptor interaction. This article describes two fast and reliable point-by-point protocols of enzyme-linked immunosorbent assays (ELISAs) for the investigation of ligand-receptor interactions: the direct ligand-receptor interaction assay (LRA) and the competition LRA. As a case study, the ELISA based analysis of the interaction between different lambda interferons (IFNLs) and the alpha subunit of their receptor (IL28RA) is presented: the direct LRA is used for the determination of dissociation constants (KD values) between receptor and IFN ligands, and the competition LRA for the determination of the inhibitory capacity of an oligopeptide, which was designed to compete with the IFNLs at their receptor binding site. Analytical steps to estimate KD and half maximal inhibitory concentration (IC50) values are described. Finally, the discussion highlights advantages and disadvantages of the presented method and how the results enable a better molecular understanding of ligand-receptor interactions.
서문
신호 전달 경로의 포괄적 인 이해는 리간드 - 수용체 상호 작용에 대한 자세한 지식이 필요합니다. 그 특정 수용체와 특정 리간드의 상호 작용을 평가하기위한 대부분의 방법은 시간이 많이 걸리고, 노동 집약적, 비싼 특정 장비와 전문 지식 1을 필요로한다.
직접 리간드 - 수용체 상호 작용 분석 (LRA)와 경쟁 LRA :이 문서에서는 면역 분석법 (ELISA)을 연결하는 효소에 따라 리간드 - 수용체 상호 작용을 조사하기 위해 두 빠르고 신뢰할 수있는 포인트 별 프로토콜을 설명합니다. ELISA는 일상적으로 거의 모든 실험에서 사용 된 매우 민감한 특정 용이 가능한 기술이다. ELISA를 수행하고 다양한 패션에 적응 될 수있다. 제시된 프로토콜은 다른 인터페론 람다 (INFLs)와 그 수용체 간의 상호 작용 연구를 위해 최적화된다.
직접 LRA는 quantificati 수 있습니다리간드 - 수용체의 리간드 농도에 대해 결합함으로써 결합 곡선을 산출한다. 리간드 - 수용체 상호 작용에 대한 적절한 모델을 사용하여, 데이터가 상기 해리 상수 (K D)를 추정하기 위해 분석 될 수있다.
제시된 프로토콜, 일반적으로 사용되는 힐 방정식 리간드 결합 수용체를 모델링에 적용된다. 이러한 표면 플라즈몬 공명 기술 2,3- 다른 방법은 두 단백질 사이의 결합 친화도의 측정을 할 수 있지만,이 기술은 종종 노동 집약적 고가이고 특별한 실험 장비를 필요로한다.
LRA는 경쟁 저해 펩티드의 스크리닝을 가능 : 리간드 결합 수용체 펩티드가 농도에 대해 정량화된다. 이것은 펩티드의 억제 효과를 설명하는 용량 - 반응 곡선을 산출한다. 데이터는 상기 IC (50) (반 최대한 억제 농도를 추정하기 위해 분석 될 수있다 ) 블로킹 펩타이드.
두 ELISA 프로토콜은 사용하기 쉽고 연구 질문의 넓은 범위로 적용 할 수있다. 어떤 종류의 재조합 단백질을 확실하고 빠르게 상호 작용 부분을 결정하기 위해 사용될 수있다. 또한, 경쟁 LRA는 리간드 또는 수용체를 모방하도록 설계 차단 펩티드를 사용하여 리간드 및 수용체의 중요한 상호 작용 위치를 결정하는데 사용될 수있다. 차단 펩타이드 효율적이고 특정 억제를 표시하는 경우, 펩타이드는 중요한 상호 작용 리간드의 사이트 (펩타이드 모방 경우 수용체) 또는 리간드 (펩타이드 모방 경우 리간드)를 차지한다.
제 1 프로토콜은 다른 INFLs의 K D 값 결정 및 리셉터의 알파 서브 유니트, 즉 설명 직접 LRA를 사용하여 인터루킨 28 수용체 (IL28RA). 다음에, 제 2 프로토콜에 20 아미노산 길이의 펩티드의 능력을 확인하는 방법을 도시INFL-IL28RA 상호 작용을 억제한다. 펩티드들은 수용체 결합 부위에서 IFNLs 경쟁하도록 설계함으로써 상호 작용 분자 이해할 수있다. 또한,이 펩타이드는 하류 시그널링 4 효과에 미치는 영향을 결정하기 위해 시험 관내 실험에서 IL28RA을 차단하는데 사용될 수있다.
프로토콜
1. 시약 준비
- 탄산염 코팅 완충액을 제조 0.36 g 나 2 CO 3 및도 3의 100 ml의 증류수에 0.84 g의 NaHCO3를 용해하는 단계; 멸균 필터를 사용까지 RT에서 0.22 ㎛의 폴리 에테르 설폰 (PES) 멤브레인 필터 저장 구동 진공을 이용하여 버퍼.
- 인산염에 0.05 % v / V를 트윈 20을 추가하여 세척 용액을 제조 식염수 (PBS)를 버퍼.
- 4 ℃에서 5g을 100㎖의 PBS에 BSA (≥98 %) 저장을 용해시켜 5 % 소 혈청 알부민 (BSA) PBS 용액 (블로킹 용액)을 준비한다.
- 재조합 수용체, 리간드 및 차단 펩티드
- Reconstitutethe 재조합 인간 인터루킨 수용체 알파 서브 유닛 (IL28RA) 및 -80 ° C에서 제조업체의 지침 및 저장에 따라 인간의 IFN (IFNL1-3)의 재조합 그의 - 태그 리간드. Synthetize은 펩티드를 차단 및 이전 (4) 기술로 사용된다. 리간드의 다양한 농도를 준비하는 PBS를 사용하여S 및 검정에 사용하기위한 펩타이드.
- 차 항체를 준비하려면 1에서 0.1 % BSA와 PBS의 6 배 그의 마우스 단일 클론 항체를 희석 : 1,000 희석. 희석 차 항체를 제조 고추 냉이 퍼 옥시 다제 (HRP) (1)에서 0.1 % BSA와 함께 PBS에 공액 된 염소 항 - 마우스 IgG (H + L) : 10,000 희석.
- 제조자의 지시에 따른 시약을 혼합하여 B TMB 용액을 제조 하였다.
- 실온에서 증류수와 저장소에 5 N 황산 (H 2 SO 4)을 추가하여 스톱 솔루션을 준비합니다.
2. 면역 흡수 분석법 (ELISA를)을 효소 결합
주 : 직접적인 리간드 - 수용체 상호 작용을 ELISA (직접 LRA도 1) 수용체 - 리간드 결합 친화도의 척도로서, 일정한 수용체 리간드의 해리 (K D)를 측정하는데 사용될 수있다. 경쟁 리간드 - 수용체 상호 작용 ELISA (경쟁 LRA, 그림 2) 모든리간드와 수용체 사이의 상호 작용을 방해하는 작용 펩타이드 (및 기타 차단 화합물)의 심사 OWS. 이전에 5 게시 된 기본 프로토콜은 더욱 최적화되었다.
주 :이 방법의 각 단계에서 96 웰 플레이트에 대한 솔루션을 추가 멀티 채널 피펫을 사용하여 ELISA 양이다. 솔루션 캔트 또는 세척 단계에서, 싱크에 직접 솔루션을 밖으로 던져.
- 직접 리간드 - 수용체 상호 작용 분석 (직접 LRA)
참고 : 워크 플로의 그림은 (그림 1 참조).- 재조합 수용체와 코팅 플레이트
- 100 NG / μL 최종 농도 카보네이트 버퍼 재조합 수용체 희석. 잘 멀티 채널 피펫을 사용하여 각 100 μl를 피펫 팅에 의해 고정 된 수용체 농도 (100 NG / μL) 96 웰 마이크로 타이 플레이트의 코트 우물. 잘 가장자리 유물을 방지하기 위해 판의 외벽을 제외합니다. 뚜껑 접시를 덮고을 품어4 ° CO / N에서 판.
- 차단 및 리간드의 추가
- 다음 날, 싱크대에 대한 판을 기울여 코팅 용액을 제거하고 세척 용액 (PBS + 0.05 % v / V를 트윈 20)와 플레이트 3 번 씻는다.
- 물론 멀티 채널 피펫을 사용하여 각각 5 % BSA 용액 200 μl를 사용하여 도장 판의 자유 수용체 결합 부위를 차단하고 실온에서 2 시간 동안 플레이트를 배양한다.
- 블로킹 용액을 폐기 (. 단계 2.1.2.1 참조) 세정액 판을 3 회 세척 하였다.
- 상이한 농도 (AT 재조합에게 그의 태그가 리간드를 준비 예 8 ㎍ / ㎖, 4 μg의 / ㎖, 2 ㎍ / ㎖, 1 ㎍ / ㎖, 0.5 ㎍ / ㎖, 0.25 ㎍ / ㎖, 0.125 ㎍ / ㎖, 0.063 μg의 / PBS에서 ㎖, 0.031 μg의 / ㎖, 0.0 μg의 / ㎖). 빈 우물 만 PBS를 추가합니다.
- 중복 우물에 각 리간드 농도의 100 μl를 추가하고 수용체 - 리간드를 허용 RT에서 2 시간 동안 접시를 품어상호 작용.
- 항체와 배양
- 리간드와 인큐베이션 후, 세척 용액으로 플레이트를 3 회 세척 하였다.
- 피펫 차 항 그 마우스 모노클로 날 항체 용액 (1 : 1000) 100 ㎕를 각 웰에 관한 것이다.
- 2 시간 동안 실온에서 접시를 품어; 배양 후, 항체 용액을 (단계 2.1.2.1 참조). 버리고 세정액으로 플레이트를 3 회 세척 하였다.
- 물론 각 : HRP 100 ㎕를 염소에게 항 - 마우스 IgG 이차 항체 용액 (10,000 1) 결합 추가합니다. 실온에서 45 분 동안 접시를 품어.
- 항체 용액을 폐기 (. 단계 2.1.2.1 참조) 세정액 판을 3 회 세척 하였다.
- 기판 및 개발의 추가
- 실온 TMB 기질 용액을 가져와 1 TMB 기질을 용액 A 및 B를 준비 : 1 비율. 갓 각 웰에 기판을 준비 100 μl를 추가하고 15 ~ 30 분 동안 실온에서 접시를 유지합니다. 충분한 COL 후 또는 개발은 50 μl의 중지 솔루션을 추가 할 수 있습니다.
- 접시와 데이터 분석 읽기
참고 설명 프로토콜 측정 신호가 특이 적 결합에서 상승한다는 가정에 기초한다. 이 신호에 비특이적 결합 기여도를 추정해야 할 수도 있지만, 이것은이 프로토콜의 범위를 벗어난다.- 직접 450 nm에서의 흡광도 (광학 밀도, OD)를 참조하십시오.
- 측정 된 OD 값에서 배경 신호를 빼고이를 정규화. (10를 기록,베이스 10) 로그 스케일로 리간드 농도의 모든 값을 변환.
- 정규화 배경 OD 값 보정 플롯 (10 로그 스케일, X 축)의 리간드 농도에 대해 대수 (Y 축 점유 수용체 결합 부위의 일부에 해당).
- K D 값을 추정하는, 힐 방정식은 다음 형태로 데이터를 적합 :
tp_upload / 53575 / 53575eq1.jpg "/>
참고 : 여기에 Y 점유 수용체 결합 부위와 Y 최대 바인딩을 최대의 분율을 의미한다; [L]은 무료로 리간드와 힐 계수의 농도를 나타낸다. 리간드에 대한 하나의 결합 부위가 존재하면, 힐 계수 N 이상의 리간드 결합 부위를 가진 시스템의 경우 = 1, 결합 전시 긍정적 협동성되면, N> 1 음극 협동성 경우 N <1 N 만약 아니오 협동성 = 1 현미경 해리 상수라고하고 반 최대 유효 농도 EC 50 (6)에 해당합니다. 겉보기 해리 상수는 K의 D = (K D) n은. 간단한 경우 N = 1에서, 결합 부위의 절반 수용체 점령의 K D = K D되어있는 리간드 농도 해리 상수에 대응한다. 이 모델은 단지 작은 분획이뿐만 아니라, 평형 상태에서 바인딩 질량 동작을 가정추가 된 리간드, 수용체에 결합되어 즉, [L] >> [RL].
- 재조합 수용체와 코팅 플레이트
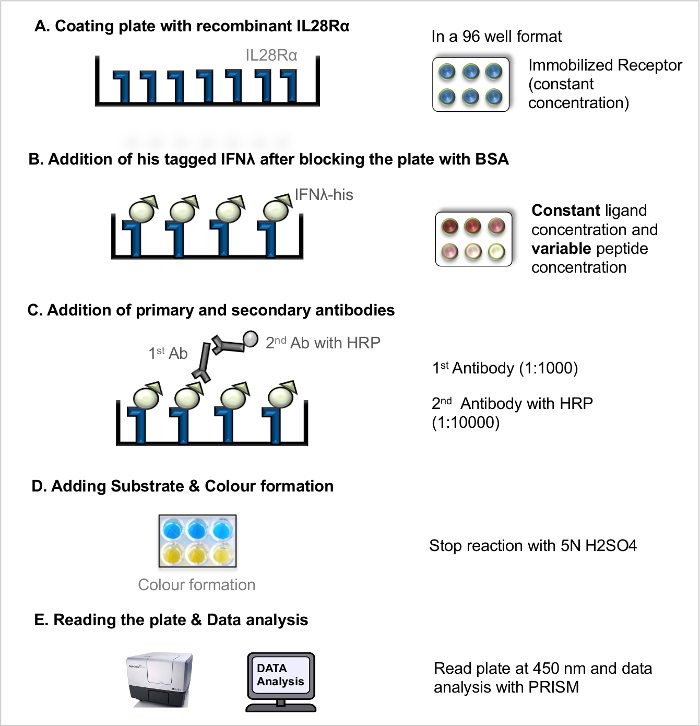
그림 1. 직접 리간드 - 수용체 상호 작용 분석 (직접 LRA). 직접 LRA에 대한 단계별 프로토콜입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 경쟁 리간드 - 수용체 상호 작용 분석 (경쟁 LRA)
참고 :. 워크 플로우의 그림은 그림 2를 참조하십시오 경쟁 LRA 절차는 리간드에 중요한 변경 사항을 제외하고는 동일한 직접 LRA로 단계 (접시 코팅, 항체 배양, 플레이트 개발) 다음과 첨가 단계를 펩티드. 적절한 음성 대조군은이 분석을 위해 필수적이다. 이전 스크리닝 연구에서 4, 스크램블 차단 펩타이드 길항 효과를 보이지 않았다.- 차단 - 리간드 및 차단 펩타이드의 추가를
- 다음날, 도포 액을 제거하고 (2.1.2.1 참조) 플레이트를 세척한다.
- 각 웰을 5 % BSA 용액 200 μl를 첨가함으로써 도장 판을 차단하고 실온에서 2 시간 동안 플레이트를 배양한다.
- PBS의 고정 된 농도 (2 × 20 NG / ㎖)에서 그의 재조합 태깅 리간드 (IFNL1-3)을 준비한다.
- 용량 - 반응 곡선을 보장하는 PBS 10 nM 내지 100 μM의 범위의 다양한 농도로 차단 펩티드 (참조 표 3)를 준비한다.
참고 :이 차단 펩타이드의 IC (50) 값의 후속 결정을 할 수 있습니다. 대조군 웰에서 최대 (100 %) 결합을 유도하는 펩티드없이 단지 고정 리간드의 농도를 추가한다. 빈에서 리간드 또는 펩티드없이 단지 PBS를 추가합니다. - 리간드의 50 μL (IFNL1-3) 및 각 PE의 50 μl를 추가중복의 우물에 ptide 농도.
- 실온에서 2 시간 동안 접시를 품어.
- 플레이트 및 데이터 분석 읽기
참고 설명 프로토콜 측정 신호가 특이 적 결합에서 상승한다는 가정에 기초한다. 이 신호에 비특이적 결합 기여도를 추정해야 할 수도 있지만, 이것은이 프로토콜의 범위를 벗어난다.- 직접 450 nm에서의 흡광도 (광학 밀도, OD)를 참조하십시오.
- 측정 된 OD 값에서 배경 신호를 빼고이를 정규화. (10를 기록,베이스 10) 로그 스케일로 펩타이드 농도의 모든 값을 변환.
- 정규화 배경 OD 값 보정 플롯 (10 로그 스케일, X 축)의 리간드 농도에 대해 대수 (Y 축 점유 수용체 결합 부위의 일부에 해당).
- IC 50 값을 측정하기 위해, 다음 식에 맞게 데이터 :
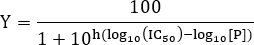
참고 : 여기에 [P]는 펩타이드 농도와 힐 슬로프입니다. 힐 기울기는 용량 - 반응 곡선의 기울기에 대해 설명합니다. IC (50)는 수용체와 리간드 사이의 결합의 50 % 억제가 관찰되는 억제제의 농도에 상당한다.
- 차단 - 리간드 및 차단 펩타이드의 추가를

그림 2. 경쟁 리간드 - 수용체 상호 작용 분석 (경쟁 LRA). 경쟁 LRA에 대한 단계별 프로토콜입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
INFL1-3 및 수용체 알파 소단위 IL28RA 사이의 해리 상수는 직접 LRA를 사용하여 측정 하였다. 결과는도 3에 도시되어 차지하는 결합 부위의 비율은 각각의 IFN 농도의 로그에 대해 도시된다. 데이터의 스캐 챠드 플롯은 오른쪽 하단 모서리에 표시됩니다. 결과는 직접 LRA는 상기 K D 값을 추정하기 위해 분석 될 수있다 결합 곡선을 얻을 수 있음을 나타낸다. K...
토론
ELISA는 많은 실험실에 대한 표준과 잘 확립 된 방법이다. 우리는 더 수정 이전에 게시 된 방법 5,7를 개선했다. 입증 단계별 프로토콜이 리간드 - 수용체 상호 작용의 K D 값을 결정하는 간단한 방법으로 사용할 수있는 방법을 도시한다. 또한, 리간드 - 수용체 상호 작용을 방해 차단 펩타이드 IC50이 측정 될 수있다.
대부분의 연구자들은 이전 ELISA 프로토콜을 사?...
공개
A.E. was supported by a research grants from the "SNSF Ambizione Score" program (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" University of Basel, Stiftungsinfektionskrankheiten Basel, and Bangeter Rhyner Stiftung. J.L. acknowledges support by an iPhD fellowship of the SystemsX.ch initiative in systems biology program (9th call).
감사의 말
We thank Prof. J. Stelling (Department of Biosystems Science and Engineering, ETH Zurich and Swiss Institute for Bioinformatics, Basel, Switzerland) for his critical review of the manuscript.
자료
| Name | Company | Catalog Number | Comments |
| Nunc-Immunoplate (F96 Maxi sorp) | Thermo Scientific | 442404 | ELISA plate |
| Sodium carbonate (Na2CO3) | Merck | 497-19-8 | For ELISA plate coating buffer |
| Sodium hydrogen carbomnate(NaHCO3) | Merck | 144-55-8 | For ELISA plate coating buffer |
| Bovine Serum Albumin (BSA) | Sigma | A7030-100G | 5% BSA in PBS for Blocking |
| rhIL-28Rα/IFNλR1 | R&D systems | 5260-MR | Recombinant human interlukin-28 Receptor alpha |
| rhIL-29/IFNλ1 | R&D systems | 1598-IL/CF | Recombinant human interlukin-29/Carrier free/C-terminal 10-His tag |
| rhIL-28A/IFNλ2 | R&D systems | 1587-IL/CF | Recombinant human interlukin-28A/Carrier free/C-terminal 6-His tag |
| rhIL-28B/IFNλ3 | R&D systems | 5259-IL/CF | Recombinant human interlukin-28B/Carrier free/C-terminal 6-His tag |
| 6x His Monoclonal antibody (Mouse) | Clontech | 631212 | Primary antiboy to capture His tagged Ligands |
| Goat anti-Mouse igG (H+L) | Jackson Immuno Research | 115-035-166 | Horseradish Peroxidase conjucated secondary antibody |
| BDoptEIA TMB reagent set | BD Biosciences | 555214 | ELISA - TMB substrate solution |
| Sulfuric acid (H2SO4) | Fulka | 84720 | 5 N H2SO4 (Enzyme reaction stop solution) |
| Synergy/H1 - Microplate reader | BioTeK | ELISA plate reader |
참고문헌
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods in enzymology. 545, 103-125 (2014).
- Rossi, G., et al. Biosensor analysis of anti-citrullinated protein/peptide antibody affinity. Analytical biochemistry. 465, 96-101 (2014).
- van der Merwe, P. A., Barclay, A. N. Analysis of cell-adhesion molecule interactions using surface plasmon resonance. Curr Opin Immunol. 8, 257-261 (1996).
- Egli, A., et al. IL-28B is a key regulator of B- and T-cell vaccine responses against influenza. PLoS Pathog. 10, e1004556 (2014).
- Rosenbluh, J., et al. Positively charged peptides can interact with each other, as revealed by solid phase binding assays. Analytical biochemistry. 352, 157-168 (2006).
- Goutelle, S., et al. The Hill equation: a review of its capabilities in pharmacological modelling. Fundamental & clinical pharmacology. 22, 633-648 (2008).
- Levin, A., et al. Peptides derived from HIV-1 integrase that bind Rev stimulate viral genome integration. PLoS One. 4, e4155 (2009).
- Egli, A., Santer, M. D., O'Shea, D., Tyrrell, D. L., Houghton, M. The impact of the interferon-lambda family on the innate and adaptive immune response to viral infections. Emerging infectious diseases. , e51 (2014).
- Gad, H. H., Hamming, O. J., Hartmann, R. The structure of human interferon lambda and what it has taught us. J Interferon Cytokine Res. 30, 565-571 (2010).
- Folch, B., Rooman, M., Dehouck, Y. Thermostability of salt bridges versus hydrophobic interactions in proteins probed by statistical potentials. Journal of chemical information and modeling. 48, 119-127 (2008).
- Yuzlenko, O., Lazaridis, T. Interactions between ionizable amino acid side chains at a lipid bilayer-water interface. The journal of physical chemistry. B. 115, 13674-13684 (2011).
- Tissot, A. C., Vuilleumier, S., Fersht, A. R. Importance of two buried salt bridges in the stability and folding pathway of barnase. Biochemistry. 35, 6786-6794 (1996).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유