需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在小鼠胚胎干细胞结构功能研究使用重组酶介导的盒式交换
摘要
蛋白质常含有可发挥不同的细胞功能多个域。基因敲除(KO)不考虑这个功能的多样性。这里,我们报告在KO胚胎干细胞的重组介导的盒式交换(RMCE)系的结构 - 功能的方法,其允许各种功能结构域或蛋白质的变体的分子清扫。
摘要
在小鼠胚胎或胚胎干细胞(mESCs)基因工程允许对于给定的蛋白质的功能的研究。蛋白质是细胞的工作母机和经常由多个功能性结构域,其可以通过翻译后修饰的影响的。整个蛋白在有条件的或组成型敲除(KO)小鼠的耗尽不考虑这一功能多样性和调节。先前报道的mESC的线和衍生的小鼠模型,其中停靠位点FLPE重组介导的盒式交换(RMCE)插入所述ROSA26(R26)基因座内,被。在这里,我们在结构与功能的办法,允许多域蛋白质的不同功能的分子解剖报告。为此,RMCE兼容小鼠必须用基因敲除小鼠杂交,然后RMCE兼容KO mESCs必须隔离。接着,推定救援构建体的面板可以被引入到经由RMCE targeti的R26轨迹NG。所述救援候选的cDNA可以使用重组克隆的靶向载体的RMCE位点之间很容易地插入。接着,KO mESCs被转染的化合物,连同FLPE重组酶表达质粒靶向载体。 RMCE重新激活在ROSA26停放地点的启动子的新霉素抗性基因,并允许正确的靶向事件的选择。以这种方式,获得接近100%的高效率的定位,从而允许在一个半高通量的方式多个推定的救援构建体的插入。最后,R26驱动救援构建体的多个可以针对其营救在亲本KO mESCs观察到表型的能力进行测试。我们目前在P120连环蛋白(p120ctn各)使用内胚层分化的胚状体(EB)的表型读数KO mESCs一个验证的原理结构与功能的研究。这种方法使重要领域的确定,假定下游途径,与疾病相关的点背后对于给定的蛋白质KO表型的突变。
引言
据估计,哺乳动物的基因组包含约20000个蛋白质编码基因。选择性剪接和翻译后修饰进一步增加蛋白质的剧目。蛋白具有模块化结构1和通常包含多个相互作用结构域,其允许其招募不同的蛋白质复合物以及它们在多种细胞过程2的参与。一个例子是所谓的p120ctn各多功能蛋白。 p120ctn各由Ctnnd1基因编码,并且由通过N端和C端区域侧接的大型中央犰狳重复结构域。的p120ctn各犰狳域结合经典钙黏着蛋白,其参与细胞 - 细胞粘着的高度保守的近膜结构域,但它也结合所述转录阻遏Kaiso。 p120ctn各的N-末端结构域具有不同的激酶,磷酸酶,小RhoGTPases,和微管相关p相互作用roteins 3。有趣的是,作为选择性剪接的结果,可以从四个备选起始密码子4产生同种型p120ctn各。亚型p120ctn各1A是最长的,因为它是从最-5' 翻译起始密码子,并含有全长N-末端片段。在同种型中p120ctn各3和4所示,该N端片段部分和完全,分别删除。了解蛋白质(或蛋白质亚型)和他们的域名在不同的细胞功能的确切作用仍然是一个挑战。
基因靶向mESCs使蛋白质功能的研究,通过相应基因的基因缺失和发育的重要疾病相关的基因和通路的识别已经广泛贡献。这一突破在反向遗传学在mESC的分离和基因靶向的领域的发展的结果,由于同源重组5 。同源重组是在其中的DNA片段的双链(DS)DNA断裂后两个相似或相同的核酸部分之间交换的过程。通常情况下,HR是低效的,因为双链DNA断裂是罕见的。最近,同源定向基因靶向的效率可以使用位点特异性核酸酶6,7被增加,但不幸的是,这些都是容易脱靶效应8。一个更可靠的技术,以使基因靶向是RMCE,这是基于位点特异性重组系统,如酶Cre / loxP位或FLPE / FRT。 loxP和FRT序列在噬菌体P1被发现和酿酒酵母 ,分别和由34个碱基对,包括确定该网站的取向的不对称8bp的序列。在另一方面,中,定向例如,DNA拉伸内的两个loxP位将决定两侧装接loxP DNA是否变得切除或I在的Cre介导的重组9 nversed。此外,Cre重组酶也可以诱导易位如果两个站点位于不同染色体上。 RMCE采用异种重组位不交叉反应和嵌入在一个基因位点的优势。在包含由相同的异种位点侧翼的DNA片段的供体质粒的存在,重组酶将插入该DNA片段成因为双同时易位( 图1)的RMCE兼容基因组基因座。在这里,只有正确RMCE靶向克隆可以使药物抗性由于对传入向量的启动子,恢复了"俘获"无启动子的新霉素抗性基因(neo R)存在于所述对接单元的R26基因组( 图1) 10,11。这导致了非常高的靶向效率,通常接近100%11,</ SUP> 12。总之,基于RMCE靶向效率高,可用于结构 - 功能研究;但是,它需要一个预先设计的基因组位点。
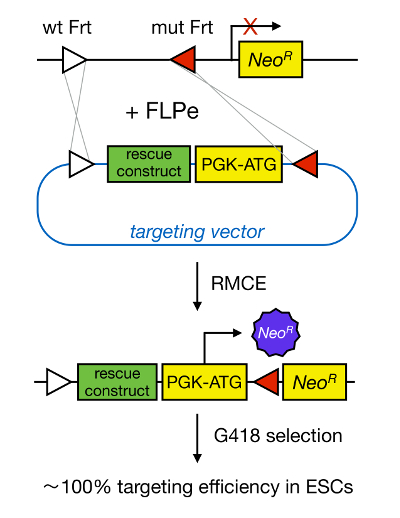
图1. RMCE介导的靶向示意图。 RMCE允许DNA片段从进入靶向载体至限定基因组基因座的交换如果两个怀有2个异种FRT位点(由白色和红色三角形描绘)。此外,工程化基因组基因座包含一个启动子和截短的新霉素抗性(NEO R)基因。通过在进入的DNA片段提供启动子和起始密码子,只有正确的重组事件恢复新霉素抗性,从而导致高的定位效率。 请点击此处查看T的放大版他的身影。
在mESCs基因组工程允许RMCE兼容小鼠的产生。在1981年,两组成功地从胚泡的内细胞团(ICM)捕获多能细胞,并且在培养13 和 14保持它们。 mESCs是能够自我更新和分化成所有类型的胚胎和成年细胞,包括生殖细胞谱系。因此,在基因靶向mESCs通过组成型或条件(使用酶Cre / loxP系统)KO小鼠的发展,使反向遗传学研究。然而,分离的小鼠ES细胞中的经典方法是非常低效的。几个重大的改进已大大增加成功率,用于导出mESC的线,包括使用限定的血清替代(SR)培养基中15的,含有SR和胎牛血清(FBS)16 mESC的介质之间交替,并且使用药理的逻辑化合物如pluripotin或2I 17。 Pluripotin,小合成分子,允许mESCs的未分化状态在不存在白血病抑制因子(LIF)和小鼠胚胎成纤维细胞(MEF中)18传播。最后,已经显示,mESCs可以以非常高的效率(接近100%)时的SR / FBS培养基交替协议与LIF和pluripotin 19,20组合来分离。这些协议使能随后用于结构 - 功能研究RMCE兼容KO mESCs的有效隔离。
本文描述了使一个以确定负责特定细胞过程的蛋白中的关键的结构域或残基的方法。为此,先进的技术,实现高效mESC的隔离,靶向载体组件和mESC的目标管道是创建天。与蛋白同种型,结构域突变体,和下游效应物,例如,大板可以在KO mESCs被引入并可以针对其营救体外 KO表型的能力进行评估。
研究方案
在老鼠身上所有的实验都按照制度,国家和欧洲法规的动物进行。
1. RMCE兼容KO mESCs的分离
- 繁殖与RMCE兼容的小鼠,如ROSALUC小鼠10或ROSA26-iPSC集小鼠21杂合敲除小鼠。既RMCE兼容小鼠维持混合129 / C57BL6 /瑞士背景。
注:杂合子基因敲除小鼠穿越建议克服纯合子基因敲除小鼠胚胎致死。 - 使用PCR以选择包含在R26轨迹12的RMCE盒杂合敲除小鼠。
- 品种杂合子基因敲除小鼠RMCE兼容,杂合子基因敲除小鼠和隔离RMCE兼容,纯合KO囊胚。
- 成立时间交配在傍晚和检查交配第二天早上插头。
注:插头由从男性的凝结和水疱腺体分泌物凝固的。这些插头填补了女性的阴道,并持续8 - 繁殖后24小时。堵塞的女性被认为是携带0.5 DPC(天交配后)的胚胎。- 要检查插头,她的尾巴根部提起女性,并通过检查她的白色大众阴道口。传播外阴的嘴唇与斜角探头稍当插头是很难看到的。从她们的男性单独插入女性。
- 在3.5 DPC收集囊胚。
- 经批准的方法( 例如,颈椎脱位)安乐死怀孕的女性。做一个切口midventral和解剖子宫输卵管和使用细剪刀和镊子(仍然彼此连接)。
- 弯曲26号针成45°角。附加的1毫升注射器填充有M2培养基到该弯曲针并使用它来从子宫胚泡冲入10-cm培养皿的盖子。
- 针插入子宫结束最接近输卵管。把握在用细镊子地方针,同时推动柱塞;子宫肿胀指示成功冲洗。
- 使用吸管口(直径为100 - 200微米),收集所有的胚胎和新鲜的M2介质液滴洗两次。洗过后,立即转移到胚泡的培养板(见下文)。
注意:应在空气层流进行囊胚的解剖和处理。
- 成立时间交配在傍晚和检查交配第二天早上插头。
- 隔离RMCE兼容KO mESCs
- 准备与丝裂霉素C处理的DR4的MEF一个12孔板(参见材料的表 )的胚泡分离的前一天。
注意:这些MEF中从包含四个药物选择基因和赋予对新霉素,嘌呤霉素,潮霉素抗性的Tg(DR4)1Jae / J小鼠中分离的,和6-硫鸟嘌呤22。- 外套有0.1%明胶的所有培养板中。添加0.1%的明胶到培养板,在5%CO 2孵育5分钟,在37℃,并吸出明胶溶液。种子P2的MEF的在12孔板的小瓶的四分之一和在2mL MEF培养基的生长(请参阅表1, 材料的表 ),以汇合单层19。
- 用丝裂霉素-C(10微克/毫升)使其失活3小时,并用磷酸盐缓冲盐水(PBS)19把它们洗干净的两倍。
- 使用口移液管,镀胚泡到糊化12孔板(1个孔/胚)中,用在SR-ES细胞培养基的丝裂霉素C处理的MEF中(2毫升/孔)补充有2μMpluripotin或与2I (1μMERK抑制剂PD0325901和3μMGSK3抑制剂CHIR99021)。在5%CO 2孵育在37℃下。
- 刷新SR-ES细胞培养基(补充有pluripotin或2I)每2 - 3天。
- 检查一个stereomicro下的每个囊胚范围在4.0X倍率并检查孵化和附接至MEF层。
注:当囊胚孵化,他们失去的是它们封装的透明带。与独立的囊胚井需要用口吸液被刷新。 - 使用一次性的提示P10吸管培养12天 - 10后(使用立体显微镜)挑选个别ICM长出。转移在约10介质的μL向外生长至含有30微升/孔的PBS(在室温下)的V形,96孔板。
- 添加0.25%胰蛋白酶的50μL,每孔用多道移液器,并在5%CO 2在37℃下孵育3分钟。
- 添加100μL含有FBS的介质mESC的的;吹打10-15倍解离ICM长出成单细胞;和离解的细胞转移到丝裂霉素C处理,96孔的是制备一天ICM集落挑选之前MEF平板上。
- 从这一步开始,OMI吨pluripotin或2I从mESC的平台。第二天,从FBS的培养基改变为含SR-mESC的培养基(100μL/孔)。
- 展开成立mESC的线从96到24孔格式19。
- 清洗细胞,用PBS的200μL,添加胰蛋白酶的50μL,并在5%CO在37℃下孵育5分钟添加基于FBS-mESC的介质的100μL。通过吸取10离解 - 使用多道移液器15倍;和转移解离的细胞,以丝裂霉素C处理,24孔板MEF。
- 更改为基于SR-介质上的第二天。展开mESCs以类似的方式从24到6孔格式。从汇合6孔板19 4寒冻-使3。
- 识别用PCR引物对R26轨迹23和选择的KO等位基因(在这种情况中p120ctn RMCE兼容,纯合KO mESCs;的PCR为空p120ctn各前和进行了描述两侧装接loxP的等位基因小姑娘= "外部参照"> 12)。
- 准备与丝裂霉素C处理的DR4的MEF一个12孔板(参见材料的表 )的胚泡分离的前一天。

表1.培养基。所有的培养基保存于4℃下并在使用前温热至37℃30分钟。
2.生成一个RMCE兼容打靶载体的使用重组克隆
- 克隆救援构建体导入用限制性内切酶(RE)重组兼容载体为基础的或基于PCR的24种克隆技术。确保的cDNA包含一个终止密码子。
- 设计AttB位标记的引物24。确保正向引物包含以下元素:一个GGGG伸展,一个AttB1位点,连接子,Kozak序列,以及约25救援cDNA的核苷酸(从它的ATG)。确保反向引物也有类似的组成:一个GGGG舒展,一个AttB2位的网站,链接器和大约25 NUC救援的cDNA(反向互补)的leotides。
- 放大经由 PCR救援的cDNA,以获得AttB位侧翼的cDNA。
- 执行用100ng AttB位侧翼的cDNA的重组和兼容供体载体,其包含卡那霉素抗性基因的150毫微克10-μLBP反应。
- 变换在热休克感受态MC1061 大肠杆菌 ( 大肠杆菌 )的细菌(类似于在步骤2.3中所述)5μL的BP混合物。
- 鉴定含有正确的救援含有的cDNA的载体的菌落(类似于上述步骤2.4)
- 执行使用100ng的救援含有cDNA的载体的10-μLLR反应; Cre的切除pRMCE-DV1矢量11(LMBP 8195)的150毫微克;和2μL重组酶混合物,其包含噬菌体编码的整合和切除酶和细菌整合宿主因子。在25℃下孵育2小时。
注意:一个LR反应是重组反应离子,其中含有的attL位点和含有attR位点的目的载体一起进入克隆通过LR克隆酶酶混合物复合。这导致含有attB位点侧翼的目的基因的表达克隆。 - 在热休克感受态MC1061 大肠杆菌变换LR混合物的5μL。
- 加入5个LR的μL混合物至肋状,掠过,2毫升螺旋盖管与热休克感受态大肠杆菌细菌的40μL并孵育在冰上20分钟。在37℃下孵育5分钟。
- 加1的Luria肉汤(LB)培养基中,并在37℃下孵育1个小时。板在氨苄青霉素50μL(安培; 100微克/ ml)的琼脂平板上并在37℃下生长过夜。
- 确定殖民地,用正确的靶向载体。
- 挑5个菌落,随机使用P200尖端。转移尖端含有2玻璃试管 - 5 LB培养基中并在37℃下生长过夜。
- 防爆道从所述细菌培养物使用市售试剂盒的质粒DNA。
- 使用RE消化和测序验证它们。切0.5 - 2微克使用RE 0.2μL(20单位/μL)对应的10x缓冲液的1μL的质粒和在10-μL反应。孵育在37℃和至少1小时单独在1%琼脂糖凝胶上。选择用于与DNA片段的预测模式的菌落。
- 分析使用Sanger测序确认的载体(50纳克/微升)用Tlox F(ATC ATG TCT GGA TCC CCA TC)和IRES R(GGG GCG GAA TTC GAT ATC AAG)引物(5皮摩尔/微升)。
3. RMCE介导的靶向mESC的救援的构造到R26轨迹
- 在基于FBS-mESC的媒体的MEF开始RMCE兼容KO mESCs和通道他们的文化至少两次。分裂上的糊化6孔板的mESCs。
- 第二天,刷新细胞,在50%左右汇合,有1.5基于FBS-mESC的介质中,并转染用的Cre切除pRMCE-DV1靶向含有救援的cDNA载体的mESCs。
- 做一个DNA混合物。添加靶向载体的1微克和1μgFLPE表达质粒25的纯DMEM培养基中的250μL。
- 使脂质体转染组合。添加基于脂转染转染试剂( 例如,脂质转染胺2000),以纯DMEM培养基中的250μL的孵育在室温下(RT)5分钟的7μL。
使用其它基于脂质体转染的试剂( 例如,脂质体LTX和的Effectene)获得了类似的RMCE靶向效率:注意。 - 混合与脂转染混合物中的DNA混合,并在室温下孵育20分钟。移液管将转染混合物到刷新mESCs。漩涡轻轻地离开过夜。
- 转染后一天,分割从6孔板所有mESCs到10cm的培养皿与DR4的MEF的汇合层和基于FBS-10毫升的米ESC培养基。
- 转染后两天,通过加入0.2毫克/毫升G418(100倍)到介质选择具有正确FLPE介导的盒式交换mESC的克隆。
注意:请击杀曲线G418的每批识别G418杀死所有mESCs的最低浓度。 - 含G418-mESC的媒体每日刷新mESCs。殖民地后,应该出现7 - 10天,所以挑选和扩大这些为每步1.4。
- 请通过 PCR 11正确的克隆。
4.分化胚体mESCs的(EBS)
- 在基于FBS-mESC的媒体的MEF开始KO mESCs与R26驱动的救援结构和通道他们培养至少两次。通道一旦糊化6孔板的mESCs摆脱的MEF。
- 用PBS洗涤和胰蛋白酶化近汇合mESC的培养。板分离在不同的稀释到非粘附,细菌级PET mESCs(1/20 1/40和)RI-菜分化培养基。
- 允许EB的形成在这些菜30天。的EB悬浮液转移到一个50毫升的管中,让将EB定居通过重力,除去上清液,加入新鲜培养基,并转移EB悬浮液回细菌级:使用以下程序3天 - 刷新介质每2碟。
- 通过使用先前描述的12免疫荧光协议和透射电子显微镜分析靶向mESCs和EBS。
结果
以分离RMCE兼容KO mESC的线的过程在图2中被描绘。连续两个育种需要获得RMCE兼容KO囊胚。首先,杂合基因敲除小鼠与RMCE兼容小鼠杂交获得RMCE兼容,杂合子基因敲除小鼠。然后将这些小鼠用于与其它杂合敲除小鼠交配定时以获得3.5-DPC,RMCE兼容,纯合KO胚泡。获得这样的胚的机会是八分之一的,由孟德尔遗传所预测。因此,需要一种有效的隔离mESC的协议。使用plur...
讨论
我们mESC的隔离方法是用户友好,不需要高深的技能或设备,如囊胚显微外科。因此,这种技术是相当大的比重,科学界的访问。任何人只要有基本的细胞培养经验可以传播ICM长出,并建立mESCs线。然而,囊胚的冲洗和处理需要一些练习。甲口移液管用于传递胚泡,由微量移,微量吸管保持器,管道和抽吸嘴件28的。微量可以通过加热巴斯德吸管的部分最好为几秒钟,从火焰中除?...
披露声明
作者什么都没有透露。
致谢
我们感谢金科D'HONT,康斯登范Rockeghem,娜塔莉Farla,凯利·莱米尔和RIET德Rycke的出色的技术支持。我们也感谢EEF Parthoens,Evelien凡Hamme的,和阿曼达·戈卡尔弗斯从炎症研究中心的生物成像核心设施为他们提供专家援助。我们承认为有价值的讨论我们的研究小组的成员。这项工作是由比利时科学政策支持(Belspo校际景点虫眼 - 奖IAPⅦ-07 DevRepair; https://devrepair.be),由伊丽莎白女王医学基金会,比利时(GSKE 2008年至2010年; HTTP:// WWW .fmre-gske.be),以及比利时根特大学(http://www.ugent.be/en/ghentuniv)的协同研究行动(GOA 01G01908)。 SG是法兰德斯研究基金(FWO-V)的博士后研究员。
材料
| Name | Company | Catalog Number | Comments |
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20 °C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23 G needles | Fine-ject | 8697 | |
| 1-mL syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 mL distilled water, autoclave and store at 4 °C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 mL, 10 mL and 25 mL | |||
| 15-mL and 50-mL conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μL) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37 °C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media | |||
| MEF Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| SR-based mESC medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/mL recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium) | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/mL ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
参考文献
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。