Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Структурно-функциональные исследования в мышиных эмбриональных стволовых клеток Использование Рекомбиназа-опосредованного кассетный Обмен
В этой статье
Резюме
Белки часто содержат несколько доменов, которые могут вызывать различные клеточные функции. Генные выбивки (KO) не считают это функциональное разнообразие. Здесь мы сообщаем о рекомбинации опосредованного обмена кассетного (RMCE) основа структурно-функциональный подходе в нокауте эмбриональных стволовых клеток, что позволяет для молекулярного рассечения различных функциональных доменов или вариантов белка.
Аннотация
Генная инженерия в мышиных эмбрионов или эмбриональных стволовых клеток (mESCs) позволяет для изучения функции данного белка. Белки являются лошадками клетки и часто состоят из нескольких функциональных доменов, которые могут быть под влиянием посттрансляционных модификаций. Истощение всего белка в условном или конститутивном цепных из (KO) мышей не принимать во внимание это функциональное разнообразия и регулирование. Линии MESC и производная модель мыши, в котором стыковочный участок для FLPe рекомбинации опосредованного обмена кассеты (RMCE) был вставлен в ROSA26 (R26) локуса, ранее сообщались. Здесь мы сообщаем о структурно-функциональном подходе, который позволяет молекулярное рассечение различных функциональных многодоменного белка. С этой целью, RMCE-совместимыми мыши должны быть скрещены с мышами KO, а затем RMCE-совместимый mESCs KO должен быть изолирован. Далее, группа предполагаемых спасательных конструкций может быть введена в локус R26 через RMCE targetiнг. Спасательный кДНК-кандидатов может быть легко вставлен между RMCE участками ориентации вектора с использованием рекомбинации клонированию. Далее, KO mESCs трансфицируют с адресным переносчиком в сочетании с выражением рекомбиназы плазмиды FLPe. RMCE задействуется ген неомицин-сопротивления промотор-менее в док-сайтов ROSA26 и позволяет для выбора правильного события таргетинга. Таким образом, эффективность высокой таргетинга, близкие к 100%, получают, что позволяет для вставки множества предполагаемых спасательных конструкций в полу-высокой пропускной способности способом. Наконец, множество R26-управляемых спасательных конструктов могут быть проверены на предмет их способности, чтобы спасти фенотип, который наблюдался в родительских mESCs КО. Мы представляем структурно-функциональные исследования корректуры из-принципа в p120 катениной (p120ctn) KO mESCs с использованием энтодермы дифференциации эмбрионального телец (ЭТ) в качестве фенотипического считывания. Такой подход позволяет выявить важные области, предполагаемые пути вниз по течению, и болезни релевантной точкимутации, которые лежат в основе KO фенотипов для данного белка.
Введение
Предполагается, что геномы млекопитающих содержат около 20000 белок-кодирующих генов. Альтернативный сплайсинг и посттрансляционные модификации дальнейшего увеличения белка репертуара. Белки имеют модульную конструкцию 1 и часто содержат несколько доменов взаимодействия, которые позволяют их набор в различные белковых комплексы и их участие в многочисленных клеточных процессах 2. Одним из примеров является многофункциональный белок под названием p120ctn. p120ctn кодируется геном Ctnnd1 и состоит из большого центрального домена армадилл повтора в окружении N-концевой области и С-концевой. Домен армадилла из p120ctn связывается с высоко консервативным доменом околомембранного классических кадхеринов, которые участвуют в межклеточной адгезии, но она также связывается с репрессором транскрипции Kaiso. N-концевой домен p120ctn взаимодействует с различными киназ, фосфатаз, небольшие RhoGTPases, и ассоциированный с микротрубочками рroteins 3. Интересно отметить , что в результате альтернативного сплайсинга, p120ctn изоформы могут быть получены из четырех альтернативных стартовых кодонов 4. p120ctn изоформы 1A является самым длинным, как это переводится с большей-5' старт-кодоном и содержит полноразмерный N-концевой сегмент. В p120ctn изоформ 3 и 4, это N-концевой сегмент удаляется частично и полностью, соответственно. Понимание точной роли белков (или белкового изоформ) и их доменов в различных клеточных функциях остается проблемой.
Ген ориентации в mESCs позволяет исследовать функции белка через генетической делеции соответствующего гена и широко способствовал выявлению онтогенетически важных и болезненных значимых генов и путей. Этот прорыв в обратной генетики явилась результатом достижений в области изоляции MESC и гена ориентации за счет гомологичной рекомбинации 5 . Гомологичная рекомбинация представляет собой процесс, в котором происходят обмен ДНК-фрагменты между двумя аналогичными или идентичными нуклеиновыми остатками после того, как двухцепочечный (DS) разрывами ДНК. Как правило, HR является неэффективным, поскольку дц перерывы являются нечастыми. В последнее время , эффективность гомологического-направленный ген ориентации может быть увеличена с помощью сайта-специфических нуклеаз 6, 7, но , к сожалению, они склонны к вне целевых эффектов 8. Более надежный метод для того, чтобы ген таргетирование RMCE, который основан на конкретных участках систем рекомбинации, таких как Cre / LoxP или FLPe / Frt. LoxP и последовательность Frt найдены в бактериофаге Р1 и Saccharomyces CEREVISIAE, соответственно, и состоит из 34 пар оснований , в том числе последовательности асимметричных 8 пар оснований, которая определяет ориентацию сайта. С другой стороны, ориентация, например, два LoxP сайтов в участке ДНК будет определять, является ли становится вырезала floxed ДНК или яnversed при Cre-опосредованной рекомбинации 9. Кроме того, Cre может также индуцировать транслокацию, если два участка расположены на разных хромосомах. RMCE воспользовался преимуществом неспецифических сайтов рекомбинации, которые не вступают в перекрестную реакцию и внедренных в геномной локуса. В присутствии донора плазмиды, содержащая фрагмент ДНК , фланкированной один и та же неспецифических сайтами, то рекомбиназа будет вставить этот фрагмент ДНК в RMCE-совместимый геномный локус из - за двойное одновременное транслокации (рисунок 1). Здесь только правильно RMCE-ориентированные клоны могут оказать лекарственную устойчивость благодаря промотору на входящем векторе , который восстанавливает «ловушка» промотор-менее ген резистентности к неомицину (Neo R) присутствует в R26 геноме дока - клетках (фигура 1) 10, 11. Это приводит к очень высокой эффективности таргетинга, часто близкой к 100%, 11 </ SUP> 12. В заключении, на основе RMCE нацеливание имеет высокую эффективность и может быть использовано для структуры-функции исследований; Однако, это требует предварительно спроектированных геномного локуса.
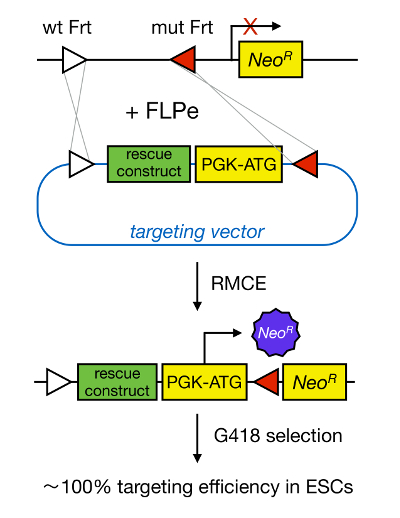
Рисунок 1. Схематическое изображение RMCE-опосредованной нацеливание. RMCE позволяет для обмена сегментов ДНК из входящего вектора направленного к определенной геномной локуса, если оба питают два неспецифических сайтов FRT (изображенные белыми и красными треугольниками). Кроме того, разработано геномный локус содержит ген без промотора и усеченной неомицин-сопротивление (Neo R). Предоставляя промотор и стартовый кодон во фрагменте ДНК входящего, только правильные события рекомбинации восстановить устойчивость к неомицину, что приводит к высокой эффективности таргетинга. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию тего фигура.
Геном инжиниринг в mESCs позволяет для генерации RMCE-совместимых мышей. В 1981 году две группы удалось захватить плюрипотентных клеток из внутренней клеточной массы (ICM) бластоцист и в поддержании их в культуре 13, 14. mESCs способны к самообновлению и дифференцировке во все типы эмбриональных и взрослых клеток, в том числе зародышевых клеток линии. Таким образом, ген ориентации в mESCs дает обратное генетические исследования путем разработки конститутивного или условного (с использованием системы / LoxP Cre) мышей KO. Тем не менее, классический способ выделения клеток мыши ES очень неэффективно. Несколько основных улучшений значительно увеличили вероятность успеха для получения линий MESC, в том числе использование определенного сывороточного замещения (SR) среды 15, чередуя MESC среде , содержащей SR и фетальной бычьей сыворотки (FBS) 16, а также использование фармакоЛогические соединения , такие как pluripotin или 2i 17. Pluripotin, небольшая синтетическая молекула, позволяет для распространения mESCs в недифференцированном состоянии в отсутствии фактора ингибировани лейкоза (LIF) и эмбриональных фибробласты мышей (MEFs) 18. Наконец, было показано , что mESCs может быть выделен с очень высокой эффективностью (близкой к 100%) , когда / ФБС протокола SR среднего чередование сочетается с LIF и pluripotin 19, 20. Эти протоколы позволяют эффективно изолировать RMCE-совместимый KO mESCs, которые впоследствии могут быть использованы для исследований структурно-функциональных.
В этой статье описан способ, который дает возможность определить ключевые домены или остатки в пределах белка, которые отвечают за специфических клеточных процессов. С этой целью трубопровод передовых технологий, позволяющих эффективно изоляции мЭСК, ориентации вектора сборки и мЭСК нацеливания было создатьд. Как таковые, большие панели с изоформы белка, мутанты доменов и вниз по течению эффекторов могут быть введены в KO mESCs и могут быть оценены по их способности , чтобы спасти в пробирке KO фенотип.
Access restricted. Please log in or start a trial to view this content.
протокол
Были проведены все эксперименты на мышах по институциональным, национальным и европейским нормам животных.
1. Выделение RMCE-совместимых mESCs KO
- Порода гетерозиготных мышей KO с RMCE-совместимых мышей, таких как ROSALUC мышей 10 или ROSA26-иПСК мышей 21. Оба RMCE-совместимых мышей поддерживали на смешанном 129 / C57BL6 / Swiss фоне.
Примечание: Пересечение с гетерозиготным мышеем KO рекомендуются преодолеть эмбриональную летальность у гомозиготного мышея KO. - С помощью ПЦР , чтобы выбрать гетерозиготных мышей KO , содержащих RMCE кассету в R26 локуса 12.
- Порода RMCE-совместимая, гетерозиготный мышей KO с гетерозиготным мышеем KO и изолировать RMCE-совместимой, гомозиготные бластоцисты KO.
- Установите время вязку вечера и проверить спаривание пробки на следующее утро.
Примечание: Вилки изготовлены из скоагулированных выделений из коагулирующих и везикулярных желез у мужчин.Эти пробки заполняют влагалище самки и сохраняются в течение 8 - 24 ч после разведения. Вставленные женщины считаются проведение 0,5 DPC (дней после коитуса) эмбрионов.- Чтобы проверить наличие заглушек, поднимите самку основанием хвоста и изучить ее влагалища для белесой массы. Разведите губы вульвы слегка наклонным зондом, когда вилка трудно увидеть. Отдельные подключенные самки из их самцов.
- Сбор бластоцисты на 3,5 ДПЗ.
- Эвтаназии беременных самок утвержденного метод (например, рак шейки дислокации). Сделать midventral надрез и рассекают матку и яйцевод (все еще привязаны друг к другу) с использованием тонких ножниц и щипцов.
- Изгиб 26-калибровочную иглу в угол 45 °. Приложить 1-мл шприц, заполненный средой М2 к этой изогнутой иглы и использовать его, чтобы смыть бластоцисты из матки в крышку 10 см чашку.
- Вставьте иглу в конце матки, которая находится ближе всего кяйцевод. Удерживая иглу в месте с тонким пинцетом, нажимая на поршень; отек матки указывает на успешное гиперемию.
- Используйте рот пипеткой (с диаметром 100 - 200 мкм), чтобы собрать все эмбрионы и мыть их дважды в капле свежей среды М2. Сразу же после мытья их, передают бластоцисты в культуре пластины (см ниже).
Примечание: Вскрытие и обработка бластоциста от должно быть сделано в ламинарном потоке воздуха.
- Установите время вязку вечера и проверить спаривание пробки на следующее утро.
- Изолировать RMCE-совместимый KO mESCs
- Подготовка 12-луночный планшет с митомицин-С-обработанных DR4 MEFs (см Таблицу материалов) за один день до изоляции бластоцисты.
Примечание: Эти MEFs были выделены из мышей Tg (DR4) 1Jae / J , которые содержат четыре гена наркотиков по выбору и придают устойчивость к неомицину, гигромицину, пуромицину, и 6-тиогуанин 22.- Шерсть все культуральные планшеты с 0,1% желатина. Добавить 0,1% желатинав культуральные планшеты, инкубируют в течение 5 мин при 37 ° С в 5% CO 2, и аспирацию раствора желатина. Семенной одна четверть флакона Р2 MEFs в 12-луночный планшет и выращивают их в 2 мл среды MEF (таблица 1, таблица материалов) к вырожденной монослоя 19.
- Деактивировать их с митомицином-C (10 мкг / мл) в течение 3 ч и промыть их дважды фосфатно-буферным солевым раствором (PBS) 19.
- Использование рот пипеткой, высевания бластоцисты на желатинизированные 12-луночные планшеты (1 хорошо / эмбрион), с митомицином-С-обработанных MEFs в SR-ES клеточной среде (2 мл / лунку) с добавлением либо 2 мкМ pluripotin или 2i (1 мкМ ингибитора Эрк PD0325901 и 3 мкМ ингибитора GSK3 CHIR99021). Инкубируют при 37 ° С в 5% СО 2.
- Обновление среды клеток SR-ES (с добавлением pluripotin или 2i) каждые 2 - 3 дней.
- Проверьте каждые бластоцисты при виде stereomicroОбъем при увеличении 4.0x и проверить на штриховку и прикрепление к MEF слою.
ПРИМЕЧАНИЕ: Когда бластоцисты люк, они теряют пеллюцид, который инкапсулирует их. Скважины с незамужними бластоцистами должны быть обновлены с помощью рта пипетки. - Выберите индивидуальные ICM выросты (с использованием стереомикроскопа) через 10 - 12 дней культивирования с использованием P10 пипетки с одноразовыми наконечниками. Передача отросток в приблизительно 10 мкл среды в V-образную форму, 96-луночный планшет, содержащий 30 мкл / лунку PBS (при комнатной температуре).
- Добавьте 50 мкл 0,25% трипсина в каждую лунку с помощью многоканальной пипетки и инкубировать в течение 3 мин при 37 ° С в 5% СО 2.
- Добавьте 100 мкл ФБС, содержащего MESC среду; диссоциируют МКД наросты на отдельные клетки с помощью пипетки в 10-15 раз; и передачи диссоциированных клеток к митомицин-С-лечение, 96-луночные планшеты MEF, которые были получены за один день до того, как колонии ICM собирают.
- От этого шага вперед, оми т pluripotin или 2i из среды MESC. На следующий день, изменить среду от FBS- к SR-среде, содержащей MESC (100 мкл / лунку).
- Expand установленных MESC линии от 96- до формата 24-луночного 19.
- Промывают клетки с 200 мкл PBS, добавляют 50 мкл трипсина, и инкубируют в течение 5 мин при 37 ° С в 5% CO Добавьте 100 мкл ФБС-среде на основе MESC. диссоциируют с помощью пипетки 10 - 15 раз с помощью многоканальной пипетки; и передачи диссоциированных клеток на митомицин-С-лечение, 24-а MEF пластин.
- Изменение в SR на основе среды на следующий день. Разверните mESCs аналогичным образом от 24- до формата 6-луночного. Сделать 3 - 4 обморожений из вырожденного 6-луночного планшета 19.
- Определение RMCE-совместимый, гомозиготные mESCs KO с использованием ПЦР - праймеров для локуса R26 23 и KO аллеля выбора (в данном случае, p120ctn; p120ctn для МКП нуль и floxed аллели были описаны ранеедеваха = "Xref"> 12).
- Подготовка 12-луночный планшет с митомицин-С-обработанных DR4 MEFs (см Таблицу материалов) за один день до изоляции бластоцисты.

Таблица 1. Культура СМИ. Все средства массовой информации хранили при 4 ° С и нагревали до 37 ° С 30 мин перед использованием.
2. Генерация RMCE-совместимых адресный переносчик Использование Рекомбинация Cloning
- Клон спасение конструкций в рекомбинационных-совместимые векторы с использованием фермента рестрикции (RE) основе или на основе ПЦР-24 способов клонирования. Убедитесь, что кДНК содержат стоп-кодон.
- Дизайн AttB меченные праймеры 24. Убедитесь, что прямой праймер содержит следующие элементы: а GGGG протяжение, сайт attB1, компоновщик, последовательность Козака, и около 25 нуклеотидов спасения кДНКа (начиная с ATG). Убедитесь в том, что обратный праймер имеет аналогичный состав: GGgg стрейч, в AttB2 сайт, компоновщик, и около 25 NUCleotides спасательного кДНК (обратная комплемента).
- Amplify кДНК с помощью ПЦР спасательную для получения AttB-фланкированные кДНК.
- Выполнение реакции 10 мкл-BP с 100 нг AttB-фланкированной кДНК и 150 нг вектора донора рекомбинации-совместимый, который содержит ген устойчивости к канамицину.
- Transform 5 мкл смеси BP в теплового шока компетентных МС1061 Escherichia coli (E.coli) бактерии (подобные тем , которые описаны в пункте 2.3).
- Определить колонии, содержащие правильные спасательный кДНК-содержащих векторы (подобные тем, которые описаны в пункте 2.4)
- Выполните 10 мкл реакции LR с использованием 100 нг кДНК-спасательного вектора, содержащего; 150 нг Cre-вырезанной pRMCE-DV1 вектора 11 (LMBP 8195); и 2 мкл смеси рекомбиназы, который содержит фаговый кодированный интегразы и excisionase и бактериальный фактор интеграции хозяина. Инкубировать в течение 2 ч при 25 ° С.
Примечание: Реакция LR является рекомбинация естьиона, в котором клон, содержащий запись ATTL сайты и вектор, содержащий целевой атр сайты рекомбинируют с помощью фермента Clonase смеси LR. Это приводит к экспрессии клона, содержащему сайты attB, фланкирующий ген интереса. - Transform 5 мкл LR смесей теплового шока компетентных МС1061 бактерии E.coli.
- Добавьте 5 мкл смеси LR с насечками, огибала, 2-мл с завинчивающейся крышкой пробирку с 40 мкл теплового шока-компетентных бактерии E.coli , и инкубировали в течение 20 мин на льду. Инкубировать в течение 5 мин при 37 ° С.
- Добавить 1 мл бульона Лурии (LB) среды и инкубируют в течение 1 ч при 37 ° С. Пластина 50 мкл на ампициллин (Amp; 100 мкг / мл) -содержащие агаром и выращивают в течение ночи при 37 ° С.
- Определить колонии с правильным вектором таргетинга.
- Pick 5 колоний случайным образом с использованием наконечника P200. Передача наконечник в пробирку, содержащую стеклянную 2 - 5 мл LB среды и расти в течение ночи при 37 ° С.
- бывшийтракта плазмидной ДНК из бактериальных культур с использованием коммерчески доступных наборов.
- Проверка их с помощью ВЭ дайджестов и секвенирования. Вырезать 0,5 - 2 мкг плазмиды с использованием 0,2 мкл RE (20 ед / мкл) и 1 мкл соответствующего буфера 10х в реакции 10 мкл. Инкубировать в течение по крайней мере 1 ч при 37 ° С и отдельно на 1% агарозном геле. Выбрать для колоний с предсказанным рисунком фрагментов ДНК.
- Анализ подтвержденных векторов (50 нг / мкл) с Tlox F (ATC ATG TCT GGA ТСС ССА ТС) и IRES R (GGG GCG GAA TTC GAT ATC AAG) праймеров (5 пмоль / мкл) с помощью Sanger секвенирования.
3. RMCE-опосредованной MESC Нацеливание спасения Создаёт к R26 локуса
- Начало культуры RMCE-совместимый KO mESCs и прохождения им, по крайней мере дважды на МЭФ в FBS среде на основе мЭСК. Разделить на mESCs в желатинизированной пластине 6-луночной.
- На следующий день, обновить клетки, примерно 50% сплошности, с 1,5мл ФБС-среде на основе MESC и трансфекции mESCs с Cre-вырезанной pRMCE-DV1 ориентации вектора, содержащего кДНК спасательную.
- Сделайте смесь ДНК. Добавить 1 мкг вектора направленного и 1 мкг FLPe-экспрессирующей плазмиды 25 до 250 мкл среды DMEM чистой.
- Сделать Липофекцию смесь. Добавить 7 мкл липофекции на основе трансфекции реагента (например, Липофектамин 2000) до 250 мкл среды DMEM чистой и инкубировать в течение 5 мин при комнатной температуре (RT).
Примечание: Эквивалент RMCE ориентации эффективность была получена с использованием других реагентов Липофекции на основе (например, Липофектамин LTX и Effectene). - Смешайте смесь ДНК с липофекцией смесью и инкубируют в течение 20 мин при комнатной температуре. Пипетировать трансфекции смесь на обновленной mESCs. Вихревой аккуратно и оставить на ночь.
- Через день после трансфекции, разделить все mESCs из 6-луночного планшета для культивирования блюда 10 см с вырожденным слоем DR4 MEFs и 10 мл FBS на основе мESC среда.
- Через два дня после трансфекции, выберите MESC клонов с правильной FLPe-опосредованный обмен кассеты добавлением 0,2 мг / мл G418 (100x) к среде.
ПРИМЕЧАНИЕ: кривая деактивации для каждой партии С418, чтобы определить самую низкую концентрацию G418, которая убивает весь mESCs. - Обновите mESCs ежедневно с G418, содержащей мЭСК средой. Колонии должны появиться через 7 - 10 дней, так что выбрать и расширить их в соответствии с шагом 1.4.
- Проверьте правильность клонов методом ПЦР 11.
4. Дифференцирование mESCs в эмбриональном телец (ЭТ)
- Начало культуры KO mESCs с R26-приводом спасательных конструкций и прохождения их по крайней мере дважды на МЭФ в FBS среде на основе мЭСК. Прохождение mESCs раза на желатинизированных 6-луночные планшеты, чтобы избавиться от МЭФА.
- Мытье с PBS и Trypsinize почти-сливные культур мЭСК. Пластина диссоциированных mESCs в различных разведениях (1/20 и 1/40) на неклейких, бактериально-класс домашних животныхри-блюда в дифференциации среды.
- Разрешить ЭТ сформировать в эти блюда в течение 30 дней. Обновление среды каждые 2 - 3 дней, используя следующую процедуру: передать суспензии EB в пробирку 50 мл, пусть ЭТ оседает под действием силы тяжести, удалить супернатант, добавить свежую среду, а также передавать суспензии EB обратно в бактериальный-класс блюдо.
- Анализ целевых mESCs и ЭТ с помощью иммунофлуоресценции и просвечивающей электронной микроскопии с использованием протоколов , которые были описаны ранее 12.
Access restricted. Please log in or start a trial to view this content.
Результаты
Процедура , чтобы изолировать RMCE-совместимой КО MESC линий изображена на рисунке 2. Два последовательных вязки должны получить RMCE-совместимый KO бластоцисты. Во-первых, гетерозиготные мыши KO скрещены с RMCE-совместимых мышей, чтобы получить RMCE-совместимый, гетероз...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Наш метод изоляции мЭСК является удобным и не требует особых навыков или оборудования, таких как микрохирургии бластоцисты. Таким образом, эта технология доступна для значительной части научного сообщества. Любой человек, имеющий базовый опыт культивирования клеток могут распростра?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим Jinke D'Гонт, Frederique Van Rockeghem, Натали Фарла, Келли Лемейр и Рит De Rycke за отличную техническую поддержку. Мы также благодарим Eef Parthoens, Evelien Ван Hamme и Аманда Гонсалвес из биоимиджинга ядра фонда научно-исследовательского центра Воспаление за помощь экспертов. Мы признаем член нашей исследовательской группы за ценное обсуждение. Эта работа была поддержана научной политики Бельгии (Belspo Межвузовский Аттракцион Столбы - Премия IAP VII-07 DevRepair; https://devrepair.be), Королева Элизабет Медицинский фонд, Бельгия (GSKE 2008-2010 годы; HTTP: // WWW .fmre-gske.be), так и действиями Согласованное исследований (ГОА 01G01908) из университета Гента, Бельгия (http://www.ugent.be/en/ghentuniv). СГ постдокторант из Фландрии научных фондов (FWO-V).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20 °C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23 G needles | Fine-ject | 8697 | |
| 1-mL syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 mL distilled water, autoclave and store at 4 °C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 mL, 10 mL and 25 mL | |||
| 15-mL and 50-mL conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μL) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37 °C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media | |||
| MEF Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| SR-based mESC medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/mL recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium) | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/mL ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
Ссылки
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1(2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243(2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55(2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. Third edn (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены