É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estudos de estrutura e função em células-tronco embrionárias de camundongos usando troca de cassete mediada por recombinase
Neste Artigo
Resumo
Proteínas, muitas vezes contêm vários domínios que podem exercer diferentes funções celulares. Gene knock-out (KO) não consideram essa diversidade funcional. Aqui, relatamos uma abordagem de estrutura-função com base na troca de cassete mediada por recombinação (RMCE) em KO células estaminais embrionárias que permite a dissecação molecular de vários domínios funcionais ou variantes de uma proteína.
Resumo
engenharia genética em embriões de ratinho ou células estaminais embrionárias (mESCs) permite o estudo da função de uma dada proteína. As proteínas são os laboriosos da célula e frequentemente consistem em vários domínios funcionais, que podem ser influenciados por modificações pós-traducionais. O esgotamento de toda a proteína em condicional ou constitutiva knock-out ratos (KO) não leva em conta essa diversidade funcional e regulação. Uma linha MESC e um modelo de ratinho derivado, em que um local de acoplamento para FLPe troca cassete mediada por recombinação (RMCE) foi inserida dentro do locus ROSA26 (R26), foi anteriormente relatado. Aqui, nós relatamos em uma abordagem de estrutura-função que permite a dissecção molecular das diferentes funcionalidades de uma proteína de múltiplos domínios. Para este fim, os ratos RMCE-compatível deve ser cruzados com ratinhos KO e mESCs KO então RMCE-compatíveis devem ser isoladas. Em seguida, um painel de construções de salvamento putativos pode ser introduzida no locus de R26 via RMCE targeting. Os cDNAs candidatos de resgate pode ser facilmente inserido entre os locais RMCE do vector de direccionamento utilizando recombinação clonagem. Em seguida, mESCs KO são transfectadas com o vector de direccionamento, em combinação com um plasmídeo de expressão da recombinase FLPe. RMCE reativa o gene de resistência à neomicina promotor-menos nos locais de ancoragem ROSA26 e permite a seleco do evento de direccionamento correcto. Desta forma, a eficiência elevada de segmentação perto de 100% são obtidas, permitindo a inserção de várias construções de salvamento putativos de uma forma semi-elevado rendimento. Finalmente, um grande número de construções de salvamento R26 accionadas podem ser testados quanto à sua capacidade para resgatar o fenótipo que foi observada em mESCs KO parentais. Apresenta-se um estudo de estrutura-função de prova de princípio em catenina p120 (p120ctn) mESCs KO usando diferenciação endoderme em corpos embrióides (EBS) como a leitura fenotípica. Esta abordagem permite a identificação de domínios importantes, vias a jusante putativos, e ponto de doença relevantesmutações que estão subjacentes fenótipos KO para uma determinada proteína.
Introdução
Estima-se que os genomas de mamíferos contêm cerca de 20.000 genes codificadores de proteínas. O splicing alternativo e modificações pós-tradução aumentam ainda mais o repertório de proteínas. As proteínas têm uma estrutura modular de um e muitas vezes conter vários domínios de interacção, que permitem o seu recrutamento para complexos proteicos diferentes e a sua participação em vários processos celulares 2. Um exemplo é a proteína multi-funcional chamado p120ctn. p120ctn é codificada pelo gene Ctnnd1 e consiste de um grande domínio central tatu repetição flanqueado por um N-terminal e uma região C-terminal. O domínio de tatu p120ctn se liga a um domínio justamembranar altamente conservado de caderinas clássicas, que estão envolvidos na adesão célula-célula, mas que também se liga ao repressor transcricional Kaiso. O domínio N-terminal de p120ctn interage com diferentes quinases, fosfatases, pequenas RhoGTPases, e associada a microtúbulos proteins 3. Curiosamente, como um resultado de splicing alternativo, isoformas p120ctn podem ser gerados a partir de quatro codões de iniciação alternativos 4. p120ctn isoforma 1A é a mais longa, uma vez que é traduzida a partir da maioria-5' do codão de iniciação e contém o segmento de comprimento completo N-terminal. Em p120ctn isoformas de 3 e 4, este segmento N-terminal é eliminado parcialmente e completamente, respectivamente. Compreendendo o papel preciso de proteínas (ou isoformas de proteas) e os seus domínios em diferentes funções celulares continua a ser um desafio.
Direccionamento de genes em mESCs permite o estudo da função de uma proteína através da deleco genica do gene correspondente e tem amplamente contribuiu para a identificação de genes e vias developmentally importantes e doenças relevantes. Esta descoberta em engenharia genica inversa foi o resultado de avanços em campos de isolamento MESC e direccionamento de genes devido à recombinação homóloga 5 . A recombinação homóloga é um processo no qual fragmentos de ADN são trocadas entre duas porções nucleicos semelhantes ou idênticas depois de cadeia dupla (ds) quebras de ADN. Normalmente, RH é ineficiente porque quebras ADNcd são pouco frequentes. Recentemente, a eficiência do gene dirigida por homologia de segmentação pode ser aumentada usando nucleases específicas do local 6, 7, mas, infelizmente, estes são propensas a efeitos fora do alvo 8. Uma técnica mais fiável para permitir o direccionamento gico é RMCE, que é baseado em sistemas de recombinação específicos do local tais como Cre / loxP ou FLPe / Frt. LoxP e sequência DRF são encontrados no bacteriago P1 e Saccharomyces cerevisiae, respectivamente, e consistem de 34 pb, incluindo uma sequência de pb assimétrica 8 que determina a orientação do local. Por outro lado, a orientação de, por exemplo, dois sítios loxP no interior de um trecho de ADN irá determinar se o ADN floxed torna-se excisado ou inversed após recombinação mediada por Cre 9. Além disso, Cre também pode induzir uma translocação se dois locais estão localizados em diferentes cromossomas. RMCE leva vantagem de locais de recombinação heteroespecíficos que não reagem de forma cruzada e que são incorporados no locus genómico. Na presença de um plasmídeo dador que contém um fragmento de ADN flanqueada pelos mesmos locais heteroespecíficos, a recombinase irá inserir este fragmento de ADN no locus genómico RMCE-compatíveis, porque de translocação duplo simultâneo (Figura 1). Aqui, os clones única correctamente RMCE orientadas podem tornar de resistência a drogas, graças a um promotor no vector de entrada que restaura um "preso", gene de resistência à Neomicina promotor-menos (Neo R) presente no genoma R26 das células de encaixe (Figura 1) 10, 11. Isto resulta numa eficiência muito alta segmentação, muitas vezes perto de 100% 11, </ sup> 12. Em conclusão, a segmentação baseada RMCE é altamente eficiente e pode ser usada para a estrutura-funções estudos; no entanto, requer um local genómico pre-engenharia.
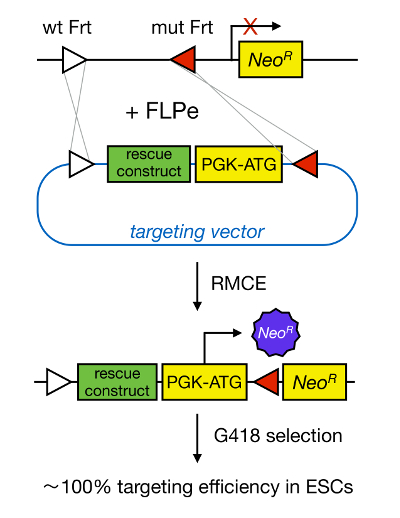
Figura 1. Representação esquemática da orientação para as mediada por RMCE. RMCE permite a troca de segmentos de ADN a partir de um vector de abordagem selectiva de entrada para um local genómico definido se tanto abrigar dois locais DRF heteroespecíficos (representados por triângulos brancos e vermelhos). Além disso, o locus genómico engenharia contém um promotor e um gene truncado de resistência à neomicina (NeoR). Ao fornecer um promotor e do codão de iniciação no fragmento de DNA de entrada, os eventos de recombinação única correcção restaurar a resistência a neomicina, resultando em altas eficiências de segmentação. Por favor clique aqui para ver uma versão maior do tsua figura.
engenharia genoma em mESCs permite a geração de ratinhos RMCE-compatível. Em 1981, dois grupos conseguiram capturar células pluripotentes a partir da massa celular interna (ICM) de blastocistos e em mantê-las em cultura 13, 14. mESCs são capazes de auto-renovação e diferenciação em todos os tipos de células embrionárias e adultos, incluindo a linhagem de células germinativas. Portanto, o direccionamento gico em mESCs permite estudos inverter-genéticas através do desenvolvimento de ratinhos KO constitutivos ou condicional (utilizando o sistema cre / loxP). No entanto, a forma clássica de isolar as células ES de ratinho é muito ineficiente. Várias melhorias importantes têm aumentado grandemente a taxa de sucesso para derivar linhas Mesc, incluindo o uso de um soro de substituição definidos (SR) de meio 15, alternando entre médio MESC contendo soro de bovino fetal e SR (FBS) a 16, e o uso de farmacocompostos lógicas tais como pluripotin ou 2i 17. Pluripotin, uma molécula pequena sintética, permite a propagação de mESCs num estado indiferenciado, na ausência do factor inibidor da leucemia (LIF) e fibroblastos de rato embrionários (MEFs) 18. Finalmente, foi demonstrado que mESCs pode ser isolado com um rendimento muito elevado (perto de 100%) quando um / FBS a meio protocolo alternância SR é combinado com LIF e pluripotin 19, 20. Estes protocolos permitem o isolamento eficiente de mESCs KO RMCE-compatível que pode subsequentemente ser utilizados para estudos estrutura-função.
Este documento descreve um método que permite que um para identificar os domínios de chave ou resíduos dentro de uma proteína que é responsável por processos celulares específicos. Para este fim, uma reserva de tecnologias avançadas que permitem o isolamento eficiente MESC, visando a montagem do vetor, e MESC segmentação era criard. Como tal, os grandes painéis com isoformas de proteas, mutantes de domínio, e efectores a jusante podem ser introduzidos em mESCs KO e podem ser avaliados pela sua capacidade para resgatar o fenótipo in vitro KO.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os experimentos com ratos foram conduzidos de acordo com os regulamentos animais institucionais, nacionais e europeus.
1. Isolamento de mESCs KO RMCE compatíveis
- Raça ratinhos KO heterozigicos com ratinhos RMCE-compatíveis, tais como ratinhos ROSALUC 10 ou ROSA26-iPSC ratos 21. Ambos os ratinhos RMCE-compatível foram mantidos num 129 / C57BL6 / fundo Swiss misto.
NOTA: Cruzando com KO heterozigotos é aconselhado para superar letalidade embrionária em ratos KO homozigotos. - Utilizar PCR para selecionar ratinhos KO heterozigicos contendo uma cassete de RMCE no locus R26 12.
- Raça, os ratinhos KO heterozigicos RMCE-compatível com ratinhos KO heterozigicos e isolar, blastocistos KO homozigicos RMCE-compatível.
- Configure acasalamentos tempo à noite e verificar a cópula conecta na manhã seguinte.
NOTA: As fichas são feitos de secreções coagulado do coagulantes e vesiculares glândulas do sexo masculino.Estes tampões de preencher a vagina da fêmea e persistem durante 8 - 24 h após o acasalamento. fêmeas conectados são consideradas transportando 0,5 dpc (dias post coitum) embriões.- Para verificar se há fichas, levantar a fêmea pela base de sua cauda e examinar por sua abertura vaginal para uma massa esbranquiçada. Espalhe os lábios da vulva ligeiramente com uma sonda angular quando a ficha é difícil de ver. fêmeas ligados separar de seus masculina.
- Recolhe blastocistos em 3,5 dpc.
- Eutanásia fêmeas grávidas pelo método aprovado (por exemplo, deslocamento cervical). Faça uma incisão médioventral e dissecar o útero e oviduto (ainda ligados uns aos outros), utilizando tesoura fina e fórceps.
- Dobrar uma agulha de calibre 26 num ângulo de 45 °. Anexar uma seringa de 1 ml, cheio com meio M2 para esta agulha dobrada e usá-lo para lavar os blastocistos do útero para a tampa de uma placa de 10 cm.
- Inserir a agulha no final do útero que está mais próximooviduto. Segure a agulha no lugar com uma pinça fina enquanto empurra o êmbolo; inchaço do útero indica uma descarga bem sucedida.
- Usar uma pipeta de boca (com um diâmetro entre 100 - 200 um) para recolher todos os embriões e lavar duas vezes em uma gota de meio M2 fresco. Imediatamente após a lavagem eles, transferir os blastocistos para as placas de cultura (ver abaixo).
NOTA: A dissecção e manuseio de blastocistos de deve ser feito em fluxo de ar laminar.
- Configure acasalamentos tempo à noite e verificar a cópula conecta na manhã seguinte.
- Isolar mESCs RMCE compatível KO
- Prepara-se uma placa de 12 poços com MEFs DR4 tratados com mitomicina-C (ver a Tabela de Materiais) um dia antes do isolamento de blastocisto.
NOTA: Estes MEFs foram isoladas a partir de ratinhos Tg (DR4) 1Jae / J que contêm quatro genes droga seleccionável e conferem resistência à neomicina, puromicina, higromicina, e 6-tioguanina 22.- Revestir todas as placas de cultura com 0,1% de gelatina. Adiciona-se 0,1% de gelatinapara as placas de cultura, incubar durante 5 min a 37 ° C em 5% de CO 2, e aspirar a solução de gelatina. Semente quarto de um frasco de P2 MEFs em uma placa de 12 poços e crescem-los em 2 mL de meio de MEF (ver Tabela 1, a Tabela de Materiais) para uma monocamada confluente 19.
- Inactivar os com mitomicina-C (10 ug / ml) durante 3 h e lave-se duas vezes com solução salina tamponada com fosfato (PBS) 19.
- Usando uma pipeta de boca, a chapa blastocistos em placas de 12 poços gelatinizados (1 bem / embrião), com as MEFs tratados com mitomicina-C em meio de células EL-ES (2 mL / poço) suplementado com 2 pluripotin uM ou com 2i (PD0325901 inibidor Erk 1 uM e 3 | iM GSK3 inibidor CHIR99021). Incubar a 37 ° C em 5% de CO 2.
- Refrescar o meio de células EL-ES (suplementado com pluripotin ou 2i) a cada 2 - 3 dias.
- Examine cada blastocisto sob uma stereomicroescopo em 4.0X ampliação e vá para incubação e de fixação à camada de MEF.
NOTA: Quando blastocistos escotilha, eles perdem a zona pelúcida que os encapsula. Wells com blastocistos não anexados precisam ser atualizados usando o pipetagem boca. - Escolha outgrowths ICM individuais (usando um microscópio estereoscópico) após 10 - 12 dias de cultura, utilizando uma pipeta P10 com pontas descartáveis. Transferir o crescimento em cerca de 10 uL de meio a uma placa em forma de V, de 96 poços contendo 30 uL / poço de PBS (à temperatura ambiente).
- Adicionar 50 mL de 0,25% de tripsina a cada poço utilizando uma pipeta de canais múltiplos e incubar durante 3 min a 37 ° C em 5% de CO 2.
- Adicionar 100 uL de SBF contendo meio MESC; dissociar as excrescências ICM em células individuais pipetando 10-15 vezes; e transferir as células dissociadas a mitomicina-C-tratados, placas de 96 poços MEF que foram preparadas um dia antes de as colónias são colhidas ICM.
- A partir desta etapa em diante, omi t pluripotin ou 2i a partir do meio MESC. No dia seguinte, mudar o meio de FBS- a forma MESC SR contendo (100 / po).
- Expandir as linhas Mesc estabelecidas a partir de 96- para o formato de 24 poços 19.
- Lavam-se as células com 200 uL de PBS, adicionar 50 ul de tripsina e incubar durante 5 min a 37 ° C em 5% de CO Adicionam-se 100? L de meio base MESC-FBS.; dissociar por pipetagem de 10 - 15 vezes usando uma pipeta de canais múltiplos; e transferir as células dissociadas a mitomicina-C-tratado, 24 bem placas MEF.
- Alterar a médio SR-base no dia seguinte. Expandir os mESCs em uma forma similar a partir de 24 de formato de 6 poços. Adicione 3 - 4 freezings de um confluente de 6 poços da placa 19.
- Identificar RMCE-compatível, mESCs KO homozigicos utilizando iniciadores de PCR para o locus 23 R26 e alelo KO de escolha (neste caso, p120ctn; PCRs para p120ctn nulo e alelos floxed foram descritos anteslass = "xref"> 12).
- Prepara-se uma placa de 12 poços com MEFs DR4 tratados com mitomicina-C (ver a Tabela de Materiais) um dia antes do isolamento de blastocisto.

Tabela 1. Meios de Cultura. Todos os meios foram armazenadas a 4 ° C e aquecida até 37 ° C, 30 min antes da utilização.
2. Geração de um vector de segmentação RMCE compatível com a utilização da recombinação Clonagem
- Clonar o resgate construes em vectores de recombinação-compatível, utilizando a enzima de restrição (RE) -based ou PCR com base em 24 técnicas de clonagem. Certifique-se de que os cDNAs conter um códon de parada.
- Iniciadores 24 projeto attB-marcados. Certifique-se de que o iniciador directo contém os seguintes elementos: um estiramento GGGG, um sítio attB1, um ligante, uma sequência de Kozak, e cerca de 25 nucleótidos de ADNc de salvamento (começando com o ATG). Certifique-se de que o primer reverso tem uma composição semelhante: um trecho GGGG, um site attB2, um elemento de ligação, e cerca de 25 nucleotides de ADNc de salvamento (complemento inverso).
- Amplificar o ADNc de salvamento através de PCR para se obter ADNc de attB-flanqueadas.
- Executar uma reacção de 10 ul BP com 100 ng de ADNc de attB-flanqueado e 150 ng do vector dador de recombinação-compatível, que contém um gene de resistência à canamicina.
- Transform 5 ul das misturas de PA em MC1061 de Escherichia coli heat-shock-competente (E. coli) (semelhantes aos descritos no passo 2.3).
- Identificar colónias contendo os vectores contendo ADNc de salvamento correcção (semelhantes às descritas no passo 2.4)
- Executar uma reacção de LR-10 ul usando 100 ng de resgate do vector contendo ADNc; 150 ng do vector excisado Cre-pRMCE-DV1 11 (LMBP 8195); e 2 uL da mistura de recombinase, a qual contém uma integrase codificada-fago e excisionase e um factor de integração hospedeiro bacteriano. Incubar durante 2 horas a 25 ° C.
NOTA: Uma reação LR é uma recombinação reagirde iões em que um clone de entrada contendo locais attL e um vector de destino contendo locais attR são recombinados pela LR mistura de enzima clonase. Isto resulta num clone de expressão contendo os locais attB que flanqueiam o gene de interesse. - Transform 5 ul das misturas de LR em bactérias coli MC1061 de E.-de choque térmico competente.
- Adicionar 5 uL de LR misturas para um nervuras, contornado, tubo de 2 mL com tampa de rosca com 40 uL de bactérias de E. coli de choque térmico-competentes e incubar durante 20 min em gelo. Incubar durante 5 min a 37 ° C.
- Adicionar 1 mL de meio de caldo de Luria (LB) e incubar durante 1 h a 37 ° C. Placa 50 uL sobre ampicilina (Amp; 100 / mL) molecular contendo placas de agar e crescer durante a noite a 37 ° C.
- Identificar as colónias com o vector de direccionamento correcto.
- Escolha 5 colónias aleatoriamente utilizando uma ponta de p200. Transferir a ponta de um tubo de ensaio de vidro contendo 2-5 mL de meio LB e crescer durante a noite a 37 ° C.
- Extrato do DNA de plasmídeo a partir de culturas bacterianas utilizando kits disponíveis comercialmente.
- Validá-los usando digere RE e sequenciamento. Cortar 0,5-2 ug de plasmídeo utilizando 0,2 uL de RE (20 U / mL) e 1 uL do tampão 10x correspondente numa reacção de 10 uL. Incuba-se durante pelo menos 1 h a 37 ° C e separado num gel de agarose a 1%. Escolha de colónias com o padrão previsto de fragmentos de ADN.
- Analisar os vectores confirmados (50 ng / mL) com Tlox F (ATC ATG TCT GGA TCC CCA TC) e IRES R (GGG GCG GAA TTC GAT ATC AAG), iniciadores (5 pmol /), utilizando sequenciação de Sanger.
3. MESC mediada por RMCE Segmentação de salvamento Constrói para o R26 Locus
- Iniciar uma cultura de mESCs e passagem deles KO RMCE compatível com pelo menos duas vezes em MEFs em meio MESC baseado em FBS. Dividir os mESCs em uma placa de 6 poços gelatinizado.
- No dia seguinte, refrescar as células, em cerca de 50% de confluência, com 1,5ml de meio de base MESC-FBS e transfectar as mESCs com um pRMCE-DV1 Cre-excisada vector de direccionamento que contém o ADNc de resgate.
- Faça uma mistura de DNA. Adicionar 1 ug de vector de direccionamento e 1 ug de plasmídeo de expressão FLPe-25-250 uL de meio DMEM puro.
- Faça uma mistura lipofecção. Adicionar 7 mL de reagente de transfecção à base de lipofecção (por exemplo, Lipofectamine 2000) para 250? L de meio DMEM puro e incubar durante 5 min a temperatura ambiente (RT).
NOTA: RMCE similares direccionamento eficiências foram obtidos utilizando outros reagentes à base de lipofecção (por exemplo, Lipofectamina LTX e Effectene). - Misturar a mistura de ADN com a mistura de lipofecção e incubar durante 20 min à TA. Pipetar a mistura de transfecção para as mESCs refrescadas. Agite bem e deixe durante a noite.
- Um dia após a transfecção, todos os dividir mESCs da placa de 6 pos para uma placa de cultura de 10 cm com uma camada confluente de MEFs DR4 e m baseado em FBS a 10 mL deCES meio.
- Dois dias após a transfecção, seleccionar clones Mesc com a troca correcta cassete mediada por FLPe por adição de 0,2 mg / mL de G418 (100x) ao meio.
NOTA: Faça uma curva de mortalidade para cada lote de G418 para identificar a menor concentração de G418 que mata todos os mESCs. - Recarregar os mESCs diariamente com meio MESC contendo G418. Colônias deve aparecer após 7 - 10 dias, assim que escolher e expandir estes como por passo 1.4.
- Confirmar os clones correctos por meio de PCR de 11.
4. Diferenciação de mESCs em corpos embrióides (EB)
- Iniciar uma cultura de mESCs KO com construções de resgate R26-driven e passagem deles pelo menos duas vezes em MEFs em meio MESC baseado em FBS. A passagem mESCs uma vez em 6 bem-placas gelatinizadas para se livrar das MEFs.
- Lava-se com PBS e as culturas trypsinize Mesc quase confluentes. Placa dissociado mESCs em diferentes diluições (1/20 e 1/40) sobre não-aderente, para animais de estimação bacteriana de grauRI-pratos em meio de diferenciação.
- Permitir EBs para formar nestes pratos por 30 dias. Refrescar o meio a cada 2 - 3 dias usando o seguinte procedimento: transferir a suspensão EB para um tubo de 50 mL, deixe os CEs assentar por gravidade, remover o sobrenadante, adicionar meio fresco, e transferir a suspensão EB volta para um grau bacteriana prato.
- Analisar os mESCs segmentados e EBs por microscopia de imunofluorescência e electrónica de transmissão usando protocolos que foram descritos anteriormente 12.
Access restricted. Please log in or start a trial to view this content.
Resultados
O procedimento para isolar linhas KO Mesc RMCE-compatível está representado na Figura 2. Dois cruzamentos consecutivos são necessários para obter blastocistos KO RMCE compatível. Primeiro, os ratinhos KO heterozigicos são cruzados com ratinhos RMCE-compatível, para obter ratinhos KO heterozigicos RMCE-compatível. Estes ratinhos são então utilizados para acasalamentos programados com outros ratinhos KO heterozigicos para se obter 3,5-DPC, RMCE-compatível, blast...
Access restricted. Please log in or start a trial to view this content.
Discussão
Nosso método de isolamento MESC é user-friendly e não requer habilidades avançadas ou equipamentos, tais como a microcirurgia de blastocistos. Assim, esta tecnologia é acessível a uma grande parte da comunidade científica. Qualquer pessoa com experiência básica de cultura celular pode propagar outgrowths ICM e estabelecer mESCs linhas. No entanto, a lavagem e manuseio de blastocistos requer alguma prática. Uma pipeta de boca é usado para transferir os blastocistos e consiste de uma micropipeta, um suporte de ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos Jinke D'Hont, Frederique Van Rockeghem, Natalie Farla, Kelly Lemeire e Riet De Rycke por sua excelente suporte técnico. Agradecemos também a EEF Parthoens, Evelien Van Hamme, e Amanda Goncalves do Mecanismo BioImaging Núcleo do Centro de Pesquisa Inflamação por sua assistência especializada. Reconhecemos membros do nosso grupo de pesquisa para discussões valiosas. Este trabalho foi apoiado pela Política belga Science (Belspo Interuniversitário de atração poloneses - Prêmio IAP VII-07 DevRepair; https://devrepair.be), pela Fundação Rainha Elisabeth Medical, Bélgica (GSKE para 2008-2010; http: // www .fmre-gske.be), e pelas acções concertadas de pesquisa (GOA 01G01908) da Universidade de Ghent, Bélgica (http://www.ugent.be/en/ghentuniv). SG é uma pós-bolseiro dos meios de investigação Flandres (FWO-V).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20 °C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23 G needles | Fine-ject | 8697 | |
| 1-mL syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 mL distilled water, autoclave and store at 4 °C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 mL, 10 mL and 25 mL | |||
| 15-mL and 50-mL conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μL) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37 °C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media | |||
| MEF Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| SR-based mESC medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/mL recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium) | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/mL ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
Referências
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1(2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243(2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55(2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. Third edn (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados