このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
リコンビナーゼ媒介カセット交換を用いて、マウス胚性幹細胞における構造と機能の研究
要約
タンパク質は、多くの場合、異なる細胞機能を発揮することができ、複数のドメインを含みます。遺伝子ノックアウト(KO)は、この機能的多様性を考慮していません。ここでは、様々な機能ドメインまたはタンパク質の変異体の分子解剖を可能KO胚性幹細胞における組み換え媒介カセット交換(RMCE)ベースの構造と機能のアプローチを報告しています。
要約
マウスの胚または胚性幹細胞における遺伝子工学(たmESC)は、与えられたタンパク質の機能を研究することができます。タンパク質は、細胞の主力であり、しばしば翻訳後修飾によって影響を受けることができる複数の機能ドメインからなります。条件付きまたは構成ノックアウト(KO)マウスでは、全タンパク質の枯渇を考慮に入れ、この機能的多様性と規制を負いません。 MESCラインとFLPe組換え媒介カセット交換(RMCE)のためのドッキング部位がROSA26(R26)遺伝子座内に挿入された誘導されたマウスモデルは、以前に報告されました。ここでは、マルチドメインタンパク質の異なる機能の分子解剖することができます構造 - 機能アプローチについて報告します。このため、RMCE互換マウスは、KOマウスと交配されている必要があり、その後、RMCE互換KOたmESCを分離する必要があります。次に、推定レスキュー構築物のパネルは、RMCE targetiを介してR26遺伝子座に導入することができますNG。候補レスキューcDNAを容易組換えクローニングを使用してターゲティングベクターのRMCE部位の間に挿入することができます。次に、KOのたmESCはFLPeリコンビナーゼ発現プラスミドと組み合わせたターゲティングベクターでトランスフェクトされます。 RMCEは、ROSA26ドッキング部位でプロモーターレスネオマイシン耐性遺伝子を再活性化し、正しい標的化事象の選択を可能にします。このように、100%に近い高いターゲティング効率は、半高スループット様式での複数の推定レスキュー構築物の挿入を可能にする、得られます。最後に、R26駆動型救助構築物の多くは、親のKOたmESCで観察された表現型を救出する能力について試験することができます。私たちは、P120カテニン(p120ctn)表現型の読み出しとして胚様体(EB)中胚葉分化を使用してのKOたmESCにおける実証の原則構造と機能の研究を提示します。このアプローチは、重要なドメイン、推定下流経路、および疾患関連点の識別を可能にします与えられたタンパク質のためのKO表現型の基礎となる変異。
概要
哺乳動物のゲノムは、約20,000のタンパク質をコードする遺伝子が含まれていると推定されています。選択的スプライシングと翻訳後修飾は、さらに、タンパク質のレパートリーを増やします。タンパク質は、モジュラー構造1を有し、しばしば、異なるタンパク質複合体へのそれらの動員および複数の細胞プロセス2への参加を可能にする、複数の相互作用ドメインを含みます。一つの例は、p120ctnと呼ばれる多機能性タンパク質です。 p120ctnはCtnnd1遺伝子によってコードされ、N末端およびC末端領域によって隣接大きな中央アルマジロリピートドメインから構成されています。 p120ctnのアルマジロドメインは、細胞 - 細胞接着に関与している古典的カドヘリンの高度に保存された膜近傍ドメインに結合し、それはまた、転写リプレッサーKaisoに結合します。 p120ctnのN末端ドメインは、異なるキナーゼ、ホスファターゼ、小さなRhoGTPases、及び微小管関連Pと相互作用しますroteins 3。興味深いことに、選択的スプライシングの結果として、p120ctnアイソフォームは、4つの代替開始コドン4から生成することができます。それは最も5' 開始コドンから翻訳および全長N末端セグメントを含むようp120ctnアイソフォーム1Aは、最長です。 p120ctnアイソフォーム3および図4に、このN末端セグメントは、それぞれ、部分的におよび完全に削除されます。さまざまな細胞機能におけるタンパク質(またはタンパク質アイソフォーム)とそのドメインの正確な役割を理解することが課題です。
たmESCにおいて標的遺伝子は、対応する遺伝子の遺伝子欠失を介してタンパク質の機能の研究を可能にし、広く発達重要と疾患関連遺伝子および経路の同定に貢献しています。逆遺伝学では、この画期的なによる相同組換え5にMESC単離及び標的遺伝子の分野における進歩の結果でしたアップ。相同組換えは、DNAフラグメントが二本鎖(ds)DNA切断後に2つの類似または同一の核酸部分との間で交換されるプロセスです。二本鎖DNA切断が頻繁であるため、通常、HRは非効率的です。最近、標的相同性指向性遺伝子の効率は、部位特異的ヌクレアーゼ6,7を用いて増加させることができるが、残念ながら、これらは、オフターゲット効果8を受けやすいです。遺伝子ターゲティングを可能にするためのより信頼性の高い技術は、のCre / loxP配列又はFLPe / FRTなどの部位特異的組換え系に基づいているRMCE、です。 LoxP及びFRT配列は、 バクテリオファージP1で発見され、 サッカロミセス・セレビシエ(Saccharomyces cerevisiae)は 、それぞれ、サイトの向きを決定非対称8塩基対の配列を含む、34塩基対から成ります。例えば、DNAストレッチ内の2つのloxP部位は、flox化DNAを切除またはIとなるかどうかを決定する一方、配向のCre媒介組み換え9時nversed。二つの部位が異なる染色体上に位置している場合また、Creをも転位を誘導することができます。 RMCEは、クロス反応し、ゲノム遺伝子座に埋め込まれていない異種の組換え部位を利用しています。同じ異種部位に隣接するDNA断片を含有するドナープラスミドの存在下で、リコンビナーゼは、なぜなら、二重同時トランスロケーション( 図1)のRMCE互換ゲノム遺伝子座にこのDNA断片を挿入します。ここで、のみ正しくRMCE標的クローンをドッキング細胞のR26ゲノム中に存在する「捕捉された、」プロモーターレスネオマイシン耐性遺伝子(ネオR)を復元着信ベクター上のプロモーター( 図1)に対する薬剤耐性のおかげをレンダリングすることができ10、11。これは、<100%11しばしば近く、非常に高いターゲティング効率をもたらします/ SUP> 12。結論として、RMCEベースのターゲティングは非常に効率的であり、構造機能研究のために使用することができます。しかし、それは事前設計ゲノム遺伝子座を必要とします。
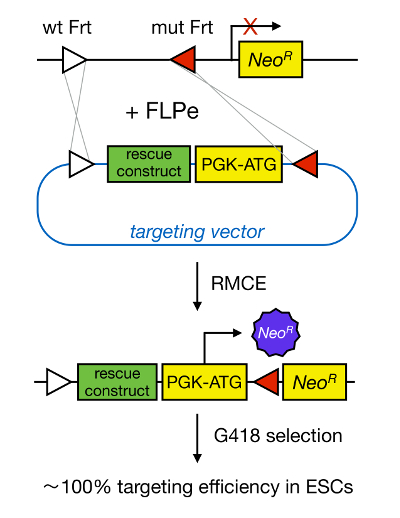
図1. RMCE媒介ターゲティングの略図。両方は、2つの異種FRT部位(白及び赤の三角形によって示される)を保有する場合RMCEは、定義されたゲノム遺伝子座への着信ターゲティングベクターからのDNAセグメントの交換を可能にします。加えて、操作されたゲノム遺伝子座は、プロモーターおよび短縮型ネオマイシン耐性(ネオR)遺伝子を含みます。プロモーターを提供することによってのみ正しい組換え事象は、高いターゲティング効率で得られ、ネオマイシン耐性を復元する、入ってくるDNA断片に開始コドン。 トンの拡大版をご覧になるにはこちらをクリックしてください。彼のフィギュア。
たmESCにおけるゲノム工学は、RMCE互換マウスの生成を可能にします。 1981年に、2つのグループが胚盤胞の内部細胞塊(ICM)から多能性細胞を捕捉及び培養13、14でそれらを維持することに成功しました。たmESCは、生殖細胞系列を含む、胚および成人の細胞のすべてのタイプの中に自己複製と分化することができます。したがって、たmESCにおいて標的遺伝子(のCre / loxPシステムを使用して)構成的または条件付きKOマウスの開発を通して逆遺伝学的研究を可能にします。しかし、マウスES細胞を分離するための古典的な方法は非常に非効率的です。いくつかの主要な改良が大幅MESC SRとウシ胎児血清(FBS)16を含有する培地、及び薬理学の使用の間に交互に、15培地(SR)に定義血清置換の使用を含む、MESCラインを導出するための成功率が増加しています例えばpluripotin又は2I 17などの論理化合物。 Pluripotin、小さな合成分子は、白血病阻害因子(LIF)およびマウス胚線維芽細胞(MEFの)18の非存在下で未分化状態におけるたmESCの伝播を可能にします。最後に、SR / FBS培地交替プロトコルはLIFと19、20 pluripotin組み合わせた場合たmESCは(100%に近い)非常に高い効率で単離することができることが示されています。これらのプロトコルは、その後、構造 - 機能研究のために使用することができるRMCE互換ノックアウトたmESCの効率的な分離を可能にします。
本論文では、特定の細胞プロセスに責任があるタンパク質内のキーのドメインまたは残基を同定するために、1つを可能にする方法を説明します。この目的のために、効率的MESC分離を有効に高度な技術、ターゲティングベクターのアセンブリ、およびMESCターゲティングのパイプラインを作成しましたD。このようにして、タンパク質アイソフォーム、ドメイン変異体、および下流のエフェクターとの大きなパネルがKOされたmESCで導入することができ、in vitroでの KO表現型を救出する能力について評価することができます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
マウス上の全ての実験は、機関投資家、国、ヨーロッパの動物の規定に従って行われました。
RMCE互換KOたmESCの単離
- そのようなROSALUCマウス10またはROSA26-のiPSCマウス21などのRMCE互換マウスとヘテロ接合性KOマウスを繁殖。両方のRMCE互換マウスは、混合129 / C57BL6 /スイスの背景上で維持しました。
注:ヘテロKOマウスとの交配は、ホモ接合型KOマウスの胚性致死を克服することをお勧めします。 - R26座12にRMCEカセットを含有するヘテロ接合性KOマウスを選択するためにPCRを使用します。
- ヘテロ接合性KOマウスとRMCE互換性、ヘテロ接合性KOマウスを繁殖し、RMCE互換性、ホモ接合型KO胚盤胞を単離します。
- 夕方に時間交配を設定し、交尾が翌朝プラグを確認してください。
注:プラグは男性の凝固及び小胞腺からの分泌物の凝固で作られています。これらのプラグは、女性の膣を満たし、8持続 - 飼育後24時間。差し込まれ、女性は0.5 DPC(日ポスト交尾)の胚を運ぶことが考えられています。- 、プラグをチェックし、彼女の尾の付け根で女性を持ち上げ、によって白っぽい塊のための彼女の膣口を調べるために。プラグは見ることが困難な場合、わずかに角度のついたプローブを用いて外陰部の唇を広げます。その男性とは別のプラグインの女性。
- 3.5 DPCの胚盤胞を収集します。
- 承認された方法( 例えば、頚椎脱臼)によって妊娠した雌を安楽死させます。 midventral切開部を作り、子宮や卵管を解剖細かいハサミやピンセットを使用して(まだお互いに取り付けられています)。
- 45°の角度に26ゲージの針を曲げます。この曲がった針をM2培地で満たされた1 mLの注射器を取り付け、10 cmディッシュの蓋に子宮から胚盤胞をフラッシュするために使用します。
- に最も近い子宮の終わりに針を挿入します卵管。プランジャーを押しながら細かい鉗子と場所に針を保持します。子宮の腫れは成功したフラッシュを示します。
- すべての胚を収集し、新鮮なM2培地のドロップに二度、それらを洗浄するために - (200〜100μmの直径を持つ)口のピペットを使用してください。すぐに洗浄した後、培養プレートに胚盤胞を転送する(下記参照)。
注:の胚盤胞の解剖と取り扱いが層流で行う必要があります。
- 夕方に時間交配を設定し、交尾が翌朝プラグを確認してください。
- RMCE互換KOたmESCを隔離
- マイトマイシンC処理したDR4 MEFを有する12ウェルプレート( 材料の表を参照)胚盤胞の単離の前に一日を準備します。
注:これらのMEFは、4つの薬物選択遺伝子を含有し、ネオマイシン、ピューロマイシン、ハイグロマイシンに対する耐性を付与するのTg(DR4)1Jae / Jマウスから単離し、そして22 6-チオグアニンました。- 0.1%ゼラチンでコートすべての培養プレート。 0.1%のゼラチンを追加培養プレートに、5%CO 2中、37℃で5分間インキュベートし、ゼラチン溶液を吸引します。コンフルエント単層19にシード12ウェルプレート中のP2のMEFのバイアルの四分の一とMEF培地2mlでそれらを成長させる( 表1、 材料の表を参照のこと)。
- 3時間マイトマイシンC(10μg/ ml)でそれらを不活性化し、リン酸緩衝生理食塩水(PBS)19で二回洗っ。
- SR-ES細胞培地中のマイトマイシンC処理したMEFと、ゼラチン化12ウェルプレート上に胚盤胞(1ウェル/胚)板、口のピペットを用いて、(2ミリリットル/ウェル)のいずれか2μMのpluripotinまたは2Iを補充します(1μMのErkインヒビターPD0325901及び3μMGSK3インヒビターCHIR99021)。 5%CO 2で37℃でインキュベートします。
- 3日間 - すべての2(pluripotinまたは2Iを補っ)SR-ES細胞培地をリフレッシュします。
- stereomicro下の各胚盤胞を調べ4.0Xの倍率でスコープとMEF層へのハッチングと添付ファイルを確認してください。
注:胚盤胞のハッチ、彼らはそれらをカプセル化透明帯を失います。アタッチされていない胚盤胞とのウェルズは、口のピペットを使用してリフレッシュする必要があります。 - 使い捨てチップとP10ピペットを用いて培養12日 - 10後(実体顕微鏡を使用して)、個々のICMの増生を選択します。 (室温)30μL/ウェルのPBSを含むV字型、96ウェルプレートに培地の約10μLで伸長を転送します。
- 各ウェルにマルチチャンネルピペットを使用して、0.25%トリプシンの50μLを加え、5%CO 2中で37℃で3分間インキュベートします。
- FBS含有MESC媒体の100μLを追加します。 10〜15回ピペッティングによって単一細胞にICMの派生物を解離。そしてICMコロニーが採取される前に、一日に調製したマイトマイシンC処理した、96-ウェルMEFプレートに解離した細胞を移します。
- OMI、これ以降のステップから MESC媒体からのT pluripotinまたは2I。次の日に、(100μL/ウェル)SR含有MESC媒体にFBS-からメディアを変更します。
- 96〜24ウェルフォーマット19から確立MESCラインを展開。
- PBS200μLで細胞を洗浄し、トリプシンの50μLを添加し、5%CO中で37℃で5分間インキュベートFBSベースMESC培地100μLを加えます。 10ピペットで解離 - マルチチャンネルピペットを用いて15回。およびマイトマイシンC処理した、24-ウェルMEFプレートに解離した細胞を移します。
- 次の日にSRベースのメディアに変更します。 24から6ウェルフォーマットと同様にたmESCを展開。コンフルエントな6ウェルプレート19から4 freezings - 3を作ります。
- 選択のR26軌跡23及びKO対立遺伝子(この場合、p120ctnためのPCRプライマーを用いてRMCE互換、ホモKOたmESCを識別する; p120ctnヌルとフロックス対立遺伝子についてPCRを以前に記載しました。小娘= "外部参照"> 12)。
- マイトマイシンC処理したDR4 MEFを有する12ウェルプレート( 材料の表を参照)胚盤胞の単離の前に一日を準備します。

表1.培養培地。すべてのメディアは、4℃で保存し、使用前に37℃で30分間に温めました。
組換えクローニングを用いRMCE互換標的ベクターの2世代
- 制限酵素(RE)を使用して組換え互換ベクターは、ベースまたはPCRベース24件のクローニング技術にレスキュー構築物クローン。 cDNAは終止コドンが含まれていることを確認してください。
- デザインのattBタグ付きプライマー24。 GGGGストレッチ、にattB1サイト、リンカ、Kozak配列、および救助cDNAの約25ヌクレオチド(そのATGで始まる):フォワードプライマーは、以下の要素が含まれていることを確認してください。 GGGGストレッチ、AttB2サイト、リンカ、および約25 NUC:リバースプライマーは、同様の組成を有していることを確認します救助のcDNA(逆相補体)のleotides。
- attB-隣接してcDNAを得るために、PCR を介して救助するcDNAを増幅します。
- attB-挟まれたcDNA 100ngのとカナマイシン耐性遺伝子を含む組み換え互換ドナーベクター、150ngの10-μLBP反応を行います。
- 熱ショックコンピテントMC1061 大腸菌 (E. coli)(工程2.3に記載のものと同様の)細菌中BP混合物の5μLを変換します。
- (ステップ2.4で説明したものと同様の)正しいレスキューcDNAを含むベクターを含むコロニーを同定
- レスキューcDNAを含有するベクター100ngを用いて、10μLLR反応を行います。 Cre切除pRMCE-DV1ベクトル11(LMBP 8195)の150 ngの。ファージにコードさインテグラーゼと切出し酵素や細菌統合宿主因子が含まれているリコンビナーゼミックス、の2μL。 25℃で2時間インキュベートします。
注:LR反応が再結合である反応attL部位およびattR部位を含むデスティネーションベクターを含むエントリークローンをLRクロナーゼ酵素ミックスによって再結合されたイオン。これは、目的の遺伝子に隣接するattB部位を含む発現クローンになります。 - 熱ショックコンピテントMC1061 大腸菌にLRの混合物の5μLを変換します。
- リブ5μLLRの混合物を追加し、熱ショックコンピテント大腸菌の40μLと、2 mLのスクリューキャップチューブスカート、氷上で20分間インキュベートします。 37°Cで5分間インキュベートします。
- 1 mLのルリアブロス(LB)培地を加え、37℃で1時間インキュベートします。プレートアンピシリンに50μL(アンペア;100μg/ mLの)寒天プレートを含有し、37℃で一晩増殖。
- 正しいターゲッティングベクターを用いてコロニーを同定します。
- P200チップを使用してランダムに5個のコロニーを選択してください。 2を含有するガラス試験管にチップを移す - LB培地5mlを、37℃で一晩増殖。
- 例市販のキットを使用して細菌培養物からのプラスミドDNAを道。
- RE消化と配列決定を使用してそれらを検証します。 10μLの反応でREの0.2μL(20 U /μL)および対応する10×緩衝液、1μLを用いてプラスミド2μgの - 0.5を切りました。 37℃で少なくとも1時間インキュベートし、1%アガロースゲル上で分離します。 DNA断片の予測パターンを持つコロニーを選択します。
- サンガー配列決定を用いてTlox F(ATC ATG TCT GGA TCC CCA TC)及びIRES R(GGG GCG GAA TTC GAT ATC AAG)プライマー(5ピコモル/μL)で確認ベクトル(50 ng /μLで)を分析します。
救助の標的3. RMCE媒介MESCはR26座に構築します
- FBSベースMESC培地中のMEF上に少なくとも二回RMCE互換KOのたmESC通路それらの文化を開始します。糊化6ウェルプレート上たmESCを分割します。
- 翌日、1.5で、約50%の集密度で、細胞をリフレッシュFBSベースMESC培地のmL及びレスキューcDNAを含むベクターを標的のCre切除pRMCE-DV1とたmESCをトランスフェクトします。
- DNAミックスを作成します。純粋なDMEM培地を250μLにFLPe発現プラスミド25の1ターゲッティングベクターおよび1μgを加えます。
- リポフェクションミックスを作成します。純粋なDMEM培地の250μLにリポフェクションベースのトランスフェクション試薬の7μL( 例えば、リポフェクタミン2000)を追加し、室温(RT)で5分間インキュベートします。
注:同様のRMCEターゲティング効率が他のリポフェクションベースの試薬( 例えば、リポフェクタミンLTXとのEffectene)を用いて得ました。 - リポフェクションミックスとDNAミックスを混合し、室温で20分間インキュベートします。リフレッシュたmESCにトランスフェクション混合物をピペット。優しく旋回し、一晩おきます。
- トランスフェクションの1日後、コンフルエントDR4とのMEFの層及び10mLのFBS系Mと10 cmの培養皿に6ウェルプレートから全てたmESCを分割ESC培地。
- トランスフェクションの2日後、培地には0.2mg / mLのG418(100X)を添加することによって正しいFLPe媒介カセット交換とMESCクローンを選択します。
注:すべてのたmESCを殺すG418の最低濃度を識別するためにG418の各バッチにKill曲線を作成します。 - G418含有MESC培地で毎日たmESCをリフレッシュします。コロニーは7の後に表示されます - 10日なので、ステップ1.4に従ってこれらを選択して展開します。
- PCR 11 を介して正しいクローンを確認します。
胚様体におけるたmESCの分化4(EBS)
- FBSベースMESC培地中のMEF上に少なくとも二回R26駆動型レスキュー構築物およびそれらを通過してのKOたmESCの文化を開始します。 MEFを取り除くために糊化6ウェルプレート上の通路たmESC一回。
- PBSで洗浄し、ほぼコンフルエントMESC培養物をトリプシン処理。プレートは、非接着性、細菌グレードのペットに異なる希釈(1/20と1/40)でたmESCを解離しました分化培地中でRI-料理。
- EBを30日間これらの皿で形成することを可能にします。 50mLのチューブにEB懸濁液を転送し、EBを重力によって沈降させ、上清を除去し、新鮮な培地を追加し、そして細菌のグレードに戻るEB懸濁液を転送:次の手順を使用して3日 - すべての2培地をリフレッシュ皿。
- 以前12に記載されたプロトコルを使用して免疫蛍光および透過電子顕微鏡により標的たmESCとEBSを分析します。
Access restricted. Please log in or start a trial to view this content.
結果
RMCE互換KO MESC株を単離するための手順は、図2に示されています。二つの連続交配はRMCE互換KO胚盤胞を得るために必要とされています。まず、ヘテロKOマウスはRMCE互換、ヘテロKOマウスを得ることがRMCE互換のマウスと交配されています。これらのマウスは、次いでRMCE互換3.5 DPC、ホモ接合型KO胚盤胞を得るために、他のヘテロ接合性KOマウスとの時限交配の?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
私たちのMESC分離法は、ユーザーフレンドリーであり、そのような胚盤胞のマイクロサージェリーなどの高度なスキルや設備を必要としません。したがって、この技術は、科学界の大部分にアクセスできます。基本的な細胞培養の経験を持つ誰もがICMの派生物を伝播したmESCラインを確立することができます。しかし、胚盤胞の洗浄及び取り扱いはいくつかの練習が必要です。口のピペットは?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、開示することは何もありません。
謝辞
私たちは、その優れた技術サポートのためにJinke D'Hont、フレデリック・ヴァン・Rockeghem、ナタリーFarla、ケリー・レメアー、およびRietデRyckeに感謝します。我々はまた、彼らの専門家の支援のための炎症研究センターのバイオイメージングコア施設からEEF Parthoens、EvelienヴァンHamme、およびアマンダGoncalvesの感謝します。私たちは貴重な議論のための私たちの研究グループのメンバーを認めます。この作品は、ベルギーの科学政策によってサポートされていました(Belspo大学間アトラクションのポーランド - 賞IAP VII-07 DevRepair; https://devrepair.be)エリザベート王妃医療財団、ベルギー(GSKE 2008年から2010年で、;のhttp:// WWW .fmre-gske.be)、およびゲント大学、ベルギー(http://www.ugent.be/en/ghentuniv)の協調研究アクション(GOA 01G01908)によります。 SGフランダース研究費(FWO-V)のポスドクです。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20 °C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23 G needles | Fine-ject | 8697 | |
| 1-mL syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 mL distilled water, autoclave and store at 4 °C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 mL, 10 mL and 25 mL | |||
| 15-mL and 50-mL conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μL) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37 °C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media | |||
| MEF Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| SR-based mESC medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/mL recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium) | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/mL ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
参考文献
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1(2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243(2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55(2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. Third edn (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved