JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
재조합 효소 매개 카세트 교환을 사용하여 마우스 배아 줄기 세포의 구조 - 기능 연구
요약
단백질은 종종 다른 세포 기능을 발휘할 수있는 여러 도메인을 포함한다. 유전자 녹아웃 (KO)이 기능의 다양성을 고려하지 않는다. 여기, 우리는 다양한 기능 영역 또는 단백질의 변이의 분자 해부를 허용 KO 배아 줄기 세포에서 재조합 중재 카세트 교환 (RMCE) 기반 구조 - 기능 접근 방식을보고합니다.
초록
마우스 배아 또는 배아 줄기 세포 (mESCs)에서 유전자 공학은 주어진 단백질의 기능 연구를 위해 수 있습니다. 단백질은 세포 골격을 이루는 종종 번역 후 변형에 의해 영향을받을 수있는 다수의 기능 영역들로 구성된다. 조건부 또는 구성 적 녹아웃 (KO) 마우스에서 전체 단백질의 고갈이 고려 기능적 다양성 및 규제를받지 않는다. MESC 라인 FLPe 재조합 매개 카세트 교환 (RMCE)을위한 도킹 사이트가 ROSA26 (R26)의 궤적 내에 삽입되는 유도 마우스 모델은 이전에보고되었다. 여기, 우리는 멀티 도메인 단백질의 서로 다른 기능의 분자 해부를 허용하는 구조 기능 접근에보고한다. 이를 위해, RMCE 호환 마우스는 KO 마우스를 교차해야하고 RMCE 호환 KO의 mESCs는 격리해야합니다. 다음으로, 추정 구조 구조의 패널의 RMCE targeti 통해 R26 로커스에 도입 될 수있다NG. 후보 구조 cDNA를 쉽게 재조합 복제를 사용하여 대상 벡터의 RMCE 사이트 사이에 삽입 할 수 있습니다. 다음에, 코 mESCs는 FLPe 재조합 발현 플라스미드와 함께 타겟팅 벡터로 형질 감염된다. RMCE는 ROSA26 도킹 사이트에서 프로모터 이하 네오 마이신 - 내성 유전자를 재 활성화하고 정확한 표적화 이벤트를 선택할 수 있습니다. 이러한 방식으로, 100 %에 가까운 높은 타겟팅 효율이 반 고 스루풋 추정 방식 다중 구조 구조의 삽입을 허용 얻어진다. 마지막으로, R26 기반 구조 구조의 다수는 부모 KO의 mESCs에서 관찰 된 표현형을 구출하기 위해 자신의 능력을 테스트 할 수 있습니다. 우리는 P120의 카테닌 (p120ctn) 표현형 판독으로 배아 체 (교환 사채)에서 내배엽 분화를 사용 KO의 mESCs의 원리 증명 구조 기능 연구를 제시한다. 이러한 접근 방식은 중요한 영역의 식별, 추정 다운 스트림 경로, 질병 관련 지점을 수 있습니다주어진 단백질 KO의 표현형의 기초가 돌연변이.
서문
포유류의 게놈은 약 20,000 단백질 코딩 유전자를 포함하는 것으로 추정된다. 스 플라이 싱 및 번역 후 변형은 상기 단백질 레퍼토리를 증가시킨다. 단백질은 모듈 식 구조 (1)을 가지고 있고 종종 서로 다른 단백질 복합체에 자신의 모집 및 여러 세포 과정 2에 참여를 허용 여러 상호 작용 도메인을 포함한다. 한 가지 예는 p120ctn라는 다기능 단백질이다. p120ctn Ctnnd1는 유전자에 의해 코딩 및 N 말단 및 C 말단 영역에 의해 측면 큰 중앙 딜 반복 영역으로 구성된다. p120ctn의 딜 도메인이 세포 - 세포 부착에 관여하는 고전 cadherins의 고도로 보존 된 막 근접 영역에 결합 할뿐만 아니라, 전사 리프레 가이 소 (海)에 결합한다. p120ctn의 N- 말단 도메인은 다른 키나제, 포스파타제, 작은 RhoGTPases, 및 미세 소관 - 연관된 페이지와 상호 작용roteins 3. 흥미롭게도, 스 플라이 싱의 결과, p120ctn 이성체 네 대체 개시 코돈 (4)로부터 생성 될 수있다. 이 개시 코돈 '가장 -5- 번역 및 전장 N 말단 부분을 포함한다으로 p120ctn 이성체 (1A)는, 최장. p120ctn 3 및도 4는,이 N 말단 부분을 부분적으로 완전 각각 삭제 이소 폼. 다른 세포 기능의 단백질 (또는 단백질 이소 형)과 도메인의 정확한 역할을 이해하는 것은 과제로 남아.
mESCs 타겟팅 유전자는 해당 유전자의 유전 삭제를 통해 단백질의 기능 연구를 가능하게하고 널리 발달 중요한 질병 관련 유전자 및 경로의 식별에 기여하고있다. 역 유전학이 침투 의한 상동 재조합 5 MESC 분리 및 표적 유전자의 분야에서의 진보의 결과였다 까지. 상동 재조합은 DNA 단편은 이중 가닥 (DS) DNA 휴식 후 2 개 유사하거나 동일한 핵산 잔기 사이에서 교환되는 과정이다. dsDNA 나누기가 자주 있기 때문에 일반적으로, HR은 비효율적이다. 최근 타겟팅 상동 관한 유전자의 효율이 부위 특이 적 뉴 클레아 제 (6, 7)를 사용하여 증가 될 수 있지만, 불행하게도, 이러한 오프 - 표적 효과 8 쉽다. 보다 신뢰성있는 기술은 표적 유전자를 활성화하는 등 Cre 호텔 /은 loxP 또는 FLPe / FRT 등의 부위 특이 적 재조합 시스템에 근거 RMCE이다. 및 FRT에 loxP 서열은 P1 박테리오파지에서 발견 사카 cerevisiae에 각각, 상기 위치의 방향을 결정하는 비대칭 8 염기쌍 서열을 포함하여 34 염기쌍으로 구성. 반면에,의 방향은 예를 들면, DNA 스트레치 내 두에 loxP 사이트는 floxed DNA 절제된다 여부를 확인 아니면 내가 것Cre 호텔 - 중재 재조합 9시 nversed. 이 개 사이트는 서로 다른 염색체에있는 경우 또한, Cre 호텔도 전좌를 유도 할 수 있습니다. RMCE 교차 반응하지 않고 그 게놈 궤적에 포함 된 이종 재조합 사이트 활용합니다. 같은 이종 사이트 어귀 DNA 단편을 포함하는 도너 플라스미드의 존재에서, 재조합으로 인해 이중 동시 전위 (도 1)의 RMCE 호환 게놈 로커스에이 DNA 단편을 삽입하는 것이다. 여기에만 정확하게 RMCE 타겟 클론 복원 수신 벡터상의 프로모터에 약제 내성 덕분에 렌더링 할 수있는 "포획"프로모터 이하 네오 마이신 내성 유전자 도킹 세포 R26 게놈에 존재하는 (네오 R) (도 1) 10, 11. 이 <100 % 11 종종 가까운 매우 높은 타겟팅 효율성, 결과/ SUP> 12. 결론적 RMCE 기반 타겟팅 매우 효율적인 구조 및 기능 연구를 위해 사용될 수있다; 그러나, 사전 설계 게놈 궤적을 필요로한다.
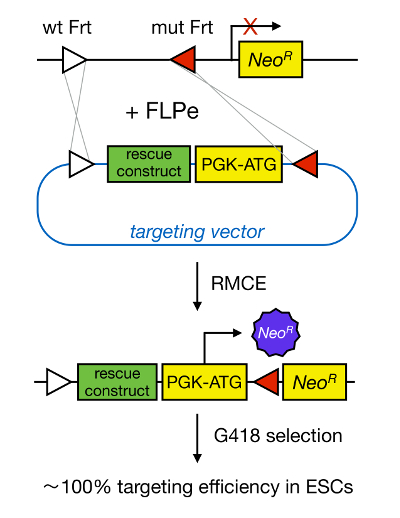
RMCE 매개 타겟팅 그림 1. 도식 표현. 모두 두 이종 FRT 부위 (흰색과 빨간색 삼각형으로 도시)을 품고있는 경우 RMCE 정의 된 게놈 로커스에 들어오는 대상 벡터에서 DNA 세그먼트의 교환을 허용한다. 또한, 유전자 조작 궤적이 promoterless 및 절단 네오 마이신 내성 (네오 R) 유전자를 포함한다. 들어오는 DNA 단편의 코돈 프로모터를 제공하고 시작함으로써 만 정확한 재조합 높은 타겟팅 효율 결과, 네오 마이신 저항성을 복원. t의 더 큰 버전을 보려면 여기를 클릭하십시오그의 그림.
mESCs에서 게놈 엔지니어링은 RMCE 호환 마우스의 생성을 허용합니다. 1981 년에, 두 그룹은 배반포의 내부 세포 덩어리 (ICM)로부터 다 능성 세포를 포착 및 배양 13, 14에서 그 유지에 성공했다. mESCs는 세균 세포 계보를 포함하여 배아 및 성체 세포의 모든 유형에자가 재생과 분화 할 수있다. 따라서 mESCs 타겟팅 유전자는 구조적 또는 (정속 신장식 /에 loxP 시스템을 이용하여) 조건부 KO 마우스의 개발을 통해 역 유전 연구를 가능하게한다. 그러나, 마우스 ES 세포를 분리하는 고전적인 방법은 매우 비효율적이다. 몇몇 주요 개선은 매우 SR 및 소 태아 혈청 (FBS) (16)를 포함 MESC 매체 번갈아 15 배지 정의 혈청 여분 (SR)의 사용을 포함하여, 유도 MESC 라인 성공률을 증가 및 약리학 사용했다이러한 pluripotin 또는 2I 17 논리 화합물. Pluripotin 작은 합성 분자, 백혈병 억제 인자 (LIF) 및 마우스 배아 섬유 아 세포 (MEFs) (18)의 부재 하에서 미분화 상태 mESCs의 전달을 허용한다. 마지막으로,이 mESCs는 SR / FBS 배지 교대 프로토콜 (20)과 함께 LIF 및 19 pluripotin 결합 될 때 (100 %에 가까운) 아주 높은 효율로 분리 될 수 있음을 보여왔다. 이러한 프로토콜은 이후 구조 기능 연구에 사용할 수 있습니다 RMCE 호환 KO의 mESCs의 효율적인 분리를 할 수 있습니다.
이 논문은 하나의 특정 세포 과정을 담당하는 단백질 내에서 키 도메인 또는 잔류 물을 식별 할 수있는 방법을 설명합니다. 이를 위해, 효율적인 MESC 분리를 가능하게 고급 기술, 대상 벡터 조립 및 MESC 타겟팅의 파이프 라인을 생성했다디. 단백질 이성체, 도메인 돌연변이 및 다운 스트림 이펙터와 같은 대형 패널은 KO의 mESCs에 도입 될 수 있으며, 체외 KO 표현형을 구출 할 수있는 능력을 평가 할 수있다.
프로토콜
마우스에 대한 모든 실험은, 기관, 국가 및 유럽의 동물 규정에 따라 실시 하였다.
RMCE 호환 KO의 mESCs 1. 분리
- 이러한 ROSALUC 마우스 10 ROSA26-IPSC 마우스 (21) 등 RMCE 호환 마우스와 이형 KO 쥐 품종. 두 RMCE 호환 마우스는 혼합 129 / C57BL6 / 스위스 배경에 유지되었다.
참고 : 이형 KO 마우스를 교차은 동형 접합 KO 마우스의 배아 치사를 극복하는 것이 좋습니다. - R26의 궤적 (12)의 RMCE 카세트를 포함하는 이형 KO 마우스를 선택 PCR을 사용합니다.
- 이형 KO 마우스와 RMCE 호환, 이형 KO 마우스 새끼를 낳 및 RMCE 호환, 동형 접합 KO의 배반포을 격리 할 것.
- 저녁 시간 교배를 설정하고 교미가 다음 날 아침에 플러그를 확인하십시오.
참고 : 플러그는 남성의 응고 및 기공 땀샘에서 응고 된 분비물로 만들어진다.이 플러그는 여성의 질을 작성하고 8 지속 - 번식 후 24 시간. 전원 사용 여성은 0.5 DPC (일 포스트 교미) 배아를 운반하는 것으로 간주됩니다.- 플러그를 확인 그녀의 꼬리의 기지에 의해 여성을 들어 올려하여 백색의 물질에 대한 그녀의 질 입구를 검사합니다. 플러그가 보이지 때 약간 각진 프로브와 외음부의 입술을 확산. 자신의 남성에서 별도의 연결 여성.
- 3.5 DPC에서 배반포를 수집합니다.
- 승인 된 방법 (예를 들어, 자궁 경부 전위)에 의해 임신 한 여성을 안락사. midventral 절개를하고 자궁과 난관을 해부 미세 가위와 집게를 사용 (여전히 서로에 부착).
- 45 ° 각도로 26 게이지 바늘이 구부러. 이 굽은 바늘 M2 배지로 채워진 1 ml 주사기를 부착하고, 10 cm 접시 뚜껑에 자궁에서 포배를 플러시 사용.
- 에 가장 가까운 자궁의 끝 부분에 바늘을 삽입난관. 미세 집게로 장소에 바늘을 잡고있는 동안 플런저를 밀어; 자궁의 팽창하는 것은 성공적인 홍조를 나타냅니다.
- 모든 태아를 수집하고 신선한 M2 배지 한 방울 두번 씻어 - (200 내지 100㎛의 직경)은 입 피펫을 사용한다. 즉시 세척 후, 배양 접시에 포배를 전송 (아래 참조).
참고 : 층류 공기 흐름에 실시 할 필요가 배반포의 해부 및 취급.
- 저녁 시간 교배를 설정하고 교미가 다음 날 아침에 플러그를 확인하십시오.
- RMCE 호환 KO의 mESCs을 분리
- 미토 마이신 C 처리 DR4 MEFs에있는 12 개 웰 플레이트 (재료의 도표 참조) 배반포 분리 하루 전에 준비한다.
주의 : 이러한 약물 MEFs에 네 개의 선택 가능한 유전자를 포함하고 네오 마이신, 푸로 마이신, 하이 그로 마이신에 내성을 부여의 Tg (DR4) 1Jae / J 마우스로부터 분리하고, 22 6- 티오 구아닌 하였다.- 코트 0.1 % 젤라틴 모든 배양 플레이트. 0.1 % 젤라틴 추가배양 판을 5 % CO 2에서 37 ° C에서 5 분 동안 배양하고, 젤라틴 용액을 흡인. 종자 한 12 웰 플레이트 MEFs에 P2의 바이알 분기 MEF 배지 2 ㎖로 그들을 성장 (표 1의 재료를 표) 합류 단층 (19).
- 3 시간 동안 미토 마이신 C (10 ㎍ / ㎖)로 불 활성화하고 인산 완충 용액 (PBS) (19)로 두 번 씻어.
- SR-ES 세포 배지 중의 미토 마이신 C 처리 된 MEFs으로 젤라틴 화 12 웰 플레이트 상에 포배 (1 웰 / 배아) 판, 입 피펫을 사용하여 (2 ㎖가 / 웰) 중 2 μM의 pluripotin 또는 2I 보충 (1 μM ERK 억제제 PD0325901 3 μM GSK3 억제제 CHIR99021). 5 % CO 2에서 37 ℃에서 인큐베이션.
- 3 일 - 매 2 (pluripotin 또는 2I 보충)을 SR-ES 세포 매체를 새로 고칩니다.
- stereomicro 아래의 각 배반포를 검사4.0 배율 범위와 MEF 층 부화 부착 확인.
참고 : 배반포 해치, 그들은 그것들을 캡슐화 투명대를 잃게합니다. 무소속 배반포와 웰스는 입 피펫을 사용하여 갱신 될 필요가있다. - 일회용 팁과 P10 피펫을 사용하여 문화의 12 일 - 10 후 (실체 현미경을 사용하여) 개별 ICM의의 outgrowths을 선택합니다. (상온에서) / 웰 PBS 30 μL를 포함하는 V 형 96 웰 플레이트에 배지의 약 10 μL의 파생물을 전송.
- 각 웰 멀티 채널 피펫을 사용하여 0.25 % 트립신을 50 μL를 첨가하고, 5 % CO 2에서 37 ℃에서 3 분 동안 배양한다.
- MESC 매체 FBS를 함유하는 100 μL를 추가; 10-15 회 피펫 팅하여 단일 세포로 된 ICM의 outgrowths를 해리; 및 미토 마이신 C로 처리가 해리 된 세포를 전송할 상기 ICM 콜로니 촬상 전에 하루 제조 하였다 96- 웰 플레이트 MEF.
- 오미, 이후이 단계에서 MESC 매체로부터 t를 pluripotin 또는 2I. 다음 날, (물론 100 μL /) SR-포함 MESC 매체에 FBS-에서 매체를 변경합니다.
- 96에서 24 웰 형식 (19)에 설립 MESC 라인을 확장합니다.
- , 200 μL의 PBS로 세포를 세척 트립신 50 μL를 추가하고, 5 % CO에서 37 ° C에서 5 분 동안 배양 계 MESC FBS 배지 100 ㎕를 추가한다.; 10 피펫 팅에 의해 해리 - 멀티 채널 피펫을 사용하여 15 번; 및 세포에 해리 전송 24- 웰, MEF 판을 미토 마이신 C - 처리.
- 다음날 SR 기반의 매체로 변경합니다. 24에서 6 자 형식으로 유사한 방식으로 mESCs를 확장합니다. 합류 6 잘 판 (19)에서 4 freezings - 3을 확인합니다.
- 널 (null) p120ctn에 대한 PCR들과 floxed 대립 유전자는 이전에 설명 된이 경우, p120ctn에서 R26의 궤적 (23)과 선택의 KO 대립 유전자 (대한 PCR 프라이머를 사용하여 RMCE 호환, 동형 접합 KO의 mESCs를 확인아가씨 = "외부 참조"> 12).
- 미토 마이신 C 처리 DR4 MEFs에있는 12 개 웰 플레이트 (재료의 도표 참조) 배반포 분리 하루 전에 준비한다.

표 1. 문화 미디어. 모든 미디어는 4 ℃에서 보관하고 사용하기 전에 37 ° C에서 30 분 가온 하였다.
재조합 복제를 사용하여 RMCE 호환 타겟팅 벡터의 2 세대
- 기반 또는 24 개 클로닝 PCR 기술은 기반 구조는 제한 효소 (RE)를 사용하는 재조합 벡터에 대응 복제 생성한다. cDNA를이 정지 코돈이 포함되어 있는지 확인합니다.
- 디자인 프라이머 (24) AttB는-태그. GGGG 스트레치, AttB1 사이트, 링커, 코작 서열, 및 (그 ATG로 시작하는) 구조의 cDNA의 약 25 뉴클레오티드 : 정방향 프라이머는 다음과 같은 요소가 포함되어 있는지 확인합니다. GGGG 스트레치, AttB2 사이트, 링커, 약 25 NUC : 역방향 프라이머는 유사한 구성이 있는지 확인하십시오구조의 cDNA (역 보완)의 leotides.
- AttB-측면의 cDNA를 얻기 위해 PCR을 통해 구조의 cDNA를 증폭.
- AttB - 측면의 cDNA 100 NG 및 카나마이신 내성 유전자를 포함 재결합 호환 도너 벡터 150 ng를 갖는 10 μL BP 반응을 수행한다.
- 열 충격 유능한 MC1061, 대장균 (대장균) (단계 2.3에 기재된 것과 유사) 박테리아에서 BP 혼합물의 5 μL 변환.
- 정확한 구조 cDNA를 포함하는 벡터를 함유하는 콜로니를 확인한다 (단계에 기재된 것과 유사한 2.4)
- 구조 cDNA를 포함하는 벡터를 이용하여 100 ng의 10 μL LR 반응을 수행한다; Cre 호텔 - 절제 pRMCE-DV1 벡터 11 (8195 LMBP) 150 NG; 과 파지 인코딩 된 인테그라 및 excisionase 및 세균 통합 호스트 요소를 포함 재조합 효소 믹스, 2 μL. 25 ° C에서 2 시간 동안 인큐베이션.
참고 :는 LR 반응은 재조합 반응입니다이온있는 attL 사이트와 ATTR 사이트를 포함하는 대상 벡터를 포함하는 항목의 복제는 LR clonase 효소의 혼합에 의해 재조합된다. 이 관심의 유전자 측면을 노릴 attB 사이트를 포함하는 발현 복제가 발생합니다. - 열 충격 관할 MC1061 대장균에서 LR 혼합물의 5 μL 변환.
- 리브 5 μL LR의 혼합물을 추가 열 충격 유능한 대장균의 40 μL로, 2 ㎖의 스크류 캡 튜브 스커트 얼음에 20 분 동안 배양한다. 37 ° C에서 5 분 동안 인큐베이션.
- 1 mL의 루리아 브로 쓰 (LB) 배지 첨가하고 37 ℃에서 1 시간 동안 배양한다. 암피실린 플레이트에 50 μL AMP (100 ㎍ / ㎖) 한천 플레이트를 함유하고 37 ℃에서 하룻밤 동안 성장한다.
- 정확한 타겟팅 벡터로 식민지를 식별합니다.
- 무작위 P200 팁을 사용하여 5 개 식민지를 선택하십시오. (2) 함유하는 유리 시험관에 팁을 전송 - 5 ㎖의 LB 배지 중, 37 ℃에서 밤새 성장.
- 전의시중에서 판매하는 키트를 사용하여 박테리아 문화 플라스미드 DNA를 기관.
- RE 다이제스트 및 시퀀싱을 사용하여 확인합니다. 10 μL 반응에서 RE 0.2 μL를 사용하여 플라스미드 (20 U / μL) 및 대응 배 완충액 1 μL 2 μg의 - 0.5 컷. 1 % 아가 로스 겔 상에 적어도 하나의 C 37 H 분리 배양한다. DNA 조각의 예측 패턴 식민지에 대한 선택합니다.
- 생거 시퀀싱을 사용 Tlox F (ATC ATG TCT GGA TCC CCA TC) 및 IRES R (GCG GGG GAA TTC GAT ATC AAG) 프라이머 (5 pmol의 / μL)으로 확인 된 벡터 (50 NG / μL)을 분석.
구조의 타겟팅 3. RMCE 매개 MESC는 R26 로커스에 구축
- FBS 기반 MESC 매체에서 MEFs에에 적어도 두 번 RMCE 호환 KO의 mESCs 및 통과 그들의 문화를 시작합니다. 호화 6 웰 플레이트에 mESCs을 분할합니다.
- 다음 날, 1.5, 약 50 %의 포화 상태에서 세포를 새로 고침FBS 기반 MESC 배지 용액과 구조의 cDNA를 포함하는 벡터를 대상으로 Cre 호텔 - 절제 pRMCE-DV1과 mESCs를 형질.
- 하는 DNA 믹스를 확인합니다. 순수 DMEM 매체의 250 μL에 FLPe 발현 플라스미드 (25)의 1 대상 벡터의 μg의 1 μg의 추가.
- 리포 펙 믹스를 확인합니다. 리포 펙션 계 형질 감염 시약 (예를 들면, 1.091) 순 DMEM 배지 250 μL로하고, 실온 (RT)에서 5 분 동안 배양 7 μL를 추가한다.
참고 : 유사 RMCE 대상으로 효율성은 다른 리포 펙 기반 시약 (예를 들면, 리포 펙 타민 LTX 및 Effectene)를 사용하여 얻을 수 있었다. - 리포 펙 믹스와 DNA 혼합물을 혼합하고 실온에서 20 분 동안 배양한다. 리프레시 mESCs 상에 형질 전환 혼합물을 피펫. 부드럽게 소용돌이와 하룻밤 둡니다.
- 하루 형질 감염 후에, 합류 DR4의 MEFs에 층과 10 mL의 FBS 기반 m와 10 cm의 배양 접시로 6 웰 플레이트에서 모든 mESCs 분할ESC 매체.
- 형질 감염 후 2 일째, 배지에 0.2 ㎎ / ㎖ G418 (100X)를 추가하여 올바른 FLPe 매개 된 카세트와 교환 MESC 클론을 선택한다.
참고 : 모든 mESCs을 죽이고 G418의 가장 낮은 농도를 확인하기 G418의 각 배치에 대한 킬 (kill) 곡선을 확인합니다. - G418 함유 MESC 매체 매일 mESCs를 새로 고칩니다. 식민지는 7 뒤에 표시 - 십일, 그래서 선택하고 단계 1.4에 따라 다음을 확장합니다.
- PCR (11)을 통해 올바른 클론을 확인합니다.
배아 이용성 mESCs 4. 분화 (사채)
- FBS 기반 MESC 매체에서 MEFs에에 적어도 두 번 R26 기반 구조 구축 및 통과 그들에게로 KO의 mESCs의 문화를 시작합니다. 한 번 호화 6 웰 플레이트에 통로 mESCs는 MEFs에 제거합니다.
- PBS로 세척하고 거의-합류 MESC의 문화를 Trypsinize. 플레이트는 비 접착 성, 세균성 급 애완 상에 다른 희석 mESCs (1/20 및 1/40)를 해리차별화 매체에서 리 - 요리.
- EBS는 30 일 동안이 요리의 형성을 허용합니다. 50 ML의 튜브에 EB 서스펜션을 전송의 사채가 중력에 의해 정착하자, 상층 액을 제거, 신선한 매체를 추가하고 박테리아 수준으로 다시 EB 서스펜션을 전송 : 다음 절차를 사용하여 3 일 - 매 2 매체를 새로 고침 요리.
- 앞서 설명한 12 된 프로토콜을 사용하여 면역 형광 및 투과형 전자 현미경에 의해 타겟 mESCs 및 EB를 분석.
결과
RMCE 호환 KO MESC 라인을 분리하는 절차는 그림 2에 도시되어있다. 두 연속 breedings는 RMCE 호환 KO의 배반포를 얻기 위해 필요합니다. 첫째, 이형 KO 마우스는 RMCE 호환, 이형 KO 마우스를 얻기 위해 RMCE 호환 마우스와 교차된다. 이러한 마우스는 RMCE 호환 3.5 DPC, 동형 KO의 포배를 얻었다 다른 이형 KO 마우스와 교배 시간 제한 사용된다. 멘델의 유전 법칙에 의해 예측 ?...
토론
우리 MESC 분리 방법은 사용하기 쉬운 및 배반포의 미세 같은 고급 기술이나 장비를 필요로하지 않습니다. 따라서,이 기술은 과학계의 큰 비율에 액세스 할 수 있습니다. 기본 세포 배양 경험을 가진 사람은 ICM의의 outgrowths을 전파하고 mESCs 라인을 설정할 수 있습니다. 그러나 배반포의 세척 및 처리는 연습이 필요합니다. 구강 내에 피펫 포배를 전송하는 데 사용되는 마이크로 피펫, 마이크로 피펫 ...
공개
저자가 공개하는 게 없다.
감사의 말
우리는 우수한 기술 지원을 Jinke D' Hont, 프레 더 리크 반 Rockeghem, 나탈리 Farla, 켈리 레메어 및 Riet 드 RYCKE 감사합니다. 우리는 또한 전문가의 도움에 대한 염증 연구 센터의 Bioimaging 핵심 시설에서 EEF Parthoens, Evelien 반 Hamme, 아만다 Goncalves은 감사합니다. 우리는 가치있는 토론에 대한 우리의 연구 그룹의 구성원을 인정합니다. 이 작품은 벨기에의 과학 정책에 의해 지원되었다 (Belspo Interuniversity 명소 폴란드 - 상 IAP VII-07 DevRepair, https://devrepair.be) 퀸 엘리자베스 의료 재단, 벨기에 (GSKE 2,008에서 2,010 사이에 의해;에 http : // www가 ) - gske.be을 .fmre하고, 겐트 대학, 벨기에 (http://www.ugent.be/en/ghentuniv)의 공동의 연구 작업 (GOA 01G01908)에 의해. SG는 플랑드르 연구 기금 (FWO-V)의 박사후 연구원이다.
자료
| Name | Company | Catalog Number | Comments |
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20 °C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23 G needles | Fine-ject | 8697 | |
| 1-mL syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 mL distilled water, autoclave and store at 4 °C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 mL, 10 mL and 25 mL | |||
| 15-mL and 50-mL conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μL) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37 °C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media | |||
| MEF Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| SR-based mESC medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/mL recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium) | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/mL ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
참고문헌
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유