需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
Ovine Lumbar椎间盘退变模型利用横向腹膜后位钻伤
* 这些作者具有相同的贡献
摘要
椎间盘退变是背部疼痛的重要原因,也是全球残疾的主要原因。存在许多椎间盘退变的动物模型。我们展示了椎间盘退变的羊模型,利用钻头,实现了一致的椎间盘损伤和椎间盘退变的可重复水平。
摘要
椎间盘退变是背部疼痛发展和全球残疾的主要原因的重要因素。已经开发了许多椎间盘退变的动物模型。关于形态学,生物力学性质和无脊髓细胞的缺失,理想的动物模型应该密切地模拟人椎间盘。绵羊腰椎间盘模型符合这些标准。我们通过侧腹膜后方法,利用钻头损伤呈现椎间盘退变的羊模型。横向方法显着减少了与传统的前路方法相关的切口和潜在发病率。使用钻头方法的伤害提供了产生一致和可重复的损伤,精确尺寸的能力,从而引发一致程度的椎间盘退变。环形的焦点性质髓核缺损更密切地模拟了局限性椎间盘突出症的临床状况。羊按照这个程序迅速恢复,通常是在一小时内移动和进食。随后发生椎间盘退变,羊进行尸检和随后的分析。我们认为椎间盘退变的钻头损伤模型比较传统的环形损伤模型具有优势。
引言
下背痛是全世界残疾的主要原因1 。腰椎间盘退变相关性椎间盘突出症被认为是下腰痛的重要原因之一2 。对可靠的椎间盘疾病动物模型的需求不断增加,以扩大对退行性过程的理解和潜在疗法的调查。
存在许多椎间盘退变的动物模型3 。用于调查退行性椎间盘疾病的动物模型的大小范围从小鼠4到较大的哺乳动物如狗5 ,绵羊6和非人灵长类动物7 。用于诱导椎间盘退变的方法可以大致分为机械类( 例如椎间盘缩小术) n 8或手术损伤6 ),化学( 例如化学性核解解5 )或较不常见的自发性变性( 例如沙鼠9 )。
鉴于人椎间盘退变的复杂性,不存在完美的动物模型。然而,在选择合适的动物模型以模拟这种情况的重要考虑已经被确定3 。这样的考虑包括:没有脊索细胞(原始细胞具有可能的祖细胞功能10,不存在于人,绵羊,山羊和软骨营养不良犬中的成年髓核,但存在于大多数哺乳动物中),动物相对于人和椎间盘尺寸相似,可比的生物力学临床条件,机制和伦理考虑3 。
非人类灵长类动物符合上述许多标准,自发性椎间盘退变的狒狒和猕猴模型已被描述为11,12,13 ,两种物种在直立或半直立的姿势中花费大量的时间 - 一个明显的优势然而,道德和实际的考虑( 例如费用,住房,自发性退化的延迟发作)限制在许多机构中的使用。羊脊柱是椎间盘退变的确定模型,其优点包括细胞,生物力学和解剖学相似于人类脊柱10,14,15。尽管绵羊的四足身材,羊腰椎间盘暴露于人类椎间盘的相似应力s ="xref"> 14。羊胎模型从伦理角度也比非人类灵长类动物模型更受广泛接受。已经描述了各种方法来启动退行性过程,其中许多方法需要直接进入椎间盘。由于脊髓在骶骨区域的终止以及后腰纵韧带在卵巢腰椎骨化,椎间盘后路接近技术上具有挑战性,较不常见于羊16 。通过前路或前外侧入路的羊腰椎的传统通路需要大的腹部切口,充满疝风险,损害内脏和神经血管结构16 。使用相对较小的外侧切口远离依赖性腹部区域可能会降低这种风险17 。
我们提出一个羊退行性腰椎间盘疾病使用微创外侧方法进行的钻头损伤,并受到张等的工作的启发。 al 18 。该协议的目的是使可靠的腰椎间盘损伤模型易于重复,产生一致的伤害,并且是安全和良好耐受的。这种方法非常适合于寻求诱导较轻度的腰椎间盘退变的研究者,而不是用传统手术瓣膜切开术(未发表的数据)观察椎间盘退变或再生疗法。这些发现将在即将出版的出版物中进行描述。
研究方案
本手稿中详细列出的方案遵循蒙纳士大学动物伦理学的动物保健指南。该议定书的动物伦理批准已经由蒙纳士大学动物伦理学授予。伦理批准号:MMCA / 2014/55
绵羊准备
注意:使用二至四岁的母羊。
- 快羊在麻醉前18小时。在运动前6-12小时,让动物进入水中。
- 通过静脉注射盐酸米托咪啶(0.015-0.020 mg / kg)镇静动物,以方便转移到手术套件。
注意:盐酸米托咪定用于减少与其他动物分离相关的动物压力和搅动,以转移到手术套件。 - 注射硫代戊酮(10-13 mL / kg),用于在到达手术套件时诱导麻醉。
- 管理预防性内静脉注射抗生素(阿莫西林1 g IV)。
- 使用尺寸7.5-9毫米(内径)气管插管20的插管绵羊。
- 使用吸入式异氟烷(2-3%)在100%氧气中以2L / min的流速维持麻醉。将脉搏血氧计安装在羊的耳朵上。
- 密切监测绵羊的生命体征(心率,呼吸频率和氧饱和度通过脉搏血氧仪和观察)和意识水平。
注意:轻度麻醉如自发咀嚼,主动反流和自发运动的指标应提高麻醉水平。指示紧急减轻麻醉的红旗标志包括呼吸困难和严重的心动过缓。眼睛的旋转不是绵羊深度麻醉的一致指标19 。
椎间盘水平和切口
- 收集s该程序所需的紧急工具:兽医剪刀,20 mL鲁尔锁注射器,21G IV针,#4手术刀手柄,#22手写刀刀片,Gillies组织钳,Metzenbaum弯曲解剖剪刀,Deaver牵开器,Hohmann牵开器刀片,3.5 mm Brad点钻头,钻头停止,钻头,可高压灭菌的兽用钻袋,针架,2-0可吸收合成编织缝线,3-0可吸收合成编织缝线和Mayo缝合剪刀。
- 准备操作套件。用70%乙醇清洁手术台和仪器架。在手术前高压灭菌所有手术器械。进行手术前麻醉检查。
- 将羊放在手术台上的右侧位置。
- 使用电子剪刀,剃刮由下肋骨下部由髂骨上部定义的区域,中间由对侧腰椎横突进行,并且同侧腰椎横突方向约10厘米。
- 掌握髂嵴,腰椎横突(L1-6)和成像脊椎角度为手术切口部位的标志。用无菌笔标记这些地标。
- 用氯己定和碘化碘消毒洗涤剂进行消毒,准备外侧腹部。
- 在整个手术过程中观察标准手术无菌技术。手术组在手术前擦洗。在手术部位放置无菌的开窗方形悬垂物,并在头顶上放置一个大的无菌方巾。
- 在手术前对所有在手术部位使用的物品进行灭菌。在整个手术过程中监测和维持手术部位的无菌性。确保引入无菌领域的所有物品都是无菌的,并以无菌方式转移。
- 使用手术放大镜放大镜和前照灯,以便于手术过程中的可视化。
- 做一个纵切口使用#2手术刀刀片连接到#4手术刀手柄上,平行于前方1厘米至1厘米的腰椎横突,高于和低于感兴趣的椎间盘水平。
注意:关于切口规划的更多信息可以在讨论中找到。 - 使用单极透热疗法分割下面的皮下组织和腹壁肌肉组织的外侧;将切开的方向指向感兴趣的椎间盘上方和下方的腰椎横突的尖端。
- 将胸廓筋膜纵向分割成横向处理。
- 可视化并保存下面的正方形体 ,腰肌和横穿神经血管束。
- 通过使用透热疗法的手术保持止血。
- 在暴露的椎间盘后,将手指扫到腹膜平面和腹后壁肌肉组织之间sc水平进行数字钝性解剖。
- 使用Deaver牵开器将后方肌肉和腰肌肌间退缩,以进一步暴露椎间盘。
- 用于椎间盘突出的凹椎椎体和凸椎间盘。
- 将收缩器立即放在光盘上,并注意确保腰部血管未损坏。
- 使用头灯的手术放大镜放大,识别位于下端板约1厘米尾的腰部血管。
- 执行术中横向X线以确认椎间盘水平。 21
注意:射线照相设置:47kV; 4 mAs 21 - 根据所需的椎间盘水平,通过如下分离周围的结构和附件来暴露椎间盘。
- 对于L3 / 4级及以上级别,请将肌肉附件放在一边sc使用数字钝器解剖。
- 对于L4 / 5及以下级别,使用双极透热和剪刀将较厚的肌腱肌肉附着物锐利地划分在椎间盘上。
注意:由于髂嵴阻塞,L6 / S1椎间盘可能难以进入。如果不能通过侧向方法实现进入,则可以使用前方法。
3.钻头伤害
注意:术前规划包括伤害/治疗水平和控制水平的分配。有关级别分配的更多信息可以在讨论中找到。
- 通过观察椎间盘的左侧和前端来定义钻头入口点。
注意:入口点位于左前外侧象限的中点(由椎间盘前后两侧限定)。在该入口点插入钻头,其轨迹瞄准朝向椎间盘的中心并且稍微颅导向垂直。 - 在钻机上安装一个Brad-point钻头。确保钻头的直径略小于椎间盘高度, 即 60-70 kg绵羊腰椎间盘的约3.5 mm。
- 应用钻头止动器,为60-70公斤羊的腰椎间盘提供大约一半腰椎间盘直径的无保护钻头长度, 即 〜12 mm。
- 将钻头应用到入口点,并将其引导到稍微颅骨到椎间盘中心的轨迹。轻微的颅骨角度是尽量减少终板损伤的风险。
- 将钻头缓慢进入椎间盘,钻头在低功率下1秒钟。如果遇到过多的阻力,请以轻微的颅骨或尾部方式调整轨迹
注意:这样过大的电阻可能表示与端板接触。
关闭
- 一旦达到止血效果,用林格斯溶液冲洗伤口。
- 执行分层闭合,优选使用2-0可吸收的合成编织缝线到侧腹壁组织和连续3-0未染色的可吸收合成编织的皮下缝合到皮肤。
5.术后管理
- 在腹股沟区域放置芬太尼透皮贴片(75μg/ h)进行手术后镇痛3天。
- 另外,如果需要,使用静脉注射丁丙诺啡(0.005-0.01 mg / kg)补充镇痛。
- 停止吸入麻醉。当发生自主呼吸时,取出气管内管。
- 让动物在恒定观察下在保持笼中恢复。
注意:在重新获得足够的食物之前,动物不应无人值守保持胸骨躺卧的能力。 - 一旦动物完全警觉和站立,重新引进食物和水。一旦完全恢复,将动物返回到其他动物持有笔的手术设备。
- 密切观察24小时,继续观察一周。监测手术后疼痛或痛苦的证据。
注意:术后透皮芬太尼补片应用三天应提供足够的止痛。额外的止痛要求应提示动物检查。 - 通常喂羊,允许绵羊不受限制地进行正常的活动。观察羊的任何神经缺陷的证据,如跛足。
注意:由钻头损伤方法产生的椎间盘缺损是椎间盘的前外侧,损伤深度受到钻头中止的钻头限制。由于神经元素位于椎间盘的后部/后外侧,继发于症状性髓核的神经妥协的风险偏远。该模型的这种解剖特征阻止了神经学检查的使用,以区分椎间盘退变与无髓核突出。 - 在实验期结束时,将羊送回大学农场等待安乐死和尸检。
6.安乐死
- 在钻头椎间盘损伤后的适当时间间隔内进行绵羊安乐死。
- 注射戊巴比妥钠(> 100 mg / kg)用于安乐死。
结果
术前,羊进行基线3T磁共振成像(MRI)评估潜在的椎间盘形态和变性。羊进行额外的术中横向X线检查以确认椎间盘水平和计算椎间盘高度指数。来自3T MRI和术中X光片的术前矢状面切片如图1所示 。
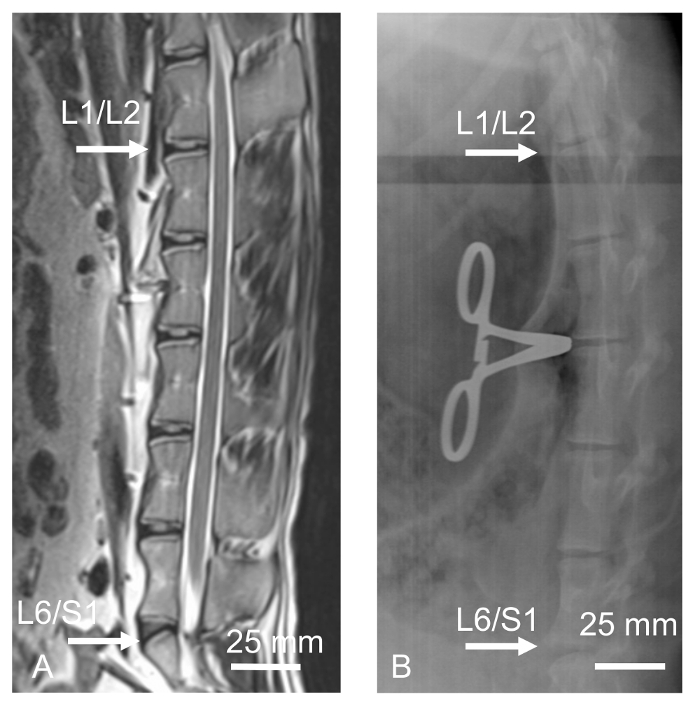
图1:手术前3T MRI( A )和术中横向射线照...
讨论
这种微创侧向通道方法是有效和安全的,没有手术后疝气,腹部伤口开裂或感染在本系列中观察到。使用具有深度停止的钻头椎间盘损伤模型提供了一种可重现的方法,引起已知尺寸( 即本研究中的3.5mm直径×12mm深度损伤)的一致的椎间盘损伤。根据我们的经验,该方法比传统描述的羊手术刀片腰椎间盘切开术模型6,22(未发表的数据)中观察到的椎间盘退变程度低得多。这将在即将出版的...
披露声明
作者宣称他们没有竞争的经济利益来披露。
致谢
Chris Daly博士是"手术基金会Richard Jepson研究奖学金"的获得者。作者要感谢Anne Gibbon博士,Dong Zhang博士和Monash University Monash Animal Services的工作人员对动物手术和护理的协助。
材料
| Name | Company | Catalog Number | Comments |
| Medetomidine Hydrochloride (10 mL Injection) | Therapon/Zoetis | PFIDOM10 | Multiple suppliers: Zoetis/Ilium |
| Thiopentone | Troy | Triothiopentone | Multiple suppliers: Neon Laboratories, Jagsonphal Pharmaceuticals |
| Isoflurane (2 - 3 % in oxygen) | Baxter | AHN3636 | Multiple suppliers: Baxter/VetOne |
| Amoxicillin parenteral | GlaxoSmithKline | JO1CA04 | Multiple suppliers: GlaxoSmithKline/Merck |
| Bupivacaine (0.5% Injection 20 mL) | Pfizer | 005BUP001 | Multiple suppliers: Pfizer/AstraZeneca |
| PVD Iodine Solution | Jurox | 61330 | Multiple suppliers: Jurox/Orion |
| Chlorhexidine 5%w/v | Jurox | Chlorhex C 5L (SCRUB) | Multiple suppliers: Jurox/Pfizer |
| Transdermal Fental Patch (75 μg/h) | Janssen-Cilag | S8-Dur7.5 | Multiple suppliers: Sandoz |
| Buprenorphine iv | Jurox | 504410 | Multiple suppliers: LGM Pharma |
| Atipamezole (Antisedan 0.06 mg/kg - 0.08 mg/kg) | Zoetis | PFIANT10 | Multiple suppliers: Ilium |
| Oster Golden A5 2-Speed Clippers | Oster | 078005-140-003 | Oster |
| 20 mL luer lock syringe | Terumo | 6SS+20L | Multiple suppliers: Medshop Australia/Terumo |
| 21 G IV needle | Terumo | SG3-1225 | Multiple suppliers:Medshop Australia/Terumo |
| #4 scalpel handle | Austvet | AD010/04 | Multiple suppliers: Austvet/SurgicalInstruments |
| #22 scalpel baldes | Austvet | ||
| Gillies tissue forceps | Austvet | AB430/15 | Multiple suppliers: Austvet/SurgicalInstruments |
| Metzenbaum curved dissecting scissors | Austvet | AC101/14 | Multiple suppliers: Austvet/SurgicalInstruments |
| Deaver retractor | Surgical Instruments | 23.75.03 | Multiple suppliers: Surgical Instrument/Austvet |
| Hohmann retractor | Austvet | KA173/35 | Multiple suppliers: Austvet/SurgicalInstruments |
| Mayo suture scissors | Austvet | AC911/14 | Multiple suppliers: Austvet/SurgicalInstruments |
| Needleholder 14 cm | EliteMedical | 18-1030 | Multiple suppliers: EliteMedical/Austvet |
| CMT 3.5 mm Brad-Point Drill | Carbatec | 516-035-51 | Multiple suppliers: Southeast Tool/Carbatec |
| Drill Bit Stop 4 mm | Drill Warehouse | 20121600 | Multiple suppliers: Amazon |
| Bosch 10.8 V Cordless Angle Drill | Get Tools Direct | GWB10.8V-LIBB | Multiple suppliers:Bunnings/Get Tools Direct |
| Autoclavable veterinary drill bag | AustVet | DRA043-AV | AustVet |
| 2-0 absorbable synthetic braided sutures | Ethicon | VCP335H | Ethicon |
| 3-0 absorbable synthetic braided sutures | Ethicon | VCP232H | Ethicon |
| Siemens 3 Tesla Skyra Widebore MRI | Siemens | N/A | Siemens |
| 9.4 Tesla Agilent (Varian) MRI | Agilent Technologies | N/A | Agilent Technologies |
| Atomscope HF 200 A Radiogaph | Radlink | 330003A | Multiple Suppliers: Radlink/DLC Australia |
| Veterinary Pulse Oximiter | DLC | 192500A | Multiple suppliers: DLC Australi Pty Ltd/AustVet |
参考文献
- Hoy, D., March, L., et al. The global burden of low back pain: estimates from the Global Burden of Disease 2010 study. Ann Rheum Dis. 73 (6), 968-974 (2014).
- Luoma, K., Riihimäki, H., Luukkonen, R., Raininko, R., Viikari-Juntura, E., Lammine, A. Low back pain in relation to lumbar disc degeneration. Spine. 25 (4), 487-492 (2000).
- Daly, C., Ghosh, P., Jenkin, G., Oehme, D., Goldschlager, T. A Review of Animal Models of Intervertebral Disc Degeneration: Pathophysiology, Regeneration, and Translation to the Clinic. BioMed Res Int. 2016 (3), 5952165 (2016).
- Sahlman, J., Inkinen, R., et al. Premature vertebral endplate ossification and mild disc degeneration in mice after inactivation of one allele belonging to the Col2a1 gene for Type II collagen. Spine. 26 (23), 2558-2565 (2001).
- Melrose, J., Taylor, T., Ghosh, P., Holbert, C. Intervertebral disc reconstitution after chemonucleolysis with chymopapain is dependent on dosage: An experimental study in beagle dogs. Spine. 21 (1), (1996).
- Oehme, D., Goldschlager, T., Shimon, S., Wu, J. Radiological, Morphological, Histological and Biochemical Changes of Lumbar Discs in an Animal Model of Disc Degeneration Suitable for Evaluating the potential regenerative capacity of novel biological agents. J Tiss Sci Eng. , (2015).
- Platenberg, R. C., Hubbard, G. B., Ehler, W. J., Hixson, C. J. Spontaneous disc degeneration in the baboon model: magnetic resonance imaging and histopathologic correlation. J Med Primatol. 30 (5), 268-272 (2001).
- Iatridis, J. C., Mente, P. L., Stokes, I. A. F., Aronsson, D. D., Alini, M. Compression-Induced Changes in Intervertebral Disc Properties in a Rat Tail Model. Spine. 24 (10), 996 (1999).
- Silberberg, R., Aufdermaur, M., Adler, J. H. Degeneration of the intervertebral disks and spondylosis in aging sand rats. Arch Pathol Lab Med. 103 (5), 231-235 (1979).
- Alini, M., Eisenstein, S. M., et al. Are animal models useful for studying human disc disorders/degeneration. Eur Spine J. 17 (1), 2-19 (2007).
- Lauerman, W. C., Platenberg, R. C., Cain, J. E., Deeney, V. F. Age-related disk degeneration: preliminary report of a naturally occurring baboon model. J Spinal Disord. 5 (2), 170-174 (1992).
- Platenberg, R. C., Hubbard, G. B., Ehler, W. J., Hixson, C. J. Spontaneous disc degeneration in the baboon model: magnetic resonance imaging and histopathologic correlation. J Med Primatol. 30 (5), 268-272 (2001).
- Nuckley, D. J., Kramer, P. A., Del Rosario, ., Fabro, A., Baran, N., S, R. P., Ching, Intervertebral disc degeneration in a naturally occurring primate model: radiographic and biomechanical evidence. J Orthop Res. 26 (9), 1283-1288 (2008).
- Wilke, H. J., Kettler, A., Claes, L. E. Are sheep spines a valid biomechanical model for human spines. Spine. 22 (20), 2365-2374 (1997).
- Sheng, S. -. R., Wang, X. -. Y., Xu, H. -. Z., Zhu, G. -. Q., Zhou, Y. -. F. Anatomy of large animal spines and its comparison to the human spine: a systematic review. Eur Spine J. 19 (1), 46-56 (2010).
- Oehme, D., Goldschlager, T., et al. Lateral surgical approach to lumbar intervertebral discs in an ovine model. Scientific World J. 2012 (8), 873726 (2012).
- Youssef, J. A., McAfee, P. C., et al. Minimally invasive surgery: lateral approach interbody fusion: results and review. Spine. 35 (Suppl 26), S302-S311 (2010).
- Zhang, Y., Drapeau, S., An, H. S., Markova, D., Lenart, B. A., Anderson, D. G. Histological features of the degenerating intervertebral disc in a goat disc-injury model. Spine. 36 (19), 1519-1527 (2011).
- White, K., Taylor, P. Anaesthesia in sheep. In Practice. 22 (3), 126-135 (2000).
- Kandziora, F., Pflugmacher, R., et al. Comparison between sheep and human cervical spines: an anatomic, radiographic, bone mineral density, and biomechanical study. Spine. 26 (9), 1028-1037 (2001).
- Oehme, D., Ghosh, P., et al. Mesenchymal progenitor cells combined with pentosan polysulfate mediating disc regeneration at the time of microdiscectomy: a preliminary study in an ovine model. J Neurosurg Spine. 20 (6), 657-669 (2014).
- Hunter, C. J., Matyas, J. R., Duncan, N. A. Cytomorphology of notochordal and chondrocytic cells from the nucleus pulposus: a species comparison. J Anat. 205 (5), 357-362 (2004).
- Hoogendoorn, R. J., Helder, M. N., Smit, T. H., Wuisman, P. Notochordal cells in mature caprine intervertebral discs. Eur Cells Mater. 10 (Suppl 3), (2005).
- Pohlmeyer, K. . Zur vergleichenden Anatomie von Damtier, Schaf und Ziege: Osteologie und postnatale Osteogenese. , (1985).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), 1873-1878 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。