Method Article
基因土壤分析的纳米 DNA 测序
摘要
生物分子序纳米技术在生命科学中有着广泛的应用, 包括病原体的鉴定、食品安全监测、基因组分析、基因环境监测和细菌的鉴定耐药性。本文应用纳米测序技术对基因土壤 DNA 测序进行了验证。
摘要
本文介绍了从土壤中构建 dna 库的步骤, 纳米流细胞的制备和使用, 以及使用计算机软件识别的 dna 序列的分析。纳米 DNA 测序是一种灵活的技术, 它允许快速的微生物基因组测序来识别细菌和病毒种类, 鉴定细菌菌株, 并检测出抗抗生素的基因突变。纳米测序 (NS) 对生命科学的好处包括其低复杂性, 降低成本, 和快速 real-time 序列纯化基因组 DNA, PCR 增, cDNA 样本, 或 RNA。NS 是一个 "链测序" 的例子, 它包括通过插入到合成聚合物膜中的纳米引导一个单链 dna 分子来测序 dna。该膜有一个电流应用于它, 因此, 由于个别基地通过纳米的电流被扰乱到不同程度的四核苷酸基地。每个核苷酸的识别是通过检测通过纳米的不同碱基对电流的特性调制来进行的。NS 系统由手持式、USB 驱动的便携设备和包含纳米阵列的一次性流单元组成。便携式设备插入到标准笔记本电脑中, 使用计算机软件读取和记录 DNA 序列。
引言
本程序的目的是为了说明准备环境 dna 库的步骤, 用于测序、利用纳米流细胞测序装置, 并利用系统软件对生成的 dna 序列进行分析, 并国家生物技术信息中心 (NCBI) 生物信息学工具, 用于识别土壤中的微生物种类。目前, 大多数 DNA 测序平台都需要对技术培训和复杂仪器进行重大投资, 这在资源贫乏的环境或现场应用中是行不通的。纳米测序 (NS) 平台消除了这些问题的成本效益, 简单易用的图书馆准备协议, 和便携设备序列和分析各种不同类型的核酸1,3。我们已将 NS 平台合并为硕士学位学生的几个实验室课程。
生物分子的纳米技术已经在生命科学中得到了广泛的应用, 包括细菌和病毒病原体的鉴定1,2,6, 环境多样性研究, 食品安全监测, 基因组分析3,5, 以及细菌耐药性的鉴定4。NS 是一种快速和准确的序列核酸的方法, 它是基于 "链测序" 原理的, 当单股 DNA 通过纳米插入带电合成聚合物膜。为 NS 制备 dna 所涉及的步骤包括基因组破碎、末端修复和3个基因组片段的 dA 尾矿、适配器和链式退火到 dna、dna 库纯化以及将库加载到纳米流细胞装置中。基因组分裂为〜 8 kb 大小是通过离心 1-2 µg 的基因组 DNA 通过一个 g 管破碎管完成。碎片基因组的结束, 然后修复和跟踪与保利 dA 使用一个商业可用的套件。单绞适配器序列 (与纳米马达蛋白相容) 被添加到 dna 末端, 用于引导 dna 序列通过纳米 (图 1)。在 dna 纯化和将 dna 分子定位到孔隙膜时, 需要系绳序列。发夹是通过结扎发夹适配器到 dA 尾库的一端来生成的。在 dna 末端的发夹结构允许读取的感觉和反义股的 dna 通过纳米 (图 2)。然后, 利用亲和珠在磁场的作用下, 从反应中纯化出准备好的基因组库, 然后将样品装入纳米流细胞进行分析。
测序的 DNA 被评估为质量和测序读数, 可接受的分析, 然后受到一些生物信息学工具, 以确定微生物。序列被 "翻译" 成 FASTQ 从 FAST5 格式。在 FASTQ 格式中, 序列可以用于爆炸分析。
研究方案
注: 基因 DNA 是从土壤 (马里兰州巴尔的摩县) 使用一个商业可用的土壤基因组隔离套件 (见材料表)。使用紫外分光光度计 (参见材料表), 纯化的基因组 DNA 应具有 260/280 (nm) 比值和 #62; 1.8 和260/230 的比率介于 2.0-2.2 之间, 以确保样品不含污染物。NS 范围从 200 ng 到2µg 所需的基因组 DNA 的数量。
1. 快速库编写方法 (短协议)
注意: 这是一个简短的协议。请参阅快速排序工具包的材料表。
- 在0.2 毫升薄壁管 (见材料表) 添加 200 ng 高分子量 DNA 在最后的7.5 µL 的蒸馏水量。
- 从快速库准备工具包中添加2.5 µL 的碎片混合 (FM), 并通过反转轻轻混合。脉冲离心机向下旋转 (1000 x g 为 5 s)。
- 将样品放在一个 thermocycler (见材料表) 中, 在30° c 下为1分钟, 其次为75° c 为1分钟. 卸下管和脉冲离心机, 旋转样品。
- 添加1µL 的快速适配器和0.2 µL 的钝/TA 连接主混合, 然后存储在冰上的适应和拴库。
注意: 如果使用短协议进行步骤8
2. 结扎测序协议 (长协议): 基因 DNA 碎裂
注: 请参阅结扎测序试剂盒的材料表。
- 在去离子水中稀释1µg 的纯化基因组 DNA, 最终体积为46µL。
- 将样品转移到 DNA 碎片管 (见材料表), 在室温下离心1分钟, 使用离心 (参见材料表), 生成 8 kb 的基因组片段。确保所有的液体都通过了收集管。
- 倒置破碎管, 返回离心机, 离心1分钟, 收集碎片基因组 DNA 到下腔。
- 将分散的基因组 dna 转移到无菌的低 DNA 结合1.5 毫升管, 并分析低百分比琼脂糖凝胶 (0.6%) 中的部分, 以确认碎片和 #62; 30 kb。
3. 支离破碎的基因组 DNA 末端制备
- 使用 800 ng 的片段基因组 DNA 在45µL 的去离子水中, 添加7µL 末端准备反应缓冲器 (见材料表), 3 µL 酶混合 (见材料表), 以及5µL 核酸游离水。
- 混合用倒置和脉冲离心机 (1000 x g 为 5 s)。
- 将样品转移到0.2 毫升的薄壁管上, 在20° c 下孵育5分钟, 然后在65° c 下孵育5分钟。
- 脉冲离心机, 使内容到底部的管。
- 转移样品到1.5 毫升低 DNA 结合离心管。
- 准备磁珠 (请参阅材料表)。添加60µL 悬浮珠到年底准备反应从步骤3.5 和混合移。
- 在 100 rpm 的旋转搅拌机上孵育 (参见材料表), 室温下为5分钟。
- 脉冲离心的样品颗粒的珠子, 然后把样品旁边的磁铁。
- 一旦珠子粘在磁铁上, 吸管关闭上清和丢弃。
- 从磁铁中取出管和洗涤珠与200µL 新鲜准备的70% 乙醇通过轻轻移样品 up-and-down。
- 脉冲离心机颗粒的珠子和返回到磁铁。
- 除去上清和丢弃。重复洗涤步骤使用200µL 70% 乙醇。
- 脉冲离心管, 回到磁铁, 并删除所有的70% 乙醇洗涤。
- 离心管盖打开, 允许珠子在室温下风干5分钟。
- 从磁铁中取出试管, 在31µL 的无菌、无核酸的水中悬浮颗粒。室温孵育2分钟。
- 回到磁铁, 直到所有的珠子有丸和洗是明确的。
- 将洗转至1.5 毫升离心管。使用1µL 的样品, 用紫外分光光度计在260纳米 (参见材料表) 对最终准备的 DNA 进行量化。
注: 回收率应为 70% (700 ng), 起始浓度为1µg 的基因组 DNA。
4. 在末端准备的基因组 DNA 片段中添加适配器和绳索
- 混合所有的钝/TA 连接主混管倒置, 然后脉冲离心机, 使内容到底部。
- 使用30µL 的最终准备 DNA, 增加20µL 的适配器混合, 和50µL 的钝/TA 结扎主混合。
- 用倒置、脉冲离心机混合, 室温下孵育10分钟。
5. 磁B预备
- 漩涡的珠子, 然后转移50µL 的悬浮珠, 以1.5 毫升离心管。
- 把管子放在磁铁上, 使珠子颗粒, 直到洗清除。
- 除去上清和丢弃。
- 添加100µL 的珠装订缓冲器 (参见材料表的珠子包) 到珠, 漩涡重珠子, 颗粒上的磁铁上, 清除上清和丢弃的珠子。用100µL 的装订缓冲器重复洗涤。
- 加入100µL 珠结合缓冲器的洗涤珠。漩涡重珠。
6. 图书馆净化
- 使用 P200 微, 添加40µL 的珠子从上一步, 以适应/拴系基因组 DNA。移仔细地混合样品。
- 在室温下, 在 100 rpm 的旋转搅拌机上孵育样品5分钟。
- 将样品放在磁铁上, 让珠子沉淀。吸管关闭上清和丢弃。
- 重在140µL 珠装订缓冲器的移。将样品放在磁铁上, 丢弃上清, 再用另外140µL 的珠装订缓冲器清洗。
- 脉冲离心管, 放置在磁铁上的管2分钟. 从颗粒中取出剩余的珠装订缓冲器。
7. 磁珠库的洗脱
- 重的磁珠在15µL 的洗脱缓冲移。在室温下孵育样品10分钟。
- 把管子放在磁铁上, 使珠子颗粒。
注: 回收率应为 25% (250 ng), 起始浓度为1µg 的基因组 DNA。
8. 开始运行/质量控制
- 从包装中移除流单元, 并将流单元附加到便携的 real-time 排序器 (请参见材料表)。
- 通过 USB 电缆将排序器连接到计算机, 然后启动顺序软件 (请参见材料表)。
- 单击 "连接" 设备通过测序软件, 选择 "NC_Platform_QC", 然后点击 "开始"。
- 质量控制 (QC) 大约需要 6-7 分钟完成;在 QC 读数上寻找一个 "绿色的海洋" (大面积的输出), 以确认有足够的活性孔隙 (和 #62; 800) 用于 DNA 测序。
9. 开始测序运行
- 打开测序程序;将出现一个对话框。在 "示例 ID" 框中, 命名示例。
- 单击 "流单元 ID" 框, 然后输入在流单元顶部的标签上找到的代码。
- 打开流单元盖, 然后将示例端口盖向右滑动 (顺时针方向), 以使示例端口可见。一旦端口打开, 检查一个小气泡。去掉一些升的缓冲, 包括气泡。
- 检查以确保传感器阵列上有缓冲区。通过混合480µL 的运行缓冲器与燃料混合 (RBF-1, 请参阅材料表) (一定要彻底混合第一) 与520µL 核酸无水。
- 将启动缓冲器的800µL 添加到启动端口。小心地提起 "SpotOn" 的盖子, 使其便于使用。
- 5分钟后, 在启动端口上增加200µL 的启动缓冲器。
10. 加载库
- 在准备图书馆之前在冰上放置以下试剂: RBF-1 (从测序试剂盒), 适应和栓的图书馆和图书馆装货珠子 (法学学士; 从测序试剂盒)。
- 对0.2 毫升离心管, 增加25.5 µL 的 RBF 和12µL 的核酸在室温保存的水。
- 混合移 up-and-down。增加26.5 µL 的法学学士到0.2 µL 管。用移 up-and-down 混合试剂。
注: 酒法学倾向于解决的混合物。 - 添加11µL 的适应和拴库的0.2 µL 管。通过脉冲离心的反演和旋转来混合。
- 将步骤9.4 中的75µL 样本添加到 "SpotOn" 端口滴。在添加下一项之前, 请确保每个拖放都流入端口。
- 仔细更换样品口盖, 使塞子进入端口, 并更换设备盖。
11. 启动测序软件协议脚本
- 在 "选择程序" 下打开下拉菜单, 然后选择 "48 小时测序"。
- 单击 "执行" 按钮以启动脚本。
- 检查在通知流中报告的Mux 扫描的结果, 以查找Mux 扫描中的活动孔隙数。
注: 此数字可能与 QC 运行中的孔隙数不同, 而较大的差异可能表明存在问题。- 如果有显着减少活性毛孔从 QC 运行, 重新启动软件, 如果仍然有明显的差异, 重新启动计算机。
- 检查散热器的温度是否34° c, 按顺序软件脚本报告。
注意: 如果温度不在34° c, 那么就不会有足够的活性孔隙来运行。 - 检查读取长度的直方图, 以确定是否期望序列长度, 并适合于实验设计。
- 使用 "关闭 x" 关闭桌面代理通过关闭 web GUI 退出顺序软件。断开设备与计算机的连接。
12. 运行分析和结果
注意: 在排序运行期间, 可以使用 "查看报告" 程序使用桌面代理来监视数据。在运行完成期间或之后, 文件以 FAST5 文件格式在数据→读→通行证文件夹 (缺省) 是可利用的。如果此文件夹在排序时处于打开状态, 则计算机可能会冻结。
- 要查看和操作序列, 请下载 "HDFViewer"。
- 查看顺序文件, 直接打开高密度纤维板查看器→打开数据文件夹→选择所有文件类型→选择 C: 驱动器 (默认) →选择数据→选择读取→选择 pass。
- 在左下拉菜单中查找并选择 FASTQ 文件;文件将打开, 可以以 FASTQ 格式保存。
注: 为了学生实验的目的, 选择了350核苷酸或更长的序列进行进一步分析。基调用的输出允许用户根据大小对序列读取进行排序。FASTQ 文件可以通过爆炸 (NCBI) 或其他生物信息学程序进行分析。
结果
实验设计和纳米技术为学生序列土壤 DNA 提供了一种快速、廉价的方法。该代表运行的质量控制参数超过800孔可供测序。奔跑导致超过12.5万读可利用为研究以中间序列长度 5.38 kb。序列得到一个质量分数, 只有那些序列与可接受的分数然后分析。由于测序反应的输出是 FAST5 格式, 这是不接受的程序, 如爆炸 (NCBI), 序列被视为在高密度纤维板查看器, 将序列转换为 FASTQ 格式, 这是兼容的爆炸分析。在软件的未来迭代中, 数据将作为 FASTQ 格式提供, 从而消除了对高密度纤维板查看器的需求。请参见补充图1、2和 3.
五十个长度超过350核苷酸的序列受 BLASTN (核苷酸对核苷酸数据库) 或 BLASTX (核苷酸翻译成氨基酸序列) (NCBI) 的分析, 以确定土壤样本中的有机体。考虑到班级的时间限制, 课程的重点是实验室方法, 而不是生物信息学, 我们让学生在这些参数中分析序列。我们的生物信息学类可以使用数据来开发管线分析工具。这一层次的生物信息学分析不包括在实验室的类。表 1是以小于 4 e-04 的 e 值标识的有机体的列表。通常, e-values 小于 4 e-04 表示输入序列 (查询) 和匹配序列之间有很强的相似性。由 BLASTN (针对非冗余 (nr) 数据库) 识别的生物体来自种类繁多, 可用于进一步的基因组和蛋白质分析。这个来自巴尔的摩郡一个花园的土壤样本从未经过测试, 因此没有以前的数据来确定土壤中的生物是什么。BLASTN 分析 (对 nr 数据库) 的分析还表明, 在 nr 数据库中没有相似的序列。为了确定这些是否是真正新颖的序列, 需要进一步研究。BLASTX 分析了几个序列, 揭示了 BLASTN 分析中不代表的生物体中的几种蛋白质。表 2列出了几种可能的蛋白质, 包括肽和 atp 样蛋白。使用这个序列库, 学生有机会使用更复杂的生物信息学工具来进行进一步的分析, 如果由导师指导。
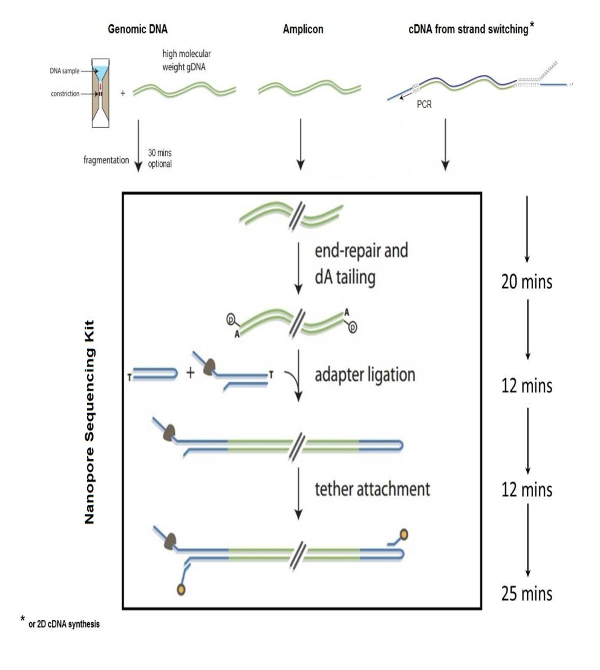
图 1: 基因组库准备.利用纳米技术制备基因组 DNA 库的步骤。此图已通过必要的权限进行了修改。请单击此处查看此图的较大版本.

图 2.使用纳米的 DNA 测序示意图.通过纳米膜的 DNA 通过电信号产生和基本识别。此图已通过必要的权限进行了修改。请单击此处查看此图的较大版本.
| 有机体 | e 值 |
| 链霉菌 sp。 | 3.00E-06 |
| Nocardoides sp。 | 5.00E-04 |
| 大头 sp。 | 5.00E-04 |
| Hyphomicrobium nitrativorens | 1.00E-139 |
| Starkeya 中篇小说 | 1.00E-31 |
| Hyphomicrobium 杆菌 | 1.00E-30 |
| Fibomicrobium sp。 | 5.00E-17 |
| 假单胞菌。 | 2.00E-15 |
| Rhodothemus marinus | 1.00E-17 |
| Turneiella 草 | 2.00E-24 |
| 大肠杆菌 | 0.00E+00 |
| 根瘤菌 sp。 | 3.00E-30 |
| Gemmatirosa kalamazoonesis | 1.00E-20 |
| 霍尔德 sp。 | 8.00E-10 |
| Sphingomonas sp。 | 8.00E-10 |
| Cellumonas sp | 6.00E-11 |
表 1: BLASTN 分析的选定结果.土壤基因 DNA 序列受 BLASTN 相似性搜索对 NCBI 非冗余核苷酸数据库。报告的数据有 e-values 4 x e-4 或更少。
| 蛋白 | 有机体 |
| 假想蛋白质 | Acidobacter 菌 |
| SAM 依赖甲基 | 杆菌 |
| 酶 | Jannaschia sp |
| 肽 | 志贺宋内 |
| 裂解蛋白 | 大肠杆菌 |
表 2: BLASTX 分析的选定结果.对 NCBI 非冗余蛋白质数据库进行 BLASTX 相似性搜索的土壤基因 DNA 序列。
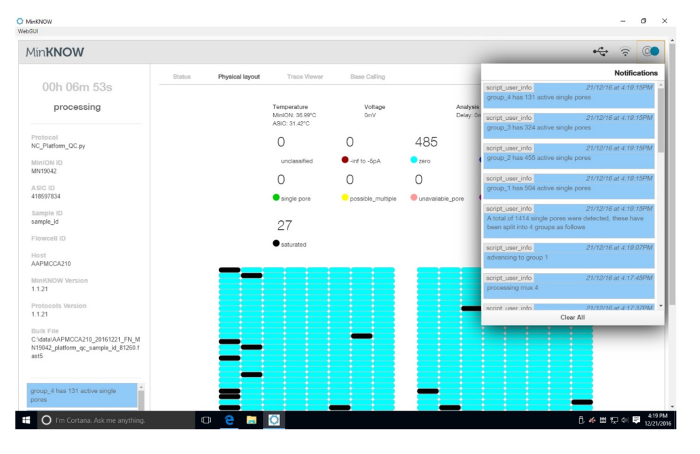
补充图 1: 平台 QC 结果.给出了平台 QC 的结果。右上角是主动毛孔的 QC 结果。对流动细胞的每个象限进行活性孔隙测试。主页面是动态的, 并随着每个象限的测试而变化。在此运行中, 检测到1414单孔。请点击这里查看更大版本的这个数字。
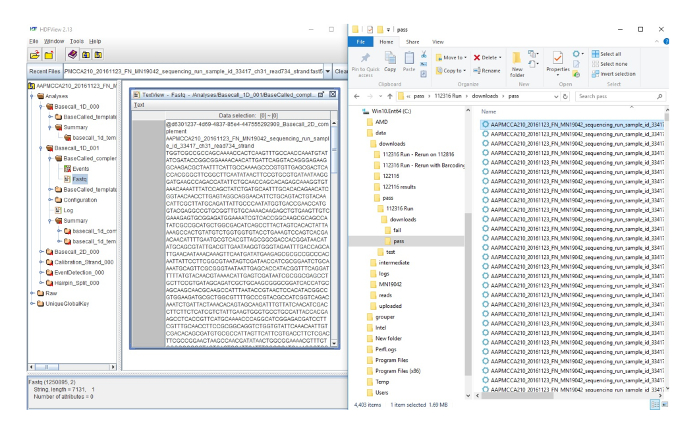
补充图 2: 将 FAST5 文件转换为 FASTQ 文件.在右侧, 是序列化运行中数据的输出。每行代表一个单独的序列。图的左侧显示了右侧的突出显示序列, 在高密度纤维板查看器中, 将序列转换为可用于进一步分析的 FASTQ 文件。请单击此处查看此图的较大版本.
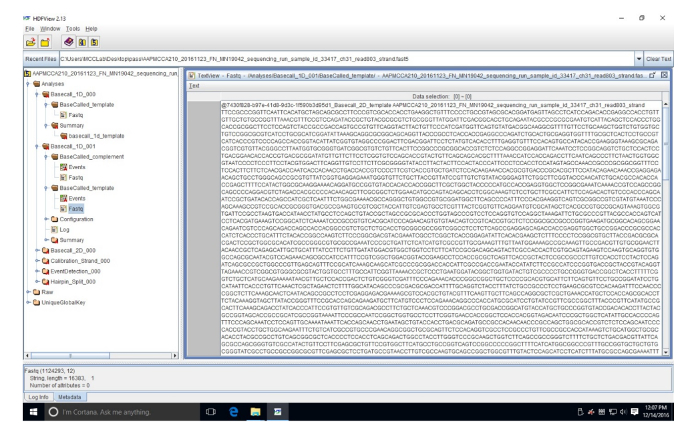
补充图 3: 高密度纤维板查看器中 FASTQ 序列的示例.此序列 (read 803) 位于 FASTQ 文件中, 它将 FAST5 数据转换为核苷酸。请单击此处查看此图的较大版本.
讨论
许多下一代测序方法已经生成, 每种方式都取决于合成的顺序, 但识别核苷酸的检测平台不同。NS 是市场上最近添加的, 它完全使用不同的方法, 不需要测序反应或标记核苷酸。这种方法利用了已合并的核苷酸的电荷微分, 因为它们通过一个带电的孔隙。每个核苷酸的识别发生在通过纳米的不同碱基的电流调制。这个多路复用系统允许用户一次序列许多片断。通过对 DNA 的两股进行测序, 序列的精确度大大提高, 而测序软件可以加载到笔记本电脑上, 处理信号并提供可分析的序列信息。
在序中, 通过合成 (SBS) 方法测序, 检测到模板中的特定碱基取决于荧光测定和化学发光信号的生成8。在离子半导体测序中, 释放的氢离子, 降低 pH 值的离子传感器检测到9。单分子 real-time 测序取决于零模式波导 (ZMW)10, 它照亮了检测一个荧光灯分子标记为合并核苷酸。SBS 使用一种独特的方法来放大目标 DNA, 这样就生成了13的唯一序列的簇。当被标记的核苷酸的荧光记录时, 就能检测到添加的核苷酸。另一方面, NS 在其他方法上具有独特的优势, 因为它需要有限的技术资源, 是便携式的, 产生长的测序读数, 不需要事先的 DNA 放大, 并且可以以降低的成本与其他方法进行操作。我们的学生发现新的, 快速的图书馆准备协议是直截了当的, 并服从于一个三小时的实验室课程。我们遇到的一些问题是流动单元中的气泡难以去除, 它需要大量的计算机电源 (一 tb 的存储), 当前的数据输出在一个 FAST5 的文件中, 而顺序流单元在它之前的货架寿命是有限的。恶化.此外, NS 结扎测序协议 (long 协议) 的其他缺点是, 它需要几个库的准备步骤, 需要分子生物学技术的专业知识, 并产生减少的排序保真度相比排序方法3。然而, 新的快速图书馆准备试剂盒的最新进展只需要10分钟的图书馆准备, 并显示了减少的测序错误率。新的图书馆准备方法非常适合在实验室课堂上使用。
在该协议中有几个关键步骤, 特别是在流电池的 QC。这包括在五天内执行初始 QC 在流动细胞的收据和使用他们在8星期之内。虽然我们使用的流动细胞超过8周, 开放/主动毛孔的数量大大减少。重要的是, 实验计划, 以适应一个时间线, 最大限度地利用流动细胞实现。我们已经使用了清洗协议和重复使用的流动细胞与成功。
对土壤基因的研究是一种未开发的微生物多样性遗传库。例如, 一克土壤估计包含 107 -109原核细胞14。此外, 土壤有机体是新的天然产物、酶和抗生素的主要来源。因此, 土壤基因 DNA 序列分析是一个宝贵的教学工具, 为学生在各级教育。NS 技术的易用性和低成本使该系统成为一种非常有效的教学工具。学生可以序列化环境样本, 并在完成序列使用可用的生物信息学工具来识别和表征微生物和基因序列的测试样本。使用 NS 技术, 学生有真正的亲身体验, 直到现在, 因为在其他测序平台上有先进的技术专长和高试剂、设备和维护成本, 在实验室课程中的使用已经遥不可及。最近, 我们的一个学生 (j. 哈里森, 个人通信) 报告了这项技术在农田土壤环境监测项目中的应用。我们期望这项技术在教育领域将有更多的应用。
披露声明
作者没有披露。
致谢
该项目是由约翰霍普金斯大学, 教务长办公室通过网关科学倡议部分支持。
材料
| Name | Company | Catalog Number | Comments |
| Thermal Cycler | LifeECO | BTC42096 | |
| Covaris g-TUBE | Covaris | 520079 | |
| NEBNext End Repair Module | New England BioLab | E7546 | |
| Eppendorf LoBind Centrifuge Tubes | Sigma-Aldrich | Z666505 | |
| NEB Blunt/TA Ligase Master Mix | New England BioLab | MO367 | |
| MyOne C1 Strepavidin Beads | Thermo Fisher | 65001 | |
| Eppendorf microcentrifuge | Eppendorf | Model 5420 | |
| Nanodrop UV spectrophotometer | Thermo Fisher | ND-2000 | Model 2000 |
| Belly Dancer Orbital Shaker | Sigma-Aldrich | Z768499 | |
| Power Soil DNA Isolation Kit | MO BIO | 12888-50 | |
| Ligation Sequencing Kit 2D | Oxford Nanopore | SQK-LSK208 | |
| Rapid Sequencing Kit for Genomic DNA | Oxford Nanopore | SQK-RAD002 | |
| End-Prep Reaction Buffer and enzyme mix (NEB Blunt/TA Ligase Naster Mix) | New England BioLab | MO367 | |
| AmPure XP Magnetic Beads | Beckman Coulter | A63880 | |
| Basic Starter Pack | Oxford Nanopore | Includes MinION Sequencing Device and Flow Cell | |
| MinKNOW software | Oxford Nanopore | ||
| Rapid Sequencing Kit for Genomic DNA | Oxford Nanopore | SQK-RAD002 | Includes Running Buffer with Fuel (RBF), Fragmentation Mix (FRM) Rapid Adapter (RAD) Library Lodaing Beads (LLB) |
参考文献
- Quick, J., et al. Real-time, portable genome sequencing for Ebola surveillance. Nature. 530 (7589), 228-232 (2016).
- Greninger, A. L., et al. Rapid metagenomics identification of viral pathogens in clinical samples by real-time nanopore sequencing analysis. Genome Med. 7, 99(2015).
- Quick, J., et al. Rapid draft sequencing and real-time nanopore sequencing in a hospital outbreak of Salmonella. Genome Biology. 16, 114(2015).
- Ashton, P. M., et al. MinION nanopore sequencing identifies the position and structure of a bacterial antibiotic resistance island. Nat Biotechnol. 33, 296-300 (2015).
- Loman, N. J., Quick, J., Simpson, J. T. A complete bacterial genome assembled de novo. using only nanopore sequencing data. Nat Method. 12, 733-735 (2015).
- Hoenen, T., et al. Nanopore Sequencing as a Rapidly Deployable Outbreak Tool. Emerg Infect Dis. 22 (2), 331-334 (2016).
- Petrosino, J. F., Highlander, S., Luna, R. A., Gibbs, R. A., Versalovic, J. Metagenomic pyrosequencing and microbial identification. Clin Chem. 55 (5), 856-866 (2009).
- Cummings, P. J., Ahmed, R., Durocher, J. A., Jessen, A., Vardi, T., Obom, K. M. Pyrosequencing for Microbial Identification and Characterization. J. Vis. Exp. (78), e50405(2013).
- Rothberg, J. W., et al. An integrated semi-conductor device that enabling non-optical genome sequencing. Nature. 475, 348-352 (2011).
- Levene, M. J., Korlach, J., Turner, S. W., Foquet, M., Craighead, H. G., Webb, W. W. Zero-mode Waveguides for Single-Molecule Analysis at high concentrations. Science. 299, 682-686 (2003).
- Eid, J., et al. Real-Time DNA Sequencing from Single Polymerase Molecules. Science. 323, 133-138 (2009).
- Stoddart, D., Heron, A. J., Mikhailova, E., Maglia, G., Bayley, H. Single-nucleotide discrimination in immobilized DNA oligonucleotides with a biological nanopore. PNAS. 106, 7702-7707 (2009).
- Shendure, J., Hanlee, J. Next generation DNA sequencing. Nat Biotechnol. 26, 1135-1145 (2008).
- Daniel, R. The Metagenomics of Soil. Nat Rev Microbiol. 3, 470-478 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。