Method Article
Metagenomic 토양 분석 Nanopore DNA 시퀀싱
요약
Nanopore 시퀀싱 생체에 대 한 기술, 생명 과학, 병원 균, 식품 안전 모니터링, 게놈 분석, metagenomic 환경 모니터링 및 박테리아의 특성의 식별을 포함 하 여 넓은 응용 프로그램에 항 생 저항입니다. 이 문서에서는, metagenomic 토양 DNA 연속 nanopore 시퀀싱 기술을 사용 하 여 종 식별을 위한 절차는 보여 줍니다.
초록
이 문서는 토양, 준비, nanopore 흐름 셀의 사용 및 컴퓨터 소프트웨어를 사용 하 여 식별 DNA 시퀀스의 분석에서 DNA 도서관의 건설을 위한 단계를 설명 합니다. 연속 Nanopore DNA 세균성 긴장 하 고 부여 하는 항생제에 저항 하는 유전자 돌연변이 검출 하 박테리아와 바이러스 종 식별 빠른 미생물 게놈 시퀀싱을 허용 하는 유연한 기술입니다. Nanopore (NS) 생명 과학에 대 한 시퀀싱의 장점은 낮은 복잡성, 비용 절감된, 그리고 순화 된 genomic DNA, PCR amplicons, cDNA 샘플, 또는 RNA의 빠른 실시간 시퀀싱을 포함 합니다. NS "가닥 시퀀싱" 합성 중합체 막에 삽입 되는 nanopore 통해 단일 좌초 된 DNA 분자를 유도 하 여 시퀀싱 DNA를 포함의 예입니다. 막 전류는 nanopore 전기 전류 통과 개별 기초는 4 개의 뉴클레오티드 기초에 의해 다양 한 각도에 중단 됩니다 그래서 그것에 적용 하고있다. 각 뉴클레오티드의 id는 nanopore를 통과 다른 기지에 의해 전기 전류의 특성 변조를 감지 하 여 발생 합니다. 휴대용의 NS 시스템 구성, USB 전원 휴대용 장치와 nanopore 배열을 포함 하는 일회용 흐름 셀. 휴대용 장치를 컴퓨터 소프트웨어를 사용 하 여 DNA 시퀀스를 기록 표준 노트북 컴퓨터에 연결 합니다.
서문
이 절차의 목표는 시퀀싱, nanopore 흐름 셀 시퀀싱 장치 활용 환경 DNA 라이브러리의 준비에 필요한 단계를 설명 하 고 시스템 소프트웨어를 사용 하 여 생성 된 DNA 시퀀스의 분석을 수행 하 고 토양에서 미생물 종 식별 하 생명 공학 정보 (NCBI) 생물 정보학 도구에 대 한 국립 센터. 현재, 대부분 DNA 시퀀싱 플랫폼 기술 교육 및 리소스 가난한 환경에서 또는 필드 응용 프로그램에서 가능 하지 않습니다 복잡 한 계측에 대 한 투자가 필요 합니다. 비용 효과 함께 이러한 문제를 제거 하는 nanopore 시퀀싱 (NS) 플랫폼 라이브러리 준비 프로토콜, 및 휴대용 장치를 사용 하 여 시퀀싱 핵 산1,3의 종류의 다양 한 분석을 하는 간단한. 우리 학생 들이 석사 학위에 대 한 여러 실험실 클래스에 NS 플랫폼을 통합 되었습니다.
Nanopore 시퀀싱 생체 기술 생명 과학, 세균성과 바이러스 성 병원 체1,2,6, 환경 생물의 다양성의 id를 포함 하 여 다양 한 응용 프로그램을 시연 하고있다 연구, 식품 안전 모니터링, 게놈 분석3,5, 그리고 세균성 항 생 저항4의 특성. NS는 신속 하 고 정확한 시퀀스 핵 산 기반의 원리 "물가 시퀀싱" 전기 장애를 감지 하 여 개별 뉴클레오티드 기초 때 단일 좌초 된 DNA는 전기에 삽입 nanopore 통해 전달 합성 폴리머 막입니다. NS 포함 게놈 조각화, 최종 수리 및 3' 다-미행 게놈 조각, 어댑터 및 밧줄, DNA에 어 닐 링 DNA 준비 단계 DNA 도서관 정화, 고 nanopore 흐름 휴대 장치에는 라이브러리를 로드. ~ 8 kb 크기에 게놈의 단편화는 g-튜브 조각화 튜브를 통해 게놈 DNA의 1-2 µ g centrifuging 여 수행 됩니다. 조각난된 게놈 끝 다음 복구 하 고 상용 키트를 사용 하 여 폴 리 다와 꼬리. 단일 좌초 어댑터 시퀀스, nanopore 모터 단백질와 호환 되는 추가 됩니다 (그림 1) nanopore 통해 DNA 시퀀스를 안내 하는 데 사용 되는 DNA 끝에. 밧줄 시퀀스는 DNA 정화 및 기 공 막에 DNA 분자를 지역화에 대 한 필요 합니다. 머리 핀 머리 핀 어댑터 다 꼬리 라이브러리의 한쪽 끝에 ligating에 의해 생성 됩니다. DNA 끝에 머리 핀 구조와 antisense 가닥의 읽기를 DNA nanopore (그림 2)을 통해 전달 가능 준비 된 게놈 라이브러리는 다음 streptavidin 구슬 nanopore 흐름 셀 분석용으로 샘플을 로드 하 여 다음 자기장을 사용 하 여를 사용 하 여 반응에서 정화 됩니다.
시퀀스 된 DNA 품질에 대 한 평가 하 고 분석에 대 한 허용 되는 연속 읽기 다음 미생물을 식별 하는 여러 생물 정보학 도구를 받게 됩니다. 시퀀스는 ""로 번역 FAST5 형식에서 FASTQ. FASTQ 형식에서 시퀀스 다음 폭발 분석에 사용할 수 있습니다.
프로토콜
참고: Metagenomic DNA는 토양 (볼티모어 카운티, 메릴랜드) 상용 토양 게놈 격리를 사용 하 여에서 정화 키트 ( 재료의 표참조). UV 분 광 광도 계를 사용 하 여 ( 재료의 표참조), 순화 된 게놈 DNA 260/280 (nm) 비율 있어야 > 1.8과 2.0-2.2 갖춰야 합니다 샘플 사이의 260/230 비율은 오염 물질의 무료. 200에서 NS 범위에 필요한 게놈 DNA의 양을 ng 2 µ g.
1. 빠른 라이브러리 준비 방법 (짧은 프로토콜)
참고: 이것은 짧은 프로토콜입니다. 급속 한 시퀀싱 키트 재료의 표를 참조 하십시오.
- 얇은 벽 튜브 0.2 mL에서 200를 추가 ( 재료의 표참조) 7.5 µ L의 증류수의 볼륨의 마지막에서 높은 분자량 DNA의 ng.
- 빠른 라이브러리 준비 키트 및 혼합에서 조각화 믹스 (FM)의 2.5 µ L 추가 부드럽게 반전으로. 스핀 다운을 펄스 원심 분리기 (1000 x g 5 s).
- thermocycler에 샘플을 배치 ( 재료의 표참조) 1 분 1 분에 75 ° c에 30 ° C에서 한 라운드에 대 한 샘플 아래로 회전 튜브 및 펄스 원심 분리기를 제거.
- 급속 한 어댑터의 1 µ L와 블런트/TA 리가 마스터, 믹스의 0.2 µ L을 추가 하 고 얼음에 적응 하 고 테더 라이브러리를 저장.
참고: 짧은 프로토콜을 사용 하 여 8 단계로 진행 하는 경우
2. 결 찰 시퀀싱 프로토콜 (긴): Metagenomic DNA 파편
주: 결 찰 시퀀싱 키트에 대 한 테이블의 자료 를 참조 하십시오.
- 이온된 수에 46 µ L의 최종 볼륨을 순화 된 게놈 DNA의 1 µ g을 희석.
- DNA 파편을 샘플 튜브 ( 재료의 표참조) 하 고는 microcentrifuge를 사용 하 여 8000 x g에서 실내 온도에 1 분 동안 원심 전송 ( 재료의 표참조) ~ 8 kb 게놈 조각을 생산 하. 모든 액체 수집 관으로 통과 했다 다는 것을 확인 하십시오.
- 조각화 튜브, 원심 분리기, 원심 분리기 1 분 낮은 챔버로 조각난된 게놈 DNA를 수집 하는 반환을 반전.
- 메 마른 저 DNA 바인딩 1.5 mL 튜브에 조각난된 게놈 DNA를 전송 하 고 조각화를 확인 하는 낮은 비율 agarose 젤 (0.6%)에 대 한 부분을 분석 > 30 kb.
3. 조각 Genomic DNA 끝-준비
- 800를 사용 하 여 이온된 수의 45 µ L에서 조각난된 genomic DNA의 ng 추가 7 µ L 최종 준비 반응 버퍼 ( 재료의 표참조), 3 µ L 효소 혼합 ( 재료의 표참조), 그리고 5 µ L nuclease의 무료 물.
- 반전 및 펄스 원심 분리기에 의해 혼합 (1000 x g 5 s).
- 0.2 mL 얇은 벽 튜브에 샘플을 전송 하 고 5 분 동안 65 ° C에 외피 다음 20 ° C에서 5 분에 대 한 샘플을 품 어.
- 튜브의 하단에 내용을가지고 펄스 원심 분리기.
- 1.5 mL 낮은 DNA 바인딩 microcentrifuge 튜브에 샘플을 전송.
- 마그네틱 구슬 ( 재료의 표참조)를 준비 합니다. Pipetting으로 단계 3.5 및 혼합에서 최종 준비 반응에 resuspended 구슬의 60 µ L 추가 합니다.
- 실 온에서 5 분 동안 100 rpm ( 재료의 표참조)에서 회전 믹서에 품 어.
- 펄스 원심 구슬, 작은 다음 자석 옆 샘플을 샘플.
- 일단 구슬 자석에 준수, 상쾌한과 폐기 플라스틱.
- 부드럽게 위아래 샘플 pipetting으로 갓된 70% 에탄올의 200 µ L로 자석 및 세척 구슬에서 튜브를 제거 합니다.
- 펄스를 작은 구슬 자석에 원심 분리기.
- 상쾌한을 제거 하 고 삭제. 70% 에탄올의 200 µ L를 사용 하 여 다시 세척 단계를 반복 합니다.
- 펄스 원심 튜브, 자석에 반환 하 고 모든 70% 에탄올 세척을 제거 합니다.
- Microcentrifuge 관 뚜껑 열고, 실 온에서 5 분 동안 건조 공기를 구슬을 허용.
- 자석에서 튜브를 제거 하 고 살 균, nuclease 무료 물 31 µ L에 펠 릿을 중단. 실 온에서 2 분 동안 품 어.
- 때까지 모든 비즈는 수송과 eluate 분명 하다 자석에 튜브를 반환 합니다.
- 1.5 mL microcentrifuge 튜브는 eluate 전송. 샘플의 1 µ L를 사용 하 여 계량 260에서 UV 분 광 광도 계를 사용 하 여 최종 준비 DNA nm ( 재료의 표참조).
참고: % 복구 해야 ~ 70% (700 ng) 게놈 DNA의 1 µ g의 시작 농도에서.
4. 어댑터와 밧줄 끝을 준비 하는 Genomic DNA 파편을 추가
- 반전에 의해 모든 블런트/TA 리가 마스터 혼합 튜브를 혼합 하 고 펄스 맨 아래 내용을가지고 원심 분리기.
- 최종 준비 DNA의 30 µ L를 사용 하 여 추가 어댑터 믹스 20 µ L 블런트/TA 결 찰 마스터 믹스의 50 µ L.
- 반전, 펄스 원심 분리기에 의해 혼합 하 고 실 온에서 10 분 동안 품 어.
5. 자석 Bead 준비
- 소용돌이 구슬과 다음 전송 50 µ L 1.5 mL microfuge 중단된 구슬의 튜브.
- 비즈는 eluate 될 때까지 작은 자석에 튜브를 놓습니다.
- 상쾌한을 제거 하 고 삭제.
- 비드 바인딩 버퍼의 100 µ L를 추가, 작은 자석에 구슬 구슬, 구슬, resuspend에 소용돌이를 하는 상쾌한 제거 하 고 삭제 (구슬 키트에 대 한 재료의 표 참조). 바인딩 버퍼의 100 µ L로 세척을 반복 합니다.
- 씻어 구슬에 구슬 바인딩 버퍼의 100 µ L를 추가 합니다. Resuspend 구슬에 소용돌이입니다.
6. 도서관 정화
- P200 micropipette를 사용 하 여 이전 단계에서 적응/곁에 genomic DNA에 구슬의 40 µ L 추가 합니다. Pipetting으로 샘플을 신중 하 게 믹스.
- 실 온에서 5 분 동안 100 rpm 회전 믹서에 샘플을 품 어.
- 자석에 샘플을 놓고 구슬 정착을 허용 합니다. 상쾌한 오프 pipette 그리고 삭제.
- Pipetting으로 구슬 구슬 바인딩 버퍼의 140 µ L에서 resuspend. 자석에 대 한 샘플, 상쾌한, 취소 놓고 구슬 바인딩 버퍼의 또 다른 140 µ L로 다시 세척 합니다.
- 펄스 원심 튜브, 튜브 자석에 장소는 펠 릿에서 나머지 비드 바인딩 버퍼를 제거 하는 2 분.
7입니다. 자석 구슬에서 라이브러리의 차입
- Pipetting으로 차입 버퍼의 15 µ L에 자석 구슬 resuspend. 실 온에서 10 분에 대 한 샘플을 품 어.
- 작은 구슬을 자석에 대 한 튜브를 놓습니다.
참고: % 복구 해야 ~ 25% (250 ng) 게놈 DNA의 1 µ g의 시작 농도에서.
8. 시작 실행/품질 관리
- 포장에서 흐름 세포를 제거 하 고 연결 흐름 셀 휴대용, 실시간 시퀀서 ( 재료의 표참조).
- USB 케이블을 통해 컴퓨터에 sequencer를 연결 하 고 시작 시퀀싱 소프트웨어 ( 재료의 표참조).
- 시퀀싱 소프트웨어를 통해 "연결" 장치를 클릭 합니다, 그리고 "NC_Platform_QC.py"를 선택 하 고 "시작"을 클릭 합니다.
- 품질 관리 (QC) 완료; 약 6-7 분 소요 '녹색의 바다'에 대 한 보고 (출력의 넓은 영역) 충분 한 활성 모 공 확인을 QC 판독에 (> 800) DNA 연속을 위한.
9. 시퀀싱 실행 시작
- 시퀀싱 프로그램; 대화 상자가 표시 됩니다. 샘플 ID 상자에 샘플을 이름.
- "흐름 셀 ID" 상자에 클릭 하 고 흐름을 셀 위에 스티커에서 찾을 코드를 입력 하십시오.
- 흐름 세포 뚜껑을 열고 한 다음 샘플 포트 커버를 오른쪽 (시계 방향으로) 샘플 포트 표시 됩니다. 일단 포트가 열려 확인 작은 거품에 대 한. 거품을 포함 하는 버퍼의 약간 microliters를 제거 합니다.
- 센서 배열에서 버퍼는 확실 하 게 확인 하십시오. 연료 혼합으로 버퍼를 실행의 480 µ L를 혼합 하 여 못쓰게 버퍼를 확인 (RBF-1 테이블의 자료를 참조) (혼합 해야 합니다. 철저 하 게 첫 번째) 520 µ L nuclease 무료 물.
- 못쓰게 포트를 못쓰게 버퍼의 800 µ L를 추가 합니다. 신중 하 게 접근할 수 있도록 "SpotOn" 덮개를 들어올립니다.
- 5 분 후 못쓰게 포트를 못쓰게 버퍼의 추가 200 µ L를 추가 합니다.
10. 로드 라이브러리
- 얼음에 다음과 같은 시 약 보관 장소를 준비 하기 전에: RBF-1 (시퀀싱 kit)에서 적응 하 고 곁에 라이브러리 및 라이브러리 로드 구슬 (LLB 시퀀싱 장비에서).
- 0.2 mL 원심 분리기 튜브를 RBF의 25.5 µ L 및 실 온에서 보관 하는 nuclease 무료 물 12 µ L를 추가 합니다.
- 위아래 pipetting으로 LLB를 믹스. 0.2 µ L 튜브에는 LLB의 26.5 µ L를 추가 합니다. 위아래 pipetting으로 시 약을 혼합.
참고:는 LLB 혼합물에서 정착 하는 경향이 있다. - 0.2 µ L 튜브에 적응 하 고 테더 라이브러리의 11 µ L를 추가 합니다. 펄스 원심 분리에 의해 역전과 회전에 의해 혼합.
- Dropwise "SpotOn" 포트 9.4 단계에서 샘플의 75 µ L를 추가 합니다. 각 드롭 흐르는 포트에 다음을 추가 하기 전에 다는 것을 확인 하십시오.
- 신중 하 게 하는 마 개 입력 포트, 샘플 포트 커버를 장착 하 고 장치 뚜껑 교체.
11. 시퀀싱 소프트웨어 프로토콜 스크립트 시작
- '프로그램 선택' 드롭다운 메뉴를 열고 "48 시간 순차 처리"를 선택
- 스크립트를 시작 하려면 "실행" 버튼을 클릭 합니다.
- 멀티플렉서 스캔 알림 스트림 멀티플렉서 스캔에서 활성 모 수에 대 한 보고의 결과 확인 합니다.
참고:이 수 수 있습니다과 다를 실행 하는 QC에 있는 숨 구멍의 수는 큰 차이 문제를 나타낼 수 있습니다.- 경우 QC 실행에서 활성 숨 구멍의 상당한 감소는 소프트웨어를 다시 시작 하 고 컴퓨터를 재부팅 하는 경우 여전히 상당한 차이.
- 있는지 확인 방열판 온도 34 ° C 시퀀싱 소프트웨어 스크립트에서 보고 합니다.
참고: 온도 34 ° C에 사용 하는 경우 다음 거기 되지 않습니다 실행에 대 한 충분 한 활성 모 공. - 시퀀스 길이 예상 하 고 실험 설계에 대 한 적절 한 확인 하려면 읽기 길이의 히스토그램을 확인 하십시오.
- '가까운 엑스' 종료 시퀀싱 소프트웨어 웹 GUI 폐쇄를 사용 하 여 데스크탑 에이전트를 닫습니다. 컴퓨터에서 장치를 분리 합니다.
12입니다. 실행 및 결과 분석
참고: 시퀀싱 실행 하는 동안 데이터를 모니터링할 수 있습니다 데스크톱 에이전트를 사용 하 여 "보고서 보기" 프로그램을 사용 하 여. 동안 또는 실행 완료 되 면 파일 데이터 →에서 파일 형식 → 통과 폴더 (기본값) 읽고 FAST5에서 사용할 수 있습니다. 시퀀싱 활성화 되어 있는 동안이 폴더를 열고, 컴퓨터 동결 수 있습니다.
- 보기 순서를 조작 하는 "HDFViewer"을 다운로드 합니다.
- 파일을 보려면 시퀀싱, 직접 오픈 HDF 뷰어 → 오픈 데이터 폴더 → 선택 모든 파일 형식 → 선택 c: 드라이브 (기본값) → 선택 데이터 → 선택 읽기 → 선택 패스 합니다.
- 찾아서; 왼쪽된 드롭다운 메뉴에서 FASTQ 파일을 선택 파일이 열리고 FASTQ 형식으로 저장 될 수 있습니다.
참고: 학생 실험 목적으로 시퀀스 350 뉴클레오티드의 이상 추가 분석을 위해 선정 됐다. 기본 호출에서 출력 시퀀스 읽기 크기에 따라 정렬 하려면 사용자 수 있습니다. FASTQ 파일은 폭발 (NCBI) 또는 다른 생물 정보학 프로그램을 통해 분석할 수 있습니다.
결과
실험 설계 및 nanopore 기술 학생 토양 DNA 시퀀싱을 위한 신속 하 고 저렴 한 방법을 제공 합니다. 대표 실행 시퀀스에 사용할 수 있는 이상의 800 숨 구멍을가지고 품질 관리 매개 변수를 전달. 실행 결과 이상 125000 읽기 사용할 수 5.38 kb의 중간 시퀀스 길이와 연구. 시퀀스는 품질 평가 점수를 주어 집니다 그리고 허용 점수와 그 시퀀스 다음 분석 했다. 시퀀싱의 출력으로 반응은 허용 되지 않습니다 프로그램 등 폭발 (NCBI), 시퀀스 시퀀스 폭발 분석에 대 한 호환 되는 FASTQ 형식으로 변환 하는 HDF 뷰어에서 볼 했다 FAST5 형식에서 이다. 미래에 소프트웨어의 반복, 데이터가 유효할 것 이다 HDF 뷰어 필요를 FASTQ 형식으로. 참조 보충 그림 1, 2, 및 3.
길이 350 뉴클레오티드의 50 시퀀스 BLASTN (뉴클레오티드 염기 데이터베이스에 대 한) 또는 BLASTX (뉴클레오티드 아미노산 서 열으로 번역)에 의해 분석 대상이 됐다 (NCBI) 토양 샘플에서 유기 체를 확인 하. 시간을 감안할 때 클래스의 제약 조건 및 그 과정의 초점은 실험실 방법 및 생물 정보학 하지, 우리는 이러한 매개 변수 내에서 시퀀스를 분석 하는 학생 들. 우리의 생물 정보학 클래스는 파이프라인 분석 도구 개발에 대 한 데이터를 사용할 수 있습니다. 이 정도의 생물 정보학 분석 실험실 기반 클래스에서 적용 되지 않습니다. 표 1 미만 4 e-04의 e 값으로 확인 된 생물의 목록입니다. 일반적으로, 전자-값 보다 작은 4 e-04 입력된 시퀀스 (쿼리)와 일치 시퀀스 간의 강한 유사성을 나타냅니다. (비 중복 (nr) 데이터베이스)에 대해 BLASTN에 의해 확인 된 생물 다양 한 종에서에서 고에 사용할 수 있는 추가 게놈 및 단백질 분석. 그래서 결정 어떤 유기 체는 토양에 있는 아무 이전 데이터, 볼티모어 카운티, 메릴랜드에 정원에서 토양의이 샘플 적 테스트 되었습니다 했다. BLASTN 분석 (nr 데이터베이스)에 대 한 분석 또한 시퀀스를 nr 데이터베이스에 없는 유사 했다 표시 됩니다. 이 진정으로 새로운 시퀀스를 확인, 추가 연구 필요 하다. BLASTX에 의해 여러 시퀀스 분석 BLASTN 분석에서 대표 되지 않는다 유기 체에서 여러 가지 단백질을 밝혔다. 표 2 는 endopeptidases, 그리고 ATPases 같은 단백질을 포함 하 여 여러 가지 가능한 단백질을 나열 합니다. 시퀀스의이 라이브러리를 사용 하 여, 학생 들은 강사에 의해 감독 하는 경우 추가 분석을 수행 하려면 고급 생물 정보학 도구를 사용 하는 기회.
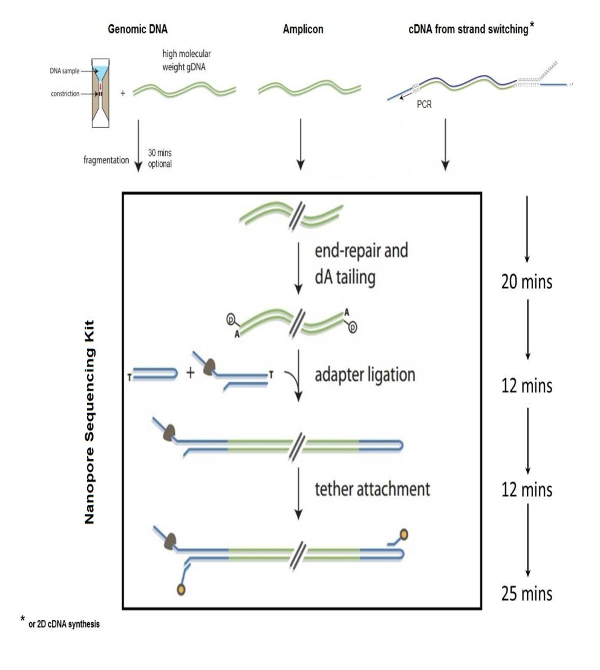
그림 1 : 게놈 라이브러리 준비. 시퀀싱 nanopore 기술을 사용 하 여 게놈 DNA 라이브러리의 준비를 위한 단계. 이 그림은 필요한 사용 권한이 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 . nanopore를 사용 하 여 DNA 연속의 도식. 전기 신호 생성 및 자료 확인 nanopore 멤브레인을 통과 하는 DNA 이 그림은 필요한 사용 권한이 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 유기 체 | e 값 |
| Streptomyces sp. | 3.00E-06 |
| Nocardoides sp. | 5.00E-04 |
| Gordonia sp. | 5.00E-04 |
| Hyphomicrobium nitrativorens | 1.00E-139 |
| Starkeya 노벨 | 1.00E-31 |
| Hyphomicrobium denitrificans | 1.00E-30 |
| Fibomicrobium sp. | 5.00E-17 |
| 모나 스 sp. | 2.00E-15 |
| Rhodothemus 리누스 | 1.00E-17 |
| Turneiella parva | 2.00E-24 |
| 대장균 | 0.00E + 00 시 |
| Bradyrhizobium sp. | 3.00E-30 |
| Gemmatirosa kalamazoonesis | 1.00E-20 |
| Burkholderia sp. | 8.00E-10 |
| 스핀 sp. | 8.00E-10 |
| Cellumonas sp에. | 6.00E-11 |
표 1: BLASTN 분석의 결과 선택. NCBI 비중복 뉴클레오티드 데이터베이스에 대해 BLASTN 유사성 검색 대상이 토양 metagenomics DNA 시퀀스. 보고 데이터 4 x e-4 또는 더 적은의 e 값을 가집니다.
| 단백질 | 유기 체 |
| 가설 단백질 | Acidobacter 박테리아 |
| 샘 종속 methyltransferase | H. denitrificans |
| ATPase | Jannaschia sp에. |
| Endopeptidase | Shigella sonnei |
| 세포 단백질 | 대장균 |
표 2: BLASTX 분석 결과 선택. NCBI 비중복 단백질 데이터베이스에 대해 BLASTX 유사성 검색 대상이 토양 metagenomics DNA 시퀀스.
보충 그림 1: 플랫폼 QC 결과. 품질 관리 플랫폼의 결과 표시 됩니다. 오른쪽 상단 모서리에서 활성 모 공에 대 한 QC의 결과입니다. 각 사분면 흐름 셀의 활성 모 공에 대 한 테스트입니다. 메인 페이지는 동적 이며 각 사분면 테스트 변경. 이 실행에서 1,414 단일 모 감지 했다.이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
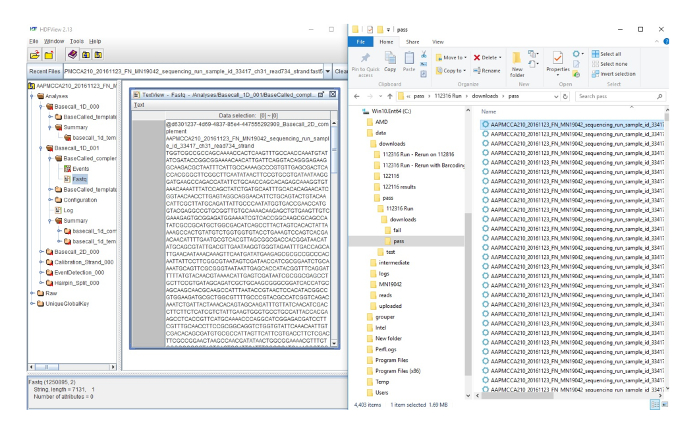
보충 그림 2: FASTQ 파일을 변환 FAST5 파일. 여기 오른쪽에 시퀀싱 실행에서 데이터의 출력이입니다. 각 줄은 개별 시퀀스를 나타냅니다. 그림의 왼쪽 시퀀스 추가 분석을 위해 사용 될 수 있는 FASTQ 파일을 변환 하는 HDF 뷰어 오른쪽 측면에서 강조 표시 된 시퀀스를 보여 줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
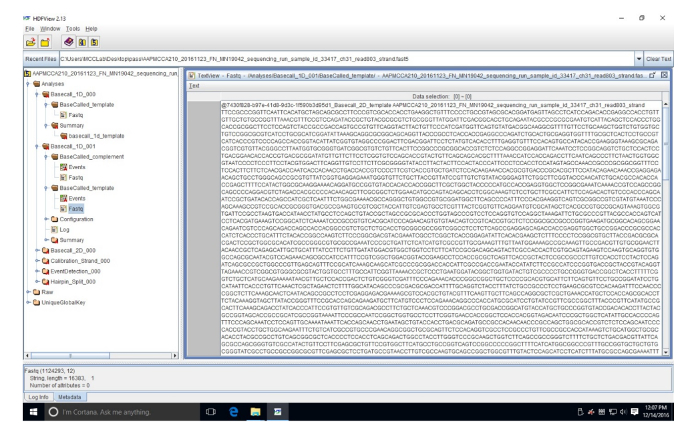
보충 그림 3: HDF 뷰어 예의 FASTQ 순서. 이 시퀀스 (읽기 803) 뉴클레오티드 FAST5 데이터 변환 FASTQ 파일에서입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
많은 다음 세대 시퀀싱 방법 생성 된 각 합성 하 여 시퀀싱에 따라 달라 집니다 하지만 뉴클레오티드를 식별을 위해 탐지 플랫폼 다릅니다. NS, 시장에 가장 최근 추가 연속 반응 필요 하지 않습니다 또는 뉴클레오티드를 표시 완전히, 다른 메서드를 사용 합니다. 이 방법을 활용 이미 통합된 뉴클레오티드의 충전 차동 전기 공 통과 합니다. 각 뉴클레오티드의 id는 nanopore를 통과 다른 기지에 의해 전기 전류의 변조에 의해 발생 합니다. 이 다중화 시스템을 사용 하면 한 번에 많은 파편을 순서를 수 있습니다. DNA의 두 가닥을 시퀀싱 하 여 시퀀스의 정확도 크게 증가 하 고 노트북 컴퓨터에 로드 될 수 있습니다, 시퀀싱 소프트웨어 신호를 처리 하 고 분석할 수 있는 시퀀스 정보를 제공 합니다.
Pyrosequencing, 합성 (SBS) 메서드에서 시퀀싱에서에서 서식 파일에 통합 하는 특정 자료의 검색 luciferase 분석 결과 및 chemiluminescent 신호8세대에 따라 달라 집니다. 이온 반도체 시퀀싱, pH 감소 발표 수소 이온, 이온 센서9에 의해 감지 됩니다. 단일 분자 실시간 시퀀싱은 제로 모드 웨이브 가이드 (ZMW)10, 통합된 뉴클레오티드에 형광 분자 검출에 대 한 조명에 따라 달라 집니다. SBS 되도록 고유한 시퀀스의 클러스터 생성된13표적 DNA를 증폭 하는 독특한 방법을 사용 합니다. 추가 된 뉴클레오티드의 검색 태그 뉴클레오티드의 형광 기록 됩니다 때 이루어집니다. NS는 다른 한편으로 그 제한 된 기술 자원이 필요로, 휴대용, 긴 연속 읽기를 생산 하 고, 필요 없는 이전 DNA 증폭 이며 다른 방법에 비해 저렴된 한 비용에 작동 될 수 있다 다른 방법에 비해 고유한 이점이 있다. 우리 학생 들은 최신, 빠른 라이브러리 준비 프로토콜을 간단 하 고 3 시간 실험실 수업을 받을 수 발견. 우리가 발생 하는 문제 중 일부를 제거 하기 어려운는 흐름 셀에 거품 했다, 중요 한 컴퓨터 전원 (1 테라바이트 스토리지의) 요구, 데이터의 현재 출력 FAST5 파일에 있으며 시퀀싱 흐름 셀 전에 제한 된 수명 악화. 또한,는 NS 결 찰 시퀀싱 프로토콜 (긴)의 다른 단점은 그것 여러 라이브러리 준비 단계, 분자 생물학 기술, 전문 지식이 필요로 일부에 비해 감소 시퀀싱 충실도 생성 시퀀싱 방법론3. 그러나, 새로운 빠른 라이브러리 준비 키트와 함께 최근 발전 라이브러리 준비에 대 한 불과 10 분을 필요 하며 에러율 감소 시퀀싱을 시연 하고있다. 새로운 라이브러리 준비 방법은 실험실 클래스에 사용 하기 위해 매우 순종 이었다.
특히 흐름 셀의 QC에에서 몇 가지 중요 한 단계는 프로토콜에 있다. 이 흐름 셀의 영수증의 5 일 이내 초기 품질 관리를 수행 하 고 8 주 이내에 그들을 사용 하 여 포함 됩니다. 우리는 사용 하지만 8 주 이상 된 흐름 세포, 오픈/액티브 숨 구멍의 수는 크게 감소. 흐름 셀의 최대 사용 달성 되는 타임 라인에 맞게 실험 계획은 중요 하다.입니다. 우리 청소 프로토콜을 사용 하 고 다시 성공 흐름 세포.
토양 대표 미생물 다양성의 미 개발된 유전 저수지의 metagenomics 조사. 예를 들어 한 토양의 그램 10 사이 포함 추정7 -109 prokaryotic 세포14. 또한, 토양 유기 체 소설 자연 제품, 효소, 및 항생제의 주요 원천입니다. 따라서, 토양 metagenomics DNA 순서 분석 교육의 모든 수준에서 학생 들을 위한 유용한 교육 도구를 나타냅니다. NS 기술이이 시스템 매우 효과적인 교육 도구로 사용 하 고 저렴 한 비용의 용이성. 학생 환경 샘플, 시퀀스 및 시퀀스의 완료 되 면 사용 가능한 생물 정보학 도구 식별 하 고 특성 테스트 샘플에서 미생물 및 metagenomics 시퀀스 수 있습니다. NS 기술을 사용 하 여, 학생 들은까지 지금 밖으로 도달 실험실 과정에서 사용 하기 위해 고급 전문 기술 및 다른 시퀀싱 플랫폼에서 높은 시 약, 장비, 및 유지 보수 비용 때문에 진정한 체험 경험 있습니다. (J. 해리슨, 개인 통신) 학생 중 하나는 최근, 농장 토양의 환경 모니터링 프로젝트에이 기술 사용을 했다. 우리는이 기술 교육 공간에 대 한 많은 더 많은 애플 리 케이 션 있을 것입니다 기대 합니다.
공개
저자 아무 공개 있다.
감사의 말
이 프로젝트는 존스 홉킨스 대학, 통해 학장의 사무실에 의해 지원으로 일부는 게이트웨이 과학 이니셔티브.
자료
| Name | Company | Catalog Number | Comments |
| Thermal Cycler | LifeECO | BTC42096 | |
| Covaris g-TUBE | Covaris | 520079 | |
| NEBNext End Repair Module | New England BioLab | E7546 | |
| Eppendorf LoBind Centrifuge Tubes | Sigma-Aldrich | Z666505 | |
| NEB Blunt/TA Ligase Master Mix | New England BioLab | MO367 | |
| MyOne C1 Strepavidin Beads | Thermo Fisher | 65001 | |
| Eppendorf microcentrifuge | Eppendorf | Model 5420 | |
| Nanodrop UV spectrophotometer | Thermo Fisher | ND-2000 | Model 2000 |
| Belly Dancer Orbital Shaker | Sigma-Aldrich | Z768499 | |
| Power Soil DNA Isolation Kit | MO BIO | 12888-50 | |
| Ligation Sequencing Kit 2D | Oxford Nanopore | SQK-LSK208 | |
| Rapid Sequencing Kit for Genomic DNA | Oxford Nanopore | SQK-RAD002 | |
| End-Prep Reaction Buffer and enzyme mix (NEB Blunt/TA Ligase Naster Mix) | New England BioLab | MO367 | |
| AmPure XP Magnetic Beads | Beckman Coulter | A63880 | |
| Basic Starter Pack | Oxford Nanopore | Includes MinION Sequencing Device and Flow Cell | |
| MinKNOW software | Oxford Nanopore | ||
| Rapid Sequencing Kit for Genomic DNA | Oxford Nanopore | SQK-RAD002 | Includes Running Buffer with Fuel (RBF), Fragmentation Mix (FRM) Rapid Adapter (RAD) Library Lodaing Beads (LLB) |
참고문헌
- Quick, J., et al. Real-time, portable genome sequencing for Ebola surveillance. Nature. 530 (7589), 228-232 (2016).
- Greninger, A. L., et al. Rapid metagenomics identification of viral pathogens in clinical samples by real-time nanopore sequencing analysis. Genome Med. 7, 99(2015).
- Quick, J., et al. Rapid draft sequencing and real-time nanopore sequencing in a hospital outbreak of Salmonella. Genome Biology. 16, 114(2015).
- Ashton, P. M., et al. MinION nanopore sequencing identifies the position and structure of a bacterial antibiotic resistance island. Nat Biotechnol. 33, 296-300 (2015).
- Loman, N. J., Quick, J., Simpson, J. T. A complete bacterial genome assembled de novo. using only nanopore sequencing data. Nat Method. 12, 733-735 (2015).
- Hoenen, T., et al. Nanopore Sequencing as a Rapidly Deployable Outbreak Tool. Emerg Infect Dis. 22 (2), 331-334 (2016).
- Petrosino, J. F., Highlander, S., Luna, R. A., Gibbs, R. A., Versalovic, J. Metagenomic pyrosequencing and microbial identification. Clin Chem. 55 (5), 856-866 (2009).
- Cummings, P. J., Ahmed, R., Durocher, J. A., Jessen, A., Vardi, T., Obom, K. M. Pyrosequencing for Microbial Identification and Characterization. J. Vis. Exp. (78), e50405(2013).
- Rothberg, J. W., et al. An integrated semi-conductor device that enabling non-optical genome sequencing. Nature. 475, 348-352 (2011).
- Levene, M. J., Korlach, J., Turner, S. W., Foquet, M., Craighead, H. G., Webb, W. W. Zero-mode Waveguides for Single-Molecule Analysis at high concentrations. Science. 299, 682-686 (2003).
- Eid, J., et al. Real-Time DNA Sequencing from Single Polymerase Molecules. Science. 323, 133-138 (2009).
- Stoddart, D., Heron, A. J., Mikhailova, E., Maglia, G., Bayley, H. Single-nucleotide discrimination in immobilized DNA oligonucleotides with a biological nanopore. PNAS. 106, 7702-7707 (2009).
- Shendure, J., Hanlee, J. Next generation DNA sequencing. Nat Biotechnol. 26, 1135-1145 (2008).
- Daniel, R. The Metagenomics of Soil. Nat Rev Microbiol. 3, 470-478 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유