Method Article
Séquençage de l’ADN pour l’analyse métagénomique sol NANOPORE
Dans cet article
Résumé
Nanopore technologie des biomolécules de séquençage a de vastes applications dans les sciences de la vie, y compris l’identification de pathogènes, surveillance de la sécurité alimentaire, analyse génomique, la surveillance de l’environnement métagénomiques et caractérisation des bactéries résistance aux antibiotique. Dans cet article, la procédure de séquençage de l’ADN du sol métagénomique pour identifier les espèces utilisant la technologie de séquençage nanopore est illustrée.
Résumé
Cet article décrit les étapes de construction d’une bibliothèque d’ADN du sol, préparation et utilisation de la cellule de flux nanopore et l’analyse des séquences ADN identifié à l’aide de logiciels. Séquençage de l’ADN nanopore est une technique souple qui permet pour le séquençage de génomes microbiens rapide identifier les espèces bactériennes et virales, de caractériser les souches bactériennes et pour détecter les mutations génétiques qui confèrent une résistance aux antibiotiques. Les avantages de nanopore séquençage (NS) pour les sciences de la vie sont sa faible complexité, coût réduit et rapide en temps réel séquençage de l’ADN génomique purifié, PCR amplicons, échantillons de cDNA ou l’ARN. NS est un exemple de « séquençage de brin » qui implique le séquençage de l’ADN en guidant une seule molécule d’ADN échouée à travers un nanopore qui s’insère dans une membrane de polymère synthétique. La membrane dispose d’un courant électrique appliqué dessus, alors que les bases individuelles passent par le nanopore le courant électrique est perturbé à des degrés divers par les quatre bases nucléotidiques. L’identification de chaque nucléotide se produit en détectant la modulation caractéristique du courant électrique par les différentes bases pendant qu’ils traversent la nanopore. Le système de NS se compose d’un ordinateur de poche, alimenté par USB, appareil portatif et une cellule d’écoulement jetables qui contient un tableau nanopore. Le dispositif portatif se branche sur un ordinateur portable standard qui lit et enregistre la séquence d’ADN à l’aide de logiciels.
Introduction
Cette procédure vise à montrer les étapes nécessaires à la préparation d’une bibliothèque d’ADN environnementale de séquençage, utilisation d’un appareil de séquençage nanopore flux cellulaire et d’effectuer une analyse des séquences ADN générés à l’aide du logiciel système et le National Center for outils bioinformatiques Biotechnology Information (NCBI) pour identifier une espèce microbienne dans le sol. Actuellement, la plupart des plateformes de séquençage de l’ADN prévoient un investissement majeur dans la formation technique et des instruments complexes, qui ne sont pas faisable dans les environnements de pauvres ressources ou en applications sur le terrain. La plate-forme de séquençage (NS) nanopore élimine ces problèmes avec un coût-efficacité, simple à utiliser le protocole de préparation de bibliothèque et un dispositif portable de séquencer et d’analyser une variété de différents types d’acides nucléiques1,3. Nous avons incorporé la plate-forme NS dans plusieurs classes de laboratoire pour les étudiants de maîtrise.
Nanopore technologie des biomolécules de séquençage a démontré des applications larges dans les sciences de la vie, y compris l’identification des agents pathogènes bactériens et viraux1,2,6, la biodiversité environnementale études, surveillance de la sécurité alimentaire, l’analyse génomique3,5et caractérisation de la résistance bactérienne aux antibiotiques4. NS est une méthode rapide et précise de la séquence d’acides nucléiques qui se fonde sur le principe de « chapelet de séquençage » en détectant les perturbations électriques en bases nucléotidiques individuels lorsque seul ADN bicaténaire passe à travers un nanopore insérée dans un électrifiée membrane de polymère synthétique. Les étapes à suivre pour préparer l’ADN pour NS comprennent la fragmentation du génome, réparation fin et 3' dA-tailing des fragments génomiques, adaptateur et d’attache recuit à l’ADN, ADN bibliothèque purification et chargement de la bibliothèque dans le dispositif de cellule de flux nanopore. Fragmentation du génome en kb ~ 8 tailles s’effectue par 1 à 2 µg d’ADN génomique à travers un tube de fragmentation g-tube de centrifugation. Les extrémités de génomiques fragmentées sont ensuite réparées et queue avec dA poly à l’aide d’un kit disponible dans le commerce. Séquences d’adaptateur brin unique, qui sont compatibles avec la protéine motrice nanopore, sont ajoutés aux extrémités de l’ADN qui servent à guider la séquence d’ADN par l’intermédiaire de la nanopore (Figure 1). Les séquences d’attache sont requis pour la purification de l’ADN et pour localiser les molécules d’ADN à la membrane de porosité. L’épingle est générée en ligaturant un adaptateur en épingle à cheveux à une extrémité de la bibliothèque à queue dA. Les structures en épingle à cheveux à l’extrémité de l’ADN permet la lecture des brins sens et antisens car l’ADN traverse le nanopore (Figure 2). La banque génomique préparée est ensuite purifiée à partir la réaction à l’aide de streptavidine perles en utilisant un champ magnétique, puis en chargeant l’échantillon dans la cellule d’écoulement nanopore pour analyse.
L’ADN séquencée est évaluée pour la qualité et des lectures de séquençage qui sont acceptables pour l’analyse sont ensuite soumises à plusieurs outils de bio-informatique pour identifier les microbes. Les séquences sont « traduites » en un FASTQ d’un format FAST5. Dans le format FASTQ, les séquences puis peuvent être utilisés que dans l’analyse de l’explosion.
Protocole
Remarque : Métagénomique ADN est purifiée à partir du sol (comté de Baltimore, Maryland) à l’aide d’un isolement de génomique de sols disponibles dans le commerce nécessaire (voir la Table des matières). À l’aide d’un spectrophotomètre UV (voir Table des matières), l’ADN génomique purifié devrait avoir un ratio de (nm) de 260/280 > 1.8 et un rapport de 260/230 entre 2.0-2.2 pour s’assurer que l’échantillon est exempt de contaminants. La quantité d’ADN génomique requis pour NS varie de 200 ng à 2 µg.
1. procédé de préparation de la bibliothèque rapid (protocole court)
Remarque : Il s’agit d’un protocole court. Voir Table des matières pour le kit de séquençage rapide.
- Dans un 0,2 mL tube à parois minces (voir Table des matières) ajoutez 200 ng de haut poids moléculaire ADN lors d’une finale du volume de 7,5 µL d’eau distillée.
- Ajouter 2,5 µL du mélange (FM) de la fragmentation de la trousse de préparation rapide Bibliothèque et mélanger doucement à l’inversion. Centrifugeuse de pouls pour filer vers le bas (1 000 x g pendant 5 s).
- Placer l’échantillon dans un thermocycleur (voir Table des matières) pour un tour à 30 ° C pendant 1 min, suivie de 75 ° C pendant 1 min. Retirer le tube et le pouls centrifugeuse pour filer vers le bas de l’échantillon.
- Ajouter 1 µL d’adaptateur rapide et 0.2 µL du mélange principal de ligase blunt/TA et puis stockez la bibliothèque adaptée et attachée sur la glace.
Remarque : Si l’utilisation du protocole court passez à l’étape 8
2. ligature séquençage Protocol (protocole Long) : Métagénomique Fragmentation de l’ADN
Remarque : Consultez la Table des matières pour le kit de séquençage de la ligature.
- Diluer 1 µg d’ADN génomique purifié pour un volume final de 46 µL dans l’eau désionisée.
- Transfert de l’échantillon à une fragmentation de l’ADN de tube (voir Table des matières) et centrifuger pendant 1 min à température ambiante comprise entre 8 000 x g, en utilisant une micro-centrifugeuse (voir Table des matières) pour produire des fragments génomiques ~ 8 Ko. Veillez à ce que tout le liquide est passé dans le tube de prélèvement.
- Il faut inverser le tube de fragmentation, retour à la centrifugeuse et centrifuger pendant 1 min recueillir le fragments d’ADN génomique dans la chambre inférieure.
- Transférer le fragments d’ADN génomique dans un tube de 1,5 mL stérile basse-DNA binding et analyser une partie sur un gel d’agarose de pourcentage faible (0,6 %) pour confirmer la fragmentation à > 30 Ko.
3. fragmenté fin-préparation d’ADN génomique
- À l’aide de 800 ng d’ADN génomique fragmenté dans 45 µL d’eau désionisée, ajouter 7 réaction de fin-prep µL tampon (voir Table des matières), mélange de 3 µL enzymatique (voir Table des matières) et 5 µL de nucléase eau libre.
- Mix par inversion et pulse centrifugeuse (1 000 x g pendant 5 s).
- Transférer l’échantillon dans un tube à parois minces de 0,2 mL et incuber les échantillons pendant 5 min à 20 ° C, suivie d’une incubation à 65 ° C pendant 5 min.
- Centrifugeuse de pouls pour apporter le contenu vers le bas du tube.
- Transférer l’échantillon dans un tube de microcentrifuge de basse-DNA binding 1,5 mL.
- Préparer des billes magnétiques (voir table des matières). Ajouter 60 µL de billes remises en suspension à la réaction de préparation fin d’étape 3.5 et mélange de pipetage.
- Incuber dans un mélangeur de rotateur à 100 tr/min (voir Table des matières) pendant 5 min à température ambiante.
- Impulsion Centrifuger l’échantillon pour les perles de granule, puis placer l’échantillon à côté de l’aimant.
- Une fois que les perles soient respectées à l’aimant, Pipetter hors surnageant et jetez-la.
- Retirer le tube les perles aimant et lavage avec 200 µL d’éthanol à 70 % fraîchement préparée par pipetage doucement l’échantillon de haut en bas.
- Centrifugeuse d’impulsion pour les perles de granule et revenir à l’aimant.
- Retirez le surnageant et le jeter. Répétez l’étape de lavage à l’aide de 200 µL d’éthanol à 70 %.
- Impulsion Centrifuger le tube, de retour à l’aimant et enlever tout le lavage de l’éthanol 70 %.
- Le couvercle de tubes de microcentrifuge ouvert, laisser sécher pendant 5 min et les perles à l’air à température ambiante.
- Retirez le tube du aimant et suspendre le culot dans 31 µL d’eau stérile, exempte de nucléase. Incuber pendant 2 min à température ambiante.
- Retourner le tube à l’aimant jusqu'à ce que toutes les perles sont granulées et l’éluat est clair.
- Transférer l’éluat dans un tube de microtubes de 1,5 mL. À l’aide de 1 µL de l’échantillon, de quantifier l’ADN de fin-préparée à l’aide d’un spectrophotomètre UV à 260 nm (voir Table des matières).
Note : Le pourcentage de récupération devrait être environ 70 % (700 ng) à un départ de la concentration de 1 µg d’ADN génomique.
4. adaptateur et ajout d’attache aux Fragments d’ADN génomique préparée à la fin
- Mélanger tous la ligase blunt/TA mélange maître tubes par inversion, et ensuite des impulsions centrifugeuse pour apporter le contenu vers le bas.
- Avec 30 µL d’ADN préparée à la fin, ajouter 20 µL du mélange de l’adaptateur et 50 µL du mélange principal de ligature blunt/TA.
- Mélanger par retournement, centrifugeuse de l’impulsion et incuber pendant 10 min à température ambiante.
5. magnétique Bead préparation
- Vortex les perles et puis transfert de 50 µL de suspension perles à un microtubes de 1,5 mL tube.
- Placer le tube sur l’aimant pour granuler les perles jusqu'à ce que l’éluat efface.
- Retirez le surnageant et le jeter.
- Ajouter 100 µL de tampon de liaison perle (voir Table des matières pour kit de billes) aux talons, vortex pour remettre en suspension les perles, les perles sur l’aimant de granule, éliminer le surnageant et jeter. Répéter le lavage avec 100 µL de tampon de liaison.
- Ajouter 100 µL de tampon de liaison perle aux talons lavés. Vortex pour remettre en suspension les perles.
6. Bibliothèque Purification
- À l’aide d’une micropipette P200, ajouter 40 µL de perles de l’étape précédente à l’ADN génomique adapté/tethered. Mélanger soigneusement l’échantillon de pipetage.
- Incuber l’échantillon sur un mélangeur de rotateur à 100 tr/min pendant 5 min à température ambiante.
- Placer l’échantillon sur l’aimant et laisser les perles de s’installer. Pipetter hors le surnageant et le jeter.
- Remettre en suspension les perles dans 140 µL de tampon de liaison perle de pipetage. Placer l’échantillon contre l’aimant, éliminer le surnageant et lavez de nouveau avec un autre 140 µL de tampon de liaison de perle.
- Pulse Centrifuger le tube, placer le tube sur l’aimant pour 2 min. Retirer le tampon de liaison perles restantes de la pastille.
7. l’élution de la bibliothèque de perles aimant
- Remettre en suspension les billes magnétiques dans 15 µL de tampon d’élution par pipetage. Incuber l’échantillon pendant 10 min à température ambiante.
- Placer le tube contre l’aimant pour granuler les perles.
NOTE : Le pourcentage de récupération devrait être environ 25 % (250 ng) à un départ de la concentration de 1 µg d’ADN génomique.
8. démarrer un contrôle qualité/Run
- Sortir de la cellule d’écoulement d’emballage et fixer la cellule d’écoulement sur le séquenceur portable, en temps réel (voir Table des matières).
- Fixez le séquenceur à un ordinateur via un câble USB et lancez le logiciel de séquençage (voir Table des matières).
- Cliquez sur « Connect » périphérique via le logiciel de séquençage, sélectionnez « NC_Platform_QC.py » et cliquez sur « Démarrer ».
- Le contrôle de la qualité (CQ) prend environ 6-7 min pour terminer ; Recherchez une « mer de verdure » (grandes surfaces de sortie) sur la lecture QC pour confirmer qu’il y a assez actifs pores (> 800) pour le séquençage de l’ADN.
9. commencer une course de séquençage
- Ouvrez le programme de séquençage ; une boîte de dialogue apparaîtra. Dans la zone ID d’échantillon, nommez l’échantillon.
- Cliquez sur la case « Flow Cell ID » et entrez le code que se trouve sur l’autocollant sur le dessus de la cellule de flux.
- Ouvrez le couvercle de cellule de flux et faites ensuite glisser le couvercle du port échantillon vers la droite (sens horaire) pour que le port de l’échantillon est visible. Une fois que le port est ouvert, vérifiez pour une petite bulle. Enlever quelques microlitres de tampon dont la bulle.
- S’assurer qu’il n’y a tampon sur la baie de capteur. Faire le tampon d’amorçage en mélangeant 480 µL de tampon en cours d’exécution avec un mélange de carburant (DSR-1, voir la Table des matières) (n’oubliez pas de mélanger soigneusement) avec de l’eau exempte de nucléase 520 µL.
- Ajouter 800 µL de tampon d’amorçage au port d’amorçage. Soulevez le couvercle « SpotOn » pour le rendre accessible.
- Après 5 min, ajouter une supplémentaire 200 µL de tampon d’amorçage au port d’amorçage.
10. chargement de la bibliothèque
- Avant de préparer le lieu bibliothèque réactifs suivants sur la glace : DSR-1 (à partir de la trousse de séquençage), adapté et attachés Bibliothèque et bibliothèque de chargement des billes (LLB ; à partir du kit de séquençage).
- Dans un tube à centrifuger 0,2 mL, ajouter 25,5 µL du RBF et 12 µL d’eau exempte de nucléase conservé à température ambiante.
- La composition de la LLB de pipetage va-et-vient. Ajouter 26,5 µL de la LLB dans le tube de 0.2 µL. Mélanger les réactifs en pipettant également, ces hauts et bas.
Remarque : La LLB a tendance à se déposent dans le mélange. - Ajouter 11 µL de la bibliothèque adaptée et captif dans le tube de 0.2 µL. Mélanger par inversion et spin down par centrifugation de l’impulsion.
- Ajouter 75 µL de l’échantillon de l’étape 9.4 au port « SpotOn » goutte à goutte. Assurez-vous que chaque goutte se jette dans le port avant d’ajouter le suivant.
- Soigneusement remplacer le couvercle du port échantillon de sorte que la bonde entre dans le port et remettez le couvercle de l’appareil.
11. démarrer un Script de protocole de logiciel de séquençage
- Ouvrez le menu déroulant sous « Choisir un programme » et sélectionnez « séquençage de 48 heures. »
- Cliquez sur le bouton « Exécuter » pour lancer le script.
- Vérifier les résultats de la Mux scan a signalé dans la notification pour le nombre de pores actives dans le MUX scan.
Remarque : Ce nombre peut différer du nombre de pores de la CQ et une grande différence peut indiquer un problème.- S’il y a une réduction significative des pores actives de la course QC, redémarrez le logiciel et s’il y a toujours une différence significative, redémarrez l’ordinateur.
- Vérifier que la température du radiateur est de 34 ° C tel que rapporté par le script de logiciel de séquençage.
Remarque : Si la température n’est pas à 34 ° C puis il sera pas assez actifs pores pour la course. - Vérifier l’histogramme d’une longueur de lecture afin de déterminer si la longueur de la séquence est attendus et adaptés à la conception expérimentale.
- Fermer l’agent de bureau à l’aide de « fermer x. » quitter le logiciel de séquençage en fermant le web GUI. Déconnectez le périphérique de l’ordinateur.
12. analyse de l’exécution et les résultats
Remarque : Lors de l’exécution de séquençage, les données peuvent être surveillées en utilisant le programme « Afficher le rapport » à l’aide de l’agent de bureau. Pendant ou après la série est terminée, les fichiers sont disponibles dans un FAST5 format de fichier dans le → données lit → pass dossier (par défaut). Si ce dossier est ouvert alors que le séquençage est actif, l’ordinateur risque de geler.
- Pour afficher et manipuler des séquences, télécharger un « HDFViewer ».
- Pour afficher les fichiers de séquençage, directement ouvert le HDF viewer → ouvert données dossier → sélectionner que tous les fichiers types → sélectionner C: lecteur (par défaut) → sélectionner des données → sélectionner lectures → select pass.
- Rechercher et sélectionner le fichier FASTQ dans le menu déroulant de gauche ; les fichiers seront ouvrira et peuvent être sauvegardés au format FASTQ.
Remarque : Dans le but de l’expérience de l’étudiant, des séquences de 350 nucléotides ou plus ont été sélectionnées pour une analyse ultérieure. Sortie de l’appel de base permet à l’utilisateur de trier les lectures de séquence basées sur la taille. Les fichiers FASTQ peuvent être analysées via BLAST (NCBI) ou d’autres programmes de bio-informatique.
Résultats
La technologie de conception et nanopore expérimentale a fourni une méthode rapide et peu coûteuse pour les étudiants à séquencer l’ADN de sol. Le terme représentant passé les paramètres de contrôle de qualité avec plus de 800 disponibles pour le séquençage des pores. La course a entraîné plus 125 000 lectures disponibles pour l’étude d’une longueur de séquence médian de 5,38 kb. Séquences bénéficient d’un niveau de qualité et seulement ces séquences avec une note acceptable ont ensuite été analysées. Comme la sortie du séquençage réaction est au format FAST5, qui n’est pas acceptée par des programmes tels que BLAST (NCBI), les séquences ont été lus dans la visionneuse HDF qui convertit les séquences au format FASTQ, qui est compatible pour l’analyse de l’explosion. À l’avenir les itérations du logiciel, les données seront disponibles dans un format FASTQ, éliminant le besoin de la visionneuse HDF. Voir complémentaires chiffres 1, 2 et 3.
Cinquante séquences de longueur de plus de 350 nucléotides ont fait l’objet de l’analyse par BLASTN (nucléotides sur base de données de séquences de nucléotides) ou BLASTX (nucléotides traduits en séquence d’acides aminés) (NCBI) pour identifier les organismes dans l’échantillon de sol. Compte tenu du temps des contraintes de la classe et que le cours porte sur les méthodes de laboratoire et pas de bio-informatique, nous avons les élèves analyser les séquences au sein de ces paramètres. Nos classes de bioinformatique peuvent utiliser les données pour le développement d’outils d’analyse de pipeline. Ce niveau d’analyse bio-informatique n’est pas couvert dans la classe de laboratoire. Le tableau 1 donne une liste des organismes qui ont été identifiés avec des valeurs de e de moins de 4 e-04. E-les valeurs inférieures à 4 e-04 indiquent généralement, forte similitude entre la séquence d’entrée (requête) et la séquence correspondante. Les organismes identifiés par BLASTN (contre la base de données non redondantes (nr)) sont d’une grande variété d’espèces et sont disponibles pour plus de génomique et les analyses de protéines. Cet échantillon de sol, qui provenait d’un jardin dans le comté de Baltimore, MD n’avait jamais été testé, donc il n’y a pas de données précédents permettant de déterminer quelles seraient les organismes dans le sol. BLASTN analyse (contre la base de données nr) analyse a également indiqué il y a des séquences avec aucune similitude dans la base de données de nr. Pour déterminer si ce sont vraiment de nouvelles séquences, une étude plus approfondie est nécessaire. L’analyse de plusieurs séquences de BLASTX a révélé plusieurs protéines d’organismes non représentés dans l’analyse BLASTN. Le tableau 2 répertorie plusieurs protéines possibles, y compris les endopeptidases et protéines de type ATPases. En utilisant cette bibliothèque de séquences, les étudiants ont la possibilité d’utiliser des outils plus sophistiqués de bioinformatique pour effectuer une analyse plus approfondie, si réalisé par l’instructeur.
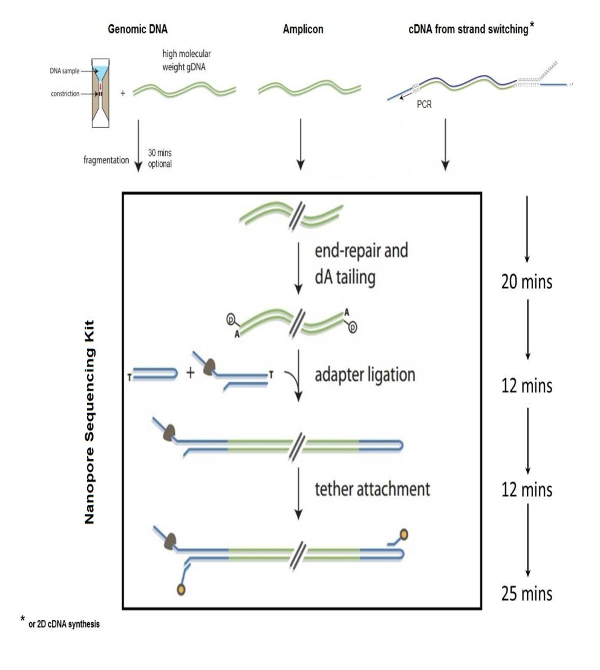
Figure 1 : Préparation de banque génomique. Étapes pour la préparation de la Banque d’ADN génomique pour l’ordonnancement à l’aide de la technologie nanopore. Ce chiffre a été modifié avec les autorisations nécessaires. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 . Schématique du séquençage de l’ADN à l’aide d’un nanopore. ADN en passant à travers une membrane nanopore avec identification de génération et de la base de signal électrique. Ce chiffre a été modifié avec les autorisations nécessaires. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Organisme | valeur de e |
| Streptomyces sp. | 3.00E-06 |
| Nocardoides sp. | 5.00E-04 |
| Gordonia sp. | 5.00E-04 |
| Hyphomicrobium nitrativorens | 1.00E-139 |
| Starkeya novella | 1.00E-31 |
| Hyphomicrobium denitrificans | 1.00E-30 |
| Fibomicrobium sp. | 5.00E-17 |
| Pseudomonas sp. | 2.00E-15 |
| Rhodothemus marinus | 1.00E-17 |
| Turneiella parva | 2.00E-24 |
| E. coli | 0.00E + 00 |
| Bradyrhizobium sp. | 3.00E-30 |
| Gemmatirosa kalamazoonesis | 1.00E-20 |
| Burkholderia sp. | 8.00E-10 |
| Sphingomonas sp. | 8.00E-10 |
| Cellumonas sp. | 6.00E-11 |
Tableau 1 : résultats de l’analyse BLASTN. Séquences d’ADN métagénomique sol soumis à la recherche de similarité BLASTN contre la base de données de nucléotides non redondant de NCBI. Les données rapportées ont e-valeurs de x 4 e-4 ou moins.
| Protéine | Organisme |
| Protéine hypothétique | Bactérie Acidobacter |
| SAM méthyltransférase dépendant | H. denitrificans |
| ATPase | Jannaschia sp. |
| Endopeptidase | Shigella sonnei |
| Protéine de lyse | E. coli |
Tableau 2 : résultats d’analyse BLASTX. Séquences d’ADN métagénomique sol soumis à la recherche de similarité BLASTX contre la base de données de protéine non redondant de NCBI.
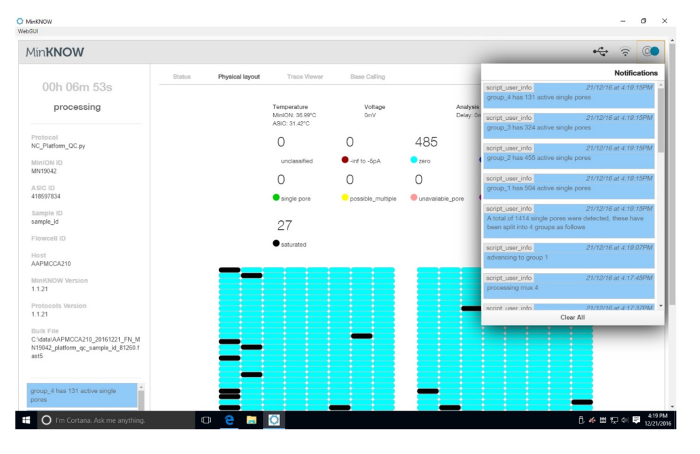
Supplémentaire Figure 1 : résultats plate-forme QC. Les résultats de la plate-forme QC sont présentés. Dans le coin supérieur droit sont les résultats du QC pour les pores actives. Chaque quadrant de la cellule de flux est testé pour les pores actives. La page d’accueil est dynamique et change à mesure que chaque quadrant est testée. Lors de cette exécution, 1 414 pores simples ont été détectés.S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
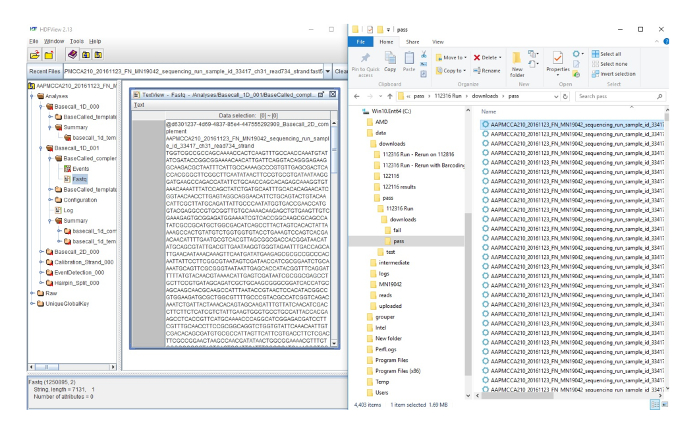
Supplémentaire Figure 2 : fichiers FAST5 convertissant en fichiers FASTQ. Sur le côté droit, voici la sortie des données de la course de séquençage. Chaque ligne représente une séquence individuelle. Le côté gauche de la figure montre la séquence en surbrillance du côté droit, dans la visionneuse HDF qui convertit la séquence dans un fichier FASTQ qui peut être utilisé pour une analyse ultérieure. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
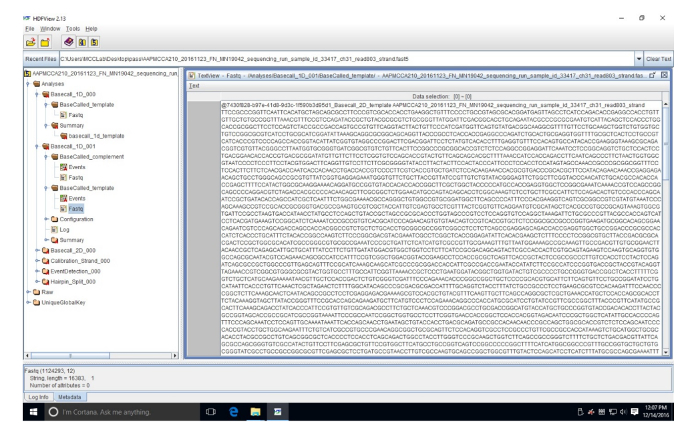
Supplémentaire Figure 3 : séquence d’exemple de FASTQ dans l’observateur d’HDF. Cette séquence (lire 803) est dans un fichier FASTQ qui convertit les données FAST5 en nucléotides. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
De nombreuses méthodes de séquençage génération suivante ont été générés et chacun dépend de séquençage par synthèse, mais les plates-formes de détection pour identifier les nucléotides diffèrent. NS, la plus récente addition au marché, utilise une méthode différente tout à fait, qui ne nécessite pas une réaction de séquençage ou étiqueté nucléotides. Cette méthode tire parti des prime de frais de nucléotides déjà constituées pendant qu’ils traversent un pore électrifié. L’identification de chaque nucléotide se fait par modulation du courant électrique par les différentes bases pendant qu’ils traversent la nanopore. Ce système multiplexé permet à l’utilisateur de nombreux fragments de séquences à la fois. En séquençant les deux brins de l’ADN, l’exactitude de la séquence s’accroît et le logiciel de séquençage, ce qui peut être chargé sur un ordinateur portable, traite les signaux et fournit les informations de séquence qui peuvent être analysées.
Dans pyrosequencing, un séquençage par la méthode de synthèse (SBS), détection de la base spécifique incorporée dans le modèle dépend de l’analyse de luciferase et la génération de signaux par chimiluminescence8. Dans le séquençage d’ion de semi-conducteur, l’ion d’hydrogène libérée, ce qui diminue le pH est détectée par un capteur d’ion9. Séquençage en temps réel de l’unique molécule dépend le zéro mode wave guide (ZMW)10, qui s’allume pour la détection d’une molécule fluorescente taggée pour le nucléotide incorporé. SBS utilise une méthode unique pour amplifier l’ADN cible, telle que les grappes de séquences uniques sont générés13. Détection du nucléotide ajouté est obtenue quand la fluorescence des nucléotides marqués est enregistrée. NS a en revanche un avantage unique par rapport aux autres méthodes car il nécessite des moyens techniques limités, est portable, produit depuis longtemps des lectures de séquençage, n’exige aucun préalable amplification de l’ADN et peut être commandé à un coût réduit par rapport aux autres méthodes. Nos étudiants trouvent le protocole de préparation bibliothèque plus récente, rapide simple et se prêtent à une classe de laboratoire de trois heures. Certaines des questions que nous avons rencontrés étaient des bulles dans la cellule de flux qui ont été difficiles à enlever, il a fallu puissance informatique significative (un téraoctet de stockage), le courant de la sortie de données est dans un fichier FAST5 et la cellule d’écoulement de séquençage a une durée de vie limitée avant elle se détériore. En outre, les autres inconvénients du protocole NS ligature séquençage (protocole long) est qu’il nécessite plusieurs étapes de préparation de bibliothèque, nécessite une expertise dans les techniques de biologie moléculaire et génère la fidélité de séquençage réduit par rapport à certains méthodes de séquençage3. Toutefois, les progrès récents avec le nouveau kit de préparation rapide bibliothèque nécessite seulement 10 min pour la préparation de la bibliothèque et a démontré un taux d’erreur de séquençage réduit. La nouvelle méthode de préparation de bibliothèque était très favorable pour une utilisation dans une classe de laboratoire.
Il y a plusieurs étapes cruciales dans le protocole, en particulier dans le CQ de la cellule de flux. Cela inclut effectuant un QC initial dans les cinq jours suivant la réception de la cellule de flux et de leur utilisation dans les 8 semaines. Bien que nous avons utilisé des cellules d’écoulement qui étaient au delà de 8 semaines, le nombre de pores ouverts et actifs est grandement réduit. Il est important que les expériences sont prévues pour s’adapter à un scénario où une utilisation maximale des cellules flux est atteint. Nous avons utilisé le protocole de nettoyage et réutilisé les cellules d’écoulement avec succès.
Enquête sur la métagénomique de représentent un réservoir génétique inexploité de la diversité microbienne de la sol. Par exemple, un gramme de sol estime contiennent entre 107 - 109 cellules procaryotes14. En outre, les organismes du sol sont une source principale de nouveaux produits naturels, enzymes et d’antibiotiques. Ainsi, l’analyse des séquences ADN sols métagénomique représente un outil pédagogique précieux pour les étudiants à tous les niveaux de l’éducation. La technologie NS facilité d’utilisation et de faible coût faire ce système un outil pédagogique très efficace. Les élèves peuvent séquencer les échantillons environnementaux et à la fin de la séquence, utilisez outils bioinformatiques disponible pour identifier et caractériser les séquences de microbes et métagénomique dans des échantillons de test. Utilisant la technologie de NS, étudiants ont une expérience pratique véritable, qui a jusqu'à maintenant été de rejoindre destiné aux cours de laboratoire en raison de l’expertise technique de pointe et des coûts élevés de réactif, équipement et entretien dans les autres plateformes de séquençage. Récemment, un de nos étudiants (J. Harrison, communication personnelle) a signalé l’utilisation de cette technologie dans un projet de surveillance environnementale des sols agricoles. Nous attendons qu’il y aura beaucoup plus d’applications de cette technologie dans l’espace de l’éducation.
Déclarations de divulgation
Les auteurs n’ont aucune divulgation.
Remerciements
Ce projet a été prise en charge en partie par l’Université Johns Hopkins, Bureau du prévôt à travers la passerelle Science Initiative.
matériels
| Name | Company | Catalog Number | Comments |
| Thermal Cycler | LifeECO | BTC42096 | |
| Covaris g-TUBE | Covaris | 520079 | |
| NEBNext End Repair Module | New England BioLab | E7546 | |
| Eppendorf LoBind Centrifuge Tubes | Sigma-Aldrich | Z666505 | |
| NEB Blunt/TA Ligase Master Mix | New England BioLab | MO367 | |
| MyOne C1 Strepavidin Beads | Thermo Fisher | 65001 | |
| Eppendorf microcentrifuge | Eppendorf | Model 5420 | |
| Nanodrop UV spectrophotometer | Thermo Fisher | ND-2000 | Model 2000 |
| Belly Dancer Orbital Shaker | Sigma-Aldrich | Z768499 | |
| Power Soil DNA Isolation Kit | MO BIO | 12888-50 | |
| Ligation Sequencing Kit 2D | Oxford Nanopore | SQK-LSK208 | |
| Rapid Sequencing Kit for Genomic DNA | Oxford Nanopore | SQK-RAD002 | |
| End-Prep Reaction Buffer and enzyme mix (NEB Blunt/TA Ligase Naster Mix) | New England BioLab | MO367 | |
| AmPure XP Magnetic Beads | Beckman Coulter | A63880 | |
| Basic Starter Pack | Oxford Nanopore | Includes MinION Sequencing Device and Flow Cell | |
| MinKNOW software | Oxford Nanopore | ||
| Rapid Sequencing Kit for Genomic DNA | Oxford Nanopore | SQK-RAD002 | Includes Running Buffer with Fuel (RBF), Fragmentation Mix (FRM) Rapid Adapter (RAD) Library Lodaing Beads (LLB) |
Références
- Quick, J., et al. Real-time, portable genome sequencing for Ebola surveillance. Nature. 530 (7589), 228-232 (2016).
- Greninger, A. L., et al. Rapid metagenomics identification of viral pathogens in clinical samples by real-time nanopore sequencing analysis. Genome Med. 7, 99 (2015).
- Quick, J., et al. Rapid draft sequencing and real-time nanopore sequencing in a hospital outbreak of Salmonella. Genome Biology. 16, 114 (2015).
- Ashton, P. M., et al. MinION nanopore sequencing identifies the position and structure of a bacterial antibiotic resistance island. Nat Biotechnol. 33, 296-300 (2015).
- Loman, N. J., Quick, J., Simpson, J. T. A complete bacterial genome assembled de novo. using only nanopore sequencing data. Nat Method. 12, 733-735 (2015).
- Hoenen, T., et al. Nanopore Sequencing as a Rapidly Deployable Outbreak Tool. Emerg Infect Dis. 22 (2), 331-334 (2016).
- Petrosino, J. F., Highlander, S., Luna, R. A., Gibbs, R. A., Versalovic, J. Metagenomic pyrosequencing and microbial identification. Clin Chem. 55 (5), 856-866 (2009).
- Cummings, P. J., Ahmed, R., Durocher, J. A., Jessen, A., Vardi, T., Obom, K. M. Pyrosequencing for Microbial Identification and Characterization. J. Vis. Exp. (78), e50405 (2013).
- Rothberg, J. W., et al. An integrated semi-conductor device that enabling non-optical genome sequencing. Nature. 475, 348-352 (2011).
- Levene, M. J., Korlach, J., Turner, S. W., Foquet, M., Craighead, H. G., Webb, W. W. Zero-mode Waveguides for Single-Molecule Analysis at high concentrations. Science. 299, 682-686 (2003).
- Eid, J., et al. Real-Time DNA Sequencing from Single Polymerase Molecules. Science. 323, 133-138 (2009).
- Stoddart, D., Heron, A. J., Mikhailova, E., Maglia, G., Bayley, H. Single-nucleotide discrimination in immobilized DNA oligonucleotides with a biological nanopore. PNAS. 106, 7702-7707 (2009).
- Shendure, J., Hanlee, J. Next generation DNA sequencing. Nat Biotechnol. 26, 1135-1145 (2008).
- Daniel, R. The Metagenomics of Soil. Nat Rev Microbiol. 3, 470-478 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon