需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
行为小鼠海马空间受限振荡的记录
摘要
该协议描述了用多柄线性硅探针记录局部场电位的情况。利用电流源密度分析转换信号, 可以重建小鼠海马区的局部电活动。利用这种技术, 可以在自由运动小鼠中研究空间限制的脑振荡。
摘要
局部场电位 (LFP) 是通过神经膜的离子运动而产生的。由于 LFP 电极所记录的电压反映了大量脑组织的电场, 提取有关当地活动的信息具有挑战性。然而, 研究神经元集成电路需要对真正的局部事件和来自遥远脑区的体积传导信号进行可靠的区分。电流源密度 (CSD) 分析通过提供有关电极附近的电流汇和源的信息, 为这个问题提供了解决方案。在具有层流细胞构筑的脑区, 如海马, 可通过估计 LFP 的第二空间导数来获得一维 CSD。在这里, 我们描述了一个方法, 记录 multilaminar LFPs 使用线性硅探针植入到背海马。惩教署的踪迹沿探头的个别柄计算。该协议描述了一种解决自由移动小鼠海马空间受限神经元网络振荡的方法。
引言
LFP 中的振荡在神经回路的信息处理中有重要的介入。它们涵盖了广泛的频率范围, 从慢波 (1 赫兹) 到快速脉动振荡 (~ 200 赫兹)1。不同频段与认知功能相关, 包括记忆、情感处理和导航2、3、4、5、6、7。电流在神经元膜上的流动构成了 LFP 信号8的最大部分。阳离子进入细胞 (例如通过激活谷氨酸兴奋突触) 代表一个活跃的电流接收器 (电荷离开胞外培养基)。相比之下, 正电荷对胞外介质的净流量, 例如通过激活 GABAergic 抑制突触, 描述了该位置的活动电流源。在神经元偶极子中, 电流汇与被动源成对, 反之亦然, 因为补偿电流影响到远处的膜电荷。
由远程神经过程产生的电场也可能导致记录电极上的电压偏转相当大, 因此可能被错误地认为是局部事件。这种体积传导对 LFP 信号的解释构成了严重的挑战。惩教署的分析提供有关本地电流汇和 LFP 信号来源的资料, 因此包括减少体积传导8的影响的方法。在层状结构, 如海马体, 一维的 CSD 信号可以获得的第二空间导数的 LFP 记录从等距电极安排垂直于层流平面9。商用线性硅探针的问世使研究人员得以利用 CSD 方法研究海马区的局部振荡活动。例如, 已经证明, 不同的伽玛振荡在 CA1 区10中以特定层的方式出现。此外, 惩教署的分析已确定的独立热点的伽玛活动在主细胞层的齿状回11。重要的是, 这些发现只在当地的惩教署, 而不是 LFP 的信号中可见。因此, 惩教署的分析提供了一个强有力的工具, 以获得洞察的电路操作海马。
在本协议中, 我们提供了一个全面的指南, 以获得一维的 CSD 信号与硅探针。这些方法将使用户能够调查行为小鼠海马区内的局部振荡事件。
研究方案
所有涉及活体动物的方法都已根据《德国动物福利法》获得 Regierungspräsidium 弗赖堡的批准。
1. 筹备工作
- 设计和建立一个适当的插入工具瞬时携带硅探针和电极连接器在植入过程中。有关自定义内置插入工具的示例, 请参见图 1 。
- 小心地释放硅探针和电极连接器从其包装使用陶瓷尖钳。
- 提起连接板, 并安全地修复它与一个连接到一个立场的鳄鱼钳。
- 使用立体镜, 将探头与插入工具与陶瓷尖钳对准。用一 cauterizer 熔化的2毫米石蜡层将探针粘在插入工具上。在这个过程中注意不要接触探针小腿。
- 使用标准胶带将电极连接器固定在插入工具的轴上。请注意, 根据制造商的情况, 接地线可能需要焊接到电极连接板之前植入。用焊料 (400 °c) 的锡焊料, 从两个短的清漆绝缘铜线中去除绝缘。将地线焊接到电极接头板中适当的插槽上。
- 除去两块铜线的绝缘。在不锈钢螺丝 (1 毫米直径, 2 毫米长度) 周围环绕每根裸铜线三次。适用于焊接钢的焊剂, 并将铜线焊接到螺钉盖的底部。确保螺纹的下半部分保持无锡焊料。
- 使用标准万用表检查电线和螺钉之间的电接触。
- 通过浸泡70% 乙醇 (十年代) 对硅探针和地面螺钉的柄进行消毒。
- 通过将一个塑料巴斯德吸管的头部切开一半, 为探针植入物准备一个保护罩。
2. 植入手术
- 用热珠灭菌器消毒手术器械 (剪刀、细尖钳、手术钳)。用70% 乙醇擦拭所有表面。
- 3% 异氟醚在1升/分的氧气中诱导麻醉。
- 为维护, 使用 1-1.5% 异氟醚。请注意, 达到手术耐受性所需的异氟醚浓度可以从动物到动物不等。
- 当动物无法对脚趾捏起反应时, 就能实现稳定的手术耐受。监测鼠标的呼吸速率, 并在必要时调整异氟醚的浓度。
- 在动物的眼睛上涂抹药膏以防止干燥。
- 轻轻地将耳棒插入耳道, 将鼠标装入立体定向的框架中。一旦鼠标的头部由耳棒稳定, 在鼻子上放置一个口片, 连续异氟醚传递。将鼠标放在毛巾上或垫在加热垫上, 并注射丁丙诺啡皮 (0.05-0.1 毫克/千克体重), 以确保术后镇痛。
- 用标准剃须刀剃头, 用70% 乙醇消毒皮肤。使用手术剪刀, 在头骨中线切开皮肤, 用手术钳打开皮肤。
- 将动物头部与立体定向对齐工具的帮助对准 bregma 和 lambda。在 bregma 和 lambda 之间应该有小于50µm 的高度偏移量。此外, 沿 mediolateral 轴水平测量头部的深度从 bregma 在定义的距离左和右 (例如, 1 毫米左和右 bregma)。如有必要, 调整头部倾斜。
- 用3% 过氧化氢清洁头部, 用无菌的棉抹布擦拭乾燥。
- 使用适当的立体定向图谱12确定开颅术相对于 bregma 的位置。
- 使用0.9 毫米钻头, 在小脑骨上钻两个螺钉孔, 放置地面和参考螺钉。此外, 1-3 孔的锚固螺钉是可取的, 以稳定种植体。定位螺钉的位置将取决于开颅手术的位置。对于植入海马, 放置锚螺钉在对侧壁和同侧额叶皮质。使用合适的螺丝刀将螺钉插入骨骼。注意不要穿透大脑。
- 执行开颅手术, 慢慢细化头骨与演习在一个矩形区域周围的植入一侧。经常用灭菌的磷酸盐缓冲剂 (PB) 滋润骨骼。剩下的瘦头骨可以用细 (27G) 注射针和一双镊子轻轻刺穿并取出。
- 用薄 (27G) 注射针仔细刺穿硬脑膜。通过用一双镊子弯曲针尖, 并拉硬脑膜去除, 形成一个小钩子。应用 PB 防止大脑表面干燥。
- 将电极插入工具安装在一个立体定向的支架上, 将探头移到 bregma 上, 并将探头移动到所述开颅手术的立体定位坐标上。慢慢地穿透大脑表面。请确保探头轴不弯曲。避免通过血管植入。
- 慢慢降低探头直到200µm 在所需深度以上。用灭菌的凡士林盖住硅探针的开颅和小腿以保护。应用牙科水泥将探头的底座固定在颅骨的锚固螺钉上。
- 在水泥应用之后, 慢慢地将探头移至目标深度。在水泥应用后推进最后的200µm, 减少了探针的侧向运动, 确保了靶区组织损伤最小。请注意, 使用的水泥固化时间会影响协议的这一步骤。用快速固化水泥, 省略此步骤, 直接将探头植入目标深度, 以避免对硅探针的损坏。
- 水泥固化后, 用 cauterizer 将蜡熔化, 从插入工具中释放探针。
- 将连接器板从插入设备上松开, 并将其放置在头骨的适当位置, 使用附着在插入手柄上的鳄鱼钳。如果探头植入海马, 将连接器板放在侧壁骨上。用牙科水泥将连接板固定在头骨上。
- 将连接器板的地线和参考线焊接到连接在小脑上的两个螺钉上的导线上。
- 将防护罩修剪到正确的高度, 并将其置于硅探针上。用牙科水泥把盖子固定在连接板和头骨上, 避免裸露头骨周围的皮肤。通常不需要在植入部位周围缝合皮肤。
3. 手术后的恢复
- 应用适当的镇痛治疗至少2天 (如皮下注射丁丙诺啡每6小时在白天和在饮用水中过夜结合卡洛芬 (4-5 毫克/千克体重) 每 24 h)。建议单壳防止对植入物造成损害。
- 允许至少一周的恢复。与当地动物福利指南进行协商。
4. 数据采集
- 记录 LFPs 从自由移动的小鼠使用一个适当的数据采集系统通过换向器连接。要获取 LFPs, 请使用 1-5 赫的采样频率。如果单单元放电与 LFP 一起记录, 则需要较高的采样率 (20-30 赫)。
- 存储单个通道的原始记录文件以进行离线分析。
5. 组织学
- 录音完成后, 深麻醉动物 (如2 克/千克体重聚氨酯注射腹腔)。通过对脚趾捏缺乏反应来确认麻醉状态。
- 灌注老鼠 transcardially 与冰冷磷酸盐缓冲盐水 (~ 1 分钟) 跟随4% 多聚甲醛 (~ 10 分钟) 使用标准心内灌注方法13。在灌注前, 记录站点的电解毁损可能通过执行 (例如, 通过应用 10-20 V 的恒定电压, 最多1秒)。另外, 在植入前, 使用的荧光染料可以用来追踪识别。建议采用不同类型的硅探针检测电极位置的各种识别方法, 以获得最佳结果。
- 切脑部分 (~ 100 µm) 和染色切片与 4 '-6-diamidino 2-苯基吲哚 (DAPI, 1 µg/毫升) 后, 三洗涤步骤 PB (每10分钟室温)。
- 将切片放在显微镜幻灯片上, 应用嵌入介质的一滴, 并用盖子滑动覆盖截面。让嵌入介质在室温下隔夜干燥。
- 使用荧光或共焦激光扫描显微镜, 确定记录站点的位置。
- 要想进一步使用硅探针, 请用一个鳄鱼钳握住探针, 然后用烙铁 (400 °c) 小心地将牙科水泥熔化, 从而释放探针。在这个过程中注意不要接触探针柄!
- 在热蒸馏水 (80 °c, 15 分钟) 内冲洗探针, 然后用酶溶液 (1% Tergazyme 在蒸馏水中, 室温30分钟) 和蒸馏水中的另一洗涤步骤 (15 分钟)。请注意, 探针恢复的成功率很低。
6. 惩教署分析
- 使用适当的分析环境 (如Python), 将单个小腿的 LFP 数据转换为 CSD, 方法是将小腿上的第二个空间导数近似为
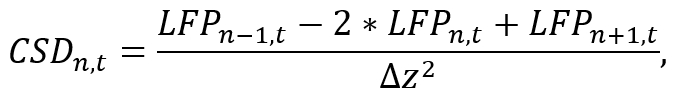
当LFPn, t 是n次电极上的 LFP 信号时t和Δz是电极间间距。请注意, 由于n-1 和n+1 操作, 不能估计小腿的第一和最后电极的 CSD, 在探针安置期间必须考虑到。使用代码的短段来实现近似公式, 在迭代期间计算每个电极的 CSD 信号 (请参见补充代码文件)。 - 使用获得的 CSD 信号进行进一步分析 (例如,通过应用带通滤波器研究脑振荡的特定频段)。
结果
图 1说明了插入工具用于硅探针的植入。图 2显示了长期植入的硅探针靶向 CA1 区和齿状回颗粒细胞层的记录。我们在 homecage 的自由运动过程中记录了探针柄 LFPs。为了最小化体积传导的影响, 所得到的信号被转换为 CSD 沿探针的每个柄 (图 2B, D)。在图 2B所示的第一个例子?...
讨论
增加的证据表明, 海马神经元电路的脑振荡发生在离散空间域10,11,16。CSD 分析大大降低了容积传导的影响, 是研究局部振荡事件的重要前提。通过这个视频, 我们提供了一个指南, 以植入小鼠海马的硅探针, 以分析惩教署的数据。我们展示了 CA1 中尖锐波波纹和齿状回局部伽玛振荡信号的代表性例子。然而, 这个协议也可以用来研?...
披露声明
作者没有什么可透露的。
致谢
我们感谢凯琳温特哈尔特和 Kerstin Semmler 的技术援助。这项工作得到了德国研究基金会 BrainLinks-BrainTools (激动 1086) 的杰出群体的支持。
材料
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
参考文献
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。