A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הקלטה במרחב מוגבל תנודות בהיפוקמפוס מתנהגים באופן עכברים
In This Article
Summary
פרוטוקול זה מתאר את ההקלטה של פוטנציאל שדה מקומי עם רב shank סיליקון ליניארי רגשים. המרה של האותות באמצעות ניתוח צפיפות המקור הנוכחי מאפשר השחזור של הפעילות החשמלית המקומית בהיפוקמפוס העכבר. בטכניקה זו, תנודות המוח מוגבל יכול להילמד במעבר בחופשיות עכברים.
Abstract
הפוטנציאל שדה מקומי (LFP) מתגלה מתנועות יון מעבר ממברנות עצביות. מאז המתח שהוקלט על ידי אלקטרודות LFP משקף את השדה החשמלי מסוכם של כמויות גדולות של רקמת המוח, חילוץ מידע אודות פעילות מקומית הוא מאתגר. עם זאת, למדתי מתוכנת עצביים, דורש הבחנה אמין בין אירועים מקומיים באמת כמנצח נפח אותות שמקורם באזורים מרוחקים המוח. הניתוח הנוכחי של צפיפות (CSD) מקור מציע פתרון בעיה זו על-ידי מתן מידע על כיורים הנוכחי ועל מקורות באזור האלקטרודות. באזורים במוח עם למינריות cytoarchitecture כגון ההיפוקמפוס, CSD חד-ממדי ניתן להשיג על ידי הערכת המרחבי הנגזרת השנייה של LFP. כאן, אנו מתארים שיטה LFPs multilaminar הרשומה באמצעות סיליקון ליניארי הגששים מושתל לתוך ההיפוקמפוס הגבי. עקבות CSD מחושבים לאורך שאנקס בודדים של המכשיר. פרוטוקול זה ובכך מתאר הליך כדי לפתור תנודות מוגבל ברשת עצביים בהיפוקמפוס לנוע בחופשיות עכברים.
Introduction
תנודות ב- LFP מעורבים באופן ביקורתי מידע עיבוד על ידי מעגלים עצביים. הם מכסים מגוון רחב של תדרים, ועד גלים איטיים (~ 1 Hz) ריפל במהירות תנודות (~ 200 Hz)1. תדירות ברורים להקות הקשורים עם תפקודים קוגניטיביים, כולל זיכרון, עיבוד רגשי של ניווט2,3,4,5,6,7. הזרימה הנוכחית מעבר ממברנות עצביים מהווה את החלק הגדול ביותר של האות LFP8. קטיונים הזנת התא (למשל באמצעות הפעלה של הסינפסות סינאפסות glutamatergic) מייצגים כיור הנוכחי פעיל (כמו תשלום משאיר המדיום חוץ-תאית). לעומת זאת, זרימה נטו של מטען חיובי למדיום חוץ-תאית, למשל על-ידי הפעלה של GABAergic הסינפסות מעכבות, מתארת מקור הנוכחי פעיל במיקום זה. ב הדיפולים עצביים, כיורים הנוכחי ניתן לזווג עם מקורות סביל ולהפך עקב קיזוז הזרמים המשפיעים על קרום תשלום באתרים מרוחקים.
השדה החשמלי שנוצר על-ידי תהליכים עצביים מרחוק יכול גם לגרום מתח ניכר deflections על אלקטרודה הקלטה, עשויות ובכך באופן כוזב להיחשב כאירוע מקומי. הולכה נפח זה מהווה אתגר רציני הפרשנות של אותות LFP. ניתוח CSD מספק מידע אודות כיורים הנוכחי מקומיים ומקורות שבבסיס LFP אותות ולכן כוללת אמצעים כדי להפחית את ההשפעה של אמצעי האחסון הולכה8. במבנים למינציה כמו ההיפוקמפוס, ניתן לקבל אותות CSD חד-ממדי הנגזרת המרחבית השנייה של LFP להקליט מ קו מקביל אלקטרודות המסודרים בניצב מטוסים למינריות9. כניסתו של הגששים סיליקון ליניארי זמינים מסחרית אפשרה לחוקרים לנצל את השיטה CSD לצורך המחקר של תנודה המקומי פעילות ההיפוקמפוס. לדוגמה, זה הוכח כי תנודות גמא ברורים להגיח באופן ספציפי שכבה באזור CA110. יתר על כן, ניתוח CSD זיהה עצמאית נקודות חמות של פעילות גמא בשכבה התא העיקרי של הפיתול משוננת11. חשוב לציין, ממצאים אלה היו רק לכאורה CSD המקומי, אבל לא LFP אותות. ניתוח CSD ובכך מספק כלי רב עוצמה כדי לקבל תובנה בפעולות microcircuit של ההיפוקמפוס.
ב פרוטוקול זה, אנו מספקים מדריך מקיף כדי לקבל אותות CSD חד-ממדי עם סיליקון הגששים. שיטות אלה יאפשר למשתמשים לחקור אירועים תנודה מקומי בהיפוקמפוס של עכברים להתנהג.
Protocol
כל השיטות המערבות בעלי חיים החיים אושרו על-ידי פרייבורג Regierungspräsidium לפי חוק רווחת בעלי חיים גרמנית.
1. תכשירים
- לתכנן ולבנות כלי הכניסה המתאים transiently נושאת את החללית הסיליקון ואת המחבר אלקטרודה במהלך תהליך ההשתלה. לקבלת כלי מותאם אישית הכניסה בנוי דוגמה, ראה איור 1 .
- בזהירות לשחרר את הסיליקון החללית ואת אלקטרודה מחבר מאריזתו באמצעות מלקחיים שקצהו קרמיקה.
- הרם את לוח מחבר, בצורה מאובטחת לתקן אותו עם מלחציים תנין המצורפת עמדה.
- שימוש של סטריאוסקופ, יישר את המכשיר בעזרת הכלי הכניסה עם מלקחיים שקצהו קרמיקה. למרוח שכבה ~ 2 מ מ של פרפין שעווה מומסת עם cauterizer להדביק את החללית ההכנסה לכלי. הקפידו לא נוגעים של שנקס בדיקה במהלך הליך זה.
- לתקן את מחבר אלקטרודה מוט של הכלי ההכנסה באמצעות דבק רגיל. שימו לב כי בהתאם ליצרן, חוטים הקרקע שאולי צריך להיות מולחמים את לוח מחבר אלקטרודה לפני ההשתלה. הסר את הבידוד של שני קטעים קצרים של חוטי נחושת בידודי לכה באמצעות פח-הלחמה להחיל עם מלחם (400 מעלות צלזיוס). הלחמה החוטים הקרקע כדי החריצים המתאימים בלוח מחבר אלקטרודה.
- הסר את הבידוד של שני חלקים נוספים של חוטי נחושת. לעטוף כל חוט נחושת חשוף שלוש פעמים סביב בורג פלדה אל חלד (בקוטר 1 מ"מ, 2 מ מ אורך). החל שטף מתאים הלחמה פלדה, הלחמה חוט הנחושת לחלק התחתון של הכיפה בורג. לוודא כי בתחתית חצי מהשרידים חריטה ללא פח-הלחמה.
- השתמש multimeter רגיל כדי לבדוק קשר חשמלי בין חוט בורג.
- לחטא את שאנקס של החללית סיליקון, את הברגים הקרקע על ידי טבילה 70% אתנול (10 s).
- להכין כיסוי מגן השתל בדיקה על ידי חיתוך ראש פלסטיק פסטר פיפטה לשניים.
2. ניתוח ההשתלה
- לחטא כלי כירורגי (מספריים, מלקחיים שקצהו פיין, מלחציים כירורגי) עם מעקר חרוז חם. למחוק את כל המשטחים עם 70% אתנול.
- לגרום הרדמה עם איזופלוריין 3% חמצן וכשאשר L ~ 1/min.
- לשימוש תחזוקה, 1-1.5% איזופלוריין. שימו לב כי ריכוז איזופלוריין הדרוש להשגת עמידות כירורגי יכול להשתנות חיה חיה.
- סובלנות כירורגי יציב מושגת כאשר החיה מצליח להגיב צובט את הבוהן. את קצב הנשימה של העכבר ולהתאים את ריכוז איזופלוריין במידת הצורך.
- להחיל משחה לעיניים של החיה כדי למנוע ייבוש.
- לטעון את העכבר בתוך מסגרת stereotaxic בהוספת סורגים האוזן בעדינות לתוך תעלת האוזן. לאחר בראש של העכבר מתייצב בסורגים האוזן, הצב חתיכה הפה מעל החוטם למסירה איזופלוריין מתמשך. הצב את העכבר על מגבת או כרית מעל כרית החימום ולהזריק. הבופרנורפין subcutaneously (0.05 - 0.1 מ"ג/ק"ג משקל גוף) כדי להבטיח נגד כאבים לאחר הניתוח.
- לגלח את הראש מכונת הגילוח סטנדרטי, לחטא את העור עם 70% אתנול. באמצעות מספריים כירורגיים, בחתך לתוך העור לאורך הקו האמצעי של הגולגולת ופתח את העור בעזרת תופסנים כירורגי.
- יישור ראש החיה בעזרת כלי היישור stereotaxic כדי bregma ברמה של למדא. צריך להיות פחות מ- 50 מיקרומטר בהיסט גובה בין bregma למדא. יתר על כן, רמת הראש לאורך הציר mediolateral על ידי מדידת העומק של bregma-הגולגולת על פני השטח-מוגדרים מרחקים ימינה ושמאלה (למשל, 1 מ מ שמאל ואת הזכות של bregma). כיוון ההטיה של הראש במידת הצורך.
- לנקות את הראש עם 3% חמצן, לנגב היבש עם מגבונים סטריליים כותנה.
- לקבוע את המיקום של הניתוח ביחס bregma שימוש הולם אטלס stereotaxic12.
- באמצעות ראש המקדחה 0.9 מ מ, תרגיל שני חורי הברגים העצם על המוח הקטן למיקום הברגים הקרקע והפניה. בנוסף, 1-3 חורים עגינת הברגים הם רצוי לייצב את השתל. המיקום של ברגי עיגון יהיה תלוי המיקום של הניתוח. עבור ההשתלה בהיפוקמפוס אל הצב בורגי עיגון מעל קליפת חזיתית הקודקוד ואת חולשת contralateral. הכנס את הברגים העצם באמצעות מברג מתאים. הקפידו לא לחדור לתוך המוח.
- לבצע את הניתוח על ידי דילול לאט את הגולגולת עם התרגיל באזור מלבני מהצד השרשה. לעתים קרובות להרטיב את העצם עם מאגר פוספט סטיריליים (PB). הגולגולת ורקמת הנותרים יכולים להיות בעדינות פירסינג והוציאו בעזרת מחט ההזרקה (27 גרם) בסדר גמור וזוג פינצטה.
- בזהירות פירס קרום הדורה עם מחט דקה של הזרקה (27 גרם). טופס קרס קטנה על-ידי כיפוף קצה המחט עם זוג מספריים ומשוך את דורא להסרת. החל PB כדי למנוע את פני השטח של המוח ממנו להתייבש.
- הר הכלי ההכנסה אלקטרודה על בעל stereotaxic, אפס את המכשיר על bregma, וזוזי החללית לקואורדינטות stereotaxic הניתוח אט-אט לחדור את פני השטח של המוח. ודא שהמוטות בדיקה לא מתכופף. הימנע להשתיל דרך כלי הדם.
- הורידו לאט את המכשיר עד מיקרומטר ~ 200 מעל העומק הרצוי. מכסים את הגולגולת ואת שאנקס של המכשיר סיליקון עם וזלין סטיריליים להגנה. החל מלט שיניים כדי לתקן את הבסיס של המכשיר כדי הבורג עגינת בגולגולת.
- מיד לאחר יישום מלט, לאט הניעו את החללית אל העומק היעד. קידום של מיקרומטר אחרונה 200 ~ לאחר היישום של הצמנט מפחית לרוחב תנועת החללית ומבטיחה נזק מינימלי לרקמות באזור המטרה. שימו לב כי הזמן ריפוי של הבטון המשמש יכול להשפיע על שלב זה של הפרוטוקול. עם במהירות ריפוי מלט, להשמיט את שלב זה, ישירות שתל החללית לעומק היעד כדי למנוע נזק החללית סיליקון.
- לאחר ריפאה הבטון, שחרר את החללית של הכלי הכניסה על ידי המסת השעווה עם cauterizer.
- לשחרר את לוח מחבר מהמכשיר ההכנסה והצב אותו למקום מתאים על הגולגולת באמצעות מלחציים תנין מחוברת ידית ההכנסה. במקרה של בדיקה ההשתלה בהיפוקמפוס אל המקום את לוח מחבר על בדופן העצם contralateral. לתקן את לוח מחבר לגולגולת באמצעות מלט שיניים.
- הלחמה את החוטים הקרקע והפניה של הלוח מחבר לרדיו המצורפת את שני הברגים על המוח הקטן.
- לקצץ את מכסה מגן בגובה הנכון ומניחים אותו מעל החללית סיליקון. לתקן את מכסה לוח מחבר ואת הגולגולת באמצעות מלט שיניים, הימנעות העור סביב הגולגולת חשוף. תפירת העור סביב אתר ההשתלה בדרך כלל לא נדרש.
3. ההחלמה לאחר הניתוח
- החל הטיפול המתאים להרגעה לפחות 2 ימים (למשל זריקות תת עורית של הבופרנורפין כל 6 שעות במהלך היום, במי השתייה בן לילה בשילוב עם carprofen (4-5 מ"ג/ק"ג משקל גוף) subcutaneously כל 24 שעות). יחיד-דיור מומלץ כדי למנוע נזק השתל.
- אפשר לפחות שבוע להתאוששות. התייעץ עם הנחיות רווחת בעלי חיים מקומיים.
4. קירור והקפאה
- LFPs שיא לנוע בחופשיות עכברים באמצעות מערכת רכישת נתונים מתאימים מחוברים דרך קומוטטור. לרכוש LFPs, השתמש תדר דגימה של 1-5 קילו-הרץ. שיעור דגימה גבוה יותר (20-30 kHz) נדרשים אם יחידה אחת הפרשות שיירשמו יחד עם LFP.
- לאחסן קבצי raw הקלטה של והערוצים לניתוח במצב לא מקוון.
5. היסטולוגיה
- לאחר השלמת ההקלטה, עמוק עזים ומתנגד החיה (למשל 2 g/kg הגוף משקל urethane מוזרק intraperitoneally). לאשר המדינה הרדמה על ידי חוסר תגובה שאורך צובט.
- Perfuse transcardially את העכבר עם קרח באגירה פוספט תמיסת מלח (~ 1 דקות) ואחריו 4% paraformaldehyde (~ 10 דקות) באמצעות שיטות זלוף intracardial תקן13. לפני זלוף, lesioning electrolytic האתרים הקלטה אולי על ידי שבוצעה (למשל על-ידי החלת 10-20 V של מתח מתמיד עד 1 s). לחלופין, צבעי פלורסנט חלה על העצות shank לפני ההשתלה יכול לשמש כדי לעקוב אחר זיהוי. בדיקות בשיטות שונות לצורך זיהוי עמדות אלקטרודה כדי להשיג תוצאות אופטימליות עם סוגים שונים של סיליקון הגששים מומלץ.
- לחתוך חלקים במוח (~ 100 מיקרומטר) ו מכתים את הפרוסות עם 4'-6-diamidino-2-phenylindole (דאפי, µg 1/mL) ואחריו שלושה צעדים כביסה ב PB (כל 10 דקות בטמפרטורת החדר).
- במקום הסעיפים על שקופית מיקרוסקופ, להחיל טיפה של הטמעת בינונית ולכסות המקטע עם מכסה. תן את ההטבעה לילה יבש בינוני בטמפרטורת החדר.
- באמצעות epifluorescence או מיקרוסקופ קונפוקלי סריקה בלייזר, לזהות את המיקום של האתרים הקלטה.
- ניסיון שחזור של המכשיר סיליקון להמשך השימוש, להחזיק את המכשיר עם מלחציים תנין ולשחרר את המכשיר מ לחתור בהתכה בקפידה את הבטון שיניים במלחם (400 מעלות צלזיוס). הקפידו לא נוגעים של שנקס בדיקה במהלך הליך זה!
- לשטוף את המכשיר במים מזוקקים חם (~ 80 מעלות, 15 דקות) ואחריו פתרון אנזימטי (1% Tergazyme במים מזוקקים, 30 דקות בטמפרטורת החדר) וצעד נוסף כביסה במים מזוקקים (15 דקות). שימו לב כי שיעור ההצלחה של בדיקה התאוששות נמוך.
6. CSD ניתוח
- באמצעות סביבת ניתוח מתאים (למשל פיתון), המרת הנתונים LFP של shank בודדים כדי CSD על ידי קירוב הנגזרת המרחבית השנייה לאורך הדוקרן כמו
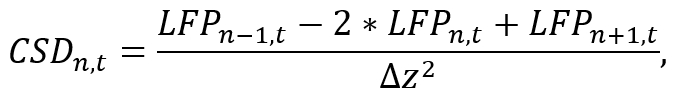
איפה LFPn, t הוא האות LFP על האלקטרודהth nבזמן t וδz המרווח בין אלקטרודה. שים לב כי עקב n-1 פעולות n+1, CSD של האלקטרודות הראשון והאחרון של הדוקרן ניתן לאמוד, אשר צריכה להילקח תחת שיקול במהלך בדיקה השמה. ליישם את הנוסחה קירוב באמצעות קטע קצר של קוד מחשב את האות CSD עבור כל אלקטרודה תוך איטראציה לאורך זמן (ראה קובץ קוד משלים). - השתמש את האות CSD שהושג עבור ניתוח נוסף (למשל, לומדת תדר מסוים להקות של תנודות המוח על-ידי החלת הלהקה לעבור מסננים).
תוצאות
איור 1 מדגימה את הכלי ההכנסה שימוש עבור ההשתלה של הגששים סיליקון. הקלטות סיליקון כרוני מושתל רגשים פילוח האזור CA1, השכבה תא גרגר של הכישור משוננת מוצגים באיור2. הקלטנו LFPs מ שאנקס בדיקה במהלך תנועה חופשית ב homecage. כדי למזער את ההשפעה של אמצעי ה...
Discussion
הגדלת עדויות מציינים כי תנודות המוח במעגלים עצביים בהיפוקמפוס להתרחש דיסקרטית תחומים מרחבי10,11,16. CSD ניתוח מפחיתה באופן דרסטי את השפעת אמצעי הולכה, תנאי חיוני לצורך המחקר של אירועים מקומיים תנודה. עם וידאו זה, אנו מספקים מדריך כדי להשתיל ס?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנחנו אסירי תודה קארין וינטרהאלטר, קרסטין Semmler לקבלת סיוע טכני עבודה זו נתמכה על ידי האשכול של מצוינות BrainLinks - BrainTools (סיפורה ה 1086) של קרן המחקר הגרמני.
Materials
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
References
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved