JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
행동 하는 쥐의 해 마에서 진동 제한 공간 기록
요약
이 프로토콜 로컬 필드 전위 선형 실리콘 프로브 멀티 생크와의 녹음을 설명 합니다. 현재 소스 밀도 분석을 사용 하 여 신호 변환 마우스 해 마에 지역 전기 활동의 개조를 허용 한다. 이 기술을 공간적으로 제한 된 뇌 진동 자유롭게 마우스를 이동에 공부 될 수 있다.
초록
로컬 필드 가능성 (LFP) 신경 세포 막에 걸쳐 이온 움직임에서 나온다. LFP 전극에 의해 기록 된 전압 반영 뇌 조직의 큰 볼륨의 총계 전기 분야, 이후 지역 활동에 대 한 정보를 추출은 도전적 이다. 그러나 공부 신경 칩,, 진정으로 지역 행사 및 볼륨 실시 신호 먼 뇌 영역에서 신뢰할 수 있는 구별을 요구 한다. 현재 소스 밀도 (CSD) 분석 전류 싱크 및 소스 전극 주변에 대 한 정보를 제공 하 여이 문제에 대 한 솔루션을 제공 합니다. 뇌 해 마 같은 층 류 cytoarchitecture와 영역, 1 차원 CSD는 LFP의 두 번째 공간 파생을 추정 하 여 얻을 수 있습니다. 여기, 우리는 기록 multilaminar LFPs 사용 하 여 선형 실리콘 프로브 등 해 마에 이식 하는 방법을 설명 합니다. CSD 추적 조사의 개별 정강이 따라 계산 됩니다. 이 프로토콜은 이렇게 자유롭게 이동 하는 쥐의 해 마에서 공간적으로 제한 된 신경 네트워크 진동 해결 하는 절차를 설명 합니다.
서문
LFP에 진동 정보 신경 회로 의해 처리에 비판적으로 참여 하는. 그들은 주파수, 느린 파도 (~ 1 Hz)에서 빠른 리플 진동 (~ 200 Hz)1의 넓은 스펙트럼을 커버. 고유한 주파수 대역 메모리, 감정 처리와 탐색2,3,,45,,67포함 한 인지 기능으로 연결 됩니다. 신경 세포 막에 걸쳐 전류 흐름 LFP 신호8의 가장 큰 부분을 구성. 입력 셀 (예: glutamatergic 흥분 성의 시 냅 스의 활성화를 통해) 양이온 (충전 나뭇잎 extracellular 매체)로 활성 전류 싱크를 나타냅니다. 반면, 긍정적인 GABAergic 억제 시 냅 스의 활성화에 의해 예를 들면, extracellular 매체의 net 흐름 그 위치에서 활성 전류 소스 묘사. 신경 쌍 극 자에서 전류 싱크 먼 사이트에서 막 요금에 영향을 미치는 전류 보상 때문 수동 소스와 결합 됩니다.
원격 신경 과정에 의해 생산 하는 전기 분야 또한 기록 전극에 상당한 전압 심한 귀 착될 수 있다 하 고 지역 이벤트로 이렇게 거짓으로 간주 될 수 있습니다. 이 볼륨 전도 LFP 신호 해석에 심각한 도전 포즈. CSD 분석 로컬 전류 싱크 및 LFP를 기본 소스에 대 한 정보 신호를 따라서 구성 볼륨 전도8의 영향을 줄이기 위해 수단을 제공 합니다. 해 마 같은 적 층된 구조, 1 차원 CSD 신호 LFP9층 류 평면 수직으로 배열 하는 등거리 전극에서 기록의 두 번째 공간 파생 하 여 얻을 수 있습니다. 상용 선형 실리콘 감지기의 출현 해 마에서 현지 진동 활동 연구를 위한 CSD 메서드를 활용 하는 연구자를 허용 했다. 예를 들어 별개 감마 진동 CA1 지역10층 특정 방식으로 등장할 입증 되었습니다. 또한, CSD 분석이 이랑11주 셀 계층에서 감마 활동의 독립적인 뜨거운 관광 명소를 발견 했다. 중요 한 것은, 이러한 결과 로컬 CSD 하지만 안에 LFP 신호에서만 했다. CSD 분석은 따라서 해 마의 마이크로 회로 작업에 대 한 통찰력을 얻을 수 있는 강력한 도구를 제공 합니다.
이 프로토콜에서 우리 실리콘 프로브 1 차원 CSD 신호를 얻기 위해 포괄적인 가이드를 제공 합니다. 이러한 메서드는 사용자가 지역화 된 진동 이벤트 동작 쥐의 해 마에서 조사를 수 있게 된다.
프로토콜
살아있는 동물을 포함 하는 모든 메서드는 독일 동물 복지 행위에 따라 Regierungspräsidium 프라이부르크에 의해 승인 되었습니다.
1입니다. 준비
- 디자인과 정도 들고 실리콘 프로브와 전극 커넥터 주입의 과정에서 적절 한 삽입 도구를 구축. 예를 들어 사용자 정의 내장된 삽입 도구에 대 한 그림 1 을 참조 하십시오.
- 조심 스럽게 세라믹 밀고 집게를 사용 하 여 포장에서 실리콘 프로브 및 전극 커넥터를 해제 합니다.
- 커넥터 보드를 들어올려 고 안전 하 게 악어 클램프 스탠드에 연결 된와 함께 그것을 해결.
- stereoscope를 사용 하 여 삽입 도구 프로브 세라믹 밀고 집게 맞춥니다. 프로브 삽입 도구를 접착제로 cauterizer와 녹 인 파라핀 왁 스의 ~ 2 mm 레이어를 적용 합니다. 이 절차 동안 프로브 정강이 건드리지 않도록 주의.
- 표준 접착 테이프를 사용 하 여 삽입 도구의 샤프트에 전극 커넥터를 수정 합니다. 참고는 제조업체에 따라 접지 전선이 이식 전에 전극 커넥터 보드에 납땜을 해야 할 수 있습니다. 주석-납 납땜 (400 ° C)와 함께 적용을 사용 하 여 광택 절연 구리 와이어의 두 개의 짧은 조각에서 단 열을 제거 합니다. 전극 커넥터 보드에 적절 한 슬롯에 접지 전선 땜 납.
- 구리 철사의 2 개의 추가적인 조각의 절연을 제거 합니다. 세 번 (1 밀리미터 직경, 2mm 길이) 스테인리스 나사 주위 각 벌 거 벗은 구리 와이어 랩. 플럭스 강철 솔더링에 적합을 적용 하 고 나사 뚜껑의 하단에 구리 철사를 납땜. 있는지 확인 하단의 나사 스레드 남아의 절반 주석 땜 납의 무료.
- 표준 멀티 미터를 사용 하 여 와이어와 나사 사이 전기 접점에 대 한 확인.
- 70% 에탄올에 침수에 의해 실리콘 프로브와 접지 나사의 정강이 소독 (10 s).
- 절반에 플라스틱 파스퇴르 피 펫의 머리를 절단 하 여 프로브 임 플 란 트에 대 한 보호 커버를 준비 합니다.
2. 이식 수술
- 수술 도구 (가 위, 뾰족한 집게, 외과 클램프)와 뜨거운 비드 소독 기 소독. 70% 에탄올과 모든 표면을 닦아냅니다.
- 3 %isoflurane ~ 1 L/min에 전달 하는 산소에서와 마 취를 유도.
- 유지 보수, 1-1.5 %isoflurane 사용 합니다. 참고 isoflurane 농도 외과 공차를 달성 하는 데 필요한 동물 동물에서 달라질 수 있습니다.
- 안정적인 수술 공차 동물 발가락 곤란에 응답 하지 못할 때 이루어집니다. 마우스의 호흡 비율을 모니터링 하 고 필요한 경우 isoflurane의 농도 조정 합니다.
- 동물의 눈을 밖으로 건조 방지에 연 고를 적용 됩니다.
- 부드럽게 귀 바 외가도에 삽입 하 여 stereotaxic 프레임에 마우스를 탑재 합니다. 일단 마우스의 머리는 귀 바에 의해 안정, 지속적인 isoflurane 배달에 대 한 주 둥이 입 조각 장소. 마우스 패드 또는 수건에 위에 난방 패드를 놓고 buprenorphine를 피하 주사 (0.05-0.1 mg/kg 체중) 수술 후 진통 되도록.
- 표준 면도기로 머리를 면도 하 고 70% 에탄올으로 피부를 소독. 수술가 위를 사용 하 여 두개골의 중간 선 따라 피부에 절 개 하 고 수술 클램프를 사용 하 여 피부를 엽니다.
- 레벨 bregma 및 람다 stereotaxic 정렬 도구의 도움으로 동물의 머리를 맞춥니다. Bregma 및 람다 사이의 높이 오프셋의 50 µ m 이어야 한다. 또한, 두개골에 bregma에서 깊이 측정 하 여 입장 축 머리에 표면 수준 정의 거리 왼쪽 및 오른쪽 (예를 들어, 왼쪽 1 mm와 bregma의 오른쪽). 필요한 경우 머리의 기울기를 조정 합니다.
- 3% 과산화 수소와 함께 머리를 깨끗 하 고 마른 면 물티슈로 닦아 건조.
- Craniotomy bregma 적절 한 stereotaxic 아틀라스12를 사용 하 여 상대적인 위치를 결정 합니다.
- 0.9 m m 드릴 머리를 사용 하 여, 지상 및 참조 나사를 소 뇌에 뼈에 두 개의 나사 구멍을 드릴. 또한, 고정 나사에 대 한 1-3 구멍 안정 이식 하는 것이 있다. 앵커 나사 위치는 craniotomy의 위치에 따라 달라 집니다. 해 마에 이식에 대 한 앵커 나사 contralateral 정수 리와 동측 담당에 배치. 적합 한 드라이버를 사용 하 여 뼈에 나사를 삽입 합니다. 알아서 하지 뇌에 침투.
- 천천히 주입 측면 주위 직사각형 영역에 드릴으로 두개골을 엷게 해는 craniotomy를 수행 합니다. 멸 균된 인산 버퍼 (PB)와 뼈를 자주 축 축 하 게. 나머지 남았다 두개골을 부드럽게 피어 싱 하 고 괜 찮 아 요 (27 G) 주사 바늘과 핀셋 한 켤레의 도움으로 제거 될 수 있습니다.
- 신중 하 게 얇은 (27 G) 주입 바늘 dura mater 피어스. 핀셋의 쌍을 가진 바늘의 팁을 절곡 하 여 작은 고리를 형성 하 고 제거에 대 한 경질을 당겨. PB 뇌 표면 밖으로 건조 하지 않도록 하려면 적용 됩니다.
- Stereotaxic 홀더에 전극 삽입 도구를 탑재 하 고 bregma에 프로브를 0에서 craniotomy를 통해 stereotaxic 좌표에 프로브를 이동 합니다. 천천히 뇌 표면 침투. 프로브 샤프트 구 부 하지 않는 다는 것을 확인 하십시오. 혈관을 통해 이식 하지 마십시오.
- 천천히 원하는 깊이 이상 ~ 200 µ m까지 프로브를 낮춥니다. Craniotomy와 정강이의 보호에 대 한 멸 균된 바 셀 린과 실리콘 프로브 커버. 두개골에 고정 나사에 조사 자료를 해결 하기 위해 치과 시멘트를 적용 됩니다.
- 시멘트 신청 후 바로, 조사 대상 깊이 천천히 이동. 시멘트의 응용 프로브의 측면 운동 감소 보장 대상 지역에서 최소한의 조직 손상 후 마지막 ~ 200 µ m를 전진. 참고 사용 하는 시멘트의 경화 시간 프로토콜의이 단계에 영향을 수 있습니다. 신속 하 게 시멘트 경화와 함께이 단계를 생략 하 고 직접 실리콘 프로브에 손상을 방지 하기 위해 대상 깊이 조사를 임 플 란 트.
- 시멘트는 치료 삽입 도구에서 프로브를 cauterizer와 왁 스를 용 해 하 여 놓습니다.
- 삽입 장치에서 커넥터 보드를 놓고 삽입 핸들에 부착 된 악어 클램프를 사용 하 여 두개골에 적당 한 장소에 배치. 해 마에 프로브 주입, 경우 contralateral 정수 리 뼈에 커넥터 보드를 놓습니다. 치과 시멘트를 사용 하 여 두개골에 커넥터 보드를 수정 합니다.
- 소 뇌에 있는 두 개의 나사에 연결 된 전선 커넥터 보드의 지상 및 참조 선 땜 납.
- 올바른 높이에 보호 커버를 장식 하 고 실리콘 프로브 위에 놓습니다. 커넥터 보드와 두개골 노출된 두개골 주위 피부를 피하고 치과 시멘트를 사용 하 여 표지를 수정 합니다. 이식 사이트 주위 피부를 봉합 일반적으로 필요 하지 않습니다.
3입니다. 수술 후 회복
- 최소 2 일 (예: 모든 6 h 낮 동안 및 식 수에 하룻밤 함께 carprofen (4-5 밀리 그램/kg 체중) 피하 모든 24 h buprenorphine의 피하 주사)에 대 한 적절 한 진통 치료를 적용 합니다. 단일 주택 이식의 손상을 방지 하는 것이 좋습니다.
- 적어도 1 주 복구를 허용 합니다. 로컬 동물 복지 가이드라인에 게 문의 하십시오.
4. 데이터 수집
- 자유롭게 이동 하는 정류를 통해 연결 하는 적합 한 데이터 수집 시스템을 사용 하 여 마우스에서 기록 LFPs. 1-5 kHz의 샘플링 주파수를 사용 하 여 LFPs를 취득. 높은 샘플링 속도 (20-30 kHz) 단일 단위 방전은 LFP 함께 기록 하는 경우 필요 하다
- 오프 라인 분석을 위해 개별 채널의 원시 기록 파일을 저장 합니다.
5입니다. 조직학
- 녹음 완료 후 깊이 동물 (예: 2g/kg 몸 무게 우 레 탄 주입 intraperitoneally) anesthetize. 곤란 하 게 발가락에 응답의 부족에 의해 마 취 상태를 확인 합니다.
- 얼음 처럼 차가운 인산 염 버퍼 식 염 수 (~ 1 분) 4 %paraformaldehyde (~ 10 분) 표준 intracardial 관류 방법13를 사용 하 여 다음으로 마우스 transcardially perfuse 관류, 전에 전해 lesioning 녹음 사이트의 수에 의해 수행 (예: 10-20 V의 정 전압 최대 1을 적용 하 여 s). 또는, 형광 염료에 적용 칼 팁 이식 식별 추적을 사용할 수 있습니다. 실리콘 감지기의 종류와 최적의 결과 얻기 위해 전극 위치의 식별에 대 한 다양 한 방법을 테스트 하는 것이 좋습니다.
- 뇌 섹션 (~ 100 µ m) 고 4'-6-diamidino-2-phenylindole (DAPI, 1 µ g/mL) 샌드위치 (실 온에서 각 10 분)에 3 개의 세척 단계 다음으로 분할 영역을 얼룩.
- 섹션 현미경 슬라이드에, 적용 매체를 포함 한 방울 놓고 커버 슬립으로 섹션을 커버 합니다. 포함 매체 실 온에서 하룻밤 건조 하자.
- Using epifluorescence 또는 confocal 레이저 스캐닝 현미경, 녹음 사이트의 위치를 식별 합니다.
- 추가 사용에 대 한 실리콘 감지기의 복구를 시도, 악어 클램프 프로브 잡고과 신중 하 게 납땜 (400 ° C)와 치과 시멘트를 용 해 하 여는 났으며에서 프로브를 놓습니다. 이 절차 동안 프로브 정강이 건드리지 않도록 주의!
- 효소 솔루션 다음 뜨거운 증류수 (~ 80 ° C, 15 분)에 프로브를 세척 (1% 증류수, 실 온에서 30 분에에서 Tergazyme)와 다른 세척 증류수 (15 분). 참고 검색 복구 성공률 낮습니다.
6. CSD 분석
- 적합 한 분석 환경 (예: 파이썬), 변환으로 정강이 따라 두 번째 공간 파생에 가깝게 하 여 CSD에 개별 칼의 LFP 데이터를 사용 하 여
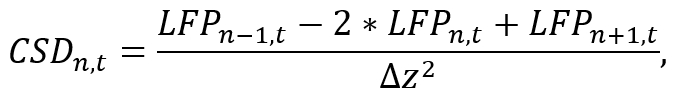
어디 LFPn, t는 시간 t 에서 n번째 전극에 LFP 신호 이며 Δz 전극 간 간격. Note는 n-1과 n+ 1 작업, 칼의 처음과 마지막 전극의 CSD 수 없습니다 예상할 수, 프로브 배치 중 고려 주의가 있다. (참조 추가 코드 파일)을 반복 하는 동안 각 전극에 대 한 CSD 신호를 계산 하는 코드의 짧은 세그먼트를 사용 하 여 근사 공식을 구현 합니다. - 추가 분석 (예를 들어, 밴드 패스 필터를 적용 하 여 뇌 진동의 특정 주파수 대역을 공부)에 대 한 획득된 CSD 신호를 사용 합니다.
결과
그림 1 에서는 실리콘 프로브의 주입에 사용 되는 삽입 도구를 보여 줍니다. 만성 이식된 실리콘에서 녹음 CA1 영역을 대상으로 조사 하 고가 뇌의과 립 세포 층은 그림 2에 표시 됩니다. 우리는 homecage에서 자유로운 이동 하는 동안 프로브 정강이에서 LFPs을 기록 했다. 볼륨 전도의 효과 최소화 하기 위해 얻은 신호 프로브 (
토론
증가 증거 hippocampal 신경 회로에서 두뇌 진동 개별 공간 도메인10,,1116발생을 나타냅니다. CSD 분석은 크게 볼륨 전도, 현지 발진 이벤트의 연구에 대 한 중요 한 필수의 영향을 줄일 수 있습니다. 이 비디오와 함께 우리 CSD 데이터의 분석에 대 한 마우스의 해 마에 실리콘 프로브를 이식 하는 가이드를 제공 합니다. 우리는 CA1 및?...
공개
저자는 공개 없다.
감사의 말
우리는 기술 지원을 위해 카린 Winterhalter 및 Kerstin Semmler 감사입니다. 이 작품의 우수성 BrainLinks-BrainTools (EXC 1086) 독일 연구 재단의 클러스터에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
참고문헌
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유