Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Enregistrement dans l’espace restreint des Oscillations dans l’hippocampe de se comporter de souris
Dans cet article
Résumé
Ce protocole décrit l’enregistrement des potentiels de champ local multi queue linéaire silicium sondes. Conversion des signaux en utilisant l’analyse de la densité actuelle source permet la reconstruction de l’activité électrique locale dans l’hippocampe de souris. Avec cette technique, les oscillations dans l’espace restreint de cerveau peuvent être étudiées en se déplaçant librement souris.
Résumé
Le potentiel de champ local (LFP) émerge des mouvements ioniques à travers les membranes neuronales. Puisque la tension enregistrée par électrodes LFP reflète le champ électrique additionnée d’une grande quantité de tissu cérébral, extraire des informations sur l’activité locale est un défi. Études de microcircuits neuronales, exige toutefois une distinction fiable entre des événements vraiment locales et volume à diriger des signaux provenant de régions éloignées cerveau. Analyse de densité (CSD) source actuelle offre une solution à ce problème en fournissant des informations sur l’actuels puits et sources dans le voisinage des électrodes. Dans les zones du cerveau avec cytoarchitecture laminaire comme l’hippocampe, on trouvera des CSD unidimensionnel en estimant la dérivée seconde spatiale de la LFP. Nous décrivons ici une méthode d’enregistrement multilaminaire LFPs à l’aide de sondes linéaires silicone implantés dans l’hippocampe dorsal. Traces CSD sont calculées le long des tiges individuelles de la sonde. Ce protocole décrit ainsi une procédure pour résoudre les oscillations de réseau neuronal dans l’espace restreint dans l’hippocampe de déplacer librement les souris.
Introduction
Oscillations dans le PDD sont gravement impliquées dans traitement de circuits neuronaux de l’information. Ils couvrent un large spectre de fréquences, allant des ondes lentes (~ 1 Hz) à ondulation rapides oscillations (~ 200 Hz),1. Bandes de fréquences distinctes sont associées à des fonctions cognitives, y compris la mémoire, traitement émotionnel et navigation2,3,4,5,6,7. Courant à travers les membranes neuronales constitue la plus grande partie de la LFP signal8. Les cations entrant dans la cellule (par exemple via l’activation des synapses excitatrices glutamatergiques) représentent un récepteur actif actuel (comme charge quitte le milieu extracellulaire). En revanche, les flux nets de charges positives dans le milieu extracellulaire, par exemple par l’activation des GABAergiques synapses inhibitrices, représente une source de courante active à cet endroit. En dipôles neuronales, puits actuels sont jumelés avec des sources passives et vice versa en raison de la compensation des courants qui affectent la membrane gratuitement sur des sites éloignés.
Domaine de l’électricité produit par des processus neuronaux distants peut également conduire à des détournements de tension considérable sur une électrode d’enregistrement et peut donc être faussement considéré comme un événement local. Cette conduction volume pose un sérieux défi à l’interprétation des signaux de la LFP. Analyse de la CSD fournit des informations sur locales actuels puits et sources sous-jacentes LFP signaux et comprend donc un moyen de réduire l’impact du volume conduction8. Structures laminées comme l’hippocampe, unidimensionnel CSD signaux peuvent être obtenus par la dérivée seconde spatiale de la LFP enregistrée entre perpendiculaires équidistantes électrodes disposées et les avions laminaire9. L’avènement des sondes disponibles dans le commerce de silicium linéaires a permis aux chercheurs d’utiliser la méthode de CDD pour l’étude de l’activité d’oscillation locale dans l’hippocampe. Par exemple, il a été démontré que les oscillations distinctes gamma émergent de manière spécifique à la couche dans la zone CA110. En outre, analyse de la CSD a identifié indépendante des points chauds de l’activité gamma dans la couche de cellules principales du gyrus dentelé11. Ce qui est important, ces résultats n’étaient seulement apparents en CDD local mais pas en signaux LFP. Analyse de la CSD a donc fournit un outil puissant pour mieux comprendre les opérations de microcircuit de l’hippocampe.
Dans ce protocole, nous fournissons un guide complet pour obtenir des signaux unidimensionnels de CDD avec des sondes de silicium. Ces méthodes permettra aux utilisateurs d’enquêter sur les événements d’oscillation localisée dans l’hippocampe de souris se comporter.
Protocole
Toutes les méthodes faisant intervenir des animaux vivants ont été approuvés par le Regierungspräsidium à Fribourg conformément à la loi allemande de bien-être Animal.
1. les préparatifs
- Concevoir et construire un outil d’insertion approprié transitoirement transportant la sonde de silicium et le connecteur d’électrode au cours du processus d’implantation. Voir la Figure 1 pour un exemple personnalisé construit introducteur.
- Soigneusement libérer le connecteur de sonde et des électrodes de silicium de son emballage à l’aide de pinces à pointe céramique.
- Soulevez la carte connecteur et fixez-le solidement avec une pince crocodile attachée à un stand.
- À l’aide d’un stéréoscope, aligner la sonde avec l’outil d’insertion avec une pince à embout céramique. Appliquer une couche de paraffine fondue avec un cauterizer de coller la sonde à l’outil d’insertion ~ 2 mm. Prendre soin de ne pas pour toucher les jarrets de la sonde au cours de cette procédure.
- Fixez le connecteur d’électrode à la tige de l’outil d’insertion à l’aide d’un ruban adhésif standard. Notez que selon le fabricant, fils de terre devraient peut-être être soudé à l’Office de connecteur d’électrode avant implantation. Enlever l’isolant des deux courtes pièces de fil de cuivre isolé vernis à l’aide de soudure étain appliqué avec un fer à souder (400 ° C). Souder les fils de terre dans les fentes appropriées au sein du Conseil de connecteur d’électrode.
- Enlever l’isolant des deux autres morceaux de fil de cuivre. Enveloppez chaque fil de cuivre nu trois fois autour d’une vis en acier inoxydable (diamètre de 1 mm, 2 mm de longueur). Appliquer des flux pour soudure acier et souder le fil de cuivre au fond de la capsule à vis. Assurez-vous que le fond la moitié du filet de vis demeure libre d’étain-étain.
- Utilisez un multimètre standard pour vérifier un contact électrique entre le fil et vis.
- Désinfecter les jarrets de la sonde de silicium et les vis de sol par immersion dans de l’éthanol à 70 % (10 s).
- Préparer une plaque de protection pour l’implant de sonde en coupant la tête d’un plastique, pipette Pasteur en deux.
2. implantation chirurgicale
- Stériliser les instruments chirurgicaux (ciseaux, pinces à pointe fine, clamps chirurgicaux) avec un stérilisateur de boudin chaud. Essuyez toutes les surfaces avec l’éthanol à 70 %.
- Induire l’anesthésie à l’isoflurane 3 % d’oxygène envoyées à ~ 1 L/min.
- Utiliser pour l’entretien, 1 à 1,5 % isoflurane. Notez que la concentration d’isoflurane requise pour atteindre la tolérance chirurgicale peut varier d’un animal à l’autre.
- Stable tolérance chirurgicale est réalisée lorsque l’animal ne répond pas aux orteils-pincement. Suivre le rythme de la respiration de la souris et ajuster la concentration d’isoflurane, si nécessaire.
- Pommade pour les yeux de l’animal pour éviter le dessèchement.
- Montez la souris dans un cadre stéréotaxique en insérant doucement les barres d’oreilles dans le conduit auditif. Une fois que la tête de la souris est stabilisée par les barres d’oreilles, placer un morceau de bouche sur le museau pour la livraison de l’isoflurane continue. Placez votre souris sur une serviette ou un tampon sur un coussin chauffant et injecter la buprénorphine par voie sous-cutanée (0,05 - 0,1 mg/kg de poids corporel) pour s’assurer de l’analgésie postopératoire.
- Se raser la tête avec un rasoir standard et désinfecter la peau avec l’éthanol à 70 %. À l’aide de ciseaux chirurgicaux, faites une incision dans la peau le long de la ligne médiane du crâne et ouvrir la peau à l’aide de pinces chirurgicales.
- Aligner la tête de l’animal à l’aide d’un outil d’alignement stéréotaxique à niveau bregma et lambda. Il devrait y avoir moins de 50 µm de décalage de hauteur entre bregma et lambda. Par ailleurs, niveau de la surface de la tête le long de l’axe médio-latérale en mesurant la profondeur de bregma à crâne au définie distances gauche et droit (p. ex., 1 mm à gauche et droite du bregma). Réglez l’inclinaison de la tête si nécessaire.
- Nettoyer la tête avec le peroxyde d’hydrogène 3 % et essuyer avec des lingettes de coton stérile.
- Déterminer l’emplacement de la craniotomie par rapport au bregma à l’aide d’un atlas stéréotaxiques appropriées12.
- Avec une tête de perçage de 0,9 mm, percez deux trous de vis dans l’OS sur le cervelet pour placer les vis de fixation au sol et référence. En outre, 1-3 trous pour vis de fixation sont souhaitables pour stabiliser l’implant. L’emplacement de la vis d’ancrage dépendra de l’emplacement de la craniotomie. Pour l’implantation dans l’hippocampe, placer vis d’ancrage sur le cortex frontal controlatéral pariétal et ipsilatéral. Insérez les vis dans l’os à l’aide d’un tournevis adapté. Prendre soin de ne pas pour pénétrer dans le cerveau.
- Effectuer la craniotomie éclaircie lentement le crâne avec la perceuse dans une zone rectangulaire sur le côté de l’implantation. Fréquemment, humidifier l’OS avec un tampon phosphate stérilisé (PB). Le crâne éclairci restant peut être percé doucement et enlevé à l’aide d’une fine aiguille d’injection (27G) et une paire de pincettes.
- Percer avec précaution la dure-mère avec une fine aiguille à injection (27G). Former un petit crochet en pliant le bout de l’aiguille avec une paire de pinces à épiler et tirez la dure-mère pour enlèvement. Appliquer le PB pour éviter que la surface du cerveau se dessèchent.
- Monter l’outil d’insertion de l’électrode sur un support stéréotaxique, zéro la sonde sur bregma et survolez la sonde aux coordonnées stéréotaxiques la craniotomie. Lentement pénétrer la surface du cerveau. Assurez-vous que les arbres de la sonde ne se plient pas. Évitez l’implantation par le biais des vaisseaux sanguins.
- Abaissez lentement la sonde jusqu’au ~ 200 µm au-dessus de la profondeur désirée. Couvrir la craniotomie et les queues de la sonde de silicium avec de la Vaseline stérile pour protection. Appliquer un ciment dentaire pour fixer le fond de la sonde à la vis d’ancrage dans le crâne.
- Tout de suite après l’application de ciment, déplacez lentement la sonde à la profondeur de la cible. Faire progresser la dernière ~ 200 µm après que application du ciment réduit le déplacement latéral de la sonde et assure les dommages de tissu minime dans la zone cible. Notez que le temps de durcissement du ciment utilisé peut influer sur cette étape du protocole. Avec rapidement guérir ciment, omettez cette étape et l’implant directement la sonde à la profondeur de la cible afin d’éviter d’endommager la sonde de silicium.
- Après que le ciment a séché, libérer la sonde de l’outil d’insertion par la fonte de la cire avec un cauterizer.
- Libérer le jury de connecteur du dispositif d’insertion et placez-la à un endroit approprié sur le crâne à l’aide d’une pince crocodile attachée à la poignée d’insertion. En cas d’implantation de sonde dans l’hippocampe, placez le carton de connecteur sur l’os pariétal controlatéral. Fixer la lamelle de connecteur sur le crâne à l’aide de ciment dentaire.
- Soudez les fils au sol et de référence du Conseil de connecteur pour les fils attachés aux deux vis sur le cervelet.
- Coupez le couvercle de protection à la bonne hauteur et placez-le sur la sonde de silicium. Fixer le couvercle pour le Conseil de connecteur et le crâne avec un ciment dentaire, en évitant la peau autour du crâne exposé. Suturer la peau autour du site d’implantation n’est généralement pas nécessaire.
3. rétablissement après la chirurgie
- Appliquer un traitement antalgique approprié pendant au moins 2 jours (par exemple les injections sous-cutanées de buprénorphine toutes les 6 h pendant la journée et dans l’eau potable du jour au lendemain combiné avec carprofène (4-5 mg/kg de poids corporel) par voie sous-cutanée toutes les 24 h). Single-logement est recommandé d’éviter d’endommager l’implant.
- Laissez au moins une semaine pour la récupération. Consulter les lignes directrices locales de bien-être animal.
4. Acquisition de données
- LFPs Records de bouger librement des souris à l’aide d’un système d’acquisition de données adéquates connecté via un commutateur. Pour acquérir LFPs, utiliser une fréquence de 1 à 5 kHz. Taux d’échantillonnage plus élevés (20 à 30 kHz) sont nécessaires si les rejets unitaires doivent être enregistrées avec la LFP.
- Stocker les fichiers d’enregistrement raw des canaux individuels pour l’analyse hors ligne.
5. histologie
- A l’issue de l’enregistrement, profondément anesthésier l’animal (par exemple 2 g/kg corps poids uréthane injecté par voie intrapéritonéale). Confirmer l’État anesthésique par absence de réponse à l’orteil de pincement.
- Perfuse la transcardially souris avec glacé tampon phosphate salin (~ 1 min) suivi de 4 % de paraformaldéhyde (~ 10 min) à l’aide de méthodes de perfusion standard intracardial13. Avant la perfusion, lésion électrolytique des sites d’enregistrement pourrait par effectuée (par exemple en appliquant des 10-20 V de tension constante pour jusqu'à 1 s). Alternativement, colorants fluorescents appliquent à l’extrémité de la tige avant implantation peut être utilisée pour suivre l’identification. Est recommandé de tester les différentes méthodes pour l’identification des emplacements des électrodes afin d’obtenir des résultats optimaux avec différents types de sondes de silicium.
- Coupes de cerveau (~ 100 µm) et colorer les tranches avec 4'-6-diamidino-2-phénylindole (DAPI, 1 µg/mL) suivie de trois étapes de lavage en PB (chaque 10 min à température ambiante).
- Déposer les éléments sur une lame de microscope, appliquez une goutte d’enrobage moyen et couvrir la section avec une lamelle couvre-objet. Laissez la moyenne encastrement sécher jusqu’au lendemain à la température ambiante.
- D’un épifluorescence ou microscope confocal à balayage laser, identifier le noms des lieux de l’enregistrement.
- Pour la tentative de récupération de la sonde de silicium pour une utilisation ultérieure, tenir la sonde avec une pince crocodile et libérer la sonde de la godille en fonte avec soin le ciment dentaire avec un fer à souder (400 ° C). Prendre soin de ne pas pour toucher les jarrets de la sonde au cours de cette procédure !
- Laver la sonde dans de l’eau distillée (~ 80 ° C, 15 min) suivie d’une solution enzymatique (1 % Tergazyme dans l’eau distillée, 30 min à température ambiante) et laver une autre étape dans l’eau distillée (15 min). Notez que le taux de réussite de récupération de la sonde est faible.
6. CSD analyse
- En utilisant un environnement d’analyse appropriée (par exemple Python), convertir les données LFP de cambrion individuelle à CSD par approximation de la dérivée seconde spatiale le long de la tige comme
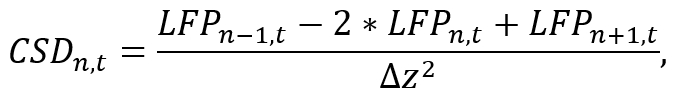
où LFPn, t est le signal de la LFP sur l’électrode deth nau temps t et Δz correspond à l’espacement inter-électrode. Notez qu’en raison de la n-1 et n+ 1 opérations, la DLC des électrodes premières et la dernières de la tige ne peut être estimée, qui doit être pris en considération pendant le placement de la sonde. Mise en oeuvre de la formule d’approximation à l’aide d’un court segment de code qui calcule le signal de la CSD pour chacune des électrodes tout en effectuant une itération dans le temps (voir le fichier de Code supplémentaires). - Utiliser le signal CSD obtenu pour une analyse ultérieure (par exemple, étudier les bandes de fréquences spécifiques des oscillations de cerveau en appliquant des filtres passe-bande).
Résultats
La figure 1 illustre l’outil d’insertion utilisé pour l’implantation des sondes de silicium. Enregistrements de silicium chroniquement implanté les sondes ciblant la région CA1 et la couche de cellules de granules du gyrus denté sont indiquées à la Figure 2. Nous avons enregistré LFPs des jarrets de la sonde au cours de la libre circulation dans le homecage. Pour minimiser l’effet de conduction de volume, les signa...
Discussion
Plus en plus de preuves indiquent qu’oscillations cérébrales dans des circuits de neurones hippocampiques dans les domaines spatial discrets10,11,16. Analyse de la CSD réduit considérablement l’influence de la conduction de volume, un préalable essentiel à l’étude des événements locaux d’oscillation. Avec cette vidéo, nous fournissons un guide d’implantation des sondes de silicium dans l’hippocampe de souri...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous sommes reconnaissants à Karin Winterhalter et Kerstin Semmler pour l’assistance technique. Ce travail a été soutenu par le pôle d’excellence BrainLinks - BrainTools (1086 EXC) de la Fondation de recherche allemande.
matériels
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
Références
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon