このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
行動中マウスの海馬における振動を制限空間録音
要約
このプロトコルでは、リニア シリコン プローブ マルチすねローカル フィールド電位の記録について説明します。電流源密度解析を用いた信号の変換は、マウスの海馬においてローカル電気的活動の復興をことができます。このテクニックの自由行動マウス空間制約の脳の振動を学ぶことができます。
要約
ローカル場ポテンシャル (LFP) は、神経膜を渡るイオンの動きから出てくる。LFP 電極によって記録される電圧は、脳組織の大ボリュームの合計電気フィールドを反映しているので地元の活動に関する情報を抽出することは困難です。神経回路を勉強して、しかし、本当に地元のイベントと遠い脳領域のボリューム実施信号の信頼性の高い区別が必要です。電流源密度 (CSD) 分析は、現在のシンクとソース電極近傍の情報を提供することによってこの問題のソリューションを提供します。海馬などの薄層の細胞構築と脳領域、LFP の 2 番目の空間微分を推定による 1 次元 CSD を取得できます。ここでは、レコード multilaminar LFPs 背側の海馬に移植したリニア シリコン プローブを使用する方法をについて説明します。CSD のトレースは、プローブの個々 のシャンクに沿って計算されます。このプロトコルはこうして自由行動マウスの海馬ニューロン ネットワークの空間的制限振動を解決する手順を説明します。
概要
LFP 振動は、批判的に神経回路による情報処理に関与しています。彼らは、周波数、遅い波 (~ 1 Hz) から高速リップル振動 (~ 200 Hz)1に至るまでの広い範囲をカバーします。異なる周波数帯は、メモリ、感情的な処理、およびナビゲーションの2,の3,の4,の5,6,7を含む認識の機能に関連付けられます。神経細胞の膜を渡る現在の流れは、LFP 信号8の最も大きい部分を構成します。陽イオン (例えばグルタミン酸作動性の興奮性シナプスの活性化を介して) 細胞に入る (電荷の葉細胞外媒体)、アクティブな現在のシンクを表します。対照的に、gaba 作動性抑制性シナプスの活性化によって、例えば、細胞の中に正電荷のフローは、その場所に現在アクティブなソースを示しています。神経ダイポール アンテナの電流シンク ペアになっている源パッシブと遠隔部位の膜電位に影響を与える電流補償のため。
リモートの神経プロセスによって生成される電場記録電極上かなり電圧たわみにもつながるし、ローカル イベントとして誤って考慮されるかもしれない従って。このボリューム伝導 LFP 信号の解釈に深刻な問題が生じます。CSD 解析は、ローカル電流シンクと LFP の基になるソースの情報を通知し、したがって伝導の8巻の影響を軽減するための手段を構成を提供します。海馬のような積層構造は、一次元の CSD 信号は9層流面等距離にある電極を配置した垂直から記録 LFP の 2 番目の空間微分によって得られます。市販のリニア シリコン プローブの出現は、海馬の局部発振活動に関する研究の CSD 法を活用して研究者を許可しています。たとえば、異なるガンマ振動が CA1 領域10の層に固有の方法で出てくることが実証されています。さらに、CSD 解析11海馬歯状回の主要細胞層におけるガンマ活動の独立したのホット スポットを識別しています。重要なは、これらの調査結果のみローカルの CSD ではなく LFP 信号で明らかにされました。CSD 解析したがって海馬のマイクロ操作に洞察力を得るために強力なツールを提供します。
このプロトコルでは、シリコン プローブを持つ 1 次元の CSD 信号を得るための包括的なガイドを提供します。これらのメソッドは行動中のマウスの海馬における局在振動のイベントを調査するユーザーを有効にします。
プロトコル
生きている動物を含むすべてのメソッドは、Regierungspräsidium フライブルク ドイツ動物福祉法によって承認されています。
1. 準備
- 設計および一過性注入のプロセス中にシリコン プローブ、コネクタの電極を運ぶ適切な挿入ツールを構築します。カスタム構築された挿入ツールの例について図 1を参照してください。
- セラミックス製のピンセットを使用してパッケージからシリコン プローブと電極コネクタを慎重に取り外します。
- コネクタ基板を持ち上げ、しっかりスタンドに接続されているワニ クランプで固定します。
- 堅実を使用すると、セラミックス製鉗子挿入ツールを使ってプローブを合わせます。挿入ツールにプローブを接着する師で溶かしたパラフィン ワックスの ~ 2 mm の層を適用します。この手順中にプローブ シャンクスに触れないように注意してください。
- 標準の粘着テープを使用して挿入ツールの軸に電極コネクタを修正します。製造元によって、アース線は注入前に電極コネクタ基板にはんだ付けする必要があることに注意してください。ワニス絶縁銅線錫はんだはんだごて (400 ° C) で適用の 2 つの小品から断熱材を削除します。電極コネクタ基板の適切なスロットにアース線をはんだ付けします。
- 銅ワイヤの 2 つの追加部分の断熱材を削除します。(直径 1 mm、長さ 2 mm) ステンレス鋼ねじ周りを 3 回各裸銅線をラップします。鋼をはんだ付け用フラックスに適したを適用し、スクリュー キャップの底に銅線をはんだ付けします。確認錫はんだねじ山遺跡の半分無料下。
- ワイヤーとネジの間の電気接触を確認する標準のマルチメータを使用します。
- 70% エタノールに浸漬法によるシリコン プローブとネジを地面のシャンクスを駆除 (10 s)。
- 半分にプラスチック製のパスツール ピペットの頭を切断することによってプローブ インプラント用保護カバーを準備します。
2. 注入手術
- 手術器具 (はさみ、細い鉗子、手術用クランプ) をホット ビーズ滅菌器で滅菌します。70% エタノールで表面を拭いてください。
- ~ 1 L/分で酸素 3% イソフルレン麻酔を誘導します。
- 維持のためには、1 〜 1.5% イソフルランを使用します。イソフルラン濃度手術公差を達成するために必要がある動物から動物を変わることができることに注意してください。
- 安定した手術トレランスは、動物がつま先ピンチに応答に失敗した場合に実現されます。マウスの呼吸数を監視し、必要に応じてイソフルランの濃度を調整します。
- 動物の目に完全に乾くことを防ぐために軟膏を塗る。
- 優しく耳バーを外耳道に挿入すると、固定フレームでマウスをマウントします。一度耳バーにマウスの頭を安定連続イソフルラン配信の鼻の上の口部分を配置します。タオルやパッドの加熱パッドの上にマウスを置くし、ブプレノルフィンを皮下注入 (0.05 - 0.1 mg/kg 体重) の術後鎮痛を確保するため。
- 標準的なシェーバーで頭を剃るし、70% アルコールで皮膚を消毒します。外科はさみを使用すると、頭蓋正中線に沿って皮膚切開を行い用クランプを使用して皮膚を開きます。
- レベル前とラムダに固定配置ツールの助けを借りて、動物の頭を揃えます。未満 50 μ m 前とラムダの高さオフセットの必要があります。さらに、頭蓋骨で前から深さを測定することによって内外の軸に沿って頭の表面レベルには、距離は左と右 (例えば、 1 ミリメートル左、前の右) が定義されています。必要な場合は、頭の傾きを調整します。
- 3% 過酸化水素とヘッド クリーニングし、滅菌綿でのふき取りと乾燥を拭いてください。
- 適切な脳定位固定装置アトラス12を使用して前を基準にして開頭手術の場所を決定します。
- 0.9 mm のドリル頭を使用すると、地面と参照のネジを配置する小脳の上骨の 2 つのネジ穴をドリルします。また、1-3 の固定ネジ穴がインプラントを安定化することが望ましいです。アンカーのネジの位置は、開頭手術の場所によって異なります。海馬への注入、対側の頭頂部と同側の前頭皮質の上のアンカーのネジを配置します。適切なドライバーを使用して骨にネジを挿入します。脳に浸透しないように注意してください。
- ゆっくりと注入側周辺の長方形ドリルで頭蓋骨を薄くことによって、開頭手術を実行します。滅菌リン酸緩衝 (PB) と骨をよく湿らせます。残りの間伐の頭蓋骨を優しくピアスし、罰金 (27 G) 注射針とピンセットのペアの助けを借りて削除できます。
- 慎重に薄い (27 G) 注射針で硬膜に穴を開けます。ピンセットのペアで針の先端を曲げることによって小さなフックを形成し、除去のため硬膜を引きます。脳の表面の乾燥を防ぐために PB を適用します。
- 脳定位固定装置のホルダー電極挿入ツールをマウント、前、プローブをゼロし、開頭手術で脳定位固定座標にプローブを移動します。ゆっくりと脳の表面に浸透します。プローブ シャフトを曲げていないかどうかを確認します。血管を植え付けることは避けてください。
- 所定の深さの上 〜 200 μ m までプローブをゆっくりと下ろします。開頭術と保護用滅菌ワセリンとシリコン プローブのシャンクをカバーします。頭蓋骨の固定ネジにプローブのベースを修正する歯科用セメントを適用します。
- セメント塗布後右、ターゲットの深さにプローブをゆっくりと移動します。セメントのアプリケーション プローブの横方向の動きが減少、ターゲット地域に最低限の組織の損傷を確認した後は、最後 〜 200 μ m を進めます。使用されるセメントの硬化時間は、プロトコルのこの手順に影響を与えることができます注意してください。セメントを硬化迅速に、この手順を省略、シリコン プローブへの損傷を避けるためにターゲットの深さをプローブを直接インプラントします。
- セメントが硬化した後、師のワックスを溶かすことによって挿入ツールからプローブを取り外します。
- コネクタ ボードを挿入デバイスからと挿入ハンドルに付いているワニ クランプを使用して頭蓋骨に適当な場所に配置します。海馬にプローブ注入の場合対側の頭頂骨にコネクタ ボードに置きます。歯科用セメントを使用して頭蓋骨にコネクタ基板を固定します。
- 小脳の上 2 つのネジに接続されている配線にコネクタ基板のグラウンドと参照のワイヤーをはんだ付けします。
- 正しい高さに保護カバーをトリミングし、シリコン プローブの上に置きます。コネクタ基板と頭蓋骨が露出した頭蓋骨の周りの皮膚を避ける、歯科用のセメントを使用してカバーを修正します。通常、移植部位の周りの皮膚を縫合は必要ではありません。
3. 手術後の回復
- 少なくとも 2 日間 (昼間と飲料水のすべての 6 h 一晩併用 (4-5 mg/kg 体重) カルプロフェン皮下すべての 24 h ブプレノルフィンの皮下注射など) 適切な鎮痛処置を適用します。シングル住宅はインプラントを損傷しないようにお勧めします。
- 回復には少なくとも 1 週間を許可します。動物愛護のガイドラインを参照してください。
4. データ集録
- 整流子を介して接続されている適切なデータ集録システムを使用してマウスを自由に移動するからレコードの LFPs。LFPs を取得するには、1-5 kHz のサンプリング周波数を使用します。高いサンプリング レート (20-30 の kHz) は、単体放電 LFP と共に記録する場合に必要です。
- オフラインで分析できる個々 のチャネルの生録音ファイルを格納します。
5. 組織学
- 録音が完了したら、麻酔動物 (例えば2 g/kg 本体重量ウレタン腹腔内注入) が深く。摘心をつま先への応答の欠乏によって麻酔の状態を確認します。
- 冷たいリン酸緩衝生理食塩水 (~ 1 分) 4% パラホルムアルデヒド (~ 10 分) 標準 intracardial 灌流方法13を使用して続いてマウス transcardially を灌流します。灌流前、に記録サイトの電解示したによって実行可能性 (例えば10-20 V まで 1 の定電圧を適用することによって s)。また、蛍光染料は、シャンクの先端に注入することができます識別を追跡する使用する前に適用されます。シリコン プローブの種類と最適な結果を得るための電極の位置を識別するためのさまざまな方法をテストすることをお勧めします。
- 脳のセクション (~ 100 μ m) を切り取って、4'-6-diamidino-2-phenylindole (DAPI、1 μ G/ml) PB (室温では 10 分ごと) で 3 つの洗浄のステップが続くとスライスを染色します。
- 顕微鏡スライドの上セクションに配置、包含媒質の滴を適用、カバー スリップでセクションをカバーします。室温で埋め込みの中一晩の乾燥ができます。
- 落射蛍光または共焦点レーザー走査型顕微鏡を使用して、記録サイトの場所を特定します。
- さらに使用するためシリコン プローブの回復には、プローブを持つワニ クランプから慎重にはんだごて (400 ° C) で歯科用セメントを溶かすことによってスカルからプローブを離します。この手順中にプローブ シャンクスに触れないように注意してください!
- 酵素のソリューションに続いて蒸留水 (~ 80 ° C、15 分) にプローブを洗浄 (1% 蒸留水、室温で 30 分で Tergazyme) との別の洗濯手順蒸留水 (15 分) を。プローブの回復の成功率が低いことに注意してください。
6. CSD 解析
- CSD とシャンクに沿って 2 番目の空間微分の近似によって個々 シャンクの LFP データへ変換 (例えばPython)、適切な分析の環境を使用してください。
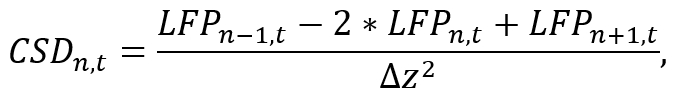
LFPn、tは時間tにn番目の電極に LFP 信号、Δzは電極間の間隔。N-1 とn+1 の操作のためのすねの最初と最後の電極の CSD は推定されない、プローブの配置の際考慮の下で撮影する必要がありますに注意してください。短い時間 (補足のコード ファイルを参照してください) を反復処理しながら、各電極の CSD 信号を計算するコード セグメントを使用して近似式を実装します。 - 詳細な分析 (例えば、帯域通過フィルターを適用することによって脳の振動の特定の周波数バンドを勉強して) 得られた CSD 信号を使用します。
結果
図 1は、シリコン プローブの注入に使用する挿入ツールを示しています。慢性的な打ち込みから録音プローブ CA1 領域をターゲットと海馬歯状回の顆粒細胞の層は、図 2に示します。我々 は、homecage で自由な動きの中にプローブのすねからの LFPs を記録しました。容積伝導の影響を最小限に抑えるために得られた信号はプ?...
ディスカッション
増加の証拠は、離散空間ドメイン10、11,16海馬神経回路における脳の振動が発生することを示します。CSD 解析は、ボリューム伝導、局部発振のイベントの研究のための重要な前提条件の影響を大幅に低減します。このビデオでは、CSD データの分析のためマウスの海馬にシリコン プローブを移植するガイドを提供します。CA...
開示事項
著者が明らかに何もありません。
謝辞
カリン ・ ウインターハルターとシャスティン セムラー テクニカル サポートに感謝しております。この作品は、BrainLinks - ドイツ研究振興協会の BrainTools (EXC 1086) の卓越性のクラスターによって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
参考文献
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved