Method Article
HEK 细胞 Mitoribosome 的快速分离
摘要
线粒体有专门的核糖体, 与他们的细菌和细胞质的对应物分叉。在这里, 我们展示如何 mitoribosomes 可以获得从他们的本地舱在 HEK 细胞。该方法包括分离悬浮细胞中的线粒体, 并由此纯化 mitoribosomes。
摘要
人类线粒体拥有一组专门的核糖体 (mitoribosomes), 它能转化线粒体基因组编码的氧化磷酸化络合物中的13种基本蛋白成分。由于人类 mitoribosomes 合成的所有蛋白质都是整体膜蛋白, 人类 mitoribosomes 在翻译过程中被拴在线粒体内膜上。与胞浆核糖体相比, mitoribosome 有55S 的沉淀系数, rRNA 含量的一半, 没有 5S rRNA 和36额外的蛋白质。因此, 较高的蛋白质-RNA 比值和非典型结构使人类的 mitoribosome 与胞浆对应物显著地不同。
尽管 mitoribosome 对生命至关重要, 但没有任何协议可以从人类细胞系净化完整的复合物。传统上, mitoribosomes 是从富含线粒体的动物组织中分离出来的, 需要公斤的起始物质。我们推测, 线粒体在分裂 HEK293-derived 人细胞生长在富含营养的表达媒介将有一个活跃的线粒体翻译, 因此, 可能是一个适当的材料来源的结构和生物化学研究mitoribosome。为了研究其结构, 我们开发了一种从 HEK 细胞中纯化完整 mitoribosomes 的协议。本文介绍了氮气空化方法作为一种快速、少劳动密集型、更有效的替代传统的基于机械剪切的细胞裂解方法。这导致了 mitoribosome 的准备, 使其结构决心高分辨率, 揭示了完整的人类 mitoribosome 及其组装中间体的组成。在这里, 我们跟进这项工作, 并提出了一个优化和更具成本效益的方法, 只需要 1010培养的 HEK 细胞。该方法可用于纯化人 mitoribosomal 翻译配合物、突变体、质量控制组件和 mitoribosomal 亚基中间体。如果需要, 纯化可以线性缩放, 也可应用于其他类型的细胞。
引言
线粒体蛋白合成的过程是以13种必需的基因为基础的, 这是由专门的膜附着 mitoribosome 转化成呼吸链的催化核心。改变的线粒体基因组和蛋白质插入 translationally 到膜中的需要极大地塑造了线粒体核糖体1的结构。最近的高分辨率的哺乳动物 mitoribosome 结构显示出一个惊人的不同的整体外观, 细菌对应2,3。特别是, 至少增加了36线粒体特异蛋白, 贡献了 ~ 1 MDa 额外的分子质量, 而 mt-rRNA 减少了双重和高度分化。结构重排改变几乎所有的关键功能特征, 以前普遍认为是普遍保守的4。
新的主要元素已经获得了每一个 mitoribosomal 亚基, 例如, 小亚基已纳入一个内在的 GTPase 蛋白 mS29 到其 ' 头部 ' 区域。在其他翻译系统中找不到 GTPase 活动, 结构表明 GTPase 可能在亚单位汇编2中发挥作用。5S rRNA 被认为是所有已知核糖体大亚基的地标, 形成中心突起的核心, 在哺乳动物 mitoribosome 中失踪, 并采用 mt-tRNA-瓦尔作为一个整体构造块代替2。潘基文和同事们表明, 猪 mitoribosome 有 tRNA, 而不是–Val5。Chrzanowska-Lightowlers, Minczuk 和同事跟进这些数据, 发现 mitoribosomes 从受损的 mt tRNA-瓦尔稳定的患者原则上可以容纳 mt-tRNA-6,7。为什么 mitoribosomes 包含了这些特定的元素, 这些独特的组件需要哪些途径和跨因素仍然是未知的。
总体而言, 人类 mitoribosome 的高度复杂性, 新的蛋白质成分, 以及 tRNA 作为结构元素的独特联想, 意味着未知的线粒体特定的跨因子的参与。然而, 由于这个系统的许多特点是独特的线粒体, 这是传统上很难调查8, 很少是已知的分子和质量控制机制。随着电子低温显微镜 (低温-EM)20高分辨率单粒子分析的发展, 现在有机会全面研究人体的装配、作用和质量控制的分子机制。mitoribosome。我们的第一个结构的人类 mitoribosome 装配中间体的报告提供了认识, 可以想象如何形成人类 mitoribosome, 并表明, 低温 EM 是有助于确定新的跨代理装配因素9。
为了扩大这一初步的努力, 我们描述了一个快速的协议, 人类 mitoribosome 净化详细。在该协议的第一部分, 描述了从悬浮细胞中分离出高度纯完整的线粒体。这个过程需要9小时, 可以很容易地修改和适应不同的细胞类型和尺度。这个协议的一个重要步骤是利用氮气空化来打破细胞的打开。该议定书的第二部分是为了净化 mitoribosomes 而开发的。这一程序需要7小时, 并为生物化学和结构研究提供足够数量的 mitoribosomes。使用纯线粒体作为起始材料提供高质量的最终准备, 并可以推断其他线粒体大分子。
研究方案
所有哺乳动物细胞培养工作必须在一个生物安全柜内进行。使用无菌设备, 如果与细胞接触。佩戴丁腈橡胶手套和实验室大衣, 并遵循良好的组织培养实践。
1. 细胞培养
- 维持 HEK293S 悬浮细胞在 Dulbecco 的改良鹰培养基 (DMEM) 补充10% 无四环素的胎牛血清 (血清), 5 微克/毫升 blasticidin 和200微克/毫升阿奇霉素, 37 摄氏度和 5% CO2。
- 最多可缩放9个 T175 烧瓶。在90% 融合, 收获细胞和旋转他们在 500 x g 5 分钟并用重悬的颗粒细胞 Freestyl 补充5% 无四环素的血清。使用自动单元格计数器计数单元格, 并将单元格浓度调整为 1.5 x 106细胞/毫升, 在通气摇瓶中。
注: 这通常对应于1000毫升通气瓶中的300毫升的起始体积。 - 孵育细胞在震动孵化器在37°c 和 5% CO2在 120 rpm (50 毫米震动直径)。
- 2天后数细胞, 并进行分裂的细胞, 如果细胞密度超过 3.0 x 106细胞/毫升。在 2 x 250 毫升的锥形瓶中, 2 x 150 毫升的细胞培养在500克上, 用5个 x 2 毫升, 新鲜的培养基和转移到 10 x 2, 1 毫升通气烧瓶, 其中包含适当体积的最后细胞密度, 将细胞分裂成并用重悬细胞。1.5 x 106细胞/毫升,如2 x 300 毫升从起始细胞密度 3.0 x 106细胞/毫升。
- 孵育细胞在震动孵化器在37°c 和 5% CO2在 120 rpm (50 毫米震动直径)。
- 两天后数细胞, 并进行分裂细胞, 如果细胞密度超过 3.0 x 106细胞/毫升。用 4 x 250 毫升的锥形瓶在500克上旋转 4 x 150 毫升细胞培养, 在5个 x 2 毫升新鲜的介质中分离细胞, 并将其转移到 10 x 2 毫升的通风瓶中, 其中包含适当体积的最后细胞密度为 2000 x. 并用重悬106细胞/毫升,例如2 x 700 毫升从起始细胞密度 3.0 x 106细胞/毫升。
- 孵育细胞在震动孵化器在37°c 和 5% CO2在 120 rpm (50 毫米震动直径)。
- 两天后数细胞, 并进行分裂细胞, 如果细胞密度超过 3.0 x 106细胞/毫升。将 2 x 700 毫升细胞培养成 2 x 2800 毫升通气烧瓶, 然后用 2 x 300 毫升新鲜培养基将细胞分裂, 达到 2 x 1 升的体积。
- 孵育细胞在颤动孵化器和 5% CO2在 120 rpm (50 毫米震动直径)。
- 在24小时计数细胞和收获细胞, 如果细胞密度是在 3.0-4.0 x 106细胞/毫升之间。
2. 线粒体隔离
- 需要缓冲区
注: 从 2 L 细胞中给出了制备的数量。提前为线粒体隔离缓冲 (MIB)、蔗糖/甘露醇缓冲 (SM4)、实验缓冲器 (MIBSM)、泥沙缓冲器 (SEM) 准备以下库存解决方案。- 制作 0.5L MIB 缓冲器: 50mM HEPES, pH 值 7.5, 10 毫米氯化钾, 1.5mM 氯化镁2, 1 毫米 EDTA, 1 毫米 EGTA, 1mM 打孔, 蛋白酶抑制剂。
- 使100毫升 SM4 缓冲: 280 毫米蔗糖, 840 毫米甘露醇, 50 毫米 HEPES, pH 值 7.5, 10 毫米氯化钾, 1.5 毫米氯化镁2, 1 毫米 EDTA, 1 毫米 EGTA, 1m 米的德勤, 蛋白酶抑制剂。
- 制作160毫升 MIBSM 缓冲器: 120 毫升 MIB 缓冲器 + 40 毫升 SM4 缓冲器。
- 存储200毫升 PBS 在4°c。
- 制作5毫升 SEM 缓冲器: 250 毫米蔗糖, 20 毫米 HEPES, pH 7.5, 1 毫米 EDTA。
- 分别对含20毫米 HEPES、pH 7.5、1毫米 EDTA 和 60%/32%/23% 和15% 蔗糖的逐步蔗糖梯度进行 4 x 10 毫升的库存解决方案。
- 线粒体隔离
注意: 快速工作和在整个过程中保持冰上的一切是很重要的。 - 预冷氮气空化室使用前。
- 2 x 1 L 细胞 (每离心管 3-4 x 109细胞) 离心在 1000 x g 为7分钟, 4 °c。
- 仔细醒酒上清, 在 2 x 100 毫升 PBS 中快速并用重悬颗粒细胞。池中的单元格。
- 离心悬浮细胞在 1200 x g 10 分钟, 4 °c。
- 仔细醒酒上清, 称量颗粒 (~ 20 克)。
- 并用重悬120毫升的 MIB 缓冲器中的颗粒。
- 在寒冷的房间里轻轻搅拌10分钟, 使细胞膨胀。
- 将氮气空化室放在冰上, 将膨胀的细胞转移到氮气空穴室。添加45毫升 SM4 缓冲器 (悬浮细胞的最终体积的 1/3, 约140毫升, 最终浓度为70毫米蔗糖和210毫米甘露醇)。
- 紧固氮气空化室, 填充氮气直至压力达到 500 psi。关闭水龙头, 在冰上保持隔离20分钟。
- 慢慢释放氮气空化室的压力, 收集裂解液 (大约185毫升)。
- 离心裂解材料去除细胞残骸和原子核在 800 x g 为15分钟, 4 °c。
- 通过把棉布倒入冰上的烧杯中, 收集上清液。不要丢弃小球。
- 并用重悬90毫升 MIBSM 缓冲器中的颗粒 (前卷 1/2)。融汇使用聚四氟乙烯/玻璃 Dounce 均质机, 并重复离心在 800 x g 15 分钟, 4 摄氏度。
- 通过把棉布倒入冰上的烧杯中, 收集上清液。将这上清液与2.2.11 的上清液结合。
- 离心机联合上清液在 1000 x g 为15分钟, 4 °c。
- 通过把棉布倒入冰上的烧杯中, 收集上清液。
- 丢弃颗粒和离心机, 含有粗线粒体的上清液在 1万 x g 15 分钟, 4 摄氏度。
注: 颗粒通常由两部分组成: 松和紧。 - 小心清洗松散的颗粒, 不干扰紧的部分。并用重悬10毫升 MIBSM 缓冲液中的致密颗粒。
- 使用商业蛋白质检测试剂盒或类似方法进行蛋白质浓度测定。典型的浓度从2升开始培养的产量是2毫克/毫升。
- 添加200单位的 RNase 免费 DNase 和离开旋转在一个辊在冷室20分钟, 以均匀混合 DNase, 以去除基因组 DNA。
- 离心机在 1万 x g 为15分钟, 4 °c 和并用重悬在2毫升 SEM 缓冲器的颗粒。融汇使用小型聚四氟乙烯/玻璃 Dounce 均质机并用重悬任何剩余的骨料。执行不超过五的上下刀路以避免破损。保持冰块。
- 将14毫升 SW40 管中的蔗糖梯度吹打1.5 毫升60% 蔗糖的缓冲液放入管底。小心地添加4.5 毫升的32% 蔗糖库存缓冲在60% 波段的顶部, 而不干扰它。重复1.5 毫升23% 蔗糖库存缓冲器, 再与1.5 毫升15% 蔗糖库存缓冲。
- 将整个线粒体悬浮液 (大约3毫升) 加载到蔗糖梯度的顶端。
- 离心机在 SW40 转子在 139, 065 x g 60 分钟。
- 仔细收集的褐色带迁移到32% 和60% 蔗糖的界面使用转移吸管, 通常2-3 毫升。
- 在液氮中冷冻纯化的线粒体, 贮存在-80 摄氏度。
3. Mitoribosome 准备
- 需要缓冲区
注: 提前准备以下库存解决方案, 以进行裂解缓冲、蔗糖缓冲/梯度和泥沙缓冲。- 制作10毫升裂解缓冲液:25 毫米 HEPES, pH 7.5, 150 毫米氯化钾, 50mM MgOAc, 2% 聚乙二醇对辛醚, 2 毫米打孔, 蛋白酶抑制剂。
- 使10毫升蔗糖缓冲缓冲: 1 米蔗糖 (34% 瓦特/v), 20 毫米 HEPES, pH 7.5, 100 毫米氯化钾, 20 毫米 MgOAc, 1% 聚乙二醇对辛醚, 2 毫米。
- 制作5毫升泥沙缓冲器:20 毫米 HEPES, pH 7.5, 100 毫米氯化钾, 20mM MgOAc, 2 毫米
- 在 TLS-55 聚碳酸酯管中用泥沙缓冲剂制作 15%-30% 线性蔗糖梯度。
- Mitoribosome 净化
- 解冻冰上冰冻的线粒体。
- 添加2卷的溶解缓冲液,例如, 将6毫升裂解缓冲液添加到3毫升的线粒体中。立即混合, 通过多次反转管。
- 融汇与小型聚四氟乙烯/玻璃 dounce 均质机, 以协助裂解和孵化5-10 分钟的冰, 以完成裂解。
- 离心裂解材料 (大约9毫升) 在 3万 x g 为20分钟, 4 °c 去除不溶性的材料。从颗粒中仔细醒酒上清, 丢弃颗粒。
- 重复离心在 3万 x g 20 分钟在4°c, 以确保澄清上清。从颗粒中仔细醒酒上清, 丢弃颗粒。
- 在120.2 管 (超清) 中制备蔗糖缓冲垫: 每管0.4 毫升蔗糖缓冲。每毫升裂解材料准备一管。
- 在蔗糖垫子上的层裂解线粒体: 每管大约1毫升, 造成裂解: 缓冲率为 2.5: 1。
- 离心样品在 231, 550 x g 为45分钟在 TLA120.2 转子在4°c。
- 用100µl 的泥沙缓冲液, 除去上清和冲洗管子, 去除残余蔗糖。
- 并用重悬在总100µl 泥沙缓冲颗粒。
- 涡在慢速三十年代溶化剩余的骨料和离心机在 17949 x g 为10分钟在微细离心机在4°c。
- 仔细收集上清, 重复离心。
- 测量 mitoribosome 吸收在260。
注: 典型产量为 7 260, 260:280比率1.3。 - 将整个样品装入单线性蔗糖梯度管。离心机在 TLS-55 转子在 213, 626 x g 120 分钟在4°c。
- 分级梯度, 确定光学密度在260和池的分数对应的核酸峰值一起。
注: 典型的a260: 峰值的280比率为 > 1.6。 - 如果需要, 请使用选择方法交换缓冲区。使用转换 1 260 = 0.1 毫克/毫升计算最终浓度。
- 泥沙缓冲液中的纯化 mitoribosome 样品, 贮存在-80 摄氏度。
结果
分离和高活性细胞是有效 mitoribosomes 纯化的基本出发点。本协议适用于任何 HEK293 悬浮细胞。我们使用内部细胞线 T501, 这是稳定地表达一个运输者在四环素诱导控制。父母细胞线是 HEK293S-GnTI 细胞 (材料表)10。在细胞生长和扩展的自由式293表达培养基中, 最小密度应保持在 1.5 x 106细胞/毫升, 以确保每两天加倍率, 而最大细胞密度不应超过 ~ 5 x 106细胞/在达到 3 x 106细胞/毫升的细胞密度后, 细胞在一个新鲜的, 预热的介质中颗粒化和悬浮, 以达到 1.5 x 106细胞/毫升的最小细胞密度。这种分裂每2-3 天重复执行一次, 直到达到该过程所需的细胞质量。最终细胞密度可以在 3-4. 5 x 106细胞/毫升的范围内变化, 至少 2 L 作为分离线粒体的起始点。细胞的生存能力应普遍保持 > 90%, 并为最终的文化收获 > 95%。不推荐用抗生素治疗大范围细胞培养。
经过一系列的差异 centrifugations 后, 2.2.20 的线粒体悬浮量通常在3-5 毫升范围内。然后在蔗糖梯度 (图 1) 与其他细胞器分离线粒体。制备了逐步蔗糖梯度, 使梯度的体积和线粒体悬浮体的体积一起填满离心管的最大体积。这里需要特别的照顾, 以收集的褐色带迁移到 60%/32% 界面, 从周围的缓冲区最小的污染。这是重要的, 以保持恒定的蛋白质: 洗涤剂比在以下步骤线粒体增溶。建议在现阶段对线粒体蛋白浓度进行评估, 并期望从 1010培养的 HEK 细胞中获得15-20 毫克总线粒体蛋白的典型产量。
在线粒体分离成功后, 裂解加入聚乙二醇对辛醚, mitoribosomes 通过蔗糖垫分离 (图 2)。为了将 mitoribosomes 与疏水性膜质物质分离, 在不含洗涤剂的缓冲液中悬浮颗粒, 疏水配合物通过离心法颗粒。这个过程是重复的, mitoribosomes 的纯化程度是由260/280的比率来量化的, 预计是1.3。典型的产量是7260从 2 L 开始文化。该 mitoribosomal 分数还含有额外的大可溶性线粒体复合物, 如丙酮酸脱氢酶和谷氨酸脱氢酶。将 mitoribosomes 与可溶性线粒体复合物分离, 将上清液应用于蔗糖密度梯度。含 mitoribosome 的分数通常位于管的底部第三。蔗糖梯度的分馏可以用自动活塞或手动的方式来完成, 或者用一根吸管仔细地取50µL 馏分, 或者用21克针打在管子底部, 然后收集水滴。
在渐变中确定了两个主要的 mitoribosomal 种群: monosome 55S 和大亚基 39S, 如图 3和图 4所示。大亚单位分数的存在表明细胞在高度活跃的分裂状态11被收获。monosome 与大亚单位峰之间的比值可能会发生变化。另一峰靠近底部可能出现在污染细胞质核糖体80S 的准备工作。请注意, 小蔗糖梯度使用摆动斗转子 TLS-55 允许快速纯化约1毫升的 mitoribosomes 在光密度为 0.4-1 260。monosome 和大亚单位峰的分离可能因分馏而略有不同, 但通常有两个峰的重叠。因此, 为了确保样本中 monosome 的比例最高, 或者更大的亚单位, 应考虑要收集哪些分数和池。对于高分辨率的低温 EM 研究, 两个 mitoribosomal 种群之间的分离不是绝对需要的 (由于在硅操作中额外)。但是, 如果需要更好的分离, 建议使用较大的管和相应的运行时间。

图 1: 在蔗糖梯度上纯化线粒体.从 2 L 启动培养的亚细胞细胞器, 通过一系列的差异 centrifugations 的划分, 如协议所述, 线粒体在不连续的蔗糖梯度上分离。纯化的线粒体在 32%/60% 界面的下部带中被发现。

图 2: 在蔗糖垫上纯化 mitoribosomes.从2升开始培养的粗 mitoribosomes 沉淀1米蔗糖缓冲。这些小球悬浮在无洗涤剂的缓冲器中, mitoribosomes 被两个 centrifugations 澄清, 如协议所述。吸光度的记录, 以评估的质量准备和典型的260/280比率 1.3 (右面板) 证明一个 mitoribosome 丰富的分数。请单击此处查看此图的较大版本.
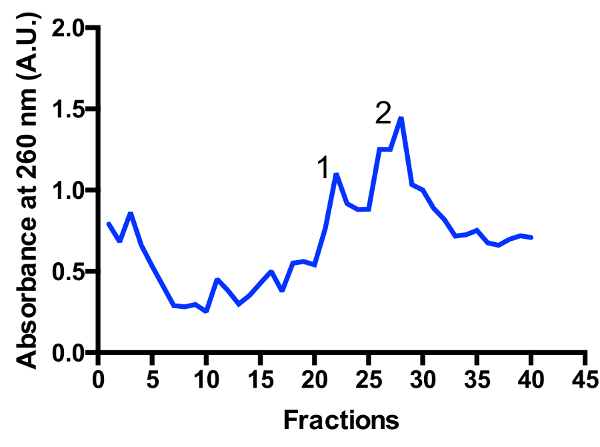
图 3: mitoribosomes 在蔗糖梯度上的精细纯化.从2升开始培养的吸收量。分数从渐变的顶部到底部进行编号。确定了两个主要的 mitoribosomal 种群: 大亚基 (峰值 1) 和 monosome 55S (峰值 2)。人口之间的比例可能会发生变化。请单击此处查看此图的较大版本.

图 4: 电子显微图像, 2D 类, 3D 重建.左面板:从 monosome 峰值2的样本的显微图像, 校准放大倍数为 1.23/像素。中间板:一个代表性的后处理数据 (2D 类), 揭示完整的 monosomes。右面板: 3D 重建。请单击此处查看此图的较大版本.
讨论
关于起始材料的来源, 虽然已知为丰富的线粒体来源的动物组织相对容易获得, 但这使得它成为 mitoribosomes3、5、12的流行选择, 13、不能轻易在实验室进行基因改造和复制。因此, 有明确的实际需要, 制定涉及均匀培养的人类细胞系的协议。处理组织和培养细胞的协议的主要区别是裂解和均匀化的模式。作为单层培养细胞, 典型的方法是聚四氟乙烯/玻璃 dounce 均匀化14。最初的准备协议, 而有效的是为小规模15开发。直接放大使用500毫升容量的均质机是可能的11, 但是, 它需要2小时的人工劳动, 以达到80% 裂解。这至少引入了三个问题: 由于长时间等待时间的细胞器聚集, 由于重物质下沉到大容器的底部而导致的非均质裂解, 由于需要多冲程, 样品加热。因此, 最好的裂解方法是利用氮气空化, 这是基于加压容器16,17减压。在这种方法中, 细胞首先膨胀在寒冷的房间, 以软化细胞, 使他们更容易溶解。由于它们被放置在氮气空化装置中, 添加了含有蔗糖和甘露醇的缓冲液, 以保持渗透压力, 从而有助于保持线粒体的完好。氮气空化装置然后加压以大容量无氧氮气, 溶化入细胞。由于压力释放出溶液中的氮气气泡, 导致细胞膜破裂。该方法具有与剪切应力和摩擦力有关的机械均质方法的优点: 1) 避免了细胞内的任何外部物理应力;2) 冷却试样的绝热膨胀, 确保对细胞器无热损伤;3) 细胞成分受惰性氮气的氧化保护;4) 悬浮介质无 pH 改变;5) 该过程是一致的, 可重复的, 因为同样的破坏性力量在每个细胞和整个样本中应用;6) 工艺快速, 可在20-30 分钟内完成。
在文献中广泛描述了细胞和组织中线粒体的分离, 它是以温和的细胞分裂为基础, 其次是一系列的差异 centrifugations。目前使用的大多数协议都遵循在上世纪18中期开发的原始程序。虽然基本的生物化学方法是正确的, 有几个误解, 在文献中强调, 并保持未被发现。为了优化 mitoribosomes 协议, 我们系统地研究了报告的一般原理, 并得出结论: 1) 在缓冲器中加入 Mg2 +和 K 是不重要的.有人认为, 氯化钾有助于防止细胞质蛋白形成凝胶19, 但是, 提供了足够的稀释, 如我们的议定书所述, 这种现象不会发生。此外, 排除镁2 +是有用的减少污染物的细胞质核糖体20;2) 没有必要将细胞的最大体积比保持在培养基上, 以保护被释放的器不受低渗透环境的侵害。我们的协议中的渗透支持是充足的由含蔗糖的缓冲, 并稀释细胞与线粒体隔离缓冲 (步骤 2. 5) 是一个重要的是有效分离器在大规模的准备。
线粒体分离缓冲液 pH 值接近生理价值,即7.5, 这也是以下 mitoribosome 准备的最佳 ph 值。结合剂 EDTA 和 EGTA 被添加到隔离介质中, 以螯合污染离子, 并分别螯合游离镁和钙。讨论了 EDTA 的加入可能导致内线粒体膜的损伤14, 因此浓度限制为1毫米作为预防措施。在蔗糖密度梯度的最终纯化步骤中, 我们没有观察到5毫米 EDTA 的差异。
本文所述的协议使用 HEK293S-derived 人类细胞纯化 mitoribosome。该制剂的质量使所获得的样品能够生化和结构地进行原子分辨率的研究。这使得人们可以将该方法应用于人类 mitoribosomal 翻译复合体、质量控制组件和 mitoribosomal 亚基中间体。此外, 由于癌细胞已扩增 OXPHOS 容量和高线粒体蛋白的翻译与相邻的基质组织21, mitoribosomes 是建立癌症的药物靶点22。因此, 在抑制剂存在的情况下, 使用本协议对 mitoribosomes 进行特定的纯化将有医学应用。此外, mitoribosomal 突变已与遗传性线粒体疾病23。由于这些突变对结构有直接的影响, 这里提出的方法将有助于它们的结构表征。该协议可以被实验性地扩展, 并应用于各种科学问题, 解决人类线粒体中翻译的基本理解及其医学意义。
披露声明
没有
致谢
这项工作得到瑞典战略研究基金会 (未来领导人赠款 FFL15:0325)、拉格纳 Söderberg 基金会 (医学 M44/16)、瑞典研究理事会 (启动赠款 NT×2015-04107)、FEBS 长期研究金 (SA) 的支持。, H2020-MSCA-ITN-2016 项目 721757 (VS)。
材料
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) high glucose, GLUTAMAX supplement, pyruvate | Thermo Scientific | 31966-021 | |
| Fetal Bovine Serum (FBS) | Thermo Scientific | 16000-044 | |
| Blasticidin S HCl | Thermo Scientific | R210-01 | |
| Zeocin selection reagent | Thermo Scientific | R25001 | 100 mg/ml |
| Freestyle 293 Expression medium | Thermo Scientific | 12338026 | |
| T175 tissue culture flask with vented cap | Sarstedt | 83.3912.002 | |
| Shaker flasks with vented cap | Thermo Scientific | 4115-0500, 4115-1000, 4115-2000, 4115-2800 | |
| 250 ml conical bottle tubes, sterile | Corning | 430776 | |
| Eve automated cell counter | NanoEnTek | E1000 | |
| Nitrogen cavitation cell disruption vessel | Parr Instruments | 4635, 4639 | safety volume: 40ml, 600ml respectively |
| Dnase (RNA-free) | HT Biotechnology | N401a | |
| Teflon/glass dounce homogenizers | Cambridge Glassblowing Limited | Size designed upon request | |
| SW40 tubes for mitochondria gradient | Beckman | 344060 | Polypropylene, thin wall |
| Transfer pipettes | Sarstedt | 86.1171 | |
| TLA 120.2 tubes for cushion | Beckman | 343778 | Polycarbonate, thick wall |
| TLS-55 tubes for gradient | Beckman | 347356 | Ultra-clear |
| Gradient Station IP | BioComp | 153-002 |
参考文献
- Ott, M., Amunts, A., Brown, A. Organization and regulation of mitochondrial protein synthesis. Annual review of biochemistry. 85, 77-101 (2016).
- Amunts, A., Brown, A., Toots, J., Scheres, S. H., Ramakrishnan, V. The structure of the human mitochondrial ribosome. Science. 348 (6230), 95-98 (2015).
- Greber, B. J., Bieri, P., Leibundgut, M., Leitner, A., Aebersold, R., Boehringer, D., Ban, N. The complete structure of the 55S mammalian mitochondrial ribosome. Science. 348 (6232), 303-308 (2015).
- Greber, B. J., Ban, N. Structure and function of the mitochondrial ribosome. Annual review of biochemistry. 85, 103-132 (2016).
- Greber, B. J., Boehringer, D., Leitner, A., Bieri, P., Voigts-Hoffmann, F., Erzberger, J. P., Ban, N. Architecture of the large subunit of the mammalian mitochondrial ribosome. Nature. 505 (7484), 515-519 (2014).
- Rorbach, J., Gao, F., Powell, C. A., D'Souza, A., Lightowlers, R. N., Minczuk, M., Chrzanowska-Lightowlers, Z. M. Human mitochondrial ribosomes can switch their structural RNA composition. Proceedings of the National Academy of Sciences. , 201609338 (2016).
- Chrzanowska-Lightowlers, Z., Rorbach, J., Minczuk, M. Human mitochondrial ribosomes can switch structural tRNAs-but when and why?. RNA biology. 14 (12), 1668-1671 (2017).
- Gammage, P. A., Moraes, C. T., Minczuk, M. Mitochondrial Genome Engineering: The Revolution May Not Be CRISPR-Ized. Trends in Genetics. , (2017).
- Brown, A., Rathore, S., Kimanius, D., Aibara, S., Bai, X. C., Rorbach, J., Ramakrishnan, V. Structures of the human mitochondrial ribosome in native states of assembly. Nature Structural and Molecular Biology. 24 (10), 866 (2017).
- Reeves, P. J., Callewaert, N., Contreras, R., Khorana, H. G. Structure and function in rhodopsin: high-level expression of rhodopsin with restricted and homogenous N-glycosylation by tetracycline-inducible N-acetylglucosaminyltransferase I-negative HEK293S stable mammalian cell line. Proceedings of National Academy of Sciences USA. 99, 13419-13424 (2002).
- Brown, A., Amunts, A., Bai, X. C., Sugimoto, Y., Edwards, P. C., Murshudov, G., Ramakrishnan, V. Structure of the large ribosomal subunit from human mitochondria. Science. 346 (6210), 718-722 (2014).
- O'Brien, T. W., Kalf, G. F. Ribosomes from rat liver mitochondria I. Isolation procedure and contamination studies. Journal of Biological Chemistry. 242 (9), 2172-2179 (1967).
- Spremulli, L. L. Large-scale isolation of mitochondrial ribosomes from mammalian tissues. Mitochondria: Practical Protocols. , 265-275 (2007).
- Rice, J. E., Lindsay, J. G., Grahamand, J. M., Rickwood, D. Subcellular fractionation of mitochondria. Subcellular Fractionation: A Practical Approach. , 107-142 (1997).
- Attardi, G., Ching, E. Biogenesis of mitochondrial proteins in HeLa cells. Methods in enzymology. 56, 66-79 (1979).
- Gottlieb, R. A., Adachi, S. Nitrogen cavitation for cell disruption to obtain mitochondria from cultured cells. Methods in enzymology. 322, 213-221 (2000).
- Simpson, R. J. Disruption of cultured cells by nitrogen cavitation. Cold Spring Harbor Protocols. 2010 (11), (2010).
- Kennedy, E. P., Lehninger, A. L. Oxidation of fatty acids and tricarboxylic acid cycle intermediates by isolated rat liver mitochondria. Journal of Biological Chemistry. 179 (2), 957-972 (1949).
- Graham, J. M. Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Amunts, A., Brown, A., Bai, X. C., Llácer, J. L., Hussain, T., Emsley, P., Ramakrishnan, V. Structure of the yeast mitochondrial large ribosomal subunit. Science. 343 (6178), 1485-1489 (2014).
- Sotgia, F., Martinez-Outschoorn, U. E., Howell, A., Pestell, R. G., Pavlides, S., Lisanti, M. P. Caveolin-1 and cancer metabolism in the tumor microenvironment: markers, models, and mechanisms. Annual Review of Pathology: Mechanisms of Disease. 7, 423-467 (2012).
- Škrtić, M., Sriskanthadevan, S., Jhas, B., Gebbia, M., Wang, X., Wang, Z., Lai, C. K. Inhibition of mitochondrial translation as a therapeutic strategy for human acute myeloid leukemia. Cancer cell. 20 (5), 674-688 (2011).
- Boczonadi, V., Horvath, R. Mitochondria: impaired mitochondrial translation in human disease. The international journal of biochemistry & cell biology. 48, 77-84 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。