Method Article
Schnelle Isolierung von Mitoribosome von HEK Zellen
In diesem Artikel
Zusammenfassung
Mitochondrien haben Ribosomen spezialisiert, die von bakteriellen und zytoplasmatischen Gegenstücke abwich. Hier zeigen wir, wie Mitoribosomes ihre native Fach in HEK Zellen entnommen werden können. Die Methode besteht darin, Isolierung von Mitochondrien aus Aussetzung Zellen und konsequente Reinigung der Mitoribosomes.
Zusammenfassung
Die menschlichen Mitochondrien besitzen eine engagierte Gruppe von Ribosomen (Mitoribosomes), die 13 essentielles Protein-Komponenten der Oxidative Phosphorylierung komplexe von mitochondrialen Genoms kodiert zu übersetzen. Da alle Proteine synthetisiert durch menschliche Mitoribosomes integraler Membranproteine sind, sind menschliche Mitoribosomes angebunden, um die innere Mitochondrien-Membran während der Übersetzung. Im Vergleich zu der cytosolischen Ribosom hat die Mitoribosome eine Sedimentation Koeffizient der 55-jährigen, die Hälfte der rRNA-Inhalt, keine 5 s rRNA und 36 weitere Proteine. Stellen Sie daher eine höhere Protein-RNA-Verhältnis und eine atypische Struktur der menschlichen Mitoribosome wesentlich verschieden von der cytosolischen Gegenstück.
Trotz der zentralen Bedeutung der Mitoribosome zum Leben wurden keine Protokolle zur Verfügung, den intakten Komplex aus humanen Zelllinien zu reinigen. Traditionell wurden Mitoribosomes aus reich an Mitochondrien tierischen Geweben, die Kilogramm erforderlich isoliert des Ausgangsmaterials. Wir begründete, dass Mitochondrien in der Teilung HEK293 abgeleitete menschlicher Zellen in nährstoffreichen Ausdruck Medium angebaut eine aktive mitochondrische Übersetzung hätte, und daher eine geeignete Quelle von Material für die strukturellen und biochemische Studien der wäre die Mitoribosome. Um seine Struktur zu untersuchen, haben wir ein Protokoll für die großflächige Reinigung der intakten Mitoribosomes von HEK Zellen entwickelt. Hier stellen wir Ihnen Stickstoff Kavitation Methode als eine schnellere, weniger arbeitsintensiv und effizientere Alternative zu traditionellen mechanische Scherung-basierte Methoden zur Zelle Lysis. Dies führte zu Vorbereitungen für die Mitoribosome, die für die Strukturaufklärung, hohe Auflösung, enthüllt die Zusammensetzung des intakten menschlichen Mitoribosome und seine Montage Zwischenprodukte zulässig. Hier wir follow-up zu dieser Arbeit und präsentieren ein optimiertes und weitere kostengünstige Methode erfordert nur ~ 1010 HEK Zellen kultiviert. Die Methode kann eingesetzt werden, um menschliche Mitoribosomal übersetzen komplexe, Mutanten, Qualitätskontrolle Baugruppen und Mitoribosomal Untereinheiten Zwischenprodukte zu reinigen. Die Reinigung kann linear verzehnfacht skaliert werden wenn nötig, und auch auf andere Arten von Zellen angewendet.
Einleitung
Der Prozess der mitochondrialen Proteinsynthese basiert auf 13 wesentliche Mt-mRNAs, die durch eine spezielle Membran befestigt Mitoribosome um die katalytische Kern der Atmungskette übersetzt werden. Die veränderten mitochondrische Genome und der Bedarf an Proteinen, co-translationally in der Membran einzufügen haben die Architektur des mitochondrialen Ribosomen1wesentlich geprägt. Den letzten hochauflösende Strukturen von Säugetieren Mitoribosome zeigten eine auffallend anders Gesamterscheinung der bakteriellen Gegenstück2,3. Insbesondere werden mindestens 36 Mitochondrien-spezifische Proteine hinzugefügt, einen Beitrag ~ 1 MDa zusätzliche molekulare Masse, während Mt-rRNA ist durch zweifache reduziert und sehr auseinander. Die strukturelle Umstellungen ändern fast alle kritischen Funktionen, die zuvor in der Regel akzeptiert wurden um universell4konserviert.
Wichtigsten Neuerungen wurden jeweils die Mitoribosomal Untereinheiten erworben, z. B. der kleinen Untereinheit hat eine intrinsische GTPase Protein mS29 in seiner 'Kopf'-Region integriert. GTPase-Aktivität nicht in anderen Übersetzungssysteme gefunden wurde, und die Struktur zeigt an, dass die GTPase bei Untereinheit Baugruppe2eine Rolle spielen könnte. Die 5 s rRNA, die geglaubt wurde, um ein Wahrzeichen von allen bekannten ribosomale großen Untereinheiten, bilden den Kern der zentralen Protuberanz, hat fehlt in den Säugetieren Mitoribosome und Mt-tRNA-Val als integraler Baustein stattdessen2. Verbot und Kollegen zeigten, dass die Schweine Mitoribosome Mt-tRNA-Phe hat und nicht – Val5. Chrzanowska-Lightowlers, Minczuk, knüpfte an diese Daten und Kollegen festgestellt, dass Mitoribosomes von Patienten mit infizierten Mt-tRNA-Val Stabilität im Prinzip Mt-tRNA-Phe6,7aufnehmen kann. Warum die Mitoribosomes diese spezifische Elemente und welche Wege und Transeingeflossen-Faktoren sind erforderlich, für diese einzigartige Assemblys unbekannt bleiben.
Alles in allem die hohe Komplexität des menschlichen Mitoribosome, neue Proteinkomponenten und die einzigartige Verbindung von Mt-tRNA als Strukturelement implizieren die Einbeziehung der noch unbekannten Mitochondrien-spezifische Trans -Faktoren. Jedoch weil viele der Merkmale dieses Systems einzigartig, Mitochondrien, die traditionell schwierig sind,8zu untersuchen, ist wenig über die molekularen und Qualitätskontrolle-Mechanismus bekannt. Mit der Entwicklung von hochauflösenden Einzelkorn Analyse von Elektron Cryo-Mikroskopie (Cryo-EM)20ergeben sich Möglichkeiten jetzt umfassend untersuchen die molekularen Mechanismen der Versammlung, Aktion und Qualitätskontrolle des menschlichen Mitoribosome. Unser Bericht der ersten Struktur der menschlichen Mitoribosome Versammlung Mittelstufe bietet die Anerkennung, dass es möglich ist, visualisieren, wie die menschliche Mitoribosome gebildet wird und zeigt, dass die Cryo-EM maßgeblich bei der Identifizierung von neuen Trans- amtierende Montage Faktoren9.
Um auf diese Initialaufwand zu erweitern, beschreiben wir ein schnelles Protokoll für menschliche Mitoribosome Reinigung im Detail. Im ersten Teil des Protokolls wird eine groß angelegte Isolation von hochreinen intakte Mitochondrien aus Aussetzung Zellen beschrieben. Dieses Verfahren kann erfordert 9 h und leicht modifiziert und angepasst an verschiedene Zelltypen und Skalen. Ein wichtiger Schritt in diesem Protokoll wird die Verwendung von Stickstoff Kavitation die Zellen aufzubrechen. Der zweite Teil des Protokolls wurde entwickelt, um Mitoribosomes zu reinigen. Dieses Verfahren erfordert 7 h und eine ausreichende Menge an Mitoribosomes für Biochemische und strukturelle Studien ergibt. Verwendung von reinen Mitochondrien als Ausgangsmaterial qualitativ hochwertige Letzte Vorbereitungen bietet und zu anderen mitochondrialen Makromolekülen extrapoliert werden kann.
Protokoll
Innerhalb einer biologischen Sicherheitsschrank müssen alle Säugetier-Zelle Kultur Arbeiten ausgeführt werden. Verwenden Sie sterilen Ausrüstung wenn Kontakt mit Zellen. Nitril-Handschuhe und einen Laborkittel zu tragen und gute Gewebekultur Praxis zu folgen.
(1) Zellkultur
- Pflegen Sie HEK293S Aussetzung Zellen in Dulbeccos geändert Eagle Medium (DMEM) mit 10 % Tetracyclin-freie fetalen bovine Serum (FBS), 5 μg/mL Blasticidin und 200 μg/mL Azithromycin, bei 37 ° C und 5 % CO2ergänzt.
- Skalieren Sie bis zu 9 x T175 Flaschen. Bei 90 % Konfluenz Zellen ernten und drehen sie sich 500 X g für 5 min. Aufschwemmen gebeizte Zellen in Freestyl ergänzt mit 5 % Tetracyclin-freie FBS. Anzahl Zellen mit Hilfe einer automatisierten Zelle entgegenzuwirken und Zellkonzentration auf 1,5 x 106 Zellen/mL in einem gelüfteten schütteln Kolben passen.
Hinweis: Dies wird in der Regel zu einem Ausgangspunkt Volumen von 300 mL in einem 1.000 mL belüftete Kolben entsprechen. - Inkubieren Sie Zellen in einem schütteln Inkubator bei 37 ° C und 5 % CO2 bei 120 u/min (schütteln Durchmesser 50 mm).
- Nach 2 Tagen zählen Sie die Zellen und fahren Sie mit die Zellen aufgeteilt, wenn die Zelldichte über 3,0 x 106 Zellen/mL. Die Zellen durch Drehen nach unten 2 x 150 mL Zellkultur in 2 x 250 mL konische Flaschen bei 500 g für 5 min. Aufschwemmen Zellen in 2 x 10 mL frische Medien teilen und übertragen auf eine 2 x 1 000 mL belüftete Fläschchen mit dem entsprechenden Volumen für eine endgültige Zelldichte von 1,5 x 106 Zellen/mL, z.B. 2 x 300 mL ab einer Zelle Dichte von 3,0 x 106 Zellen/mL.
- Inkubieren Sie Zellen in einem schütteln Inkubator bei 37 ° C und 5 % CO2 bei 120 u/min (schütteln Durchmesser 50 mm).
- Nach zwei Tagen zählen Sie die Zellen und fahren Sie mit die Zellen aufgeteilt, wenn die Zelldichte über 3,0 x 106 Zellen/mL. Teilung der Zellen durch Drehen nach unten 4 x 150 mL Zellkultur in 4 x 250 mL konische Flaschen bei 500 g für 5 min. Aufschwemmen Zellen in 2 x 10 mL frische Medien und transfer zum 2 x 2.000 mL belüftete Kolben mit dem entsprechenden Volumen für eine endgültige Zelldichte von 1,5 x 106 Zellen/mL, z.B. 2 x 700 mL von einem Ausgangspunkt Zelldichte von 3,0 x 106 Zellen/mL.
- Inkubieren Sie Zellen in einem schütteln Inkubator bei 37 ° C und 5 % CO2 bei 120 u/min (schütteln Durchmesser 50 mm).
- Nach zwei Tagen zählen Sie die Zellen und fahren Sie mit die Zellen aufgeteilt, wenn die Zelldichte über 3,0 x 106 Zellen/mL. Teilen Sie die Zellen durch das Gießen der 2 x 700 mL entlüftet Zellkultur in 2 x 2800 mL Fläschchen und Auffüllen mit 2 x 300 mL frische Medien zu einem Volumen von 2 x 1 L.
- Inkubieren Sie Zellen in einem schütteln Inkubator bei 37° C und 5 % CO2 bei 120 u/min (schütteln Durchmesser 50 mm).
- Nach 24 Stunden zählen Sie die Zellen und ernten Sie die Zellen zu, wenn die Zelldichte zwischen 3,0-4,0 x 106 Zellen/mL liegt.
(2) Mitochondrien Isolation
- Puffer erforderlich
Hinweis: Die Mengen sind für eine Zubereitung aus 2 L Zellen angegeben. Bereiten Sie die folgenden Stammlösungen vorzeitig für mitochondriale Isolierung Puffer (MIB), Saccharose/Mannit Puffer (SM4), experimentelle Puffer (MIBSM), Wiederfreisetzung Puffer (SEM).- Machen 0,5 L MIB Puffer: 50mM HEPES-KOH, pH 7,5, 10 mM KCl, 1,5 mM MgCl2, 1 mM EDTA, 1 mM EGTA, 1 mM DTT, Protease-Inhibitoren.
- 100 mL SM4 Puffer zu machen: 280 mM Saccharose, 840 mM Mannit, 50 mM HEPES-KOH, pH 7,5, 10 mM KCl, MgCl2, 1 mM EDTA, 1 mM EGTA, 1,5 mM 1 m M DTT, Protease-Inhibitoren.
- Machen 160 mL MIBSM Puffer: 120 mL MIB Puffer + 40 mL SM4 Puffer.
- 200 mL PBS bei 4 ° c Lagern
- 5 mL SEM Puffer zu machen: 250 mM Saccharose, 20 mM HEPES-KOH, pH 7,5, 1 mM EDTA.
- Machen Sie 4 x 10 mL auf lagerlösungen für den schrittweisen Saccharose-Verlauf mit 20 mM HEPES-KOH, pH 7,5, 1 mM EDTA und 60 % / 32 % 23 % und 15 % Saccharose, beziehungsweise.
- Mitochondrien-Isolierung
Hinweis: Es ist wichtig, schnell zu arbeiten und halten alles auf Eis während des Verfahrens. - Precool der Stickstoff Kavitation Kammer vor der Verwendung.
- Ernte 2 x 1 L-Zellen (3-4 x 109 Zellen pro Zentrifugenröhrchen) durch Zentrifugation bei 1.000 x g 7 min, 4 ° C.
- Den überstand vorsichtig abgießen und gebeizte Zellen rasch in 2 x 100 mL PBS Aufschwemmen. Bündeln Sie die Zellen.
- Zentrifugieren Sie die resuspendierte Zellen bei 1.200 x g für 10 min, 4 ° C.
- Den überstand vorsichtig abgießen und das Pellet (~ 20 g) wiegen.
- Das Pellet in 120 mL MIB Puffer aufzuwirbeln.
- Lassen Sie Zellen von leichtem rühren in einem kalten Zimmer für 10 min aufquellen.
- Platzieren Sie die Kavitation stickstoffkammer auf dem Eis und übertragen Sie schwoll an Zellen auf Kavitation stickstoffkammer. 45 mL SM4 Puffer (1/3 der letzte Band der resuspendierte Zellen, ca. 140 mL, eine Endkonzentration von 70 mM Saccharose und 210 mM Mannit nachgeben).
- Befestigen Sie die Kavitation stickstoffkammer und Füllung mit Stickstoff, bis der Druck 500 Psi erreicht. Schließen Sie Hähne und halten Sie für 20 min auf Eis isoliert.
- Langsam lassen Sie den Druck in die stickstoffkammer Kavitation und sammeln die lysate (ca. 185 mL).
- Zentrifugieren Sie lysierten Materials entfernen zellenrückstand und Kerne bei 800 X g für 15 min, 4 ° C.
- Sammeln des Überstands durch Gießen durch die Gaze in ein Becherglas auf Eis gehalten. Entsorgen Sie die Tablette nicht.
- Das Pellet in 90 mL MIBSM Puffer Aufschwemmen (1/2 das bisherige Volumen). Mit Teflon/Glas Dounce-Homogenisator zu homogenisieren Sie und wiederholen Sie die Zentrifugation bei 800 X g für 15 min, 4 ° C.
- Sammeln des Überstands durch Gießen durch die Gaze in ein Becherglas auf Eis gehalten. Kombinieren Sie diesen überstand mit der Überstand von Schritt 2.2.11.
- Zentrifugieren Sie die kombinierten Überstände bei 1.000 x g für 15 min, 4 ° C.
- Sammeln des Überstands durch Gießen durch die Gaze in ein Becherglas auf Eis gehalten.
- Das Pellet zu verwerfen und Zentrifugieren des Überstands enthält grobe Mitochondrien bei 10.000 x g für 15 min, 4 ° C.
Hinweis: Das Pellet wird in der Regel aus zwei Teilen bestehen: locker und eng. - Sorgfältig ausspülen der lose Pellets ohne zu stören den engen Teil. Die enge Pellet in 10 mL MIBSM Puffer aufzuwirbeln.
- Führen Sie einen Protein-Konzentration-Assay mit einem kommerziellen Protein Assay Kit oder ähnliche Methode. Typische Konzentration Erträge aus 2 L ab Kultur sind ~ 2 mg/mL.
- 200 Einheiten der RNase frei DNase und lassen um auf eine Walze in den kalten Raum für 20 min gleichmäßig mischen die DNase zur Entfernung der genomic DNA zu drehen.
- Zentrifugieren bei 10.000 x g für 15 min, 4 ° C und das Pellet in 2 mL SEM Puffer aufzuwirbeln. Homogenisieren Sie, sanft mit einer kleinen Teflon/Glas Dounce-Homogenisator zum restlichen Aggregate aufzuwirbeln. Führen Sie nicht mehr als fünf wechselvollen Pässe um Bruch zu vermeiden. Halten Sie auf dem Eis.
- Bereiten Sie die Saccharose-Gradienten in 14 mL SW40 Röhren durch sorgfältig pipettieren 1,5 mL 60 % Saccharose Lager Puffer in den Boden des Röhrchens vor. Fügen Sie sorgfältig 4,5 mL 32 % Saccharose Lager Puffer auf die 60 %-Band ohne es zu stören. Wiederholen Sie mit 1,5 mL 23 % Saccharose Lager Puffer und wieder mit 1,5 mL 15 % Saccharose Lager Puffer.
- Laden Sie die gesamte mitochondriale Aussetzung (ca. 3 mL) auf der Oberseite der Saccharose-Gradient.
- In SW40 Rotor bei 139, 065 X g für 60 min zentrifugieren.
- Sammeln Sie sorgfältig die braunen Band Migration auf der Schnittstelle zwischen 32 % und 60 % Saccharose, die mit einem transferpipette, in der Regel 2 bis 3 mL.
- Snap-Freeze die gereinigten Mitochondrien in flüssigem Stickstoff und Store bei-80 ° C.
3. Mitoribosome Vorbereitung
- Puffer erforderlich
Hinweis: Bereiten Sie die folgenden Stammlösungen vorzeitig für die Lyse Puffer, Saccharose Kissen/Verlauf und Wiederfreisetzung Puffer.- 10 mL Lyse Puffer zu machen: 25 mM HEPES-KOH, pH 7.5, 150 mM KCl, 50mM MgOAc, 2 % Polyethylenglykol Octylphenyl Äther, 2 mM DTT, Protease-Inhibitoren.
- 10 mL Saccharose Kissen Puffer zu machen: 1 M Saccharose (34 % w/V), 20 mM HEPES-KOH, pH 7.5, 100 mM KCl, 20 mM MgOAc, 1 % Polyethylenglykol Octylphenyl Äther, 2 mM DTT.
- 5 mL Wiederfreisetzung Puffer zu machen: 20 mM HEPES-KOH, pH 7.5, 100 mM KCl, 20mM MgOAc, 2 mM DVB-t
- Machen Sie 15-30 % linear Saccharose Steigungen mit Wiederfreisetzung Puffer in TLS-55 Polycarbonat Rohre.
- Mitoribosome Reinigung
- Tauen Sie die gefrorenen Mitochondrien auf Eis.
- Fügen Sie 2 Bände des Puffers Lyse,z. B. 3 mL Mitochondrien 6 mL Lyse Puffer hinzufügen. Mischen Sie sofort durch das Rohr mehrmals umdrehen.
- Homogenisieren Sie mit eine kleine Teflon/Glas Dounce-Homogenisator zu unterstützen die Lyse und inkubieren Sie für 5-10 min auf Eis um die Lyse abzuschließen.
- Zentrifugieren Sie lysierten Materials (ca. 9 mL) bei 30.000 x g für 20 min, 4 ° C, die unlösliche Material zu entfernen. Dekantieren des Überstands vorsichtig aus dem Pellet und entsorgen das Pellet.
- Wiederholen Sie die Zentrifugation bei 30.000 x g für 20 min bei 4 ° C um Klärung des Überstands sicherzustellen. Dekantieren des Überstands vorsichtig aus dem Pellet und entsorgen das Pellet.
- Vorbereiten der Saccharose-Kissen in TLA 120,2 Röhren (ultra clear): 0,4 mL Saccharose Kissen pro Röhre. Bereiten Sie eine Röhre pro mL lysierten Materials.
- Schicht lysierten Mitochondrien auf den Saccharose-Kissen: ca. 1 mL pro Röhre, wodurch ein lysate: Kissen-Verhältnis von 2,5: 1.
- Zentrifugieren Sie die Probe bei 231, 550 X g für 45 min in TLA120.2 Rotor bei 4 ° C.
- Verwerfen Sie den überstand und spülen Sie die Rohre nacheinander mit 100 µl des Puffers Wiederfreisetzung, Rest Saccharose zu entfernen.
- Die Pellets in insgesamt 100 µl Wiederfreisetzung Puffer aufzuwirbeln.
- Wirbel auf langsamen für 30 s, lösen sich die restlichen Aggregate und Zentrifugieren bei 17.949 x g für 10 min in reaktionscup Zentrifuge bei 4 ° c
- Sorgfältig sammeln Sie den überstand zu, und wiederholen Sie die Zentrifugation.
- Mitoribosome Absorption bei A260zu messen.
Hinweis: Die typische Ausbeute ist 7 A260, mit A260: A280 Verhältnis von 1,3. - Laden Sie die gesamte Probe auf einem einzelnen linearen Saccharose gradient Rohr. Zentrifuge in TLS-55 Rotor bei 213, 626 X g 120 Minuten bei 4 ° C.
- Fraktionieren Sie der Gradient, ermitteln Sie die optische Dichte bei A260 und bündeln Sie den Anteil entsprechend der Nukleinsäure-Gipfel zusammen.
Hinweis: Die typische A260: A280 Verhältnis des Peaks ist > 1.6. - Tauschen Sie den Puffer, wenn nötig, mit einer Methode der Wahl. Berechnen Sie die Endkonzentration mithilfe der Konvertierung 1 A260 = 0,1 mg/mL.
- Snap Einfrieren die gereinigten Mitoribosome Probe im Wiederfreisetzung Puffer und im Store bei-80 ° C.
Ergebnisse
Trennenden und höchst lebensfähigen Zellen ist ein wesentlicher Ausgangspunkt für die Reinigung der aktiven Mitoribosomes. Dieses Protokoll gilt für alle HEK293 Aussetzung Zellen. Wir benutzen eigene Zelllinie T501, die stabil einen Transporter unter Tetracyclin-induzierbaren Kontrolle ausdrückt. Die elterliche Zell-Linie ist HEK293S-GnTI– Zellen (Table of Materials)10. Während die Zelle Wachstum und Expansion im FreeStyle 293 Ausdruck Medium die minimaldichte, 1,5 x 10 aufbewahrt werden6 Zellen/mL, um eine Verdoppelung alle zwei Tage, während die maximale Dichte Zelle gewährleisten sollte nicht mehr als ca. 5 x 106 Zellen / mL. bei einer Zelldichte über 3 x 106 Zellen/mL erreichen sind die Zellen oelletiert und Nukleinsäuretablette in einem frischen, vorgeheizten Medium in ein erweitertes Volume, die minimale Zelldichte von 1,5 x 106 Zellen/mL zu erreichen. Diese Aufteilung erfolgt immer wieder alle 2-3 Tage, bis eine gewünschte Zelle Masse für das Verfahren erreicht wird. Die letzte Zelle Dichte variiert im Bereich von 3 bis 4,5 x 106 Zellen/mL, und mindestens 2 L ist als Ausgangspunkt für die Isolation von Mitochondrien erforderlich. Die Zellviabilität sollten in der Regel beibehalten werden, > 90 %, und für die endgültige Kultur, die geerntet wird, > 95 %. Behandlung der groß angelegten Zellkultur mit Antibiotika wird nicht empfohlen.
Nach der Serie von differenziellen Centrifugations ist das Volumen der mitochondrialen Suspension nach Schritt 2.2.20 typischerweise im Bereich von 3 bis 5 mL. Die Mitochondrien werden dann von anderen Organellen auf den Saccharose-Verlauf (Abbildung 1) getrennt. Der schrittweise Saccharose-Gradient ist bereit, derart, dass das Volumen des Farbverlaufs und das Volumen der mitochondrialen Suspension zusammen die Zentrifugation Röhre zu seinem maximalen Volumen füllen. Hier ist besondere Sorgfalt erforderlich, um die braune Band Migration auf 60 % zu sammeln / 32 % interface mit minimalen Verunreinigungen aus dem umliegenden Puffer. Dies ist wichtig, um konstante Protein: Waschmittel-Verhältnis im folgenden Schritt der Mitochondrien Solubilisierung zu halten. Es wird empfohlen, die mitochondriale Proteinkonzentration in diesem Stadium zu bewerten, und eine typische Ausbeute von 15-20 mg Gesamtprotein mitochondriale von ~ 1010 kultiviert HEK Zellen erwartet.
Nach erfolgreichen Mitochondrien isoliert sie sind durch den Zusatz von Polyethylenglykol Octylphenyl Äther lysiert und Mitoribosomes sind getrennt durch eine Saccharose-Kissen (Abbildung 2). Um Mitoribosomes aus der hydrophoben häutigen Substanz zu trennen, sind Pellets in den Puffer nicht mit Waschmittel Nukleinsäuretablette und hydrophoben komplexe sind durch Zentrifugation pelleted. Dieser Vorgang wird wiederholt, und der Grad der Reinigung der Mitoribosomes wird durch A260quantifiziert /A280 Verhältnis, die ~ 1.3 werden soll. Typische Ausbeute beträgt 7 A260 von einem 2 L Kultur ab. Diese Mitoribosomal-Fraktion enthält auch zusätzliche große lösliche mitochondriale komplexe, wie Pyruvat-Dehydrogenase und Glutamat-Dehydrogenase. Um die löslichen mitochondriale komplexe Mitoribosomes trennen, wird der Überstand ein dichtegradient Saccharose. Brüche mit den Mitoribosome befinden sich in der Regel am unteren Drittel des Rohres. Die Fraktionierung von Saccharose Verlaufs kann dann entweder mit einer automatisierten Kolben oder manuell sorgfältig 50 µL Brüche mit einer Pipette oder Stanzen den Rohrboden mit einer Nadel 21 G und sammeln die Tropfen erfolgen.
Zwei große Mitoribosomal Populationen sind im Verlauf gekennzeichnet: Monosome 55-jährigen und große Untereinheit 39 s, wie in dargestellt Abbildung 3 und Abbildung 4. Die Anwesenheit der großen Untereinheit Fraktion legt nahe, dass Zellen in einer hochaktiven teilenden staatliche11geerntet werden. Das Verhältnis zwischen dem Monosome und große Untereinheit Gipfeln kann sich ändern. Eine zusätzliche Spitze befindet sich näher an der Unterseite erscheinen in Zubereitungen mit verunreinigen cytoplasmatische Ribosomen der 80er Jahre. Bitte beachten Sie, dass der kleine Saccharose Farbverlauf mit den schwingenden Rotor TLS-55 Eimer ermöglicht die schnelle Reinigung von ~ 1 mL Mitoribosomes in eine optische Dichte von 0,4-1 ein260. Die Trennung von Monosome und große Untereinheit Gipfeln kann leicht variieren, je nach der Fraktionierung, aber normalerweise gibt es einige Überschneidungen der beiden Gipfel. Also, welche Fraktionen zu sammeln, und Pool sollte in Betracht gezogen werden, um den höchsten Anteil an Monosome oder alternativ große Untereinheit in der Probe zu gewährleisten. Für hochauflösende Cryo-EM Studien ist die Trennung zwischen den Bevölkerungen der Mitoribosomal nicht zwingend erforderlich (durch zusätzliche in Silico Operationen). Jedoch, wenn besserer Trennung notwendig ist, empfiehlt es größere Rohre und entsprechende Laufzeiten verwenden.

Abbildung 1 : Reinigung der Mitochondrien auf einer Steigung von Saccharose. Subzellularen Organellen aus einem 2 L ab Kultur wurden durch eine Reihe von differenziellen Centrifugations fraktioniert, wie im Protokoll beschrieben und Mitochondrien wurden auf einer diskontinuierlichen Saccharose Steigung getrennt. Die gereinigten Mitochondrien befinden sich in dem unteren Band an der Schnittstelle von 32 % / 60 %.

Abbildung 2 : Reinigung von Mitoribosomes auf einem Kissen von Saccharose. Grobe Mitoribosomes aus einer 2 L-Start-Kultur sind über 1 M Saccharose Kissen sedimentiert. Die Pellets werden in einem Waschmittel-freie Puffer Nukleinsäuretablette, und Mitoribosomes werden durch zwei Centrifugations geklärt, wie im Protokoll beschrieben. Die Extinktion wird aufgezeichnet, um die Qualität der Vorbereitung und typische A260bewerten /A280 Verhältnis der ~1.3 (Rechte Abbildung) bescheinigt einen Mitoribosome Reich Teil. Bitte klicken Sie hier für eine größere Version dieser Figur.
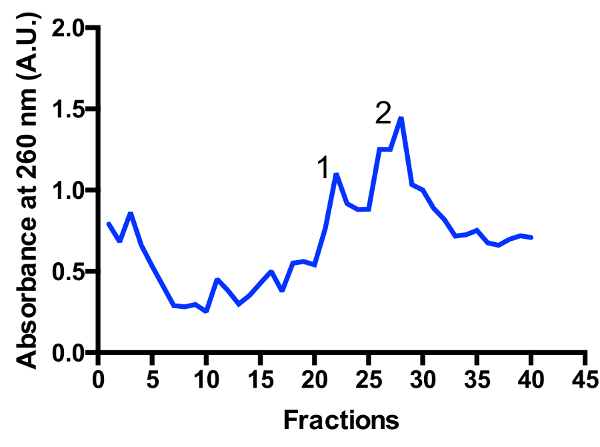
Abbildung 3 : Feine Reinigung des Mitoribosomes auf einer Steigung von Saccharose. Extinktion-Spur aus einer 2 L Kultur ab. Brüche sind an der Unterseite des Verlaufs von oben nummeriert. Zwei große Mitoribosomal Populationen sind identifiziert: große Untereinheit (Peak 1) und Monosome 55-jährigen (Peak 2). Das Verhältnis zwischen den Populationen kann sich ändern. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 : Elektron Schliffbild, 2D Klassen und 3D-Rekonstruktion. Links: ein Schliffbild mit der Probe vom Monosome Gipfel 2 bei einer kalibrierten Vergrößerung von 1,23 A / Pixel. Mitte-Panel: Eine repräsentativen Nachbearbeitung Daten (2D Klassen) intakte Monosomes enthüllt. Rechts: 3D Rekonstruktion. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In Bezug auf die Quelle des Ausgangsmaterials, obwohl die relativ leichte Verfügbarkeit von tierischem Gewebe, die als bekannt sind eine reiche Quelle von Mitochondrien, trifft es eine populäre Wahl für Mitoribosomes3,5,12, 13, sie können nicht genetisch veränderte und leicht im Labor reproduziert. Daher gibt es eine klare praktische Notwendigkeit für die Entwicklung von Protokollen mit homogen kultivierten humanen Zelllinien. Der wesentliche Unterschied zwischen den Protokollen Umgang mit Gewebe und kultivierten Zellen ist der Modus der Lyse und Homogenisierung. Für kultivierten Zellen als eine Monolage angebaut ist eine typische Methode Teflon/Glas Dounce Homogenisierung14. Die ursprüngliche Vorbereitung-Protokolle während effiziente wurden für kleine Schuppen15entwickelt. Eine direkte Skalierung mit einem Homogenisator mit einer Kapazität von 500 mL ist möglich11, jedoch erfordert es ~ 2 h der Handarbeit, 80 % Lyse zu erreichen. Dies führte mindestens drei Fragen: Aggregation der Organellen durch lange Wartezeiten, nicht-homogene Lyse durch schweres Material sinken auf den Boden eines großen Schiffes, Heizen der Probe aufgrund der Notwendigkeit von mehreren Strichen. Daher nutzt eine bevorzugte Methode der Lyse Stickstoff Kavitation, basiert auf Dekompression aus einer unter Druck stehenden Schiff16,17. Bei dieser Methode werden Zellen zuerst schwoll in den kalten Raum um die Zellen zu erweichen und machen sie anfälliger für Lyse. Wie sie in den Stickstoff Kavitation Gerät platziert werden ist ein Puffer mit Saccharose und Mannit hinzugefügt, um einen osmotischen Druck zu halten, der hilft, Mitochondrien intakt zu halten. Stickstoff Kavitation Gerät wird dann mit einem großen Volumen von Sauerstoff-freien Stickstoff, die in den Zellen löst sich unter Druck gesetzt. Da der Druck veröffentlichten stickstoffluftblasen aus Lösung Bersten der Zellmembranen ist. Diese Methode bietet mehrere Vorteile gegenüber mechanischen homogenisierende Methoden, bei denen Scherspannungen und Reibung wie folgt: 1) keine externen körperlicher Belastung auf die Zellen wird vermieden; (2) eine adiabatische Expansion, die die Probe kühlt garantiert keine Hitzeschäden Organellen; (3) Zellbestandteile sind der inerte Stickstoff vor Oxidation geschützt; (4) keine pH-Wert-Änderung des Mediums Aussetzung; (5) das Verfahren ist einheitlich und reproduzierbar, da die gleichen störenden Kräfte in jeder Zelle und im gesamten Beispiel angewendet werden; (6) das Verfahren ist schnell und kann innerhalb von 20-30 Minuten abgeschlossen werden.
Isolation von Mitochondrien aus kultivierten Zellen und Geweben ist in der Literatur ausführlich beschrieben worden, und es basiert auf einem sanften Zellaufschluss, gefolgt von einer Reihe von differenziellen Centrifugations. Die meisten der aktuell verwendeten Protokolle folgen der ursprünglichen Verfahren entwickelt, in der Mitte des vorigen Jahrhunderts18. Während die grundlegenden biochemischen Ansätze korrekt sind, gibt es einige Missverständnisse, die in der Literatur hervorgehoben und unentdeckt blieb. Um das Protokoll für Mitoribosomes zu optimieren, wir systematisch untersucht die gemeldeten allgemeinen Grundsätze und feststellen, dass: 1) Einbeziehung der Mg2 + und+ K im Puffer ist nicht entscheidend. Es ist argumentiert worden, dass die KCl hilft zu verhindern, dass zytoplasmatischen Proteine bilden ein Gel19, jedoch eine ausreichende Verdünnung wie beschrieben in unserem Protokoll vorgesehen dieses Phänomen tritt nicht auf. Darüber hinaus eignet sich Ausschluss der Mg2 + , Verunreinigungen von cytoplasmatischen Ribosomen20zu reduzieren; (2) Es gibt keine Notwendigkeit, maximal mögliche Volumenverhältnis von Zellen zu Mittel-und die freigesetzten Organellen von der Hypo-osmotischen Umwelt zu schützen. Die osmotische in unserem Protokoll wird ausreichend unterstützt von Saccharose-haltige Puffer und die Verdünnung der Zellen mit Mitochondrien Isolierung Puffer (Schritt 2.II.5) ist entscheidend für die effiziente Trennung von Organellen in einer groß angelegten Zubereitung.
Der pH-Wert der Mitochondrien Isolierung Puffer liegt in der Nähe physiologischen Werte, d. h. 7.5, das ist auch der optimale pH-Wert für die folgenden Mitoribosome Vorbereitung. Bindemittel EDTA und EGTA werden hinzugefügt, um die Isolierung Medien kontaminierende Ionen Chelat und sie chelatkomplex freien Magnesium und Calcium, beziehungsweise. Es wurde diskutiert, dass die Einbeziehung von EDTA kann zur Beschädigung der inneren mitochondrialen Membran14führen, daher beschränkt sich die Konzentration auf 1 mM als Vorsichtsmaßnahme. Wir haben keinen Unterschied nicht beobachtet, bei 5 mM EDTA in der letzte Reinigungsstufe von Saccharose dichtegradient Verwendung.
Das Protokoll beschrieben verwendet hierin HEK293S abgeleitete menschliche Zellen für die Reinigung der Mitoribosome. Die Qualität der Zubereitung kann die gewonnene Probe biochemisch und strukturell zu atomarer Auflösung untersucht werden. Dies erlaubt es, die Methode auf menschlichen Mitoribosomal übersetzen komplexe, Qualitätskontrolle Baugruppen und Mitoribosomal Untereinheiten Zwischenprodukte anzuwenden. Darüber hinaus da Krebszellen OXPHOS-Kapazität und erhöhten mitochondrialen Protein Übersetzung im Vergleich mit benachbarten Stromazellen Gewebe21verstärkt haben, sind Mitoribosomes etablierten Drogeziele für Krebs22. Daher müssen unter Verwendung dieses Protokolls für die spezielle Reinigung der Mitoribosomes in Anwesenheit von Inhibitoren medizinische Anwendungen. Darüber hinaus sind Mitoribosomal Mutationen, mitochondriale Erbkrankheiten23verbunden worden. Da diese Mutationen direkte Auswirkungen auf die Struktur haben, ist der hier vorgestellte Ansatz für ihre strukturelle Charakterisierung nützlich. Das Protokoll kann experimentell erweitert und auf eine Vielzahl von wissenschaftlichen Fragen anzugehen, das grundlegende Verständnis der Übersetzung in den menschlichen Mitochondrien und ihre medizinische Bedeutung angewendet werden.
Offenlegungen
Keine
Danksagungen
Diese Arbeit wurde von der schwedischen Stiftung unterstützt für strategische Forschung (Future Leaders Grant FFL15:0325), Ragnar Söderberg Foundation (Fellowship in Medizin M44/16), schwedischen Forschungsrat (Starting Grant NT × 2015-04107), FEBS Long-Term Fellowship (SA) , H2020-MSCA-ITN-2016 Projekt 721757 (VS).
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) high glucose, GLUTAMAX supplement, pyruvate | Thermo Scientific | 31966-021 | |
| Fetal Bovine Serum (FBS) | Thermo Scientific | 16000-044 | |
| Blasticidin S HCl | Thermo Scientific | R210-01 | |
| Zeocin selection reagent | Thermo Scientific | R25001 | 100 mg/ml |
| Freestyle 293 Expression medium | Thermo Scientific | 12338026 | |
| T175 tissue culture flask with vented cap | Sarstedt | 83.3912.002 | |
| Shaker flasks with vented cap | Thermo Scientific | 4115-0500, 4115-1000, 4115-2000, 4115-2800 | |
| 250 ml conical bottle tubes, sterile | Corning | 430776 | |
| Eve automated cell counter | NanoEnTek | E1000 | |
| Nitrogen cavitation cell disruption vessel | Parr Instruments | 4635, 4639 | safety volume: 40ml, 600ml respectively |
| Dnase (RNA-free) | HT Biotechnology | N401a | |
| Teflon/glass dounce homogenizers | Cambridge Glassblowing Limited | Size designed upon request | |
| SW40 tubes for mitochondria gradient | Beckman | 344060 | Polypropylene, thin wall |
| Transfer pipettes | Sarstedt | 86.1171 | |
| TLA 120.2 tubes for cushion | Beckman | 343778 | Polycarbonate, thick wall |
| TLS-55 tubes for gradient | Beckman | 347356 | Ultra-clear |
| Gradient Station IP | BioComp | 153-002 |
Referenzen
- Ott, M., Amunts, A., Brown, A. Organization and regulation of mitochondrial protein synthesis. Annual review of biochemistry. 85, 77-101 (2016).
- Amunts, A., Brown, A., Toots, J., Scheres, S. H., Ramakrishnan, V. The structure of the human mitochondrial ribosome. Science. 348 (6230), 95-98 (2015).
- Greber, B. J., Bieri, P., Leibundgut, M., Leitner, A., Aebersold, R., Boehringer, D., Ban, N. The complete structure of the 55S mammalian mitochondrial ribosome. Science. 348 (6232), 303-308 (2015).
- Greber, B. J., Ban, N. Structure and function of the mitochondrial ribosome. Annual review of biochemistry. 85, 103-132 (2016).
- Greber, B. J., Boehringer, D., Leitner, A., Bieri, P., Voigts-Hoffmann, F., Erzberger, J. P., Ban, N. Architecture of the large subunit of the mammalian mitochondrial ribosome. Nature. 505 (7484), 515-519 (2014).
- Rorbach, J., Gao, F., Powell, C. A., D'Souza, A., Lightowlers, R. N., Minczuk, M., Chrzanowska-Lightowlers, Z. M. Human mitochondrial ribosomes can switch their structural RNA composition. Proceedings of the National Academy of Sciences. , 201609338 (2016).
- Chrzanowska-Lightowlers, Z., Rorbach, J., Minczuk, M. Human mitochondrial ribosomes can switch structural tRNAs-but when and why?. RNA biology. 14 (12), 1668-1671 (2017).
- Gammage, P. A., Moraes, C. T., Minczuk, M. Mitochondrial Genome Engineering: The Revolution May Not Be CRISPR-Ized. Trends in Genetics. , (2017).
- Brown, A., Rathore, S., Kimanius, D., Aibara, S., Bai, X. C., Rorbach, J., Ramakrishnan, V. Structures of the human mitochondrial ribosome in native states of assembly. Nature Structural and Molecular Biology. 24 (10), 866 (2017).
- Reeves, P. J., Callewaert, N., Contreras, R., Khorana, H. G. Structure and function in rhodopsin: high-level expression of rhodopsin with restricted and homogenous N-glycosylation by tetracycline-inducible N-acetylglucosaminyltransferase I-negative HEK293S stable mammalian cell line. Proceedings of National Academy of Sciences USA. 99, 13419-13424 (2002).
- Brown, A., Amunts, A., Bai, X. C., Sugimoto, Y., Edwards, P. C., Murshudov, G., Ramakrishnan, V. Structure of the large ribosomal subunit from human mitochondria. Science. 346 (6210), 718-722 (2014).
- O'Brien, T. W., Kalf, G. F. Ribosomes from rat liver mitochondria I. Isolation procedure and contamination studies. Journal of Biological Chemistry. 242 (9), 2172-2179 (1967).
- Spremulli, L. L. Large-scale isolation of mitochondrial ribosomes from mammalian tissues. Mitochondria: Practical Protocols. , 265-275 (2007).
- Rice, J. E., Lindsay, J. G., Grahamand, J. M., Rickwood, D. Subcellular fractionation of mitochondria. Subcellular Fractionation: A Practical Approach. , 107-142 (1997).
- Attardi, G., Ching, E. Biogenesis of mitochondrial proteins in HeLa cells. Methods in enzymology. 56, 66-79 (1979).
- Gottlieb, R. A., Adachi, S. Nitrogen cavitation for cell disruption to obtain mitochondria from cultured cells. Methods in enzymology. 322, 213-221 (2000).
- Simpson, R. J. Disruption of cultured cells by nitrogen cavitation. Cold Spring Harbor Protocols. 2010 (11), (2010).
- Kennedy, E. P., Lehninger, A. L. Oxidation of fatty acids and tricarboxylic acid cycle intermediates by isolated rat liver mitochondria. Journal of Biological Chemistry. 179 (2), 957-972 (1949).
- Graham, J. M. Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Amunts, A., Brown, A., Bai, X. C., Llácer, J. L., Hussain, T., Emsley, P., Ramakrishnan, V. Structure of the yeast mitochondrial large ribosomal subunit. Science. 343 (6178), 1485-1489 (2014).
- Sotgia, F., Martinez-Outschoorn, U. E., Howell, A., Pestell, R. G., Pavlides, S., Lisanti, M. P. Caveolin-1 and cancer metabolism in the tumor microenvironment: markers, models, and mechanisms. Annual Review of Pathology: Mechanisms of Disease. 7, 423-467 (2012).
- Škrtić, M., Sriskanthadevan, S., Jhas, B., Gebbia, M., Wang, X., Wang, Z., Lai, C. K. Inhibition of mitochondrial translation as a therapeutic strategy for human acute myeloid leukemia. Cancer cell. 20 (5), 674-688 (2011).
- Boczonadi, V., Horvath, R. Mitochondria: impaired mitochondrial translation in human disease. The international journal of biochemistry & cell biology. 48, 77-84 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten