Method Article
Быстрая изоляция Mitoribosome из клеток ГЭС
В этой статье
Резюме
Митохондрии специализированные рибосомы, которые отличаются от бактериальных и цитоплазматических аналогов. Здесь мы покажем, как можно получить mitoribosomes от их родной отсека в клетках ГЭС. Метод предполагает изоляцию митохондрий от подвеска клеток и последующей очистки mitoribosomes.
Аннотация
Человека митохондрии имеют выделенный набор рибосом (mitoribosomes), которые переводят 13 основных белковых компонентов кодируемых геном митохондриальных комплексов окислительного фосфорилирования. Поскольку все белки синтезируется человека mitoribosomes являются неотъемлемой мембранных белков, человеческие mitoribosomes привязаны к внутренней митохондриальной мембраны в процессе перевода. По сравнению с цитозольной рибосома mitoribosome имеет коэффициент седиментации 55S, половина рРНК содержание, не 5S рРНК и 36 дополнительных белков. Таким образом более высокий коэффициент белка и РНК и нетипичная структура делают человека mitoribosome существенно отличается от его цитозольной коллегой.
Несмотря на центральное значение mitoribosome к жизни не протоколы были доступны для очистки нетронутыми комплекс из линий клеток человека. Традиционно, mitoribosomes были изолированы от митохондрии богатые животных тканей, которые требуют кг из исходного материала. Мы рассуждал митохондрий в делящихся клеток человека HEK293-производные, вырос в среде богатых питательными веществами выражение будет иметь активную митохондриальной перевода и, таким образом, может быть подходящим источником материала для структурного и биохимические исследования mitoribosome. Для изучения его структуры, мы разработали протокол для крупномасштабных очистки нетронутыми mitoribosomes от ГЭС клеток. Здесь мы представляем метод кавитации азота как быстрее, менее трудоемкое и более эффективной альтернативой традиционным механические методы на основе сдвига для лизиса клеток. Это привело к подготовке mitoribosome, что позволило его структурные определения с высоким разрешением, раскрывая состав нетронутым человеческие mitoribosome и его промежуточные сборки. Здесь мы следить за ходом этой работы и представить оптимизированный и более эффективный метод, требующий только ~ 1010 культивируемых клеток ГЭС. Этот метод может использоваться для человека mitoribosomal перевода комплексы, мутанты, контроля качества сборки и mitoribosomal субблоков интермедиатов очистит. Очистка линейно масштабировать десятикратно если необходимо и также применяется для других типов клеток.
Введение
Процесс синтеза белков митохондриальных основана на 13 основных mt мРНК, которые переводятся на специализированных mitoribosome мембрана подключенных к каталитической основой дыхательной цепи. Изменения митохондриального геномов и потребность белки вставить co-translationally в мембраны существенно сформировали архитектура рибосомах митохондрий1. Последние с высоким разрешением структуры млекопитающих mitoribosome показал разительно отличается общий вид бактерий коллегой2,3. Частности добавляются по крайней мере 36 митохондрии специфических белков, способствует ~ 1 MDa загородный молекулярной массы, в то время как mt рРНК уменьшен вдвое и весьма разошлись. Структурных перестроек изменить почти всех важнейших функциональных особенностей, которые были ранее общепринятым быть универсально сохраняется4.
Каждый из mitoribosomal подразделений были приобретены новые основные элементы, например, небольшие подразделения включила внутренней mS29 белка ГТФазы в его «голова» региона. ГТФазы деятельности не были найдены в других систем перевода, и структуры показывает, что ГТФазы может иметь определенную роль в Ассамблее субъединица2. 5S рРНК, которая считается важной вехой всех известных рибосомных крупных подразделений, составляющих ядро центральной выпуклости, отсутствует в млекопитающих mitoribosome и принял mt тРНК Валь как составной строительный блок вместо2. Пан и коллеги показал, что свинину mitoribosome МТ тРНК Пхе и не-вал5. Chrzanowska-Lightowlers, Minczuk и коллеги последовали за вверх на этих данных и обнаружил, что mitoribosomes у пациентов с нарушенной mt тРНК Валь стабильность в принципе может вместить mt тРНК ПТО6,7. Почему mitoribosomes включили эти конкретные элементы и какие пути и транс-факторы необходимы для эти уникальные сборки остаются неизвестными.
В целом высокая сложность человеческого mitoribosome, новых белковых компонентов и уникальные ассоциации mt-tRNA как структурный элемент подразумевает участие еще неизвестных митохондрии конкретных транс -факторов. Однако потому что многие из особенностей этой системы являются уникальными для митохондрий, которые традиционно были трудно расследовать8, мало что известно о механизме молекулярных и контроля качества. С развитием анализа высокого разрешения одной частицы электронов крио микроскопия (крио ЭМ)20теперь возникают возможности всесторонне изучать молекулярные механизмы, лежащие в основе Ассамблея, действий и контроль качества человека mitoribosome. Наш доклад о структуре первого человека mitoribosome Ассамблеи промежуточных обеспечивает признание, что это можно представить как образуется человеческого mitoribosome и показывает, что крио Эм играет важную роль в выявлении новых транс- Исполняющий обязанности Ассамблеи факторы9.
Чтобы расширить этот первоначальных усилий, мы описываем быстрый протокол для очистки человека mitoribosome в деталях. В первой части протокола описан крупномасштабных изоляции высоки чисто нетронутыми митохондрий от подвеска клеток. Эта процедура требует 9 h и можно легко изменить и адаптированные для различных типов клеток и весы. Значительный шаг в этот протокол является использование азота кавитации взломать клетки. Второй частью протокола был разработан для очистки mitoribosomes. Эта процедура требует 7 h и дает достаточное количество mitoribosomes биохимических и структурных исследований. Использование чистого митохондрий как исходный материал предлагает высокое качество окончательной подготовки и могут быть экстраполированы на других митохондриальных макромолекул.
протокол
Все работы культуры mammalian клетки должны выполняться внутри биологической безопасности кабинета. Использование стерильного оборудования Если контакт с клетками. Надевайте перчатки из нитрила и лаборатории пальто и следовать практике хорошо культуры ткани.
1. клеточная культура
- Сохранить HEK293S подвеска клетки в Дульбекко изменение Eagle среднего (DMEM) с 10% свободной тетрациклин плода бычьим сывороточным (ФБС), 5 мкг/мл blasticidin и 200 мкг/мл азитромицин, при 37 ° C и 5% CO2.
- Масштабирование до 9 x T175 колбы. На 90% confluency, урожай клетки и спина их вниз на 500 x g 5 мин Ресуспензируйте гранулированных клетки в Freestyl с 5% свободных тетрациклин FBS. Подсчитать ячейки, используя счетчик автоматизированных клеток и регулировка концентрации клеток до 1,5 х 106 клеток/мл в вентилируемые покачивая колбу.
Примечание: Это будет обычно соответствует начальный объем 300 мл в колбе вентилируемые 1000 мл. - Инкубируйте клетки в тряску инкубатора при 37 ° C и 5% CO2 при 120 об/мин (пожимая диаметром 50 мм).
- После 2 дней подсчитать количество ячеек и приступить разбить ячейки, если ячейка плотность выше 3.0 х 106 клеток/мл. Разбить ячейки, крутя вниз 2 x 150 мл культуры клеток в 2 x 250 мл конические бутылки на 500 g 5 мин Ресуспензируйте клетки в 2 x 10 мл свежего СМИ и передать 2 x 1, 000 мл вентилируемые флаконы, содержащие соответствующие тома для окончательного клеток плотность 1,5 х 106 клеток/мл, например 2 x 300 мл от Начальная плотность клеток 3.0 х 106 клеток/мл.
- Инкубируйте клетки в тряску инкубатора при 37 ° C и 5% CO2 при 120 об/мин (пожимая диаметром 50 мм).
- После двух дней подсчитать количество ячеек и приступить разбить ячейки, если ячейка плотность выше 3.0 х 106 клеток/мл. Сплит клетки, спиннинг вниз 4 x 150 мл культуры клеток в 4 x 250 мл конические бутылки на 500 g 5 мин Ресуспензируйте клетки в 2 x 10 мл свежего СМИ и передать 2 x 2000 мл вентилируемые флакон, содержащий соответствующие тома для окончательного клеток плотность 1,5 x 106 клеток/мл, например 2 x 700 мл от Начальная плотность клеток 3.0 х 106 клеток/мл.
- Инкубируйте клетки в тряску инкубатора при 37 ° C и 5% CO2 при 120 об/мин (пожимая диаметром 50 мм).
- После двух дней подсчитать количество ячеек и приступить разбить ячейки, если ячейка плотность выше 3.0 х 106 клеток/мл. Разбить ячейки, поливая 2 x 700 мл культуры клеток в 2 x 2800 мл вентилируемые колбы и долива с 2 x 300 мл свежего СМИ для достижения объемом 2 x 1 л
- Инкубируйте клетки в тряску инкубатора при 37° C и 5% CO2 при 120 об/мин (пожимая диаметром 50 мм).
- После 24 часов подсчет ячеек и урожай клетки, если плотность ячеек между 3.0-4.0 x 106 клеток/мл.
2. митохондрии изоляции
- Буферов, необходимых
Примечание: Количества даны для подготовки от 2 Л клеток. Подготовьте следующие акции решения впереди времени для митохондриального изоляции буферу (MIB), сахароза/маннитол (SM4), экспериментальный буферу (MIBSM), ресуспендирования (SEM).- Сделать 0,5 Л MIB буфера: 50 мм HEPES-Кох, pH 7.5, 10 мм KCl, 1,5 мм MgCl2, 1 мм ЭДТА, 1 мм EGTA, 1 мм DTT, ингибиторов протеазы.
- Сделать 100 мл SM4 буфера: 280 мм сахарозы, маннитол 840 мм, 50 мм HEPES-Кох, pH 7.5, 10 мм KCl, 1,5 мм MgCl2, 1 мм ЭДТА, 1 мм EGTA, 1 m M DTT, ингибиторов протеазы.
- Сделать 160 мл MIBSM буфера: 120 мл буфера МБ + 40 мл SM4 буфера.
- Хранить 200 мл PBS на 4 ° C.
- Сделать 5 мл SEM буфера: сахароза 250 мм, 20 мм HEPES-Кох, pH 7.5, ЭДТА 1 мм.
- Сделать 4 x 10 мл акций решения для поэтапного сахарозы градиента, содержащий 20 мм HEPES-Кох, pH 7.5, 1 мм ЭДТА и 60% / 32% /23% и 15%-ая сахароза, соответственно.
- Митохондрии изоляции
Примечание: Важно работать быстро и сохранить все на льду на протяжении всей процедуры. - Precool палата кавитации азота до использования.
- Урожай 2 x 1 Л клеток (3-4 х 109 ячеек на пластиковых пробирок) центрифугированием на 1000 x g за 7 мин., 4 ° C.
- Декант супернатант тщательно и Ресуспензируйте гранулированных клетки быстро в 2 x 100 мл PBS. Объединить ячейки.
- Центрифуга ресуспензированы клетки на 1200 x g за 10 мин., 4 ° C.
- Декант супернатант тщательно и весят Пелле (~ 20 g).
- Ресуспензируйте гранулы в буфере MIB 120 мл.
- Разрешить клетки к набуханию, осторожно помешивая в холодной комнате за 10 мин.
- Поместите камеру кавитации азота на льду и swelled клетки перехода к палате кавитации азота. Добавить 45 мл SM4 буфера (1/3 заключительного тома ресуспензированы клеток, около 140 мл, уступая конечная концентрация сахарозы и 210 мм маннитол 70 мм).
- Закрепите азота кавитации камеры и заполнить с азотом, до тех пор, пока давление достигает 500 psi. Закрыть краны и держать, изолированные на льду за 20 мин.
- Медленно отпустите давление в камере кавитации азота и собирать lysate (около 185 мл).
- Центрифуга лизированных материал для удаления мусора клеток и ядер на 800 x g за 15 мин., 4 ° C.
- Соберите супернатанта, поливая его через марлю в стакан хранится на льду. Не выбрасывайте гранулы.
- Ресуспензируйте гранулы в буфер MIBSM 90 мл (1/2 предыдущих тома). Однородный с использованием гомогенизатора тефлон/стекло Dounce и повторите центрифугированием на 800 x g за 15 мин., 4 ° C.
- Соберите супернатанта, поливая его через марлю в стакан хранится на льду. Объединить этот супернатант с супернатант из шага 2.2.11.
- Центрифуга для комбинированных supernatants на 1000 x g за 15 мин., 4 ° C.
- Соберите супернатанта, поливая его через марлю в стакан хранится на льду.
- Отменить гранулы и центрифуги супернатанта, содержащий сырой митохондрий в 10000 x g за 15 мин., 4 ° C.
Примечание: Гранулы будет обычно состоят из двух частей: свободные и жесткой. - Тщательно промывают сыпучих гранул не нарушая жесткая часть. Ресуспензируйте плотных гранул в 10 мл MIBSM буфера.
- Выполните концентрации assay протеина, с помощью коммерческих комплект Assay протеина или аналогичного метода. Типичные концентрации урожайность от 2 Л, начиная культуры являются ~ 2 мг/мл.
- Добавить 200 единиц РНКазы бесплатно DNase и оставить для поворота на ролик в холодной комнате для 20 мин равномерно смешать DNase для удаления геномной ДНК.
- Центрифуга на 10000 x g за 15 мин., 4 ° C и Ресуспензируйте гранулы в 2 мл SEM буфера. Однородный, нежно ресуспензируйте любые оставшиеся агрегатов с помощью небольшой гомогенизатор тефлон/стекло Dounce. Выполнение не более чем пяти прихваченного пропуска, чтобы избежать поломки. Держите на льду.
- Подготовьте градиент сахарозы, в 14 мл SW40 трубы, тщательно закупорить 1,5 мл 60% сахарозы запасов буфера в нижней части трубки. Аккуратно добавьте 4,5 мл 32% сахарозы запасов буфера поверх полосе частот 60% не нарушая его. Повторите с 1,5 мл 23% сахарозы запасов буфера и снова с 1,5 мл 15%-ая сахароза запасов буфера.
- Загрузите весь митохондриальной подвеска (примерно 3 мл) на вершине сахарозы градиента.
- Центрифуга SW40 ротора на 139, g 065 x 60 мин.
- Тщательно Соберите коричневая полоса, мигрируют в интерфейсе 32% и 60% сахарозы с помощью пипетки передачи, обычно 2-3 мл.
- Snap замораживание очищенный митохондрий в жидком азоте и хранить при температуре-80 ° C.
3. Mitoribosome подготовка
- Буферов, необходимых
Примечание: Подготовьте следующие акции решения впереди времени для буфера lysis, сахароза подушки/градиент и ресуспендирования буфера.- Сделать 10 мл буфера lysis: 25 мм HEPES-Кох, pH 7.5, 150 мм KCl, 50 мм MgOAc, 2% полиэтиленгликоль octylphenyl эфира, 2 мм DTT, ингибиторов протеазы.
- Сделать 10 мл сахарозы подушки буфер: 1 М сахарозы (34% w/v), 20 мм HEPES-Кох, pH 7.5, 100 мм KCl, 20 мм MgOAc, 1% полиэтиленгликоль octylphenyl эфира, 2 мм DTT.
- Сделать 5 мл ресуспендирования буфера: 20 мм HEPES-Кох, pH 7.5, 100 мм KCl, 20 MgOAc, 2 мм DTT
- Сделать 15% - 30% градиентов линейных сахарозы с буфером ресуспендирования в TLS-55 поликарбоната трубки.
- Очистка Mitoribosome
- Размораживания замороженных митохондрии на льду.
- Добавить 2 тома буфера lysis,например добавить 6 мл буфера lysis 3 мл митохондрий. Смешайте сразу переворачивать трубке несколько раз.
- Однородный с небольшой тефлон/стекло dounce гомогенизатор для оказания помощи lysis и проинкубируйте 5-10 мин на льду для завершения lysis.
- Центрифуга лизированных материал (примерно 9 мл) на 30000 x g за 20 мин., 4 ° C для удаления нерастворимых материалов. Декант супернатант тщательно от гранул и отбросить гранулы.
- Повторите центрифугирования в 30000 x g для 20 мин при 4 ° C для обеспечения разъяснения супернатант. Декант супернатант тщательно от гранул и отбросить гранулы.
- Подготовить на подушке сахарозы в TLA 120,2 трубы (ультрачистый): 0,4 мл сахарозы подушки в трубку. Подготовьте одну из трубок каждого мл лизированных материала.
- Слой лизированных митохондрии на сахарозу подушки: примерно 1 мл на трубе, что приводит к lysate: Подушка соотношение противоположное.
- Центрифугуйте образцы на 231, 550 x g 45 мин в TLA120.2 ротора при 4 ° C.
- Отменить супернатант и промойте трубы последовательно с 100 мкл буфера ресуспендирования для удаления остаточного сахарозы.
- Ресуспензируйте гранулы в всего 100 мкл буфера ресуспендирования.
- Вихрь на медленной скорости 30 s распустить оставшиеся агрегатов и центрифуги на 17,949 x g 10 мин в центрифуге Микропробирка при 4 ° C.
- Тщательно собирать супернатант и повторите центрифугирования.
- Измерение поглощения mitoribosome на A260.
Примечание: Типичный урожайность составляет 7 A260, с A260: A280 коэффициент 1,3. - Загрузите весь образец градиента трубу одного линейного сахарозы. Центрифуга для TLS-55 ротора в 213, 626 x g для 120 мин при 4 ° C.
- Фракционировать градиента, определения оптической плотности в A260 и бассейн дроби, соответствующий пик нуклеиновой кислоты вместе.
Примечание: Типичный A260: A280 отношение пик > 1.6. - Обмен буфера, при необходимости, с помощью метода выбора. Рассчитать конечная концентрация, используя Aпреобразование 1260 = 0,1 мг/мл.
- Оснастки заморозить очищенный mitoribosome образца в буфер ресуспендирования и хранить при температуре-80 ° C.
Результаты
Деления и высоко жизнеспособных клеток является важной отправной точкой для очистки активных mitoribosomes. Этот протокол применяется к любой HEK293 подвеска клетки. Мы используем линии собственных клеток T501, который стабильно, выражая транспортер под контролем тетрациклин индуцибельной. Родительский клеточная линия — HEK293S-GnTI– клетки (Таблица материалов)10. Во время роста клеток и расширения в среде выражение 293 FreeStyle, минимальная плотность должна быть сохранена в 1,5 х 106 клеток/мл, для того, чтобы обеспечить удвоение ставки каждые два дня, тогда как максимальная плотность ячейки не должен превышать ~ 5 x 106 клеток / Мл. по достижении плотность клеток выше 3 х 106 клеток/мл клетки являются гранулированных и высокомобильна в свежий, разогретой СМИ в расширенный объем для достижения минимальной клеток плотность 1,5 х 106 клеток/мл. Это разделение выполняется многократно каждые 2-3 дня, пока не будет достигнуто желаемого клеточной массы для процедуры. Плотность окончательный клеток может варьироваться в диапазоне 3-4.5 x 106 клеток/мл, и по крайней мере 2 L требуется в качестве отправной точки для изоляции митохондрий. Жизнеспособность клеток должны поддерживаться как правило > 90% и для окончательного культуры, которые собирают > 95%. Не рекомендуется лечение крупномасштабных клеточной культуры с помощью антибиотиков.
После серии дифференциальной centrifugations объем митохондриальной подвеска после шага 2.2.20 обычно находится в диапазоне 3-5 мл. Митохондрии затем разделяются на сахарозу градиента (рис. 1) от другие органеллы. Ступенчатые сахарозы градиент подготовлен таким образом, чтобы объем градиента и объем митохондриальной подвеска вместе заполнить вверх центрифугирования трубки для его максимальной громкости. Здесь особый уход необходим для сбора коричневая полоса, мигрируют в 60% / 32% интерфейс с минимальным загрязнением из окружающих буфера. Это важно для того чтобы держать отношение постоянно белка: моющее средство на следующем шаге солюбилизация митохондрий. Рекомендуется оценить концентрацию митохондриальных белок на данном этапе, и типичный доходность всего митохондриальных белок 15-20 мг ожидается от ~ 1010 культивируемых клеток ГЭС.
После успешного митохондрий изоляции они являются лизированы путем добавления octylphenyl эфиром полиэтиленгликоля и mitoribosomes отделены через подушку сахарозы (рис. 2). Чтобы отделить mitoribosomes от пленочной гидрофобное вещество, окатыши являются высокомобильна в буфер, не содержащий моющего средства, и гидрофобных комплексы гранулированных центрифугированием. Эта процедура повторяется, и степень очистки mitoribosomes количественно, А260/A280 соотношение, которое, как ожидается, будет ~ 1.3. Типичные урожайность-7 A260 от 2 Л, начиная культуры. Это mitoribosomal часть также содержит дополнительные большие растворимых митохондриальных комплексов, как пируват дегидрогеназы и глутамата дегидрогеназы. Чтобы отделить mitoribosomes от растворимых митохондриальных комплексов, супернатанта применяется к градиент плотности сахарозы. Фракций, содержащих mitoribosome обычно расположены в нижней трети трубки. Фракционирование сахарозы градиента можно сделать затем с автоматизированной поршня или вручную, тщательно принимая 50 мкл фракций с пипеткой или перфорация нижней трубки с иглой 21 G и собирая капли.
Два основных mitoribosomal населения определены в градиенте: monosome 55S и большой субблок 39С, как показано на рис. 3 и рис. 4. Наличие большой субблок фракции предполагает, что клетки собирают в высокоактивные деления состояние11. Соотношение между monosome и большой субблок пиков может измениться. Дополнительные пик, расположенный ближе к нижней может появиться в подготовке загрязняющими цитоплазменные рибосомах 80-х годов. Пожалуйста обратите внимание, что небольшой сахарозы градиент, используя размахивая ведро ротор TLS-55 позволяет для быстрой очистки ~ 1 мл mitoribosomes на оптической плотности 0,4-1260. Разделение monosome и большой субблок пики могут незначительно отличаться в зависимости от фракционирования, но обычно есть некоторые совпадения двух пиков. Таким образом какой фракции собирать, и бассейн должен приниматься во внимание для того, чтобы обеспечить наибольшее количество monosome, или альтернативно большой субблок, в образце. Для исследования с высоким разрешением крио EM разделение между двумя mitoribosomal населения требуется не абсолютно (из-за дополнительных в silico операций). Однако при необходимости лучшего разделения, рекомендуется использовать более крупные трубы и соответствующим управлением раз.

Рисунок 1 : Очищение митохондрий на градиент сахарозы. Внутриклеточных органелл от 2 Л, начиная культуры были фракционированный через серию дифференциальной centrifugations, как описано в протоколе, и митохондрии были отделены на градиент разрывными сахарозы. Очищенный митохондрии находятся в нижней полосы на интерфейсе 32/60%.

Рисунок 2 : Очищение mitoribosomes на подушке сахарозы. Сырой mitoribosomes от 2 Л начиная культуры отложившейся через 1 М сахарозы подушки. Гранулы высокомобильна в буфере моющее средство бесплатно, и mitoribosomes уточняются по два centrifugations, как описано в протоколе. Поглощение записывается для оценки качества подготовки и типичные A260/A280 соотношение ~1.3 (правая панель) удостоверяет малую богатые mitoribosome. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
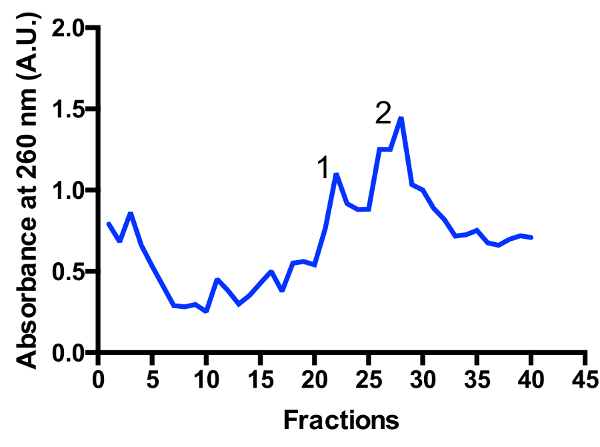
Рисунок 3 : Тонкая очистка mitoribosomes на градиент сахарозы. Поглощение след от 2 Л, начиная культуры. Фракций нумеруются от верхней до нижней части градиента. Определены два основных mitoribosomal население: большие субъединицы (пик 1) и monosome 55S (пик 2). Соотношение между населением может измениться. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Электронная микрофотография, классы 2D и 3D реконструкции. Левой панели: Микрофотография, с образец из monosome пик 2 на калиброванных увеличением 1.23 A / пиксель. Ближнем Группа: Представитель постобработки данных (2D классы) выявление нетронутыми monosomes. Правая панель: 3D реконструкции. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Что касается источник исходного материала, хотя относительно легкая доступность животных тканей, которые известны своим богатым источником митохондрий, делает его популярным выбором для mitoribosomes3,5,12, 13, они не могут быть генетически модифицировать и легко воспроизвести в лаборатории. Следовательно существует четко практическая необходимость в разработке протоколов, связанных с линий однородно культивируемых клеток человека. Основное различие между протоколами, занимающихся культивируемых клеток и тканей является режим лизис и гомогенизации. Для культивируемых клеток, выращивается как однослойная типичный метод-тефлон/стекло dounce гомогенизации14. Для малых масштабах15были разработаны оригинальные протоколы подготовки пока эффективной. Прямого расширения масштабов использованием гомогенизатора с емкостью 500 мл можно11, однако, она требует ~ 2 h ручного труда добиться лизиса 80%. Это представил по крайней мере три вопроса: агрегации органеллы благодаря длительное время ожидания, неоднородность лизис вследствие тяжелого материала, тонущий в нижней части большого судна, Отопление образца из-за необходимости несколько strokes. Таким образом предпочтительным методом лизис использует азота кавитации, которая основана на декомпрессии с давлением судно16,17. В этом методе клетки сначала увеличилось в холодной комнате для того, чтобы смягчить клетки и сделать их более восприимчивыми к lysis. Как они помещены в устройство кавитационного азота на буфер, содержащий сахарозы и маннитола добавляется для того, чтобы поддерживать осмотического давления, которая поможет сохранить нетронутыми митохондрий. Устройство кавитационного азота затем под давлением с большим объемом свободного кислорода азота, которая растворяется в клетки. Как давление выпустила азота пузырьки из решения позволило в сверлении клеточных мембран. Этот метод предлагает несколько преимуществ по сравнению с механической гомогенизации методами с участием касательные напряжения и трения следующим: 1) избегать любой внешней физической нагрузки на клетки; 2) адиабатического расширения, который охлаждает образца, обеспечивает не теплового повреждения органеллы; 3) клеток компоненты защищены от окисления азота инертного газа; 4) без изменения рН приостановки среды; 5) процесс единообразного и воспроизводимые, потому что те же самые разрушительные силы применяются внутри каждой клетки и всей выборки; 6) процесс быстро и может быть завершена в течение 20-30 мин.
Изоляция митохондрий от культивируемых клеток и тканей была описана в литературе широко, и он основан на разрушения нежный клеток, последовала серия дифференциальной centrifugations. Большинство используемых в настоящее время протоколов Следуйте оригинальной процедуры, разработанные в середине прошлого века18. В то время как основные биохимические подходы являются правильными, есть несколько заблуждений, которые выделены в литературе и оставались незамеченными. Для оптимизации протокола для mitoribosomes, мы систематически расследовать сообщения о общие принципы и заключить, что: 1) включение мг2 + и+ K в буфере не имеет решающее значение. Утверждалось, что KCl помогает предотвратить цитоплазматических белков от формирования гель19, однако, обеспечивает достаточно разрежения, как описано в наших протокол, это явление не происходит. Кроме того исключение мг2 + является полезным для уменьшения загрязнений на рибосомах цитоплазмы20; 2) нет необходимости держать максимально возможный объем соотношение клеток к средству защиты выпустила органеллы от гипо осмотического окружающей среды. Осмотического в нашей протокол достаточно поддержка буферов, содержащих сахарозу и разбавления клеток с буфером изоляции митохондрии (шаг 2.II.5) имеет решающее значение для эффективного разделения органеллы в широкомасштабной подготовки.
PH буфера изоляции митохондрий близка физиологические показатели, т.е. 7,5, который также является оптимальный рН для подготовки следующих mitoribosome. Вяжущих ЭДТА и EGTA добавляются к изоляции СМИ хелат загрязняющих ионов, и они хелат бесплатно магния и кальция, соответственно. Он обсуждался, что включение ЭДТА может привести к повреждению внутренней митохондриальной мембраны14, поэтому концентрация ограничено до 1 мм в качестве меры предосторожности. Мы не наблюдали никакой разницы при использовании 5 мм ЭДТА в окончательной очистки шаг градиента плотности сахарозы.
Протокол, в описанный здесь использует HEK293S-производные человеческих клеток для очистки mitoribosome. Качество подготовки позволяет полученные образцы должны расследоваться биохимически и структурно атомной резолюции. Это позволяет применять метод для человека mitoribosomal перевода комплексы, контроля качества сборки и mitoribosomal субблоков интермедиатов. Кроме того поскольку раковые клетки усиленный OXPHOS емкости и повышенной митохондриальных белок перевода по сравнению с прилегающих тканей стромальные21, mitoribosomes являются целями установленными наркотиков для рака22. Таким образом используя этот протокол для конкретного очищения mitoribosomes в присутствии ингибиторов будет иметь медицинских приложений. Кроме того mitoribosomal перегласовок были связаны с наследственных митохондриальных болезней23. Поскольку эти мутации оказывают прямое воздействие на структуры, представленный здесь подход будет полезен для их структурных характеристик. Протокол можно экспериментально и применяется для различных научных вопросов, борьба фундаментальное понимание перевода человека митохондрий и медицинское значение.
Раскрытие информации
Нет
Благодарности
Эта работа была поддержана Шведским фондом для стратегических исследований (будущее лидеров Grant FFL15:0325), Рагнар Söderberg Foundation (стипендия в медицине M44/16), Шведский научно-исследовательский совет (× 2015-04107 начиная Грант NT), FEBS долгосрочных стипендий (SA) , H2020-МСКА-ITN-2016 проекта 721757 (VS).
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) high glucose, GLUTAMAX supplement, pyruvate | Thermo Scientific | 31966-021 | |
| Fetal Bovine Serum (FBS) | Thermo Scientific | 16000-044 | |
| Blasticidin S HCl | Thermo Scientific | R210-01 | |
| Zeocin selection reagent | Thermo Scientific | R25001 | 100 mg/ml |
| Freestyle 293 Expression medium | Thermo Scientific | 12338026 | |
| T175 tissue culture flask with vented cap | Sarstedt | 83.3912.002 | |
| Shaker flasks with vented cap | Thermo Scientific | 4115-0500, 4115-1000, 4115-2000, 4115-2800 | |
| 250 ml conical bottle tubes, sterile | Corning | 430776 | |
| Eve automated cell counter | NanoEnTek | E1000 | |
| Nitrogen cavitation cell disruption vessel | Parr Instruments | 4635, 4639 | safety volume: 40ml, 600ml respectively |
| Dnase (RNA-free) | HT Biotechnology | N401a | |
| Teflon/glass dounce homogenizers | Cambridge Glassblowing Limited | Size designed upon request | |
| SW40 tubes for mitochondria gradient | Beckman | 344060 | Polypropylene, thin wall |
| Transfer pipettes | Sarstedt | 86.1171 | |
| TLA 120.2 tubes for cushion | Beckman | 343778 | Polycarbonate, thick wall |
| TLS-55 tubes for gradient | Beckman | 347356 | Ultra-clear |
| Gradient Station IP | BioComp | 153-002 |
Ссылки
- Ott, M., Amunts, A., Brown, A. Organization and regulation of mitochondrial protein synthesis. Annual review of biochemistry. 85, 77-101 (2016).
- Amunts, A., Brown, A., Toots, J., Scheres, S. H., Ramakrishnan, V. The structure of the human mitochondrial ribosome. Science. 348 (6230), 95-98 (2015).
- Greber, B. J., Bieri, P., Leibundgut, M., Leitner, A., Aebersold, R., Boehringer, D., Ban, N. The complete structure of the 55S mammalian mitochondrial ribosome. Science. 348 (6232), 303-308 (2015).
- Greber, B. J., Ban, N. Structure and function of the mitochondrial ribosome. Annual review of biochemistry. 85, 103-132 (2016).
- Greber, B. J., Boehringer, D., Leitner, A., Bieri, P., Voigts-Hoffmann, F., Erzberger, J. P., Ban, N. Architecture of the large subunit of the mammalian mitochondrial ribosome. Nature. 505 (7484), 515-519 (2014).
- Rorbach, J., Gao, F., Powell, C. A., D'Souza, A., Lightowlers, R. N., Minczuk, M., Chrzanowska-Lightowlers, Z. M. Human mitochondrial ribosomes can switch their structural RNA composition. Proceedings of the National Academy of Sciences. , 201609338 (2016).
- Chrzanowska-Lightowlers, Z., Rorbach, J., Minczuk, M. Human mitochondrial ribosomes can switch structural tRNAs-but when and why?. RNA biology. 14 (12), 1668-1671 (2017).
- Gammage, P. A., Moraes, C. T., Minczuk, M. Mitochondrial Genome Engineering: The Revolution May Not Be CRISPR-Ized. Trends in Genetics. , (2017).
- Brown, A., Rathore, S., Kimanius, D., Aibara, S., Bai, X. C., Rorbach, J., Ramakrishnan, V. Structures of the human mitochondrial ribosome in native states of assembly. Nature Structural and Molecular Biology. 24 (10), 866 (2017).
- Reeves, P. J., Callewaert, N., Contreras, R., Khorana, H. G. Structure and function in rhodopsin: high-level expression of rhodopsin with restricted and homogenous N-glycosylation by tetracycline-inducible N-acetylglucosaminyltransferase I-negative HEK293S stable mammalian cell line. Proceedings of National Academy of Sciences USA. 99, 13419-13424 (2002).
- Brown, A., Amunts, A., Bai, X. C., Sugimoto, Y., Edwards, P. C., Murshudov, G., Ramakrishnan, V. Structure of the large ribosomal subunit from human mitochondria. Science. 346 (6210), 718-722 (2014).
- O'Brien, T. W., Kalf, G. F. Ribosomes from rat liver mitochondria I. Isolation procedure and contamination studies. Journal of Biological Chemistry. 242 (9), 2172-2179 (1967).
- Spremulli, L. L. Large-scale isolation of mitochondrial ribosomes from mammalian tissues. Mitochondria: Practical Protocols. , 265-275 (2007).
- Rice, J. E., Lindsay, J. G., Grahamand, J. M., Rickwood, D. Subcellular fractionation of mitochondria. Subcellular Fractionation: A Practical Approach. , 107-142 (1997).
- Attardi, G., Ching, E. Biogenesis of mitochondrial proteins in HeLa cells. Methods in enzymology. 56, 66-79 (1979).
- Gottlieb, R. A., Adachi, S. Nitrogen cavitation for cell disruption to obtain mitochondria from cultured cells. Methods in enzymology. 322, 213-221 (2000).
- Simpson, R. J. Disruption of cultured cells by nitrogen cavitation. Cold Spring Harbor Protocols. 2010 (11), (2010).
- Kennedy, E. P., Lehninger, A. L. Oxidation of fatty acids and tricarboxylic acid cycle intermediates by isolated rat liver mitochondria. Journal of Biological Chemistry. 179 (2), 957-972 (1949).
- Graham, J. M. Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Amunts, A., Brown, A., Bai, X. C., Llácer, J. L., Hussain, T., Emsley, P., Ramakrishnan, V. Structure of the yeast mitochondrial large ribosomal subunit. Science. 343 (6178), 1485-1489 (2014).
- Sotgia, F., Martinez-Outschoorn, U. E., Howell, A., Pestell, R. G., Pavlides, S., Lisanti, M. P. Caveolin-1 and cancer metabolism in the tumor microenvironment: markers, models, and mechanisms. Annual Review of Pathology: Mechanisms of Disease. 7, 423-467 (2012).
- Škrtić, M., Sriskanthadevan, S., Jhas, B., Gebbia, M., Wang, X., Wang, Z., Lai, C. K. Inhibition of mitochondrial translation as a therapeutic strategy for human acute myeloid leukemia. Cancer cell. 20 (5), 674-688 (2011).
- Boczonadi, V., Horvath, R. Mitochondria: impaired mitochondrial translation in human disease. The international journal of biochemistry & cell biology. 48, 77-84 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены