Method Article
HEK 細胞から Mitoribosome の急速な隔離
要約
ミトコンドリアは、細菌や細胞質相手から乖離したリボソームを特化しました。HEK 細胞の彼らのネイティブのコンパートメントからの mitoribosomes の取得方法を紹介します。懸濁細胞からミトコンドリアの分離と mitoribosomes の結果として浄化メソッドが含まれます。
要約
人間のミトコンドリアはミトコンドリアのゲノムによって符号化される酸化的リン酸化錯体の 13 重要な蛋白質成分を変換するリボゾーム (mitoribosomes) の専用セットを所有しています。人間 mitoribosomes により合成されたすべてのタンパク質は不可欠な膜蛋白質であるので、人間の mitoribosomes は、翻訳中にミトコンドリアの内膜に繋留します。ゾル性細胞質のリボソームにに比べ、mitoribosome 55 秒、半分の rRNA コンテンツ、ない 5 s rRNA および 36 のタンパク質の沈降係数があります。したがって、蛋白・ RNA の比率が高いと非定型構造を作る人間 mitoribosome のゾル性細胞質側から大幅に異なる。
生活に mitoribosome の中央重要性にもかかわらずプロトコルはありませんでしたひと細胞ラインからそのまま複合体を浄化します。伝統的に、mitoribosomes キログラムに必要なミトコンドリアの豊富な動物組織から分離した出発材料の。私たちは、栄養豊富な表現媒体で育つ HEK293 由来ひと細胞分裂におけるミトコンドリア、アクティブなミトコンドリア翻訳だろうし、したがって、構造および生化学的研究のための材料の適切な源になりうると判断mitoribosome。その構造を調べるためには、私たちは HEK 細胞からそのまま mitoribosomes の大規模な浄化のためのプロトコルを開発しました。ここより早くより伝統的な機械的せん断ベース方法セル換散のために労働集約的なより効率的な代替として窒素キャビテーション法を紹介します。これは、高解像度、そのまま人間の mitoribosome およびそのアセンブリの中間体の組成を明らかにその構造を決定するために許可されている mitoribosome の準備で起因しました。ここでは、我々 はこの仕事のフォロー アップと最大限に活用された現在し、のみ 10 〜10を要求するより費用効果的な方法は、HEK 細胞を培養しました。メソッドは、人間 mitoribosomal 翻訳複合体、変異体、品質コントロール アセンブリおよび mitoribosomal サブユニット中間体を浄化するために用いることができます。浄化できます線形スケール アップ 10 倍必要、また細胞の他のタイプに適用される場合。
概要
ミトコンドリアのタンパク質合成の過程は、13 不可欠な mt-mRNAs から呼吸鎖の触媒中心を形成する特殊な膜に接続された mitoribosome によって変換されますに基づいています。変更されたミトコンドリアゲノムと co-translationally 膜に挿入する蛋白質の必要性は大幅にミトコンドリアのリボソーム1のアーキテクチャを形成しています。哺乳類の mitoribosome の最近の高分解能構造を示した細菌対応2,3に著しく異なる全体的な外観。特に、mt rRNA は二重削減、高分岐 〜 1 MDa 余分な分子固まり、貢献すること、少なくとも 36 ミトコンドリア特異的蛋白が追加されます。構造の再編成は、普遍的に保存4に一般に受け入れられた以前ほとんどすべての重要な機能を変更します。
Mitoribosomal サブユニットの 1 つずつ新しい主要な要素を取得されている、たとえば、小サブユニットはその '頭' 地域に組み込みの GTPase 蛋白質 mS29 を組み込んでいます。GTPase 活性は他の翻訳システムで見つかっていないと構造は、gtp アーゼがサブユニット アセンブリ2の役割を必要があることを示します。中央の突起のコアを形成するすべての既知のリボソーム大サブユニットのランドマークと信じられていた 5S rRNA 哺乳類 mitoribosome に欠けているし、採用して mt tRNA ヴァル不可欠なビルディング ブロックとして代わりに2。禁止と同僚は、ブタの mitoribosome が mt tRNA Phe でことを示した、ない-ヴァル ・5。Chrzanowska Lightowlers、Minczuk と同僚これらのデータをフォロー アップに侵害された mt tRNA ヴァル安定患者から mitoribosomes 原則的に対応できる mt tRNA Phe6,7。なぜ、mitoribosomes は、これらの特定の要素とどのような経路、トランスに組み込まれている-の要因が必要これらのユニークなアセンブリは不明のまま。
全体的にみて、人間の mitoribosome、新しい蛋白質のコンポーネント、および mt tRNA の構造要素としてのユニークな関係の量として未知ミトコンドリア固有トランス -因子の関与を意味します。ただし、このシステムの機能の多くはミトコンドリア、8を調査することは困難されている伝統的、一意なので少し分子と品質制御メカニズムについて知られています。電子顕微鏡 (Cryoem)20による高分解能単粒子解析の発展に伴い、機会が今アセンブリ、アクション、および人間の品質管理の基礎となる分子機構の総合的な研究に生じるmitoribosome。中間の人間 mitoribosome アセンブリの最初の構造の私達のレポートそれは人間の mitoribosome の形成方法を視覚化することが可能、-70S が新しいトランス- の同定に尽力を示していますという認識を提供します。演技アセンブリの要因9を。
この初期の努力を拡大するには、詳細に人間 mitoribosome 浄化用高速プロトコルについて述べる.プロトコルの最初の部分では、懸濁細胞から純度の高い無傷ミトコンドリアの大規模な分離を説明します。この手順は 9 h が必要ですと簡単の変更および異なる種類の細胞とスケールに適応することができます。このプロトコルの重要なステップは、セルを割る時に窒素のキャビテーションの使用です。プロトコルの 2 番目の部分は、mitoribosomes を浄化するために開発されました。この手順は、7 h を必要とし、生化学的および構造的研究 mitoribosomes の十分な量が得られます。純粋なミトコンドリアの使用原料高品質の最終的な準備を提供しています、他のミトコンドリアの高分子に外挿することができます。
プロトコル
生物学的安全キャビネット内すべての哺乳類の細胞培養作業を実行する必要があります。細胞場合連絡先滅菌装置を使用します。ニトリル手袋、白衣を着用し、良い組織文化実践に従います。
1. 細胞培養
- HEK293S 懸濁細胞でダルベッコ変更イーグル培地 (DMEM) 10% ウシ テトラサイクリン無料胎児血清 (FBS)、5 μ g/mL ブラストサイジン 37 ° C、5% CO2で 200 μ g/mL、アジスロマイシンとを維持します。
- 最大 9 x T175 フラスコをスケールします。90% の confluency に細胞を収穫し、5% を添加した Freestyl の小球形にされたセル 500 x g で 5 分の間に再懸濁しますでそれらをスピンダウン テトラサイクリン無料 FBS。自動化された細胞カウンターを使用してセルをカウントし、1.5 倍の 106セル/mL 出された振動フラスコ細胞濃度を調整します。
注: これは通常 1,000 mL 出されたフラスコ 300 mL の開始ボリュームに対応します。 - 120 rpm (50 φ 振動) で CO2を 37 ° C、5% で揺れのインキュベーターでセルを孵化させなさい。
- 2 日後のセルをカウントし、細胞密度が 3.0 x 106セル/mL を超える場合に、セルを分割するのに進みます。2 x 10 ミリリットル新鮮なメディアで細胞を再懸濁します 500 g で 5 分間で 2 x 250 mL 円錐形のボトルで 2 x 150 mL 細胞培養を回してセルを分割し、出されたフラスコの最終的な細胞密度の適切なボリュームを含む 2 × 1、000 mL に転送1.5 倍の 106セル/mL、例えば106セル/mL x 3.0 の開始セル密度から 2 x 300 mL。
- 120 rpm (50 φ 振動) で CO2を 37 ° C、5% で揺れのインキュベーターでセルを孵化させなさい。
- 2 日後のセルをカウントし、細胞密度が 3.0 x 106セル/mL を超える場合に、セルを分割するのに進みます。分割スピン ダウン 500 g で 5 分間で 4 x 250 mL 円錐形のボトルで 4 x 150 mL 細胞培養による細胞 2 x 10 ミリリットル新鮮なメディアで細胞を再懸濁し、1.5 x の最終セル密度の適切なボリュームを含む 2 × 2,000 mL 出されたフラスコに転送106セル/mL、例えば106セル/mL x 3.0 の開始セル密度から 2 x 700 mL。
- 120 rpm (50 φ 振動) で CO2を 37 ° C、5% で揺れのインキュベーターでセルを孵化させなさい。
- 2 日後のセルをカウントし、細胞密度が 3.0 x 106セル/mL を超える場合に、セルを分割するのに進みます。2 x 700 mL を注ぐことによって、セルの分割 2800 mL x 2 に細胞培養通気フラスコおよび 2 x 1 L のボリュームに到達する 2 x 300 mL 新鮮なメディアのトッピングをバックアップ
- 120 rpm (50 φ 振動) で CO2を 37 ° C、5% で揺れのインキュベーターでセルを孵化させなさい。
- 24 h 後のセルをカウント、細胞密度が 106セル/mL x 3.0 4.0 との間である場合にセルを収穫します。
2. ミトコンドリアの分離
- 必要なバッファー
注: 量は 2 L 細胞から準備のため与えられました。ミトコンドリアの分離バッファー (MIB)、スクロース/マンニトール バッファー (SM4) 実験 (MIBSM)、再懸濁バッファー (SEM) ために前もって次の貯蔵液を準備します。- 0.5 L MIB バッファー: 50 mM HEPES 島、pH 7.5、10 mM KCl、1.5 mM MgCl2、1 mM EDTA、1 mM グリコールエーテルジアミン四酢酸、1 mM DTT、プロテアーゼ阻害剤。
- 100 mL SM4 バッファーを作る: 280 mM ショ糖、マンニトール 840 mM、50 mM HEPES 島、pH 7.5、10 mM KCl、1.5 mM MgCl2、1 mM EDTA、1 mM グリコールエーテルジアミン四酢酸、1 m M の DTT、プロテアーゼ阻害剤。
- 作る 160 mL MIBSM バッファー: 120 mL MIB バッファー + 40 mL SM4 バッファー。
- 4 ° C で 200 mL の PBS を格納します。
- 5 mL SEM バッファーを作る: 250 mM ショ糖、20 mM HEPES 島、pH 7.5、1 mM EDTA。
- 20 mM HEPES 島、pH 7.5、1 mM EDTA および 60% を含む段階的なショ糖密度勾配の 4 x 10 mL の原液を作る/32% 23% と 15% のショ糖、それぞれ。
- ミトコンドリアの分離
注: それはすぐに働き、すべてプロシージャ全体で氷の上を維持することが重要です。 - 使用する窒素キャビテーション商工会議所前を precool します。
- 7 分、4 ° C の 1,000 × g で遠心分離によって収穫の 2 x 1 L 細胞 (遠心分離機管ごとの 10 の9セル x 3-4)
- 慎重に上清を捨て、2 x 100 mL の PBS にすばやく小球形にされた細胞を再懸濁します。セルをプールします。
- 4 ° C, 10 分間 1,200 x g で再懸濁細胞を遠心分離します。
- 慎重に上清を捨て、ペレット (~ 20 g) の重量を量る。
- 120 mL MIB バッファーにペレットを再懸濁します。
- 10 分の冷蔵室でゆっくり攪拌によって膨張します。
- 氷の上窒素キャビテーション室を置き、窒素キャビテーション室に膨らんだセルを転送します。45 mL SM4 バッファーを追加 (再懸濁細胞、約 140 mL、70 mM ショ糖と 210 mM のマンニトールの最終的な集中を降伏の最終巻の 1/3)。
- 圧力に達する 500 psi まで窒素キャビテーション商工会議所と窒素で塗りつぶしを締めます。タップと 20 分間氷の上分離された保持を閉じます。
- ゆっくりと窒素のキャビテーション チャンバー内の圧力を解放し、ライセートを収集 (約 185 mL)。
- 遠心分離機の分離材料 4 ° C、15 分間 800 x g で核細胞の残骸を削除するには
- 氷で保たれるビーカーに、寒冷紗を介してそれを注ぐことによって上澄みを収集します。ペレットは捨てないでください。
- 90 mL MIBSM バッファーでペレットを再懸濁します (1/2 以前のボリューム)。テフロン/ガラス Dounce ホモジナイザーを使用して均質化し、4 ° C、15 分間 800 × g で遠心分離を繰り返す
- 氷で保たれるビーカーに、寒冷紗を介してそれを注ぐことによって上澄みを収集します。ステップ 2.2.11 から上澄みをこの上清を組み合わせます。
- 遠心分離機の 4 ° C、15 分間 1,000 x g で複合培養上清
- 氷で保たれるビーカーに、寒冷紗を介してそれを注ぐことによって上澄みを収集します。
- ペレットを破棄し、遠心分離機の 4 ° C、15 分間 10,000 x g で原油のミトコンドリアを含む上清
注: ペレットは通常 2 つの部分で構成されます: 緩いとタイトな。 - 慎重にタイトな部分を乱すことがなく緩やかなペレットを洗います。10 mL MIBSM バッファーでタイトなペレットを再懸濁します。
- 市販のタンパク質アッセイ キットや同様の方法を使用して蛋白質濃度分析を実行します。文化を開始 2 L から典型的な濃度の利回りは、〜 2 mg/mL です。
- 200 単位の RNase フリーの DNase を追加し、ゲノム DNA の除去のための DNase を均等にミックスに 20 分間、寒い部屋でローラーの回転に任せます。
- 4 ° C、15 分間 10,000 × g で遠心し、2 mL SEM バッファーでペレットを再懸濁します。ゆっくり小さいテフロン/ガラス Dounce ホモジナイザーを使用して残り集計を再懸濁すホモジナイズしてください。破損を避けるために上下以上、5 つのパスを実行します。氷の上を保ちます。
- チューブの底に 1.5 mL の 60% ショ糖在庫バッファーを慎重にピペッティングして 14 mL のショ糖勾配 SW40 チューブを準備します。慎重にそれを乱すことがなく 4.5 mL の 60% バンドの上に 32% ショ糖在庫バッファーを追加します。23% ショ糖在庫バッファーの 1.5 mL と 1.5 mL のショ糖 15% 在庫バッファー再びを繰り返します。
- ショ糖密度勾配の上に全体のミトコンドリア サスペンション (約 3 mL) をロードします。
- 139 で SW40 ローター、60 分 065 × g で遠心分離機します。
- 茶色バンド転送ピペット、通常 2-3 mL を使用して 32% と 60% のショ糖のインターフェイスへの移行を慎重に収集します。
- スナップ凍結精製のミトコンドリアを液体窒素、-80 ° C の店で
3. Mitoribosome 準備
- 必要なバッファー
注: 換散バッファー、ショ糖クッション/グラデーション、再懸濁バッファーに前もって次の貯蔵液を準備します。- 10 mL の溶解バッファーを作る: 25 mM HEPES 島、pH 7.5、150 mM KCl、50 ミリメートル MgOAc、2% ポリエチレング リコール ポリオキシエチレンノニルフェニル エーテル、2 mM DTT、プロテアーゼ阻害剤。
- 10 mL のショ糖クッション バッファーをつくる: 1 M ショ糖 (34 %w/v)、20 mM HEPES 島、pH 7.5、100 mM KCl、20 mM MgOAc 1% ポリエチレング リコール ポリオキシエチレンノニルフェニル エーテル、2 mM DTT。
- 5 mL 再懸濁バッファーを作る: 20 mM HEPES 島、pH 7.5、100 mM KCl、20 mM MgOAc、2 mM DTT
- TLS 55 ポリカーボネート チューブで 15-30% の再懸濁バッファーとショ糖密度勾配を作る。
- Mitoribosome 浄化
- 氷の上の凍結のミトコンドリアを解凍してください。
- 例えば3 mL ミトコンドリアに 6 mL の溶解バッファーを追加、換散バッファーの 2 つのボリュームを追加します。すぐにミックスを数回チューブを反転します。
- 換散を支援し、換散を完了する氷の上の 5-10 分の間孵化させなさい小さいテフロン/ガラス dounce ホモジナイザーを用いた均質化します。
- 不溶性物質を削除する 4 ° C、20 分間 30,000 × g で遠心分離機の分離材料 (約 9 mL)。ペレットから慎重に上清をデカントし、ペレットを破棄します。
- 上澄みの明確化を確保するための 4 ° C で 20 分間 30,000 × g で遠心分離を繰り返します。ペレットから慎重に上清をデカントし、ペレットを破棄します。
- (超クリア) TLA 120.2 管内スクロース クッションを準備: チューブあたり 0.4 mL ショ糖クッション。分離材料の mL あたり 1 つの管を準備します。
- ショ糖のクッションで分離ミトコンドリアをレイヤー: チューブ、lysate の結果あたり約 1 mL: クッション 2.5: 1 の比率。
- 遠心分離機の 231 のサンプル、4 ° C で TLA120.2 ローターで 45 分間 550 x g
- 上澄みを廃棄し、残留のショ糖を削除する再懸濁バッファーの 100 μ l で順次管をすすいでください。
- 合計 100 μ l 再懸濁バッファーにペレットを再懸濁します。
- 低速で 30 の渦のマイクロ チューブ遠心 4 ° C で 10 分 17,949 × g で遠心分離機に残りの集計を溶解し s
- 慎重に上清を収集し、遠心分離を繰り返します。
- A260mitoribosome 吸収を測定します。
注: 一般的な利回りは 7 A260、 A260: 1.3 A280比率。 - 単一ショ糖密度勾配管にサンプル全体を読み込みます。213 で TLS 55 ロータ、4 ° C で 120 分の 626 × g で遠心分離します。
- グラデーションを分別、 A260光学密度を決定し、プールを一緒に核酸のピークに対応する分数。
注: 典型的なA260: ピーク時のA280比率は > 1.6。 - 選択したメソッドを使用して、必要に応じてバッファーを交換します。変換 1 A260を使用して最終濃度を計算 0.1 mg/mL を =。
- スナップ固定再懸濁バッファーと-80 ° C でストアの精製 mitoribosome サンプル
結果
分割および非常に現実的な細胞浄化アクティブな mitoribosomes のための重要な出発点です。このプロトコルは、HEK293 培養細胞に適用されます。社内セルライン T501 テトラサイクリン誘導制御の下でトランスポーターを表現する安定しています。親セルの行は、HEK293S-GnTI- (材料表) のセル10です。細胞の成長と最小限の密度は 1.5 × 10 に保つ必要がフリー スタイル 293 表現媒体の拡大の間に6セル/mL、最大細胞の密度に対し 2 日毎の倍増率を確保するためにを超えてはならない 〜 10 の6セル × 5/ml 3 x 106セル/mL 上記細胞密度に到達すると、セルを小球形して 1.5 倍の 106セル/mL のセルの最小密度を達成するために拡張されたボリュームで、予熱した新鮮なメディアで再停止されます。この分割を繰り返し実行プロシージャの目的細胞塊が得られるまで 2-3 日。106セル/mL x 3 4.5 の範囲の最後のセル密度が異なることが、少なくとも 2 L はミトコンドリアの分離のための出発点として必要です。細胞生存率は一般に維持されるべき > 90% の収穫は最後の文化 > 95%。大規模な細胞培養の抗生物質での治療はお勧めしません。
差動遠心のシリーズ後、ステップ 2.2.20 後ミトコンドリアの懸濁液の量は 3-5 mL の範囲で通常です。ミトコンドリアは他の細胞器官からショ糖密度勾配 (図 1) でそれから分かれています。段階的なショ糖密度勾配は、グラデーションのボリュームと一緒にミトコンドリアの懸濁液のボリュームは最大のボリュームに遠心分離の管を埋めるように用意しています。60% に移行する茶色のバンドを収集するために特別な注意を必要するここ/32% は周囲のバッファーから雑菌インタ フェースします。これはミトコンドリアの可溶化の次のステップでタンパク質: 洗剤の一定比率を維持するために重要です。この段階で、ミトコンドリアのタンパク質濃度を評価することを助言し、15-20 mg 総ミトコンドリア蛋白質の典型的な利回りが 10 〜10培養 HEK 細胞から期待します。
成功したミトコンドリアの分離、彼らはポリエチレング リコール オクチルフェニル エーテル添加による分離は、mitoribosomes はショ糖クッション (図 2) によって区切られます。疎水性膜物質から mitoribosomes を分離するには、ペレットは洗剤を含まれていないバッファーで再停止されるし、遠心分離によってペレットな疎水性の複合体。このプロシージャは繰り返されると mitoribosomes の精製度はA260によって定量化されます/A280の比率は、〜 1.3 をされる予定です。典型的な収穫は文化を開始 2 L から 7 A260です。Mitoribosomal 分数には、追加大きな可溶性ミトコンドリア複合体、ピルビン酸脱水素酵素、グルタミン酸脱水素酵素なども含まれています。水溶性のミトコンドリア複合体から mitoribosomes を分離するには、上清はショ糖密度勾配に適用されます。下部に、mitoribosome を含む分数がある一般的にチューブの 3 番目。自動ピストンまたは手動ピペット 50 μ L 分数を慎重に勘案または 21 G 針と管底を打つと滴を収集して、ショ糖密度勾配の分別を行う、ことが。
2 つの主要な mitoribosomal の集団がグラデーションで識別される: monosome 55 秒、大サブユニット 39 s では、図 3と図 4として。大サブユニットの端数の存在は、非常にアクティブな分割の状態11のセルを収穫していること示唆しています。Monosome と大サブユニットのピーク間の比率を変更可能性があります。80 s リボソームの汚染と準備の下に近い位置にあるピークがあります。注ローター TLS 55 をスイングを使用して小さなショ糖密度勾配にバケットにより、0.4 1 の光学密度で mitoribosomes 〜 1 mL の急速な浄化のためしてください260。Monosome と大サブユニットのピークの分離、分別によって多少異なりますが、通常 2 つのピークのいくつかの重複があります。したがって、どの画を収集するため、プールは、monosome、またはサンプルで、また大サブユニットの最高の割合を確保するために考慮に取られるべき。高分解能低温電子顕微鏡研究 mitoribosomal 個体群の分離は (追加インシリコ操作) のために絶対に必要ではありません。ただしより良い分離が必要な場合はお勧め大きいチューブと対応する実行時間を使用します。

図 1: ショ糖密度勾配にミトコンドリアの精製します。前述のプロトコルでは、文化を開始 2 L から細胞小器官が一連差動遠心のめん羊し、蔗糖不連続密度勾配分離ミトコンドリア。精製のミトコンドリアは、32/60% 界面下のバンドで発見されます。

図 2: ショ糖クッションの上 mitoribosomes の精製します。2 L 開始文化から原油 mitoribosomes、1 M ショ糖クッションを介して堆積。ペレットは洗剤を使用しないバッファーに再停止され、プロトコルで説明されているように mitoribosomes、2 つの遠心によって明らかにします。準備と典型的なA260の品質を評価するために、吸光度を記録/~1.3 (右側のパネル) のA280比率 mitoribosome 豊富な分数を証明します。この図の拡大版を表示するのにはここをクリックしてください。
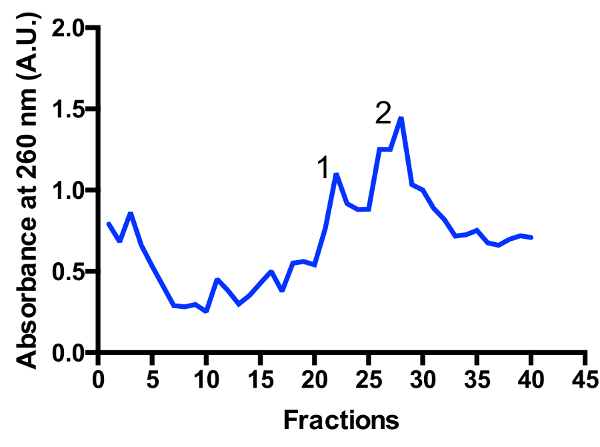
図 3: ショ糖勾配 mitoribosomes の精製を罰金します。文化を開始 2 L から吸光度トレース。分数は、グラデーションの下に上から番号が付けられます。2 つの主要な mitoribosomal の集団は、識別されます: 大サブユニット (ピーク 1) と monosome 55 秒 (最大 2)。人口比を変更可能性があります。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 電子顕微鏡写真、2 D クラス、および 3 D 再構成します。左側のパネル: 1.23 A の校正倍率で monosome ピーク 2 からサンプルを顕微鏡写真/ピクセル。中間パネル:代表的な後処理データ (2 D クラス) 明らかにそのまま monosomes。右側のパネル: 3 D 再構成。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ミトコンドリアの豊富な源であることが知られている動物の組織の比較的容易な供給 mitoribosomes3,5,12、人気のある選択肢となりますが、開始材料は、のソースをについてください。 13, 遺伝的変更および実験室で簡単に再現できません。それ故に、均一に培養されたひと細胞ラインを含むプロトコルを開発するため明らかに実用的な必要性があります。主な違いプロトコル間組織と培養細胞への対処は散と均質化のモード。初代培養細胞単層として成長した、典型的なメソッドはテフロン/ガラス dounce 均質化14です。元の準備のプロトコル間効率的な小さなスケール15開発されました。500 mL の容量を持つホモジナイザーを用いたを直接スケーリングが可能な11、ただし、80% の換散を達成するために肉体労働の ~ 2 h が必要です。これは、少なくとも 3 つの問題を導入: 長い待ち時間による細胞内小器官、大型の容器の底に沈む重い材料による非均質な換散の集計複数のストロークの必要性のためのサンプルの加熱します。したがって、換散の望ましい方法は、減圧加圧容器16,17からに基づいている窒素キャビテーションを利用しています。この方法では、細胞は細胞を柔らかくし、溶解を起こしやすくために冷蔵室で膨らんだ最初。窒素キャビテーション デバイスに置かれるショ糖とマンニトールを含むバッファーがミトコンドリアをそのまま保つを助ける浸透圧を維持するために追加されます。窒素キャビテーション デバイスは、大量の細胞に溶解する酸素フリーの窒素と加圧されます。圧力は、細胞膜の破裂の結果解決からリリースされた窒素気泡です。このメソッドは、次のようにせん断応力と摩擦を含む機械の均質化方法にいくつかの利点を提供しています: 1) セルに任意の外部の物理的なストレスを避けなさい。2) サンプルを冷却する断熱膨張により細胞内小器官; への熱損傷はありません。3) 細胞成分が不活性窒素ガスによって酸化から保護されます。4) は pH 変動しない中断する培地の5) プロセスは均一で再現可能なサンプルとして全体と各セル内に同じ破壊的な力が適用されるので6) プロセスは、高速で 20-30 分以内に完了することができます。
培養細胞や組織からミトコンドリアの分離は広範囲、文献に記載されている、差動遠心シリーズに続く穏やかなセル中断に基づいています。現在使用されているプロトコルのほとんど前の世紀18途中で開発元の手順に従います。基本的な生化学的アプローチが間違っている文献で強調表示され、検出されないままでいくつかの誤解があります。我々 は体系的に報告された一般原則を検討し、結論 mitoribosomes のプロトコルを最適化する: 1) Mg2 +の包含とバッファーの K+は重要ではありません。KCl により細胞質蛋白質のゲル19、しかしの形成を防ぐためには、この現象は発生しません私たちのプロトコルに従って十分な希釈を提供それが主張されています。さらに、Mg2 +の除外は細胞質のリボソーム20; によって汚染を減らすために役に立つ2) 低浸透圧環境からリリースされた細胞小器官を保護するために媒体にセルの最大可能な容積比を維持する必要はありません。ショ糖を含むバッファー、およびミトコンドリア分離バッファーを持つセルの希釈によって私達のプロトコルで浸透圧のサポートを十分に提供 (2.II.5 ステップ) 大規模な準備のために器官の効率的な分離のため非常に重要です。
ミトコンドリア分離バッファーの pH に近い生理値、すなわち7.5 では、次の mitoribosome 準備のため最適な pH でもあります。彼らはそれぞれ自由なマグネシウムとカルシウムをキレートし、結合剤 EDTA とグリコールエーテルジアミン四酢酸は分離メディア汚染イオンをキレート化するために追加されます。EDTA の包含は14内ミトコンドリア膜の損傷につながることができます、したがって濃度は念のため 1 mM に限定されますが、議論されています。我々 はショ糖密度勾配の最終的な精製ステップで 5 mM EDTA を使用する場合はない任意の違いを観察しました。
説明されたプロトコルはここ、mitoribosome の精製 HEK293S 由来ひと細胞を使用します。準備の質では、得られたサンプル原子分解能を生化学的および構造的に調査することができます。これは人間の mitoribosomal 複合体、品質コントロール アセンブリ、および mitoribosomal サブユニット中間体に変換する方法を適用することができます。また、OXPHOS 容量と間質組織、隣接する21と比較して高いミトコンドリアのタンパク質翻訳にがん細胞が増幅されるので mitoribosomes がん22確立した薬のターゲットであります。したがって、阻害剤の存在下での mitoribosomes 特定の浄化のためこのプロトコルを使用してには、医療への応用があります。また、mitoribosomal の突然変異は遺伝性ミトコンドリア疾患23にリンクされています。これらの突然変異は、構造に直接影響を持っている、ので、ここで紹介した方法はその構造特性のため便利になります。プロトコルを実験的展開、さまざまな科学的な質問の人間のミトコンドリアにおける翻訳の基礎的な理解とその医療の重要性への取り組みに適用できます。
開示事項
どれも
謝辞
この作品は、戦略研究 (将来指導者助成金 FFL15:0325)、ラグナル協会財団 (交わり医学 M44/16)、スウェーデン研究評議会 (開始許可 NT × 2015 04107)、FEBS 長期フェローシップ (SA) のスウェーデンの財団によって支えられました。、H2020 MSCA-ITN 2016 プロジェクト 721757 (対)。
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) high glucose, GLUTAMAX supplement, pyruvate | Thermo Scientific | 31966-021 | |
| Fetal Bovine Serum (FBS) | Thermo Scientific | 16000-044 | |
| Blasticidin S HCl | Thermo Scientific | R210-01 | |
| Zeocin selection reagent | Thermo Scientific | R25001 | 100 mg/ml |
| Freestyle 293 Expression medium | Thermo Scientific | 12338026 | |
| T175 tissue culture flask with vented cap | Sarstedt | 83.3912.002 | |
| Shaker flasks with vented cap | Thermo Scientific | 4115-0500, 4115-1000, 4115-2000, 4115-2800 | |
| 250 ml conical bottle tubes, sterile | Corning | 430776 | |
| Eve automated cell counter | NanoEnTek | E1000 | |
| Nitrogen cavitation cell disruption vessel | Parr Instruments | 4635, 4639 | safety volume: 40ml, 600ml respectively |
| Dnase (RNA-free) | HT Biotechnology | N401a | |
| Teflon/glass dounce homogenizers | Cambridge Glassblowing Limited | Size designed upon request | |
| SW40 tubes for mitochondria gradient | Beckman | 344060 | Polypropylene, thin wall |
| Transfer pipettes | Sarstedt | 86.1171 | |
| TLA 120.2 tubes for cushion | Beckman | 343778 | Polycarbonate, thick wall |
| TLS-55 tubes for gradient | Beckman | 347356 | Ultra-clear |
| Gradient Station IP | BioComp | 153-002 |
参考文献
- Ott, M., Amunts, A., Brown, A. Organization and regulation of mitochondrial protein synthesis. Annual review of biochemistry. 85, 77-101 (2016).
- Amunts, A., Brown, A., Toots, J., Scheres, S. H., Ramakrishnan, V. The structure of the human mitochondrial ribosome. Science. 348 (6230), 95-98 (2015).
- Greber, B. J., Bieri, P., Leibundgut, M., Leitner, A., Aebersold, R., Boehringer, D., Ban, N. The complete structure of the 55S mammalian mitochondrial ribosome. Science. 348 (6232), 303-308 (2015).
- Greber, B. J., Ban, N. Structure and function of the mitochondrial ribosome. Annual review of biochemistry. 85, 103-132 (2016).
- Greber, B. J., Boehringer, D., Leitner, A., Bieri, P., Voigts-Hoffmann, F., Erzberger, J. P., Ban, N. Architecture of the large subunit of the mammalian mitochondrial ribosome. Nature. 505 (7484), 515-519 (2014).
- Rorbach, J., Gao, F., Powell, C. A., D'Souza, A., Lightowlers, R. N., Minczuk, M., Chrzanowska-Lightowlers, Z. M. Human mitochondrial ribosomes can switch their structural RNA composition. Proceedings of the National Academy of Sciences. , 201609338 (2016).
- Chrzanowska-Lightowlers, Z., Rorbach, J., Minczuk, M. Human mitochondrial ribosomes can switch structural tRNAs-but when and why?. RNA biology. 14 (12), 1668-1671 (2017).
- Gammage, P. A., Moraes, C. T., Minczuk, M. Mitochondrial Genome Engineering: The Revolution May Not Be CRISPR-Ized. Trends in Genetics. , (2017).
- Brown, A., Rathore, S., Kimanius, D., Aibara, S., Bai, X. C., Rorbach, J., Ramakrishnan, V. Structures of the human mitochondrial ribosome in native states of assembly. Nature Structural and Molecular Biology. 24 (10), 866 (2017).
- Reeves, P. J., Callewaert, N., Contreras, R., Khorana, H. G. Structure and function in rhodopsin: high-level expression of rhodopsin with restricted and homogenous N-glycosylation by tetracycline-inducible N-acetylglucosaminyltransferase I-negative HEK293S stable mammalian cell line. Proceedings of National Academy of Sciences USA. 99, 13419-13424 (2002).
- Brown, A., Amunts, A., Bai, X. C., Sugimoto, Y., Edwards, P. C., Murshudov, G., Ramakrishnan, V. Structure of the large ribosomal subunit from human mitochondria. Science. 346 (6210), 718-722 (2014).
- O'Brien, T. W., Kalf, G. F. Ribosomes from rat liver mitochondria I. Isolation procedure and contamination studies. Journal of Biological Chemistry. 242 (9), 2172-2179 (1967).
- Spremulli, L. L. Large-scale isolation of mitochondrial ribosomes from mammalian tissues. Mitochondria: Practical Protocols. , 265-275 (2007).
- Rice, J. E., Lindsay, J. G., Grahamand, J. M., Rickwood, D. Subcellular fractionation of mitochondria. Subcellular Fractionation: A Practical Approach. , 107-142 (1997).
- Attardi, G., Ching, E. Biogenesis of mitochondrial proteins in HeLa cells. Methods in enzymology. 56, 66-79 (1979).
- Gottlieb, R. A., Adachi, S. Nitrogen cavitation for cell disruption to obtain mitochondria from cultured cells. Methods in enzymology. 322, 213-221 (2000).
- Simpson, R. J. Disruption of cultured cells by nitrogen cavitation. Cold Spring Harbor Protocols. 2010 (11), (2010).
- Kennedy, E. P., Lehninger, A. L. Oxidation of fatty acids and tricarboxylic acid cycle intermediates by isolated rat liver mitochondria. Journal of Biological Chemistry. 179 (2), 957-972 (1949).
- Graham, J. M. Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Amunts, A., Brown, A., Bai, X. C., Llácer, J. L., Hussain, T., Emsley, P., Ramakrishnan, V. Structure of the yeast mitochondrial large ribosomal subunit. Science. 343 (6178), 1485-1489 (2014).
- Sotgia, F., Martinez-Outschoorn, U. E., Howell, A., Pestell, R. G., Pavlides, S., Lisanti, M. P. Caveolin-1 and cancer metabolism in the tumor microenvironment: markers, models, and mechanisms. Annual Review of Pathology: Mechanisms of Disease. 7, 423-467 (2012).
- Škrtić, M., Sriskanthadevan, S., Jhas, B., Gebbia, M., Wang, X., Wang, Z., Lai, C. K. Inhibition of mitochondrial translation as a therapeutic strategy for human acute myeloid leukemia. Cancer cell. 20 (5), 674-688 (2011).
- Boczonadi, V., Horvath, R. Mitochondria: impaired mitochondrial translation in human disease. The international journal of biochemistry & cell biology. 48, 77-84 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved