Method Article
בידוד מהיר של Mitoribosome מתאי HEK
In This Article
Summary
המיטוכונדריה המתמחה הריבוזומים זה שונה מהקבצים המקבילים בקטריאליים ו cytoplasmic. הנה אנחנו מראים כיצד ניתן להשיג mitoribosomes שלהם בתא הילידים HEK תאים. השיטה כוללת בידוד של המיטוכונדריה מתאי ההשעיה ולטיהור הסוגר mitoribosomes.
Abstract
המיטוכונדריה אנושי בעלי סט ייעודי של ריבוזומים (mitoribosomes) לתרגם חלבון חיוני 13, מרכיבי מתחמי זרחון חמצוני מקודד על ידי הגנום מיטוכונדריאלי. מאז כל החלבונים מסונתז על ידי אדם mitoribosomes חלבוני ממברנלי אינטגרלי, mitoribosomes האנושי הם קשור את הקרום הפנימי מיטוכונדריאלי במהלך התרגום. בהשוואה הריבוזום cytosolic mitoribosome יש מקדם שיקוע של לבני 55 ומעלה, חצי התוכן rRNA, אין rRNA 5S 36 חלבונים נוספים. לכן, יחס גבוה של חלבון-ל-RNA מבנה טיפוסי הופכים את mitoribosome האדם נבדל מהותית המקביל cytosolic.
למרות החשיבות המרכזית mitoribosome לחיים, אין פרוטוקולים היו זמינות לטהר את מתחם שלם של שורות תאים אנושיים. באופן מסורתי, mitoribosomes הם בודדו אותנו מהמתרחש ברקמות בעלי חיים המיטוכונדריה עשיר נדרש קילוגרמים של הפעלת חומר. אנחנו הסיק כי במיטוכונדריה חלוקת תאים אנושיים נגזר HEK293 גדל עשירות ביטוי מדיום יש תרגום מיטוכונדריאלי פעיל של, לכן, יכול להיות מקור מתאים של חומר לימודי ביוכימיה מבניים mitoribosome. כדי לחקור את המבנה שלו, פיתחנו פרוטוקול לטיהור בקנה מידה גדול של mitoribosomes ללא פגע מתאי HEK. במסמך זה, נסקור חנקן שיטה קוויטציה כמו מהירה, פחות חלופה מהגידולים ויעילה יותר לשיטות מסורתיות מכני מבוסס-גזירה עבור פירוק התא. כתוצאה מכך ההכנות של mitoribosome מותרים על נחישותה מבניים לרזולוציה גבוהה, חשיפת ההרכב את mitoribosome האנושית ללא פגע, intermediates מכלול שלה. כאן, אנו לעקוב אחרי עבודה זו ולהציג על אופטימיזציה ותרבותית שיטה חסכונית יותר הדורשים בלבד ~ 1010 HEK תאים. השיטה יכול להיות מועסק לטהר mitoribosomal האנושי לתרגם מתחמי, מוטציות, בקרת איכות הרכבות, mitoribosomal subunits intermediates. הטיהור וניתן באופן ליניארי לשנותם פי עשרה אם זקוק לו, חלה גם על סוגים אחרים של תאים.
Introduction
התהליך של סינתזת חלבונים מיטוכונדריאלי מבוסס על 13 חיוני mt-mRNAs המתורגמים מאת mitoribosome צמוד-ממברנה מיוחדות כדי ליצור את ליבת קטליטי שרשרת הנשימה. הגנום מיטוכונדריאלי שונה ועל הצורך של החלבונים להוסיף co-translationally לתוך הקרום שעיצבו באופן משמעותי את הארכיטקטורה של הריבוזומים מיטוכונדריאלי1. האחרונות מבני ברזולוציה גבוהה mitoribosome יונקים הראו מראה שונה הכוללת2,המקביל חיידקי3. במיוחד, לפחות 36 חלבונים ספציפיים המיטוכונדריה מתווספים, תורם מד א ~ 1 מסה מולקולרית נוספת, ואילו mt-rRNA הוא מופחת על ידי כפולה מאוד שונה. Rearrangements מבנית לשנות כמעט כל תכונות פונקציונלי קריטי אשר היו בעבר מקובלים להיות אוניברסלית והתפאורה4.
אלמנטים ראשי חדשים שרכשו על ידי כל אחד subunits mitoribosomal, לדוגמה, יחידת משנה קטנים שילבה mS29 חלבון מהותי של GTPase לאזור 'הראש' שלה. GTPase פעילות לא נמצא במערכות אחרות תרגום, ומציין המבנה GTPase שיש תפקיד מכלול יחידת משנה2. 5S rRNA זה נחשב לסימן ההיכר של כל הידוע subunits גדול ribosomal, ומקים את ליבת בליטה במרכז, חסר mitoribosome יונקים, אימצה mt-tRNA-ואל כמו אבן בניין נפרד במקום2. באן ועמיתיו הראו כי mitoribosome חזירי יש mt-tRNA-Phe ו- Val5. Chrzanowska-Lightowlers, Minczuk, ועמיתיו אחריו נתונים אלה ומצא כי mitoribosomes של חולים עם פרוץ mt-tRNA-ואל יציבות יכול באופן עקרוני להכיל mt-tRNA-Phe6,7. למה mitoribosomes שילבו רכיבים ספציפיים אלה, איזה מסלולים, טרנס-גורמים נדרשים עבור מהרכבות ייחודיים אלה עדיין לא ידועים.
בסך הכל, למורכבות גבוהה mitoribosome האדם את מרכיבי חלבון חדש, האגודה ייחודי של mt-tRNA כרכיב מבני מרמז על מעורבותם של המיטוכונדריה ספציפיים כמו-אך-לא ידוע הטרנס -גורמים. עם זאת, כי רבות מן התכונות של מערכת זו ייחודית המיטוכונדריה, אשר באופן מסורתי היה קשה לחקור8, מעט מאוד ידוע על המנגנון המולקולרי ובקרת איכות. עם הפיתוח של חלקיק בודד ברזולוציה גבוהה ניתוח על ידי אלקטרון מיקרוסקופיה-הקפאה (הקפאה-EM)20, עולות הזדמנויות עכשיו ללמוד באופן מקיף את המנגנונים המולקולריים שבבסיס הרכבה, העשייה, בקרת איכות של האדם mitoribosome. הדוח שלנו של המבנה הראשון של מכלול אנושי mitoribosome ביניים מספק את ההכרה כי זה אפשר לדמיין איך נוצר את mitoribosome האנושית, מראה שכי הקפאה-EM הוא אינסטרומנטלי זיהוי חדש טרנס- בפועל מכלול גורמים9.
כדי להרחיב על המאמץ הראשוני הזה, אנו מתארים פרוטוקול מהיר לטיהור mitoribosome האנושי בפירוט. בחלק הראשון של הפרוטוקול, מתואר של בידוד בקנה מידה גדול של המיטוכונדריה ללא פגע מאוד טהור מתאי ההשעיה. הליך זה דורש 9 h יכול להיות בקלות ששינה ו המותאמים לסוגי תאים שונים וסולמות. צעד משמעותי פרוטוקול זה הוא השימוש של חנקן קוויטציה לשבור את התאים פתוחים. החלק השני של הפרוטוקול פותחה לטהר את mitoribosomes. הליך זה דורש 7 שעות ותשואות כמות מספקת של mitoribosomes עבור לימודי ביוכימיה מבנית. שימוש המיטוכונדריה טהור כמו בחומר המוצא מציע ההכנות באיכות גבוהה, יכול להיות אקסטרפולציה מקרומולקולות מיטוכונדריאלי אחרות.
Protocol
בתרבית של תאים כל תרבות העבודה יש לבצע בתוך בטיחות ביולוגית ארון. השתמש הציוד סטרילי אם קשר עם תאים. ללבוש את הכפפות nitrile, חלוק מעבדה ופעל תרגול טוב תרביות רקמה.
1. תרבית תאים
- לשמור על HEK293S ההשעיה תאים של Dulbecco ששינה נשר בינוני (DMEM) בתוספת 10% ללא טטרציקלין עוברית סרום שור (FBS), 5 μg/mL blasticidin ו- 200 μg/mL Azithromycin, ב CO 37 ° C ו-5%2.
- קנה המידה מבחנות x T175 עד 9. ב- 90% confluency, לקצור תאי, לסובב אותם למטה ב 500 x g עבור 5 דק Resuspend תאי pelleted Freestyl בתוספת 5% FBS נטולת טטרציקלין. ספירת תאים באמצעות תא אוטומטיות מונה ולהתאים תא ריכוז של 1.5 x 106 תאים/מ ל בקבוקון חזק פרקו.
הערה: זה בדרך כלל יתאים את נפח ההתחלתי של 300 מ ל בקבוקון פרקו 1,000 מ. - דגירה בתאים חממה חזק-37 מעלות צלזיוס ו-5% CO2 -120 סל ד (קוטר 50 מ מ חזק).
- לאחר יומיים לספור את התאים והמשך לפצל את התאים אם צפיפות התאים הוא מעל 3.0 x 106 תאים למ"ל. לפצל את התאים על ידי סחרור למטה 2 x 150 מ ל תרבית תאים בבקבוקי חרוט 2 x 250 מל ב 500 גרם במשך 5 דק Resuspend תאים בתקשורת טריים 2 x 10 מ"ל ולהעביר ל 2 x 1, 000 מ ל פרקו בקבוקונים המכילים את אמצעי האחסון המתאים עבור צפיפות התא האחרון של 1.5 x 106 תאים למ"ל, למשל 2 x 300 מ"ל של צפיפות התא ההתחלתי של 3.0 x 106 תאים למ"ל.
- דגירה בתאים חממה חזק-37 מעלות צלזיוס ו-5% CO2 -120 סל ד (קוטר 50 מ מ חזק).
- אחרי יומיים לספור את התאים והמשך לפצל את התאים אם צפיפות התאים הוא מעל 3.0 x 106 תאים למ"ל. פצל התאים על ידי ספינינג למטה 4 x 150 מ ל תרבית תאים בבקבוקי חרוט 4 x 250 מל ב 500 גרם במשך 5 דק Resuspend תאים בתקשורת טריים 2 x 10 מ"ל ולהעביר ל mL 2 x 2,000 פרקו את הבקבוק המכילים את אמצעי האחסון המתאים עבור צפיפות תא הסופי של 1.5 x 106 תאים למ"ל, למשל 2 x 700 מ"ל של צפיפות התא ההתחלתי של 3.0 x 106 תאים למ"ל.
- דגירה בתאים חממה חזק-37 מעלות צלזיוס ו-5% CO2 -120 סל ד (קוטר 50 מ מ חזק).
- אחרי יומיים לספור את התאים והמשך לפצל את התאים אם צפיפות התאים הוא מעל 3.0 x 106 תאים למ"ל. לפצל את התאים על ידי מזיגת mL 2 x 700 תרבית תאים לתוך 2 x 2800 mL פרקו מבחנות, מצטייד עם 2 x 300 מ"ל מדיה טריים להגיע נפח של 2 x 1 ל'
- דגירה בתאים חממה חזק-37 מעלות צלזיוס ו-5% CO2 -120 סל ד (קוטר 50 מ מ חזק).
- לאחר 24 שעות לספור את התאים ולקצור את התאים אם צפיפות התאים היא בין 3.0-4.0 x 106 תאים למ"ל.
2. המיטוכונדריה בידוד
- מאגרי נדרש
הערה: הכמויות ניתנים עבור הכנה מתאי 2 ל'. הכינו את הפתרונות הבאים מלאי מראש עבור מאגר בידוד מיטוכונדריאלי (MIB), סוכרוז/מניטול מאגר (SM4), מאגר ניסיוני (MIBSM), resuspension מאגר (SEM).- הפוך 0.5L MIB מאגר: 50 מ מ HEPES-קו, pH 7.5, 10 מ מ אשלגן כלורי, 1.5mM MgCl2, 1 מ"מ EDTA, 1 מ"מ EGTA, 1 מ"מ DTT, מעכבי פרוטאז.
- להפוך את מאגר 100 מ ל SM4: 280 ממ סוכרוז, מניטול 840 מ מ, 50 מ מ HEPES-קו, pH 7.5, 10 מ מ אשלגן כלורי, 1.5 mM MgCl2, 1 מ"מ EDTA, 1 מ"מ EGTA, 1 מ' מ' DTT, מעכבי פרוטאז.
- יצירת מאגר MIBSM 160 מ ל: מאגר MIB 120 מ ל + 40 מ"ל SM4 מאגר.
- לאחסן 200 מ ל PBS ב 4 º C.
- להפוך את מאגר 5 מ"ל SEM: סוכרוז 250 מ מ, 20 מ מ HEPES-קו, pH 7.5, 1 מ מ EDTA.
- להפוך את פתרונות מעבר הצבע סוכרוז stepwise המכיל 20 מ מ HEPES-קו, pH 7.5, 1 מ"מ EDTA, 60% מניות 4 x 10 מ"ל / 32% סוכרוז /23% ל- 15%, בהתאמה.
- המיטוכונדריה בידוד
הערה: חשוב לעבוד מהר ולשמור הכל על קרח לאורך כל ההליך. - Precool המנזר קאמרית קוויטציה חנקן לשימוש.
- הקציר L 2 x 1 תאים (3-4 x 109 תאים למחזור צנטריפוגה) על ידי צנטריפוגה ב g 1,000 x במשך 7 דקות, 4 מעלות צלזיוס.
- Decant את תגובת שיקוע בזהירות, resuspend תאי pelleted במהירות 2 x 100 מ"ל PBS. בריכת התאים.
- Centrifuge התאים resuspended ב 1,200 x g למשך 10 דקות, 4 מעלות צלזיוס.
- Decant את תגובת שיקוע בקפידה ולשקול בגדר (~ 20 גרם).
- Resuspend בגדר במאגר MIB 120 מ.
- לאפשר תאים להתנפח מאת בעדינות ערבוב בחדר קרים למשך 10 דקות.
- מקום תא קוויטציה חנקן על הקרח ולהעביר את התאים המנופח לתא קוויטציה חנקן. להוסיף מאגר 45 מ ל SM4 (1/3 של הכרך האחרון של תאים resuspended, בערך 140 מ ל, מניב ריכוז סופי של מניטול סוכרוז ו- 210 מ מ 70 מ"מ).
- הדקו את החנקן קוויטציה קאמרית ומילוי עם חנקן עד הלחץ מגיע 500 psi. לסגור את הברזים ולשמור מבודדת על קרח למשך 20 דקות.
- לאט לאט לשחרר את הלחץ בבית הבליעה קוויטציה חנקן ולאסוף את lysate (כ 185 מ ל).
- Centrifuge את החומר lysed להסיר את שאריות תאים ואת הגרעינים ב g x 800 למשך 15 דקות, 4 מעלות צלזיוס.
- לאסוף את תגובת שיקוע על ידי נירה דרך לאהוב את גביע שמרה על קרח. אל תמחק את גלולה.
- Resuspend בגדר במאגר MIBSM 90 מ ל (1/2 האחסון הקודם). Homogenize באמצעות טפלון/זכוכית דאונס מהמגן וחזור על צנטריפוגה ב 800 x g למשך 15 דקות, 4 מעלות צלזיוס.
- לאסוף את תגובת שיקוע על ידי נירה דרך לאהוב את גביע שמרה על קרח. לשלב זה תגובת שיקוע עם תגובת שיקוע מהשלב 2.2.11.
- Centrifuge את supernatants משולב ב 1,000 x g למשך 15 דקות, 4 מעלות צלזיוס.
- לאסוף את תגובת שיקוע על ידי נירה דרך לאהוב את גביע שמרה על קרח.
- למחוק את צניפה, centrifuge את תגובת שיקוע המכיל המיטוכונדריה גולמי ב g x 10,000 למשך 15 דקות, 4 מעלות צלזיוס.
הערה: בגדר יכלול בדרך כלל שני חלקים: חופשי והדוק. - בזהירות לשטוף בגדר חופשי מבלי להפריע את החלק חזק. Resuspend בגדר חזק במאגר MIBSM 10 מ"ל.
- ביצוע וזמינותו הריכוז של חלבון באמצעות ערכת Assay חלבון מסחרי או שיטה דומה. ריכוז טיפוסי היבול של 2 ל' מתחילה תרבות הם ~ 2 מ"ג/מ"ל.
- להוסיף 200 יחידות של RNase DNase חינם והשאר כדי לסובב על גלגלת בחדר הקר כעשרים דקות לערבב את DNase הסרה של ה-DNA גנומי באופן שווה.
- צנטריפוגה ב g x 10,000 למשך 15 דקות, 4 ° C, resuspend בגדר במאגר 2 מ"ל SEM. Homogenize בעדינות באמצעות מהמגן דאונס טפלון/זכוכית קטנות כדי resuspend כל אגרגטים הנותרים. לבצע לא יותר מחמישה שיהיה עובר כדי למנוע שבירה. לשמור על הקרח.
- הכן המילוי ההדרגתי של סוכרוז ב 14 mL צינורות SW40 על ידי בקפידה pipetting 1.5 מ ל 60% סוכרוז מאגר מניות לתוך החלק התחתון של הצינור. להוסיף בזהירות 4.5 מ ל-32% סוכרוז מניות המאגר על הלהקה 60% מבלי להפריע זה. חזור על 1.5 מ של מאגר מניות 23% סוכרוז, שוב עם 1.5 מ של מאגר מניות 15% סוכרוז.
- לטעון את המתלה מיטוכונדריאלי כולו (כ 3 מ ל) על גבי המילוי ההדרגתי סוכרוז.
- צנטריפוגה SW40 הרוטור-139, g 065 x עבור 60 דקות.
- בזהירות לאסוף את הלהקה חום לפלטפורמת הממשק של 32% ו- 60% סוכרוז באמצעות העברת פיפטה a, בדרך כלל 2-3 מ.
- Snap-ההקפאה של המיטוכונדריה מטוהרים חנקן נוזלי, חנות ב-80 מעלות צלזיוס.
3. Mitoribosome הכנה
- מאגרי נדרש
הערה: להכין את הפתרונות הבאים מלאי מראש עבור מאגר פירוק סוכרוז כרית/צבע, מאגר resuspension.- להפוך את מאגר פירוק 10 מ"ל: 25 מ מ HEPES-קו, pH 7.5, 150 מ מ אשלגן כלורי, 50 מ מ MgOAc, 2% פוליאתילן octylphenyl גליקול, 2 מ מ. DTT, מעכבי פרוטאז.
- להפוך את 10 מ"ל סוכרוז כרית מאגר: 1 מ' סוכרוז (34% w/v), 20 מ מ HEPES-קו, pH 7.5, 100 מ מ אשלגן כלורי, 20 מ מ MgOAc, 1% פוליאתילן octylphenyl גליקול, 2 מ מ DTT.
- להפוך את מאגר resuspension מ ל: 20 מ מ HEPES-קו, pH 7.5, 100 מ מ אשלגן כלורי, 20 מ מ. MgOAc, 2 מ מ DTT
- להפוך 15% - 30% סוכרוז ליניארי מעברי צבע באמצעות מאגר resuspension צינורות פוליקרבונט TLS-55.
- Mitoribosome טיהור
- מפשירים את המיטוכונדריה קפוא בקרח.
- להוסיף 2 כרכים של המאגר פירוק,למשל להוסיף מאגר פירוק 6 מ ל 3 מ"ל המיטוכונדריה. מערבבים באופן מיידי על-ידי היפוך ברכבת התחתית מספר פעמים.
- Homogenize עם מהמגן דאונס טפלון/זכוכית קטנות כדי לסייע את פירוק, תקופת דגירה של 5-10 דקות על קרח כדי להשלים את פירוק.
- Centrifuge את החומר lysed (כ- 9 מ"ל) ב- g x 30,000 עבור 20 דקות, 4 ° C כדי להסיר את החומר לא מסיסים. Decant את תגובת שיקוע בקפידה מן בגדר וזורקים בגדר.
- חזור על צנטריפוגה ב 30,000 x g עבור 20 דקות ב 4 ° C כדי להבטיח בירור תגובת שיקוע. Decant את תגובת שיקוע בקפידה מן בגדר וזורקים בגדר.
- להכין את הכרית סוכרוז TLA 120.2 צינורות (סופר ברורים): כרית 0.4 גרם סוכרוז למחזור. להכין את שפופרת אחת לכל מ"ל של חומר lysed.
- שכבה המיטוכונדריה lysed על הכרים סוכרוז: כ 1 מ"ל למחזור, וכתוצאה מכך lysate: כרית יחס של 2.5:1.
- Centrifuge את הדגימה-231, g 550 x עבור 45 min ברוטור TLA120.2 ב 4 º C.
- למחוק את תגובת שיקוע ולשטוף את צינורות ברצף עם 100 µl של המאגר resuspension כדי להסיר שאריות סוכרוז.
- Resuspend כדורי במאגר הכולל 100 µl resuspension.
- מערבולת על מהירות איטית ל 30 s כדי להמיס מצרפי הנותרים, צנטריפוגה ב 17,949 g x 10 דקות בצנטריפוגה microtube ב 4 º C.
- בזהירות לאסוף את תגובת שיקוע וחזור על צנטריפוגה.
- למדוד mitoribosome הקליטה ב A260.
הערה: התשואה טיפוסי הוא 7 א260, עם A260: א280 יחס של 1.3. - לטעון את המדגם כולו על גבי צינור מעבר צבע יחיד סוכרוז ליניארי. צנטריפוגה הרוטור TLS-55-213, g 626 x עבור 120 דקות ב 4 º C.
- Fractionate מעבר הצבע, לקבוע הצפיפות האופטית ב A260 , בריכה השבר המתאים אל פסגת חומצת גרעין יחד.
הערה: טיפוסי A260: Aיחס280 השיא > 1.6. - חילופי המאגר במידת הצורך, באמצעות שיטה של בחירה. לחשב את הריכוז הסופי באמצעות Aאת ההמרה 1260 = 0.1 מ"ג/מ"ל.
- הצמד להקפיא המדגם מטוהרים mitoribosome מאגר resuspension, חנות ב-80 מעלות צלזיוס.
תוצאות
החלוקה בר -קיימא מאוד התאים מהווה נקודת מוצא הכרחית לשם טיהור של mitoribosomes פעיל. פרוטוקול זה ישימה לתאים הבולם HEK293. אנו משתמשים שורת התאים ללא צורך במיקור חוץ T501, אשר stably מביע נהג תחת שליטה inducible-טטרציקלין. קו תא הורים הוא HEK293S-GnTI– תאים (טבלה של חומרים)10. במהלך צמיחת תאים, הרחבת המדיום ביטוי 293 פריסטייל צפיפות מינימלית יש לשמור ב 1.5 x 106 תאים/mL, על מנת להבטיח קצב ההכפלה של כל יומיים, ואילו מרבית תא צפיפות לא יעלה על 5 ~ x 106 תאים / mL. כשמגיעים צפיפות התאים מעל 3 x 106 תאים למ"ל התאים מגורען, resuspended באזור רעננה, טרופה של אמצעי אחסון מורחב כדי להשיג צפיפות התאים המיזערי של 1.5 x 106 תאים למ"ל. פיצול זה מבוצע שוב ושוב כל 2-3 ימים עד מסה התא הרצוי עבור ההליך מושגת. צפיפות תא הסופי יכול להשתנות בטווח של 3-4.5 x 106 תאים למ"ל, לפחות 2 ל' נדרש כנקודת התחלה עבור בידודו של המיטוכונדריה. הכדאיות תא צריך להיות מתוחזק באופן כללי > 90%, ועבור התרבות הסופי הוא נקצרו > 95%. טיפול של התרבות תאים בקנה מידה גדול עם אנטיביוטיקה אינה מומלצת.
לאחר הסדרה של centrifugations דיפרנציאלית, הנפח של המתלה מיטוכונדריאלי לאחר שלב 2.2.20 היא בדרך כלל בטווח של 3-5 מ. המיטוכונדריה מופרדים ואז במעבר הצבע סוכרוז (איור 1) organelles אחרים. מעבר הצבע סוכרוז stepwise מוכן כך הנפח של מעבר הצבע, הנפח של המתלה מיטוכונדריאלי יחד ממלאים צינור צנטריפוגה כדי הנפח המקסימלי שלה. כאן נדרש טיפול מיוחד כדי לאסוף את הלהקה חום מעבר ל- 60% / 32% הממשק עם זיהום מזערי מתוך המאגר שמסביב. זה חשוב כדי לשמור על יחס קבוע חלבון: דטרגנט בשלב הבא של המיטוכונדריה solubilization. מומלץ להעריך את ריכוז חלבון מיטוכונדריאלי בשלב זה, וצפויה תשואה טיפוסי של חלבון מיטוכונדריאלי סה כ 15-20 מ"ג מתאי HEK ~ 1010 תרבותי.
על הבידוד מוצלח המיטוכונדריה, הם הם lysed על ידי התוספת של פוליאתילן גליקול octylphenyl, mitoribosomes מופרדים באמצעות כרית סוכרוז (איור 2). כדי להפריד בין mitoribosomes לבין החומר עלי הלוואי קרומיים הידרופוביות, הם כדורי resuspended במאגר אשר אינו מכיל חומרי ניקוי, מתחמי הידרופובי מגורען על ידי צנטריפוגה. הליך זה חוזר על עצמו, ואת מידת טיהור mitoribosomes הוא לכמת מאת A260/א280 יחס, אשר צפוי להיות ~ 1.3. התשואה טיפוסי הוא A7260 מ בשנה השנייה מתחילים תרבות. שבר mitoribosomal הזה מכיל גם נוספים מסיסים מיטוכונדריאלי מתחמים גדולים, כגון פירובט דהידרוגנאז גלוטמט דהידרוגנאז. להפריד mitoribosomes מתחמי מיטוכונדריאלי מסיסים, תגובת שיקוע חל מעבר הדרגתי צפיפות סוכרוז. שברים המכיל את mitoribosome ממוקמים בדרך כלל בתחתית השלישי של הצינור. Fractionation של המילוי ההדרגתי סוכרוז אז יכול להיעשות עם בוכנה אוטומטית או באופן ידני על-ידי בקפידה לוקח 50 שברים µL עם פיפטה או חורים בתחתית צינור עם מחט 21 G ואיסוף הטיפות.
שתי האוכלוסיות mitoribosomal הגדולות מזוהות במעבר הצבע: monosome לבני 55 ומעלה, יחידת משנה גדולה 39S, כפי ששורטטה ב איור 3 ו- 4 איור. הנוכחות של השבר גדול יחידה משנית מרמז כי התאים נקצרים פעיל ביותר החלוקה המדינה11. היחס בין monosome לבין פסגות יחידה משנית גדולים עשויים להשתנות. שיא נוספים הממוקמים קרוב יותר לחלק התחתון עשויה להופיע במסגרת ההכנות עם מזהם cytoplasmic הריבוזומים שנות ה-80. בבקשה הערה מעבר הצבע סוכרוז קטן באמצעות החוגגת את דלי הרוטור TLS-55 מאפשר ולטיהור מהירה ~ 1 מ ל mitoribosomes צפיפות אופטית של 0.4-1 -260. ההפרדה של monosome ושל פסגות יחידה משנית גדול עשוי להשתנות מעט fractionation, אבל בדרך כלל יש חפיפה של שתי הפסגות. לפיכך, אילו שברים לאסוף, ואת הבריכה צריכים להילקח בחשבון על מנת להבטיח את היחס הגבוה של monosome, או לחלופין גדולה יחידה משנית, במדגם. ללימודים הקפאה ברזולוציה גבוהה-EM, ההפרדה בין שתי האוכלוסיות mitoribosomal אינה נדרשת לחלוטין (עקב פעולות נוספות סיליקו ). עם זאת, אם נדרשת הפרדה טובה יותר, מומלץ להשתמש צינורות גדולים יותר, המתאימים לפעול פעמים.

איור 1 : טיהור של המיטוכונדריה על מעבר הדרגתי סוכרוז. Organelles subcellular מ בשנה השנייה מתחילים תרבות היו fractionated דרך סדרה של centrifugations משלים כמפורט בפרוטוקול, המיטוכונדריה הופרדו על מעבר הדרגתי סוכרוז מקוטע. המיטוכונדריה מטוהרים מצויים הלהקה התחתון-הממשק 32% 60%.

איור 2 : טיהור של mitoribosomes על כרית סוכרוז. Mitoribosomes גולמי מתרבות המוצא 2 L הם sedimented באמצעות כרית סוכרוז 1 מ'. כדורי הם resuspended במאגר ללא דטרגנט, mitoribosomes לאשורן על ידי שני centrifugations כמפורט בפרוטוקול. ספיגת נרשם כדי להעריך את האיכות של הכנה, טיפוסי A260/א280 יחס של ~1.3 (לוח נכון) מאשרת שבריר עשיר mitoribosome. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
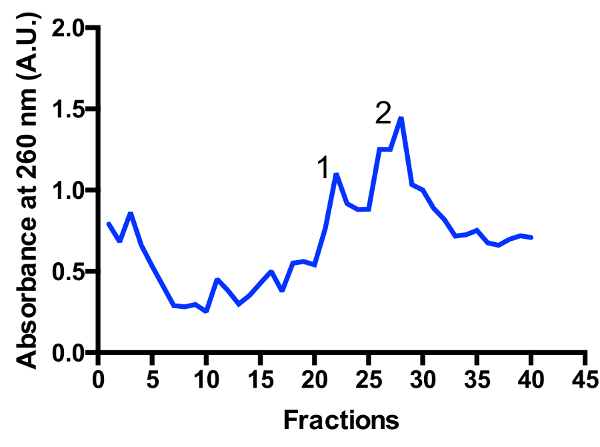
איור 3 : בסדר טיהור של mitoribosomes על מעבר הדרגתי סוכרוז. מעקב ספיגת מ בשנה השנייה מתחילים תרבות. שברים ממוספרים מהחלק העליון לחלק התחתון של מעבר הצבע. שתי האוכלוסיות mitoribosomal הגדולות מזוהות: יחידה משנית גדולה (שיא 1) ו- monosome לבני 55 ומעלה (שיא 2). היחס בין האוכלוסיות עשויים להשתנות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 : אלקטרון micrograph מחלקות 2D, 3D שחזור. פאנל שמאלי: מיקרוסקופ עם הדגימה מהשיא monosome 2 בהגדלה גדולה מכוילת של 1.23 A / פיקסל. התיכון לוח: נציג שלאחר עיבוד נתונים (2D כיתות) חשיפת monosomes ללא פגע. לוח נכון: שחזור תלת-ממד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
לגבי המקור של הפעלת חומר, למרות הזמינות קל יחסית של רקמות חיות אשר ידועים להיות מקור עשיר של המיטוכונדריה, מאפשר בחירה פופולרית עבור mitoribosomes3,5,12, 13, לא יכולה להיות גנטית שונה והם לשכפל במעבדה בקלות. לפיכך, יש צורך ברור מעשיים לפיתוח פרוטוקולים מעורבים שורות homogeneously בתרבית תאים אנושיים. ההבדל העיקרי בין הפרוטוקולים בהתמודדות עם רקמות ותאים בתרבית נמצא במצב של פירוק, המגון. עבור תאים בתרבית גדל כמו טפט, הוא שיטה אופיינית טפלון/זכוכית דאונס המגון14. הפרוטוקולים הכנה המקורי בזמן יעיל פותחו סולמות קטן15. דרוג ישירה על העסקת מהמגן עם הקיבולת של 500 מ ל אפשריים11, אולם היא דורשת ~ 2 h של עבודת כפיים כדי להשיג את פירוק 80%. זה הציג לפחות שלושה נושאים: צבירה של organelles עקב זמן ההמתנה, פירוק בלתי הומוגנית בשל חומר כבד לשקוע בתחתית קיבול גדול, חימום של המדגם בשל בצורך של קווים מרובים. לכן, שיטה עדיפה של פירוק מנצל קוויטציה חנקן, אשר מבוססת על ביטול דחיסה של כלי מווסת16,17. בשיטה זו, תאים הם התנפחו תחילה בחדר הקר על מנת לרכך את התאים ולגרום להם יותר להשפעתם של פירוק. כאשר הם ממוקמים בתוך המכשיר קוויטציה חנקן מאגר המכיל סוכרוז, מניטול נוסף על מנת לשמור על לחץ אוסמוטי זה יעזור לשמור המיטוכונדריה ללא שינוי. המכשיר קוויטציה חנקן מדוחס ואז עם כמויות גדולות של חנקן נטולת חמצן, אשר מתמוסס לתוך התאים. כמו הלחץ הוא החנקן שפורסמו הבועות מתוך פתרון והתוצאה פקיעת של קרום התא. שיטה זו מציעה מספר יתרונות על פני שיטות homogenizing מכניים מעורבים הטיה מדגיש וחיכוכים כדלקמן: 1) מתח פיזי חיצוני על התאים הוא נמנע; 2) הרחבה אנווריאנטים שמקררת את הדגימה, מבטיחה מנזקים חום organelles; 3) רכיבים תא יהיו מוגנים מפני חמצון ע י הגז חנקן אינרטי; 4) אין שינוי ה-pH של המדיום suspending; 5) התהליך הוא אחיד, לשחזור כי אותם כוחות משובש מוחלים בתוך כל תא וברחבי המדגם; 6) תהליך מהיר והוא יכול להסתיים בתוך 20-30 דקות.
בידוד של המיטוכונדריה מ בתרבית תאים ורקמות תואר בספרות בהרחבה, הוא מבוסס על הפרעה תא עדין ואחריו סדרה של centrifugations דיפרנציאלית. רוב הפרוטוקולים משמש כיום בצע את ההליכים המקורי פותח באמצע המאה הקודמת18. בעוד הגישות הביוכימי בסיסיים נכונים, יש כמה תפיסות מוטעות מודגש בספרות, נשארו בלי שירגישו. כדי למטב את פרוטוקול mitoribosomes, באופן שיטתי חקרה את עקרונות כלליים שדווחה ואנו מסיקים כי: 1) הכללת מ ג2 + ו- K+ במאגר אינה מכרעת. נטען כי מסייע אשלגן כלורי כדי למנוע cytoplasmic חלבונים יוצרים ג'ל19, עם זאת, בתנאי לדילול מספיק כפי שמתואר פרוטוקול שלנו, תופעה זו אינה מתרחשת. יתר על כן, אי-הכללה של Mg2 + שימושית לצמצום מציג על ידי ריבוזומים cytoplasmic20; 2) יש אין צורך לשמור על יחס נפח אפשרי של תאים לבינונית כדי להגן על organelles המשוחררים מן הסביבה היפו-osmotic. התמיכה osmotic בפרוטוקול שלנו מספיק מסופק על ידי מאגרי המכילים סוכרוז, הדילול של תאים עם מאגר בידוד המיטוכונדריה (שלב 2.II.5) הוא קריטי עבור ההפרדה יעיל של organelles בהכנה בקנה מידה גדול.
ה-pH של המיטוכונדריה בידוד מאגר קרובה ערכים פיזיולוגיים, כלומר 7.5, שהוא גם רמת ה-pH האופטימלי עבור הכנת mitoribosome הבאים. איגוד סוכני EDTA, EGTA מתווספים בכלי התקשורת בידוד כדי chelate יונים מזהמים, הם chelate חינם מגנזיום וסידן, בהתאמה. זה נדון כי הכללת EDTA יכול להוביל הנזק של הממברנה הפנימית מיטוכונדריאלי14, לכן הריכוז הוא מוגבל ל- 1 מ מ כאמצעי זהירות. לא הבחנו כל הבדל כאשר משתמש 5 מ מ EDTA שלב טיהור הסופי של סוכרוז צפיפות הצבע.
הפרוטוקול המתואר במסמך זה משתמשת נגזר HEK293S תאים אנושיים טיהור של mitoribosome. איכות התכשיר מאפשר את הדגימה שהושג כדי לחקור מבחינה ביוכימית, מבחינה מבנית כדי ברזולוציה אטומית. דבר זה מאפשר אחד להחיל את שיטת mitoribosomal האדם לתרגם מכלולי ההרכבות בקרת איכות, mitoribosomal subunits intermediates. יתר על כן, מאז תאים סרטניים הגבירו OXPHOS קיבולת ותרגום חלבונים מיטוכונדריאלי גבוהות בהשוואה לרקמות סמוכים סטרומה21, mitoribosomes הם סמים הוקמה מטרות עבור סרטן22. לכן, באמצעות פרוטוקול זה עבור טיהור ספציפיות של mitoribosomes בנוכחות של מעכבי יהיה יישומים רפואיים. כמו כן, היו קשורים מוטציות mitoribosomal מחלות תורשתיות מיטוכונדריאלי23. מאז מוטציות אלה יש השפעה ישירה על המבנה, הגישה המובאת כאן יהיה שימושי עבור אפיון מבניים שלהם. הפרוטוקול יכול להיות השפעול מורחבת ומוחלים למגוון רחב של שאלות בנושאים מדעיים בהתמודדות עם הבנה בסיסית של תרגום אנושי המיטוכונדריה וחשיבותו רפואי.
Disclosures
אף אחד
Acknowledgements
עבודה זו נתמך על ידי קרן שבדי למחקרים אסטרטגיים (מנהיגי העתיד FFL15:0325 גרנט), קרן Söderberg רגנר (מלגת ב רפואה M44/16), מועצת המחקר השבדי (מלגת NT × 2015-04107), מלגת ארוך טווח FEBS (SA) , H2020 MSCA-ITN--2016 פרוייקט 721757 (לעומת).
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) high glucose, GLUTAMAX supplement, pyruvate | Thermo Scientific | 31966-021 | |
| Fetal Bovine Serum (FBS) | Thermo Scientific | 16000-044 | |
| Blasticidin S HCl | Thermo Scientific | R210-01 | |
| Zeocin selection reagent | Thermo Scientific | R25001 | 100 mg/ml |
| Freestyle 293 Expression medium | Thermo Scientific | 12338026 | |
| T175 tissue culture flask with vented cap | Sarstedt | 83.3912.002 | |
| Shaker flasks with vented cap | Thermo Scientific | 4115-0500, 4115-1000, 4115-2000, 4115-2800 | |
| 250 ml conical bottle tubes, sterile | Corning | 430776 | |
| Eve automated cell counter | NanoEnTek | E1000 | |
| Nitrogen cavitation cell disruption vessel | Parr Instruments | 4635, 4639 | safety volume: 40ml, 600ml respectively |
| Dnase (RNA-free) | HT Biotechnology | N401a | |
| Teflon/glass dounce homogenizers | Cambridge Glassblowing Limited | Size designed upon request | |
| SW40 tubes for mitochondria gradient | Beckman | 344060 | Polypropylene, thin wall |
| Transfer pipettes | Sarstedt | 86.1171 | |
| TLA 120.2 tubes for cushion | Beckman | 343778 | Polycarbonate, thick wall |
| TLS-55 tubes for gradient | Beckman | 347356 | Ultra-clear |
| Gradient Station IP | BioComp | 153-002 |
References
- Ott, M., Amunts, A., Brown, A. Organization and regulation of mitochondrial protein synthesis. Annual review of biochemistry. 85, 77-101 (2016).
- Amunts, A., Brown, A., Toots, J., Scheres, S. H., Ramakrishnan, V. The structure of the human mitochondrial ribosome. Science. 348 (6230), 95-98 (2015).
- Greber, B. J., Bieri, P., Leibundgut, M., Leitner, A., Aebersold, R., Boehringer, D., Ban, N. The complete structure of the 55S mammalian mitochondrial ribosome. Science. 348 (6232), 303-308 (2015).
- Greber, B. J., Ban, N. Structure and function of the mitochondrial ribosome. Annual review of biochemistry. 85, 103-132 (2016).
- Greber, B. J., Boehringer, D., Leitner, A., Bieri, P., Voigts-Hoffmann, F., Erzberger, J. P., Ban, N. Architecture of the large subunit of the mammalian mitochondrial ribosome. Nature. 505 (7484), 515-519 (2014).
- Rorbach, J., Gao, F., Powell, C. A., D'Souza, A., Lightowlers, R. N., Minczuk, M., Chrzanowska-Lightowlers, Z. M. Human mitochondrial ribosomes can switch their structural RNA composition. Proceedings of the National Academy of Sciences. , 201609338 (2016).
- Chrzanowska-Lightowlers, Z., Rorbach, J., Minczuk, M. Human mitochondrial ribosomes can switch structural tRNAs-but when and why?. RNA biology. 14 (12), 1668-1671 (2017).
- Gammage, P. A., Moraes, C. T., Minczuk, M. Mitochondrial Genome Engineering: The Revolution May Not Be CRISPR-Ized. Trends in Genetics. , (2017).
- Brown, A., Rathore, S., Kimanius, D., Aibara, S., Bai, X. C., Rorbach, J., Ramakrishnan, V. Structures of the human mitochondrial ribosome in native states of assembly. Nature Structural and Molecular Biology. 24 (10), 866 (2017).
- Reeves, P. J., Callewaert, N., Contreras, R., Khorana, H. G. Structure and function in rhodopsin: high-level expression of rhodopsin with restricted and homogenous N-glycosylation by tetracycline-inducible N-acetylglucosaminyltransferase I-negative HEK293S stable mammalian cell line. Proceedings of National Academy of Sciences USA. 99, 13419-13424 (2002).
- Brown, A., Amunts, A., Bai, X. C., Sugimoto, Y., Edwards, P. C., Murshudov, G., Ramakrishnan, V. Structure of the large ribosomal subunit from human mitochondria. Science. 346 (6210), 718-722 (2014).
- O'Brien, T. W., Kalf, G. F. Ribosomes from rat liver mitochondria I. Isolation procedure and contamination studies. Journal of Biological Chemistry. 242 (9), 2172-2179 (1967).
- Spremulli, L. L. Large-scale isolation of mitochondrial ribosomes from mammalian tissues. Mitochondria: Practical Protocols. , 265-275 (2007).
- Rice, J. E., Lindsay, J. G., Grahamand, J. M., Rickwood, D. Subcellular fractionation of mitochondria. Subcellular Fractionation: A Practical Approach. , 107-142 (1997).
- Attardi, G., Ching, E. Biogenesis of mitochondrial proteins in HeLa cells. Methods in enzymology. 56, 66-79 (1979).
- Gottlieb, R. A., Adachi, S. Nitrogen cavitation for cell disruption to obtain mitochondria from cultured cells. Methods in enzymology. 322, 213-221 (2000).
- Simpson, R. J. Disruption of cultured cells by nitrogen cavitation. Cold Spring Harbor Protocols. 2010 (11), (2010).
- Kennedy, E. P., Lehninger, A. L. Oxidation of fatty acids and tricarboxylic acid cycle intermediates by isolated rat liver mitochondria. Journal of Biological Chemistry. 179 (2), 957-972 (1949).
- Graham, J. M. Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Amunts, A., Brown, A., Bai, X. C., Llácer, J. L., Hussain, T., Emsley, P., Ramakrishnan, V. Structure of the yeast mitochondrial large ribosomal subunit. Science. 343 (6178), 1485-1489 (2014).
- Sotgia, F., Martinez-Outschoorn, U. E., Howell, A., Pestell, R. G., Pavlides, S., Lisanti, M. P. Caveolin-1 and cancer metabolism in the tumor microenvironment: markers, models, and mechanisms. Annual Review of Pathology: Mechanisms of Disease. 7, 423-467 (2012).
- Škrtić, M., Sriskanthadevan, S., Jhas, B., Gebbia, M., Wang, X., Wang, Z., Lai, C. K. Inhibition of mitochondrial translation as a therapeutic strategy for human acute myeloid leukemia. Cancer cell. 20 (5), 674-688 (2011).
- Boczonadi, V., Horvath, R. Mitochondria: impaired mitochondrial translation in human disease. The international journal of biochemistry & cell biology. 48, 77-84 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved