需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
[18f] fdg 示踪剂在重型颅脑损伤患者中的半定量评价
摘要
[18f]-氟脱氧葡萄糖 (fdg) 正电子发射断层扫描断层扫描可用于研究与大脑功能相关的葡萄糖代谢。在这里, 我们提出了一个协议 [18f] fdg 示踪剂设置和半定量评估的目标大脑区域的利益区域分析与临床表现相关的严重创伤性脑损伤患者。
摘要
严重创伤性脑损伤 (stbi) 患者很难知道他们是否准确地表达自己的想法和情绪, 因为意识障碍, 大脑功能紊乱, 和语言障碍。由于沟通能力不足, 需要对家庭成员、医务人员和照顾者进行客观评价。其中一个评估是对大脑功能区域的评估。近年来, 多模态脑成像被用来探索受损大脑区域的功能。[18f]-氟脱氧葡萄糖正电子发射断层扫描断层扫描 ([18f] fdg-pet/ct) 是检查大脑功能的成功工具。然而, 基于 [18f] fdg-pet变 ct 的脑葡萄糖代谢评估没有标准化, 取决于几个不同的参数, 以及患者的情况。在这里, 我们描述了一系列半定量的评估协议, 用于使用 stbi 患者中自行生成的 [18 f] fdg 跟踪器进行感兴趣区域 (roi) 图像分析。该协议的重点是筛选参与者, 准备 [18f] fdg 跟踪器在热实验室, 安排获取 [18f] fdg-pet变 ct 脑图像, 并使用来自目标大脑区域的 roi 分析测量葡萄糖代谢。
引言
stbi 患者在康复过程中会出现不可预见的神经困难, 包括运动缺陷、感官缺陷和精神不稳定1。虽然临床评估通常是口头进行的, 但 stbi 患者如无反应的清醒综合征或最低意识状态的患者在了解他们是否准确表达自己的想法和情绪方面有特别的困难由于意识障碍, 大脑功能紊乱, 和言语干扰2,3。家庭成员、医务人员和照顾者有时会被不可预见的神经变化或由于沟通能力不足而导致的缺乏反应所迷惑。
近年来, 多模态脑成像被用于探索区域脑功能6、7、8、9。大脑是葡萄糖衍生能量的主要消耗者, 葡萄糖代谢提供了大约95% 的三磷酸腺苷 (atp), 大脑功能10。[18f]-氟脱氧葡萄糖 (fdg) 的摄取是脑组织摄取葡萄糖的标志物。[18楼]fdg-pet/ct 可以检测 [18f] fdg 的吸收, 因此是检查大脑功能11的有用工具.一般情况下, [18f] fdg 图像分析分为两类: roi 分析和基于体素的分析 (vba)12。此前的报告显示, 投资回报率分析是研究创伤特定区域的首选。这是因为 vba (如统计参数映射 [spm]) 需要对标准大脑进行协同和归一化, 而 tbi 由于脑组织变形 (如脑组织萎缩、肿胀、扩大和收缩) 而无法很好地工作。心室空间7,12。虽然已经开发了各种算法和软件来分析磁共振成像 (mri) 数据, 但神经外科和整形外科中使用的金属会产生噪音文物7,12,13.近年来, 利用光电倍增器与 pet/ct 装置, 提高了 petct 衍生脑图像14的空间分辨率。目前的协议侧重于在 stbi 患者中使用自生成的 [18f] fdg 示踪剂,通过[18f] fdg-petct 中的 roi 分析对葡萄糖摄入量进行半定量测量。
Access restricted. Please log in or start a trial to view this content.
研究方案
这项研究是根据机构审查委员会 (第07-01号核准书) 进行的, 并遵守了《赫尔辛基宣言》的原则。患者的法律代表对病历和脑图像的使用获得了知情同意。这项研究是在机构道德委员会 (2017-14) 批准后进行的。该议定书是根据日本核医学学会和欧洲核医学协会的指导方针制定的, 作为参考 15,16。
1. 对参与者的筛选
- 从患者的法律代表处获得使用患者病历和大脑图像的知情同意。格拉斯哥昏迷量表在事故发生时的分数≤8必须记录在每个病人的病历17,18,19。
- 每六个月举行一次神经病学、心理学和多学科员工会议, 以评估临床表现。
注: 会议成员应包括医务人员, 如医生、护士、理疗师、职业治疗师、言语治疗师、营养学家和医务社会工作者。一定要不断检查患者是否能 (口头或非口头) 沟通, 并为自己做出决定, 因为唤醒状态和神经状态通常是不稳定的。 - 使用标准的评估电池 (如昏迷) 对听觉功能、视觉功能、运动功能、口腔运动/语言功能、沟通功能、唤醒状态、面部表情等相关功能进行临床评估恢复量表 (crs-r), 肿瘤感觉昏迷量表, 和威塞克斯头部损伤矩阵20,21,22。
- 附表 [18f] fdg-pet/ct 扫描的病人谁是医学稳定, 可以安全地参加检查。如知情同意表所述, 只安排已提供知情同意或其法律代表提供知情同意的人员。附表 [18f] fdg-pet/ct 图像采集近临床评估日。
2. 在热实验室中制备 [18f] fdg 示踪剂
- 在热实验室中, 开始生产试剂试剂套件, 用于为 fdg 合成器量身定制的 fdg 的自动化生产 (参见材料表)。请务必使用自动程序来检查 fdg 合成器中泵送系统的流动性, 并确保试剂试剂盒中的空气不会泄漏。消毒机器的接触区域 (这是开始时间)。
注意: 一定要检查热实验室的辐射监测仪, 并使用便携式辐射剂量计, 在进入热实验室之前检查每个人的辐射水平。 - 检查 [16o]-水和 [18o]-水的体积以及油箱中氦、氢和氮的体积。检查一次冷却的自来水温度是否在25°c 以下, 二次冷却的自来水温度是否在22°c 以下。使用闭合系统中的所有水 (启动后 30分钟) 进行生产。
- 开始对回旋加速器中 [16o]-水的初步辐照 (启动后 1小时)。检查显示器, 确保在回旋加速器的目标区域内, 在最佳条件下 (例如, 20μa, 5分钟) 照射 2-3 ml [1 6 o]-水。辐照后, 将 [16o]-水的小瓶放入放射性同位素剂量校准器中, 测量放射性水平 (见材料表)。
注: 放射性衰变应使用以下公式计算。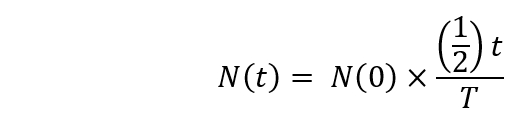
这里
n (t) 是在t = t秒的放射性原子核数;
N(0) 是在t = 0秒的放射性原子核的数字;
t = 半衰期。 - 开始对回旋加速器中的 [18o]-水进行辐照 (启动后 1小时30分钟)。将轰炸时间设置为 20分钟, 并将撞击质子的能量设置为 16.5 mev。
- 根据操作手册22 (启动后 2小时) 启动 fdg 合成器。修改后的过程如下。
- 辐照后, 利用氦气体将 [18o]-水的 2-3 ml 从回旋加速器转移到 fdg 合成器的聚丙烯接收器。
- 将注射器挂在相应的注射器驱动器上, 加压试剂瓶, 溶解 1, 3, 4, 6-四-o-乙酰-o-o-o-三氟甲基-β-d-甘皮酸在乙腈的一个小瓶 (7±0.2 ml) 中 (纯度≥99.5%), 并冲洗盒式乙 腈。
- 轰炸后, 将辐照的 [16o]-水和 [18o]-水转移到 fdg 合成器。
注: 合成开始后, 辐照 [18o]-水通过阴离子交换盒 (见材料表)。在合成之前, 请务必对墨盒进行调理并将其转换为碳酸盐。 - 将含有 [18f] 活性而不含液体的洗脱剂转移到反应容器后, 允许溶剂蒸发至干燥。在干燥过程中, 在反应容器 3倍 (每次添加 80μl) 中加入少量乙腈。在氮气流动和真空下, 在95°c 下进行蒸发。
- 将甘露糖三氟精体前体 (25 毫克) 溶解在乙腈约3.5 毫升 (纯度≥99.5%) 后, 加入干残渣中。fdg 合成器在85°c 时发生亲核取代反应。
- 作为初步纯化, 将标记的溶液与26毫升的蒸馏水混合。将稀释后的标签溶液送回反应容器, 以恢复剩余的活性。通过反向相位墨盒传递解决方案 (请参阅材料表)。在连续清洗时, 使用 10 ml、10 ml、13 ml 和 13 ml 蒸馏水冲洗含有被困标记前体4x 的墨盒。
- 通过碱性水解将乙酰化化合物 (标记前体) 转化为墨盒内的 fdg, 在室温下使用750μl 的 2 n naoh 2分钟。
- 水解后, 在7毫升的水中收集碱性 fdg 溶液, 并与中和溶液 (柠檬酸酯缓冲液5毫升, 2 n hcl 1 毫升) 混合。
- 纯化生成的中和 fdg 溶液。
- 通过第二反相墨盒 (见材料表) 传递中和 fdg 溶液, 保留部分水解化合物和非极性副产品。
- 通过氧化铝 n 墨盒 (见材料表), 保留未反应 [18f] 氟化物离子的最后痕迹。然后, 通过0.22μm 的过滤器。
- 冲洗盒式磁带和墨盒, 用3毫升的水过滤, 以恢复留在生产线上的剩余 fdg, 然后将 fdg 排出到含有15-17 毫升液体的最后一个小瓶中。
- 对 [18f] fdg 示踪剂进行定性分析 (启动后 2小时30分钟)。
- 目视观察小瓶。确认它是透明的, 并且不包括任何粒子。
- 使用 roberval 的平衡 (应为15-17 毫升) 测量液体的量。
- 使用放射性同位素剂量校准器测量放射性和半衰期 (与步骤2.3 中的相同, 见《材料表》) (标准: 105-115分钟)。
- 从小瓶中分配0.5 毫升。通过碳水化合物分析进行放射性化学纯度测试。使用 3.9 x 300 mm 的柱进行高效液相色谱 (见材料表), 以检测放射性峰值 (超过 95)。
注: 单峰意味着高纯度。 - 使用 ph 测试纸测量 ph 值 (ph 值 5.0-8.0) (见材料表)。使用试卷测量残差4、7、13、16、21、24和己氧 diazabicyclo[8.8.8]hexacosane (见材料表) (& lt; 40 ppm) (见材料表)。通过吸收测量 (见材料表) (0.25 eu/ml), 使用适当的内毒素测量装置测量内毒素。做无菌试验 (在37°c 时 8 d 后没有发现细菌)。
- 用 [18f] fdg 示踪剂填充铅和钨覆盖的小瓶, 剂量为 5 MBq/kg kg。
- 将 [18f] fdg 示踪剂从热实验室转移到工作室 (启动后 3小时25分钟)。
3. 获取 [18f] fdg-pet/ct 脑图像的时间路线
- 安排病人的时间。请务必通知工作人员停止营养和喂养通过胃造口术。不要停止供水。患者应在图像采集前7小时快速启动。
- 准备 [18f] fdg 示踪剂给药的静脉路线。在进入辐射控制区域之前, 在其中一个下肢上固定一个22-24-g 针, 用5毫升的肝素钠 (10 units/ml)。
- 让患者在进入辐射控制区之前, 先用轻担架躺下。将患者带到辐射控制区, 默默等待 3 0分钟, 而医务人员则在一旁待命。
- 用10毫升注射器抽血, 重新检查静脉注射途径的通畅程度。用血糖仪测量血糖水平。
- 将 [18f] fdg 示踪剂从热实验室转移到工作室内后, 将其设置在自动点胶和注射系统中 (参见材料表)。
- 重新检查以下信息 (通过医务人员): 患者身份证号码、姓名、生日、身高和体重;追踪者的名字示踪剂的数量 (3.5 毫升 [18f] fdg 示踪剂 + 12 毫升盐水)、编程放射性 (5 mbq/kg)、注射时间、[18f] fdg 示踪剂批号、注射速度 (通常为 0.3 mlss) 和在热实验室测量的放射性水平。
- 记录自动点胶和注射系统显示屏上出现的预注入放射性的自动测量。
- 通过步骤3.2 中准备的静脉通道 (开始后 3小时30分钟) 注入 [18f] fdg 示踪剂。
- 记录 [18f] fdg 跟踪器的剩余体积, 该跟踪器会自动显示在自动点胶和注射系统的显示屏上。
- 让患者在辐射控制区的候诊室等候 5 0分钟。
- 将病人从候诊室转移到 pet任何 ct 机 (见材料表)。记录大脑图像 10分钟 (开始后 4小时30分钟)。
注: [18f] fdg-pet™图像的成像参数为10分钟列表模式。重建10分钟垃圾箱中的数据。由于低强度信号不足, 不使用3分钟以下的数据。设置图像重建参数: 块顺序正则化期望最大化重建算法 (见材料表);矩阵大小 = 192;视野 = 25 厘米;β值: 100-200;z 轴筛选器: 无。 - 拍摄图像后, 检查注射区域是否有外渗。如果患者有带尿袋的小便池导管, 请丢弃所有尿液。
- 将患者从辐射控制区域中取出 (启动后 4小时50分钟)。
注: 有关事件时间表的示意图 (患者程序和 [18f] fdg 跟踪器的合成), 请参见图 1 。
4. [18f] fdg-pet/ct 图像分析
- 使用成像软件评估所有图像数据, 以实现标准化吸收值 (suv) 测量 (参见材料表)。
- 选择患者。
- 将数据分配给mm 肿瘤工作流。
- 单击f型未使用浏览器的按钮。
- 单击"兴趣量 " 阈值按钮。
- 将 voi 球体设置为三维浏览器。
注意: 最大 suv (suvmax) 和平均 suv (suv平均值) 是根据所选的 suvmax 阈值自动测量的 voi。请务必使用三维球体在浏览器上的目标 voi 周围绘制边框, 不包括其他目标、眼外肌肉和头皮, 因为它们往往会干扰设置的 suv 阈值。检查轴向、冠状和矢状切片上的目标区域。 - 选择所有正确的设置后, 单击"编辑度量值" 按钮。
- 更改 voi 的阈值 (例如50%), 然后单击 "确定"。
- 记录目标区域的 suvmax、suv平均、目标体积和阈值, 这些值是自动测量的。
- 要对整个大脑表面的葡萄糖代谢进行科学可视化, 请使用该软件 (参见材料表) 为基于血糖的 [18f] fdg-pet/ctc 图像设置颜色图。
- 最后, 将临床评估与 [18f] fdg-pet/ct 图像进行比较。
Access restricted. Please log in or start a trial to view this content.
结果
一名 6 3岁的男子在骑自行车时被汽车撞倒,经救护车被送往急诊室。检查显示格拉斯哥昏迷量表得分为 7 (开眼 = 1, 最佳言语反应 = 2, 最佳运动反应 = 4), 厌食症 (右: 2 毫米, 左: 3 毫米), 和负角膜反应17。头部 ct 显示蛛网膜下腔和颅内出血, 左合子、颞骨和顶骨颅骨骨折。病人没有病史, 管理保守。9个月后, 他被千叶县创伤性亚马病康复中心收治。入?...
Access restricted. Please log in or start a trial to view this content.
讨论
该协议提供了在一个机构中使用自生成的 [18f] fdg 示踪剂与 [18f] fdg-etpct 进行一系列脑葡萄糖代谢评估的方法。
[18f] fdg 示踪剂的生产遵循 fdg 合成器操作手册中描述的程序;然而, 谨慎对待三点是必要的。首先, 轰炸时间和能量 (步骤 2.5) 应根据患者人数进行调整。其次, 应注意 4, 7, 13, 16, 21, 24-己 aoxa-1, 10 diazabicyclo[8.8.8]hexacosane 的管, 因为它可以很容易地?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
提交人希望感谢索森医院的 uchino 医生的所有手术。作者还感谢来自 edanz 集团 (www.edanzediting.com/ac) 的亚当·菲利普斯编辑了这份手稿的草稿。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 20ml syringe | Terumo | SS-20ESZ | |
| 10ml syringe | Terumo | SS-10ESZ | |
| 1ml syringe | Terumo | SS-01T | |
| Protective plug | Top | ML-KS | |
| Three-way cock L type 180° | Terumo | TS-TL2K | |
| Extension tube | Top | X1-50 | |
| Indwelling needle 22G or 24G | Terumo | SR-OT2225C | |
| Tegaderm transparent dressing | 3M | 1624W | |
| Hepaflash 10U/ml 10ml | Terumo | PF-10HF10UA | |
| Auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01 | |
| Fluid for auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01-001 | |
| Millex-GS Syringe Filter Unit | Millipore | SLGSV255F | |
| Air needle | Terumo | XX-MFA2038 | |
| Check valve | Hakko | 23310100 | |
| Saline 500ml | HIKARI pharmaceutical Co., Ltd. | 18610155-3 | |
| Yukiban 25x7mm | Nitto | 3252 | |
| Elascot No.3 | Alcare | 44903221 | |
| Presnet No.3 27x20mm | Alcare | 11674 | |
| Steri Cotto a 4x4cm | Kawamoto | 023-720220-00 | |
| StatstripXp3 | Nova Biomedical | 11-110 | |
| Statstrip Glucose strips | Nova Biomedical | 11-106 | |
| JMSsheet | JMS | JN-SW3X | |
| Injection pad | Nichiban | No.30-N | |
| Stepty | Nichiban | No.80 | |
| Advantage Workstation | GE Healthcare | Volume Share 7. version 4.7 | |
| Discovery MI PET/CT | GE Healthcare | ||
| EV Insite | PSP | ||
| GE TRACERlab MXFDG synthesizer reagent kit | ABX | K-105TM | |
| TRACERlab MXFDG cassette | GE Healthcare | P5150ME | |
| Extension tube | Universal Giken Co., Ltd | AT511-ST-001 | |
| TSK sterilized injection needle 18x100 | Tochigiseiko | AT511-ST-004 | |
| TSK sterilized injection needle 18x60 | Tochigiseiko | AT511-ST-002 | |
| TSK sterilized injection needle 21x65 | Tochigiseiko | AT511-ST-003 | |
| Seal sterile vial -N 5ml | Mita Rika Kogyo Co., Ltd. | SSVN5CBFA | |
| k222 TLC plate | Universal Giken Co., Ltd. | AT511-01-005 | |
| Anion-cation test paper | Toyo Roshi Kaisha | 7030010 | |
| Endospecy ES-24S set | Seikagaku corporation | 20170 | |
| Sterile evacuated vial | Gi phama | 10214 | |
| 5ml syringe | Terumo | SS-05SZ | |
| Extension tube | Top | X-120 | |
| Finefilter F | Forte grow medical Co.Ltd. | F162 | |
| Millex FG | Merck | SLFG I25 LS | |
| Vented Millex GS | Merck | SLGS V25 5F | |
| Injection needle 18x38 | Terumo | NN-1838R | |
| Injection needle 21x38 | Terumo | NN-2138R | |
| Water-18O | Taiyo Nippon Sanso | F03-0027 | |
| Distilled water | Otsuka phrmaceutical | ||
| Hydrogen gas G1 | Hosi Iryou Sanki | ||
| Helium gas G1 | Hosi Iryou Sanki | ||
| Nitrogen G1 | Hosi Iryou Sanki | ||
| TRACERlabMXFDG | GE Healthcare | ||
| Sep-Pak Light Accell Plus QMA | WATERS | ||
| Sep-Pak Plus tC18 | WATERS | ||
| Sep-Pak Plus Alumina N | WATERS | ||
| HPLC with 3.9 X 300 mm columns | WATERS | ||
| US-2000 | Universal Giken CO. Ltd. | ||
| Kryptofix222 | Merck | ||
| EG Reader SV-12 | Seikagaku Corporation | ||
| UG-01 | Universal Giken Co., Ltd. | ||
| syngo.via | Siemens Healthineers | ||
| Advantage Workstation Volume Share 7, version 4.7 | GE Healthcare | ||
| Q clear | GE Healthcare | ||
| CRC-15PET dose calibrator | CAPINTEC, INC. |
参考文献
- Godbolt, A. K., et al. Disorders of consciousness after severe traumatic brain injury: a Swedish-Icelandic study of incidence, outcomes and implications for optimizing care pathways. Journal of Rehabilitation Medicine. 45 (8), 741-748 (2013).
- Klingshirn, H., et al. Quality of evidence of rehabilitation interventions in long-term care for people with severe disorders of consciousness after brain injury: A systematic review. Journal of Rehabilitation Medicine. 47 (7), 577-585 (2015).
- Fischer, D. B., Truog, R. D. What is a reflex? A guide for understanding disorders of consciousness. Neurology. 85 (6), 543-548 (2015).
- Klingshirn, H., et al. RECAPDOC - a questionnaire for the documentation of rehabilitation care utilization in individuals with disorders of consciousness in long-term care in Germany: development and pretesting. BMC Health Services Research. 18 (1), 329(2018).
- Stéfan, A., Mathé, J. F. SOFMER group. What are the disruptive symptoms of behavioral disorders after traumatic brain injury? A systematic review leading to recommendations for good practices. Annals of Physical and Rehabilitation. 59, 5-17 (2016).
- Liu, S., et al. Multimodal neuroimaging computing: a review of the applications in neuropsychiatric disorders. Brain Informatics. 2 (3), 167-180 (2015).
- Wong, K. P., et al. A semi-automated workflow solution for multimodal neuroimaging: application to patients with traumatic brain injury. Brain Informatics. 3 (1), 1-15 (2016).
- Chennu, S., et al. Brain networks predict metabolism, diagnosis and prognosis at the bedside in disorders of consciousness. Brain. 140 (8), 2120-2132 (2017).
- Di Perri, C., et al. Neural correlates of consciousnes s in patients who have emerged from a minimally conscious state: a cross-sectional multimodal imaging study. The Lancet Neurology. 15 (8), 830-842 (2016).
- Erecińska, M., Silver, I. A. ATP and brain function. Journal of Cerebral Blood Flow & Metabolism. 9 (1), 2-19 (1989).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807(2015).
- Byrnes, K. R., et al. FDG-PET imaging in mild traumatic brain injury: a critical review. Frontiers in Neuroenergetics. 5, 13(2014).
- Mortensen, K. N., et al. Impact of Global Mean Normalization on Regional. Glucose Metabolism in the Human Brain. Neural Plasticity. , 6120925(2018).
- Wagatsuma, K., et al. Comparison between new-generation SiPM-based and conventional PMT-based TOF-PET/CT. Physica Medica. 42, 203-210 (2017).
- Fukukita, H., et al. Japanese guideline for the oncology FDG-PET/CT data acquisition protocol: synopsis of Version 2.0. Annals of Nuclear Medicine. 28 (7), 693-705 (2014).
- Varrone, A., et al. European Association of Nuclear Medicine Neuroimaging Committee. EANM procedure guidelines for PET brain imaging using [18F]FDG, version 2. European Journal of Nuclear Medicine and Molecular Imaging. 36 (12), 2103-2110 (2009).
- Teasdale, G., Jennett, B. Assessment of coma and impaired consciousness. A practical scale. The Lancet. 2 (7872), 81-84 (1974).
- Valadka, A. B. Injury to the cranium. Trauma. Moore, E. J., Feliciano, D. V., Moore, E. E. , McGraw-Hill. New York, NY. 377-399 (2000).
- Carney, N., et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 80 (1), 6-15 (2017).
- Giacino, J. T., Kalmar, K., Whyte, J. The JFK Coma Recovery Scale-Revised: measurement characteristics and diagnostic utility. Archives of Physical Medicine and Rehabilitation. 85 (12), 2020-2029 (2004).
- Schnakers, C., et al. The Nociception Coma Scale: a new tool to assess nociception in disorders of consciousness. Pain. 148 (2), 215-219 (2010).
- Shiel, A., et al. The Wessex Head Injury Matrix (WHIM) main scale: a preliminary report on a scale to assess and monitor patient recovery after severe head injury. Clinical Rehabilitation. 14 (4), 408-416 (2000).
- GE Healthcare. TRACERlabMXFDG operator manual, Version 1. , (2003).
- Yamaki, T., et al. Association between uncooperativeness and the glucose metabolism of patients with chronic behavioral disorders after severe traumatic brain injury: a cross-sectional retrospective study. BioPsychoSocial Medicine. 12, 6(2018).
- Schwaiger, M., Wester, H. J. How many PET tracers do we need? Journal of Nuclear Medicine. 52, Suppl 2, 36S-41S (2011).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。