Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation semi-quantitative à l’aide de traceurs FDG [18F] chez les Patients atteints de lésions cérébrales graves
Dans cet article
Résumé
[18F]-fluorodésoxyglucose (FDG), tomographie par émission de positrons-la tomodensitométrie est utile pour l’étude du métabolisme du glucose associé à la fonction cérébrale. Nous présentons ici un protocole pour un traceur FDG [18F] mise en place et évaluation semi-quantitative de l’analyse de la région d’intérêt pour les zones ciblées cerveau associée à des manifestations cliniques chez les patients avec traumatisme crânien sévère.
Résumé
Souffrant de blessures graves lésions cérébrales traumatiques (LCT) ont mal sachant si fidèlement, ils expriment leurs pensées et leurs émotions en raison de troubles de la conscience, perturbé plus cerveau en fonction et perturbations verbales. En raison de la capacité suffisante pour communiquer, des évaluations objectives sont nécessaires de membres de la famille, du personnel médical et à leurs aidants. Une telle évaluation est l’évaluation du fonctionnement des zones du cerveau. Récemment, imagerie cérébrale multimodale a été utilisée pour étudier la fonction des régions cérébrales endommagées. [18F]-fluorodéoxyglucose tomographie par émission de positrons ([18F] FDG-PET/CT) est un outil efficace pour examiner le fonctionnement du cerveau. Toutefois, l’évaluation du métabolisme du glucose cerveau basé sur [18F] FDG-TEP/CT n’est pas standardisé et dépend de plusieurs paramètres variables, ainsi que l’état du patient. Nous décrivons ici une série de protocoles d’évaluation semi-quantitative pour une analyse d’image de région d’intérêt (ROI), à l’aide de traceurs FDG autoproduit [18F] chez les patients avec LCT. Le protocole met l’accent sur le dépistage les participants, la préparation traceur [18F] FDG dans le laboratoire chaud, planification de l’acquisition d’images de cerveau [18F] FDG-TEP/CT et mesure du métabolisme du glucose à l’aide de l’analyse du retour sur investissement d’une zone ciblée de cerveau.
Introduction
Patients atteints de LCT sont présentent des difficultés neurologiques imprévisibles au cours de la remise en état qui incluent des déficits moteurs, les déficits sensoriels et instabilité psychiatrique1. Bien que l’évaluation clinique est généralement réalisée verbalement, souffrant de LCT comme le syndrome de l’éveil ne répond pas ou état de conscience minimale ont des difficultés particulières en sachant qu’ils expriment avec précision leurs pensées et leurs émotions en raison de troubles de la conscience, perturbé le fonctionnement du cerveau supérieur et perturbations verbale2,3. Membres de la famille, du personnel médical et à leurs aidants sont parfois confondus par des transformations neurologiques imprévisibles ou l’absence de réponse qui peut résulter de l’insuffisante capacité associe4,5.
Récemment, l’imagerie cérébrale multimodal a été utilisée pour explorer des régions cérébrales fonction6,7,8,9. Le cerveau est le principal consommateur d’énergie dérivée de glucose, avec le métabolisme du glucose, fournissant environ 95 % de l’adénosine triphosphate (ATP) nécessaire pour le cerveau de fonctionner10. L’absorption de [18F]-fluorodésoxyglucose (FDG) est un marqueur de la captation du glucose par les tissus cérébraux. [18F] FDG-TEP/CT peut détecter l’absorption [18F] FDG et est donc un outil utile pour étudier le cerveau fonction11. En général, l’analyse d’images [18F] FDG est divisé en deux catégories : ROI analyse et analyse comparative voxel (VBA)12. Les rapports précédents montrent qu’analyse de retour sur investissement est privilégié pour l’étude des régions précises du traumatisme. C’est parce que VBA (par exemple, la cartographie statistique paramétrique [RID]) nécessite co-inscription ainsi que la normalisation d’un cerveau standard, ce qui ne fonctionne pas bien dans les cas de TBI en raison de la déformation de tissu de cerveau telles que l’atrophie cérébrale, gonflement, l’élargissement et rétrécissement des ventriculaire espace7,12. Bien que divers algorithmes et logiciels ont été développés pour l’analyse des données de l’imagerie par résonance magnétique (IRM), métaux utilisés en chirurgie orthopédique neurochirurgicale génèrent bruit artefacts7,12,13 . Récemment, l’utilisation de Photomultiplier avec appareils de TEP/CT a amélioré la résolution spatiale des images de cerveau dérivé PET/CT14. Le protocole actuel se concentre sur mesure semi quantitativement glucose uptake via ROI analyse dans [18F] FDG-PET/CT en utilisant autoproduit à traceurs FDG [18F] chez les patients avec LCT.
Access restricted. Please log in or start a trial to view this content.
Protocole
Cette étude a été réalisée dans le respect de la Commission de révision institutionnelle (agrément n° 07-01) et ont adhéré aux principes de la déclaration d’Helsinki. Consentement éclairé pour l’usage médical d’image disque et le cerveau a obtenu du représentant légal du patient. L’étude a été réalisée après l’approbation par le Comité d’éthique institutionnel (2017-14). Ce protocole a été effectué en suivant les directives de la Japanese Society of Nuclear Medicine et l’Association européenne de médecine nucléaire comme une référence15,16.
1. sélection des Participants
- Obtenir le consentement éclairé d’utiliser les dossiers médicaux et les images du cerveau des patients de représentants légaux du patient. Une échelle de Coma de Glasgow score ≤ 8 au moment de l’accident doit ont été enregistrée dans chaque patient medical record17,18,19.
- Tenez neurologie, psychologie et personnel multidisciplinaire conférences tous les six mois afin d’évaluer les manifestations cliniques.
Remarque : Les membres de la Conférence devraient inclure personnel médical tels que médecins, infirmières, physiothérapeutes, ergothérapeutes, orthophonistes, nutritionnistes et médicale des travailleurs sociaux. N’oubliez pas de constamment vérifier si les patients peuvent communiquer (verbalement ou non-verbalement) et prendre des décisions pour eux-mêmes parce que l’état d’éveil et état neurologique sont généralement instables. - Effectuer des évaluations cliniques de la fonction auditive, fonction visuelle, motricité, oromotor/verbal fonction, fonction de communication, état d’éveil, expression du visage et autres fonctions pertinentes, à l’aide de batteries standard d’évaluation tels que le Coma Récupération Scale-Revised (CRS-R), l’échelle de Coma de la Nociception et la matrice de blessure de tête de Wessex20,21,22.
- Annexe [18F] FDG-TEP/CT scans pour les patients qui sont médicalement stables et peuvent y participer en toute sécurité des examens. Planifier seulement ceux qui ont fourni un consentement éclairé ou dont les représentants légaux ont fourni un consentement éclairé, comme indiqué dans le formulaire de consentement éclairé. Acquisition d’images de calendrier [18F] FDG-TEP/CT près le jour de l’évaluation clinique.
2. préparation du traceur [18F] FDG dans le labo chaud
- Dans le laboratoire chaud, commencent à fabriquer des trousses de réactifs pour la production automatisée de FDG adaptés au synthétiseur FDG (voir Table des matières). N’oubliez pas d’utiliser le programme automatique pour vérifier la mobilité du système de pompage dans le synthétiseur FDG et à faire en sorte que l’air ne fuit pas du kit réactif. Stériliser la surface de contact de la machine (c’est l’heure de début).
Remarque : Veillez à vérifier le moniteur de rayonnement dans le laboratoire chaud et les dosimètres portable pour vérifier les niveaux de rayonnement de chaque personne avant d’entrer dans le labo chaud. - Vérifiez le volume [16O] - l’eau et [18O] - l’eau et le volume d’hélium, d’hydrogène et d’azote dans le réservoir d’essence. Vérifier si la température de l’eau du robinet pour le refroidissement primaire est de moins de 25 ° C et que pour le refroidissement secondaire est inférieure à 22 ° C. Utiliser toute l’eau dans le système fermé (30 min après le début) pour la production.
- Commencer l’irradiation préliminaire [16O]-l’eau dans le cyclotron (1 h après le début). S’assurer que le moniteur que 2-3 mL de [16O]-l’eau est irradiée dans des conditions optimales (p. ex., 20 µA, 5 min) dans la zone cible du cyclotron. Après irradiation, installer le flacon [16O]-l’eau dans un calibreur de dose de radio-isotopes et de mesurer le niveau de radioactivité (voir Table des matières).
Remarque : La désintégration radioactive devrait être calculée selon la formule suivante.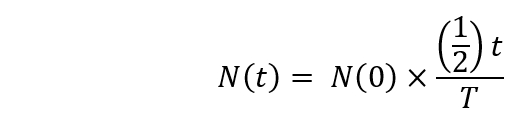
Ici,
N(t) est les numéros noyaux radioactifs à t = t secondes ;
N(0) est les numéros noyaux radioactifs à t = 0 seconde ;
T = la demi-vie. - Commencer l’irradiation [18O]-l’eau dans le cyclotron (1 h 30 min après le début). Régler l’heure de bombardement pendant jusqu'à 20 min et l’énergie des protons incidente à 16,5 MeV.
- Démarrer le synthétiseur FDG selon l’opérateur manuel22 (2 h après le début). Une procédure modifiée est donnée ci-dessous.
- Après l’irradiation, utiliser le gaz hélium pour transférer 2-3 mL du [18O]-l’eau du cyclotron vers le récepteur en polypropylène du synthétiseur FDG.
- Crochet de seringues sur les pilotes correspondants de la seringue, pressurisez les flacons de réactifs, dissoudre le 1,3,4,6-Tetra-O-acetyl-2-O-trifluoromethanesulfonyl-β-D-mannopyranose dans un flacon (7 ± 0,2 mL) d’acétonitrile (pureté ≥ 99,5 %) et rincer la cassette avec acétonitrile.
- Après le bombardement, transférer les irradiés [16O] - l’eau et [18O] - l’eau au synthétiseur FDG.
Remarque : Une fois commencée la synthèse, l’irradié [18O]-l’eau traverse une cartouche d’échange anionique (voir Table des matières). N’oubliez pas de conditionnent et convertir le carbonate avant la synthèse de la cartouche. - Après le transfert de l’éluant contenant l’activité [18F] sans liquide dans les vaisseaux de la réaction, laisser les solvants s’évaporer à sec. Lors du séchage, ajouter de petites quantités d’acétonitrile dans la cuve de réaction 3 x (à chaque fois, ajouter 80 µL). Effectuer l’évaporation à 95 ° C sous vide et courant d’azote.
- Ajouter le précurseur triflate de mannose (25 mg) pour le résidu sec après dissolvant dans environ 3,5 mL d’acétonitrile (avec une pureté ≥ 99,5 %). Une réaction de substitution nucléophile se produit à 85 ° C dans la synthèse FDG.
- Comme une purification préliminaire, mélanger la solution étiquetée avec 26 mL d’eau distillée. Renvoyer environ 4 mL de la solution diluée d’étiquetage à la cuve pour récupérer l’activité restante. Passer la solution à travers la cartouche phase inversée (voir Table des matières). Rincer la cartouche contenant le piégé étiqueté précurseur 4 x à l’aide de 10 mL, 10 mL, 13 mL et 13 mL d’eau distillée sur les lavages successifs.
- Convertir le composé acétylé (précurseur marqué) FDG dans la cartouche par hydrolyse alcaline, avec 750 µL de N 2NaOH pendant 2 min à température ambiante.
- Après hydrolyse, recueillir la solution alcaline de FDG dans 7 mL d’eau et mélanger avec la solution de neutralisation (5 mL de tampon citrate et 1 mL de HCl de N 2).
- Purifier la solution résultante de FDG neutralisée.
- Passer la solution FDG neutralisée par une deuxième cartouche de phase inversée (voir Table des matières), conservant les composés partiellement hydrolysées et les sous-produits non polaires.
- Faire passer à travers une cartouche alumine N (voir Table des matières), conservant les dernières traces d’ions fluorures n’ayant pas réagi [18F]. Ensuite, passer à travers un filtre de 0,22 µm.
- Rincer la cassette et les cartouches, filtre avec 3 mL d’eau pour récupérer le FDG résiduel qui reste dans les lignes et, ensuite, égoutter le FDG dans le flacon final, qui contient 15-17 mL de liquide.
- Effectuer une analyse qualitative du traceur [18F] FDG (2 h 30 min après le début).
- Visuellement observer le flacon. Confirmer qu’il est transparent et qu’il ne comprend pas toutes les particules.
- Mesurer la quantité de liquide à l’aide de la balance de Roberval, un (devrait être 15-17 mL).
- Mesurer la radioactivité et Half-Life à l’aide d’un calibrateur de dose de radio-isotopes (les mêmes qu’à l’étape 2.3, voir Table des matières) (critère : 105-115 min).
- Diluer 0,5 mL dans le flacon. Effectuer une analyse radiochimique test via hydrates de carbone. Utilisez les colonnes de 3,9 x 300 mm pour la chromatographie liquide haute performance (voir Table des matières) pour détecter la radioactivité maximale (plus de 95).
Remarque : Un seul pic signifie haute pureté. - Mesurer le pH (pH 5.0-8.0) à l’aide de papier réactif pH (voir Table des matières). Mesurer la hexacosane résiduelle 4,7,13,16,21,24-Hexaoxa-1,10-diazabicyclo [8.8.8] (voir Table des matières) (< 40 ppm) épreuve papier (voir Table des matières). Mesurer les endotoxines avec le dispositif de mesure endotoxine approprié par le biais de mesure absorbance (voir Table des matières) (0,25 EU/mL). Faire un test de stérilité (ne trouver aucune bactérie après 8 jours à 37 ° C).
- Remplir le flacon couvert de plomb et de tungstène avec le traceur FDG [18F] à la dose de 5 MBq/kg de poids corporel.
- Transférer le traceur FDG [18F] du labo chaud à la salle de travail (3 h 25 min après le début).
3. temps cours pour l’Acquisition des Images [18F] FDG-TEP/TDM cérébrale
- Planifier les patients. N’oubliez pas d’informer le personnel pour arrêter de nutrition et alimentation par gastrostomie. N’arrêtez pas de fournir de l’eau. Les patients devraient rapide départ 7 h avant l’acquisition de l’image.
- Préparer la voie intraveineuse pour l’administration de traceur FDG [18F]. Fixer une aiguille de 22 - 24 G avec 5 mL d’héparine sodique (10 unités/mL) sur l’un des membres inférieurs avant d’entrer dans la zone contrôlée par les radiations.
- Ont les patients à s’allonger sur une civière légère avant d’entrer dans la zone contrôlée par les radiations. Amener les patients dans la zone contrôlée de rayonnement et attendez 30 min, en silence, tandis que le personnel médical est en stand-by.
- Re-vérifier la perméabilité de la voie intraveineuse de prélever le sang avec une seringue de 10 mL. Mesurer les niveaux de glycémie avec un glucomètre.
- Après avoir transféré le traceur FDG [18F] du labo chaud à la salle de travail, mis en place dans la distribution automatique et système d’injection (voir Table des matières).
- Revérifier les informations suivantes (par l’intermédiaire du personnel médical) : numéro du patient, nom, anniversaire, hauteur et poids corporel ; le nom du tracer, la quantité de traceur (eau avec 3,5 mL de traceur FDG [18F] + 12 mL de sérum physiologique), la radioactivité programmée (5 MBq/kg), le temps d’injection, le nombre de traceurs-lot [18F] FDG, la vitesse d’injection élevée (normalement, 0,3 mL/s) et le niveau de radioactivité mesuré dans le labo chaud.
- Enregistrer la mesure automatique de la radioactivité preinjected qui s’affiche sur l’écran de la distribution automatique et système d’injection.
- Injecter le [18F] FDG traceur via la voie intraveineuse préparée à l’étape 3.2 (3 h 30 min après le début).
- Noter le volume résiduel du traceur FDG [18F], qui apparaît automatiquement sur l’écran de la distribution automatique et système d’injection.
- Avoir les patients attendent dans la salle d’attente de la zone contrôlée par rayonnement pour 50 min.
- Transférer les patients de la salle d’attente à l’appareil de TEP/CT (voir Table des matières). Enregistrer les images de cerveau pendant 10 min (4 h 30 min après le début).
Remarque : Les paramètres d’imagerie pour des images [18F] FDG-TEP/CT sont mode de liste de 10 min. Reconstruire les données provenant des bacs de 10 min. Les données de moins de 3 min ne sont pas utilisées parce que les signaux de faible intensité ne sont pas suffisants. Paramétrer l’image reconstruction : un algorithme de reconstruction bloc séquentiel attente régularisés maximisation (voir Table des matières) ; la taille de matrice = 192 ; le champ de vision = 25 cm ; Β-valeur : 100-200 ; filtre de l’axe z : aucun. - Après avoir pris les images, vérifiez la zone d’injection pour l’extravasation. Jeter toute urine si le patient a un cathéter urinoir avec poche à urine.
- Retirer le patient de la zone contrôlée par rayonnement (4 h 50 min après le début).
Remarque : Voir la Figure 1 pour une représentation schématique du calendrier des événements (procédure patient et synthèse du traceur [18F] FDG).
4. l’analyse des Images [18F] FDG-TEP/CT
- Évaluer toutes les données d’image pour une absorption normalisé (SUV) mesure de la valeur en utilisant le logiciel d’imagerie (voir Table des matières).
- Sélectionner les patients.
- Assigner les données du flux de travail oncologie MM .
- Cliquez sur le bouton pour Functional des navigateurs.
- Cliquez sur le VOI (volume d’intérêt) seuil bouton.
- Affectez la sphère VOI le navigateur en trois dimensions.
Remarque : Le SUV maximale (SUVmax) et SUV moyenne (SUVmean) sont automatiquement mesurés pour la VOI selon le seuil de SUVmax choisi. N’oubliez pas de dessiner une bordure autour du VOI ciblée sur le navigateur à l’aide de la sphère tridimensionnelle, à l’exclusion des autres cibles, des muscles extraoculaires et le cuir chevelu car ils ont tendance à déranger la valeur limite SUV. Vérifiez la zone cible sur axiales, coronales et sagittales. - Après avoir sélectionné tous les bons réglages, cliquez sur le bouton modifier la mesure .
- Modifiez la valeur de seuil (par exemple, 50 %) de la VOI et cliquez sur OK.
- Enregistrer les SUVmax, SUVmean, volume cible et seuil de la zone cible, qui sont automatiquement mesurées.
- Pour stériquement visualiser le métabolisme du glucose de la surface de l’ensemble du cerveau, utilisation du logiciel (voir Table des matières) pour établir une feuille de couleur pour les images de FDG-PET/CT [18F] basé sur la glycémie.
- Enfin, comparer l’évaluation clinique avec les images de FDG-PET/CT [18F].
Access restricted. Please log in or start a trial to view this content.
Résultats
Un homme de 63 ans qui avait été écrasé par une voiture en faisant du vélo a été présentée à la salle d’urgence par ambulance. L’examen a révélé un score de Glasgow Coma Scale de 7 (ouverture de le œil = 1, meilleure réponse verbale = 2, meilleure réponse motrice = 4), anisocorie (droite : 2 mm et à gauche : 3 mm) et une réponse négative de cornée17. A CT de la tête a montré l’hémorragie sous-arachnoïdienne et intracrânienn...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ce protocole prévoit les moyens de mener une série de cerveau-glucose évaluations métaboliques avec [18F] FDG-TEP/CT à l’aide autoproduit à traceurs FDG [18F] un seul établissement.
La production de traceur FDG [18F] suit la procédure décrite dans le manuel de l’opérateur synthétiseur FDG ; Cependant, la prudence est nécessaire concernant trois points. Tout d’abord, le bombardement temps et énergie (étape 2.5) doivent être ajustées selon ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier m. Uchino Sousen hôpital pour toutes les procédures. Les auteurs remercient également Adam Phillips du groupe Edanz (www.edanzediting.com/ac) pour l’édition d’un projet de ce manuscrit.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 20ml syringe | Terumo | SS-20ESZ | |
| 10ml syringe | Terumo | SS-10ESZ | |
| 1ml syringe | Terumo | SS-01T | |
| Protective plug | Top | ML-KS | |
| Three-way cock L type 180° | Terumo | TS-TL2K | |
| Extension tube | Top | X1-50 | |
| Indwelling needle 22G or 24G | Terumo | SR-OT2225C | |
| Tegaderm transparent dressing | 3M | 1624W | |
| Hepaflash 10U/ml 10ml | Terumo | PF-10HF10UA | |
| Auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01 | |
| Fluid for auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01-001 | |
| Millex-GS Syringe Filter Unit | Millipore | SLGSV255F | |
| Air needle | Terumo | XX-MFA2038 | |
| Check valve | Hakko | 23310100 | |
| Saline 500ml | HIKARI pharmaceutical Co., Ltd. | 18610155-3 | |
| Yukiban 25x7mm | Nitto | 3252 | |
| Elascot No.3 | Alcare | 44903221 | |
| Presnet No.3 27x20mm | Alcare | 11674 | |
| Steri Cotto a 4x4cm | Kawamoto | 023-720220-00 | |
| StatstripXp3 | Nova Biomedical | 11-110 | |
| Statstrip Glucose strips | Nova Biomedical | 11-106 | |
| JMSsheet | JMS | JN-SW3X | |
| Injection pad | Nichiban | No.30-N | |
| Stepty | Nichiban | No.80 | |
| Advantage Workstation | GE Healthcare | Volume Share 7. version 4.7 | |
| Discovery MI PET/CT | GE Healthcare | ||
| EV Insite | PSP | ||
| GE TRACERlab MXFDG synthesizer reagent kit | ABX | K-105TM | |
| TRACERlab MXFDG cassette | GE Healthcare | P5150ME | |
| Extension tube | Universal Giken Co., Ltd | AT511-ST-001 | |
| TSK sterilized injection needle 18x100 | Tochigiseiko | AT511-ST-004 | |
| TSK sterilized injection needle 18x60 | Tochigiseiko | AT511-ST-002 | |
| TSK sterilized injection needle 21x65 | Tochigiseiko | AT511-ST-003 | |
| Seal sterile vial -N 5ml | Mita Rika Kogyo Co., Ltd. | SSVN5CBFA | |
| k222 TLC plate | Universal Giken Co., Ltd. | AT511-01-005 | |
| Anion-cation test paper | Toyo Roshi Kaisha | 7030010 | |
| Endospecy ES-24S set | Seikagaku corporation | 20170 | |
| Sterile evacuated vial | Gi phama | 10214 | |
| 5ml syringe | Terumo | SS-05SZ | |
| Extension tube | Top | X-120 | |
| Finefilter F | Forte grow medical Co.Ltd. | F162 | |
| Millex FG | Merck | SLFG I25 LS | |
| Vented Millex GS | Merck | SLGS V25 5F | |
| Injection needle 18x38 | Terumo | NN-1838R | |
| Injection needle 21x38 | Terumo | NN-2138R | |
| Water-18O | Taiyo Nippon Sanso | F03-0027 | |
| Distilled water | Otsuka phrmaceutical | ||
| Hydrogen gas G1 | Hosi Iryou Sanki | ||
| Helium gas G1 | Hosi Iryou Sanki | ||
| Nitrogen G1 | Hosi Iryou Sanki | ||
| TRACERlabMXFDG | GE Healthcare | ||
| Sep-Pak Light Accell Plus QMA | WATERS | ||
| Sep-Pak Plus tC18 | WATERS | ||
| Sep-Pak Plus Alumina N | WATERS | ||
| HPLC with 3.9 X 300 mm columns | WATERS | ||
| US-2000 | Universal Giken CO. Ltd. | ||
| Kryptofix222 | Merck | ||
| EG Reader SV-12 | Seikagaku Corporation | ||
| UG-01 | Universal Giken Co., Ltd. | ||
| syngo.via | Siemens Healthineers | ||
| Advantage Workstation Volume Share 7, version 4.7 | GE Healthcare | ||
| Q clear | GE Healthcare | ||
| CRC-15PET dose calibrator | CAPINTEC, INC. |
Références
- Godbolt, A. K., et al. Disorders of consciousness after severe traumatic brain injury: a Swedish-Icelandic study of incidence, outcomes and implications for optimizing care pathways. Journal of Rehabilitation Medicine. 45 (8), 741-748 (2013).
- Klingshirn, H., et al. Quality of evidence of rehabilitation interventions in long-term care for people with severe disorders of consciousness after brain injury: A systematic review. Journal of Rehabilitation Medicine. 47 (7), 577-585 (2015).
- Fischer, D. B., Truog, R. D. What is a reflex? A guide for understanding disorders of consciousness. Neurology. 85 (6), 543-548 (2015).
- Klingshirn, H., et al. RECAPDOC - a questionnaire for the documentation of rehabilitation care utilization in individuals with disorders of consciousness in long-term care in Germany: development and pretesting. BMC Health Services Research. 18 (1), 329(2018).
- Stéfan, A., Mathé, J. F. SOFMER group. What are the disruptive symptoms of behavioral disorders after traumatic brain injury? A systematic review leading to recommendations for good practices. Annals of Physical and Rehabilitation. 59, 5-17 (2016).
- Liu, S., et al. Multimodal neuroimaging computing: a review of the applications in neuropsychiatric disorders. Brain Informatics. 2 (3), 167-180 (2015).
- Wong, K. P., et al. A semi-automated workflow solution for multimodal neuroimaging: application to patients with traumatic brain injury. Brain Informatics. 3 (1), 1-15 (2016).
- Chennu, S., et al. Brain networks predict metabolism, diagnosis and prognosis at the bedside in disorders of consciousness. Brain. 140 (8), 2120-2132 (2017).
- Di Perri, C., et al. Neural correlates of consciousnes s in patients who have emerged from a minimally conscious state: a cross-sectional multimodal imaging study. The Lancet Neurology. 15 (8), 830-842 (2016).
- Erecińska, M., Silver, I. A. ATP and brain function. Journal of Cerebral Blood Flow & Metabolism. 9 (1), 2-19 (1989).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807(2015).
- Byrnes, K. R., et al. FDG-PET imaging in mild traumatic brain injury: a critical review. Frontiers in Neuroenergetics. 5, 13(2014).
- Mortensen, K. N., et al. Impact of Global Mean Normalization on Regional. Glucose Metabolism in the Human Brain. Neural Plasticity. , 6120925(2018).
- Wagatsuma, K., et al. Comparison between new-generation SiPM-based and conventional PMT-based TOF-PET/CT. Physica Medica. 42, 203-210 (2017).
- Fukukita, H., et al. Japanese guideline for the oncology FDG-PET/CT data acquisition protocol: synopsis of Version 2.0. Annals of Nuclear Medicine. 28 (7), 693-705 (2014).
- Varrone, A., et al. European Association of Nuclear Medicine Neuroimaging Committee. EANM procedure guidelines for PET brain imaging using [18F]FDG, version 2. European Journal of Nuclear Medicine and Molecular Imaging. 36 (12), 2103-2110 (2009).
- Teasdale, G., Jennett, B. Assessment of coma and impaired consciousness. A practical scale. The Lancet. 2 (7872), 81-84 (1974).
- Valadka, A. B. Injury to the cranium. Trauma. Moore, E. J., Feliciano, D. V., Moore, E. E. , McGraw-Hill. New York, NY. 377-399 (2000).
- Carney, N., et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 80 (1), 6-15 (2017).
- Giacino, J. T., Kalmar, K., Whyte, J. The JFK Coma Recovery Scale-Revised: measurement characteristics and diagnostic utility. Archives of Physical Medicine and Rehabilitation. 85 (12), 2020-2029 (2004).
- Schnakers, C., et al. The Nociception Coma Scale: a new tool to assess nociception in disorders of consciousness. Pain. 148 (2), 215-219 (2010).
- Shiel, A., et al. The Wessex Head Injury Matrix (WHIM) main scale: a preliminary report on a scale to assess and monitor patient recovery after severe head injury. Clinical Rehabilitation. 14 (4), 408-416 (2000).
- GE Healthcare. TRACERlabMXFDG operator manual, Version 1. , (2003).
- Yamaki, T., et al. Association between uncooperativeness and the glucose metabolism of patients with chronic behavioral disorders after severe traumatic brain injury: a cross-sectional retrospective study. BioPsychoSocial Medicine. 12, 6(2018).
- Schwaiger, M., Wester, H. J. How many PET tracers do we need? Journal of Nuclear Medicine. 52, Suppl 2, 36S-41S (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon