Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación semicuantitativa usando [18F] FDG trazador en pacientes con lesión cerebral grave
En este artículo
Resumen
[18F]-fluorodeoxiglucosa (FDG) tomografía computarizada por emisión de positrones es útil para estudiar el metabolismo de la glucosa relacionadas con la función cerebral. Aquí, presentamos un protocolo para un trazador FDG [18F] puesta a punto y evaluación semicuantitativa de los análisis de la región de interés para las áreas específicas del cerebro asociados con manifestaciones clínicas en pacientes con lesión cerebral traumática severa.
Resumen
Pacientes con lesión cerebral traumática grave (sTBI) tienen dificultad para saber si están expresando con precisión sus pensamientos y emociones debido a trastornos de conciencia, alterado más función y trastornos verbales del cerebro. Como consecuencia de una insuficiente capacidad de comunicar, se necesitan evaluaciones objetivas de miembros de la familia, personal médico y los cuidadores. Una evaluación es la evaluación del funcionamiento de las áreas del cerebro. Recientemente, la imagen cerebral multimodal se ha utilizado para explorar la función de las áreas dañadas del cerebro. [18F]-tomografía computarizada de tomografía de emisión de positrón del fluorodeoxyglucose ([18F] FDG-PET/CT) es una exitosa herramienta para examinar la función del cerebro. Sin embargo, la evaluación del metabolismo de la glucosa cerebral se basa en [18F] FDG-PET/CT no se estandardiza y depende de varios parámetros diferentes, así como la condición del paciente. Aquí, describimos una serie de protocolos de evaluación semicuantitativa para un análisis de imagen de región de interés (ROI) con marcadores de producción propia [18F] FDG en pacientes con sTBI. El protocolo se centra en la selección de los participantes, preparar trazalíneas [18F] de FDG en el laboratorio caliente, programación de la adquisición de imágenes del cerebro [18F] FDG-PET/CT y medir el metabolismo de la glucosa mediante el análisis del ROI de un área específica del cerebro.
Introducción
Se presentan pacientes con sTBI con dificultades neurológicas imprevisibles a lo largo de la rehabilitación que incluyen déficits motores, déficits sensoriales e inestabilidad psiquiátrica1. Aunque la evaluación clínica generalmente se efectúa verbalmente, pacientes con sTBI como síndrome de vigilia sin respuesta o estado mínimamente consciente tienen especial dificultad de saber si están expresando con precisión sus pensamientos y emociones debido a trastornos de la conciencia, alteran función superior del cerebro y trastornos verbales2,3. Familiares, personal médico y los cuidadores se confunden a veces imprevisibles cambios neurológicos o la falta de respuesta que puede resultar de la insuficiente capacidad de comunicación4,5.
Recientemente, imagen cerebral multimodal se ha utilizado para explorar el cerebro regional función6,7,8,9. El cerebro es el principal consumidor de energía derivado de la glucosa, con metabolismo de la glucosa proporciona aproximadamente el 95% del adenosín trifosfato (ATP) necesario para que el cerebro funcionar de10. La captación de [18F]-fluorodeoxiglucosa (FDG) es un marcador para la captación de glucosa por el tejido cerebral. [18F] FDG-PET/CT puede detectar la absorción de FDG [18F] y es, por tanto, una herramienta útil para examinar el cerebro función11. En general, análisis de imagen [18F] FDG se dividieron en dos categorías: ROI análisis y análisis basado en voxel (VBA)12. Informes anteriores muestran que el análisis del ROI es preferido para el estudio de regiones específicas de lesión traumática. Esto es debido a que VBA (como mapeo paramétrico estadístico [SPM]) requiere coregistros y normalización a un cerebro estándar, que no funciona bien en los casos de TBI debido a la deformación del tejido de cerebro como atrofia del cerebro, hinchazón, agrandamiento y disminución de espacio ventricular7,12. Aunque se han desarrollado varios algoritmos y software para el análisis de datos de la proyección de imagen de resonancia magnética (MRI), metales utilizados en cirugía ortopédica y Neurocirugía generan ruido artefactos7,12,13 . Recientemente, el uso de los photomultipliers con dispositivos de PET/TC ha mejorado la resolución espacial de las imágenes PET/CT-derivado cerebro14. El protocolo actual se centra en la medición semi-cuantitativamente la glucosa absorción via ROI análisis [18F] FDG-PET/CT utilizando uno mismo-producidas [18F] trazadores FDG en pacientes con sTBI.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este estudio fue realizado en cumplimiento de la Junta de revisión institucional (approval no. 07-01) y se adhirió a los principios de la declaración de Helsinki. Se obtuvo consentimiento informado para el uso médico de la imagen del registro y el cerebro de representantes legales de los pacientes. El estudio se llevó a cabo después de la aprobación por el Comité de ética institucional (2017-14). Este protocolo se realizó siguiendo las directrices de la sociedad japonesa de Medicina Nuclear y la Asociación Europea de Medicina Nuclear como una referencia15,16.
1. selección de los participantes
- Consentimiento informado con los informes médicos y las imágenes del cerebro de los pacientes de los representantes legales de los pacientes. Una escala de Coma de Glasgow puntuación ≤ 8 en el momento del accidente debe se han registrado en expediente médico17,18,19 cada paciente.
- Mantenga Neurología, psicología y personal multi-disciplinario conferencias cada seis meses para evaluar las manifestaciones clínicas.
Nota: Miembros de la Conferencia deben incluir personal médico tales como médicos, enfermeras, fisioterapeutas, terapeutas ocupacionales, logopedas, nutricionistas y trabajadores sociales. Asegúrese de controlar constantemente si los pacientes pueden comunicarse (verbal o no verbal) y tomar decisiones por sí mismos debido a estado de excitación y estado neurológico son típicamente inestables. - Llevar a cabo evaluaciones clínicas de la función auditiva, función visual, función motora, función del oromotor/verbal, función de la comunicación, estado de excitación, expresión facial y otras funciones relevantes, utilizando baterías de evaluación estándar tales como el Coma Recuperación escalar-revisada (CRS-R), la escala de Coma de la nocicepción y la matriz de lesiones de cabeza de Wessex20,21,22.
- Horario [18F] FDG-PET/CT scans para los pacientes que son médicamente estable y con seguridad pueden participar en los exámenes. Programar sólo aquellos que han proporcionado el consentimiento informado o cuyos representantes legales han proporcionado consentimiento informado, como se indica en el formulario de consentimiento informado. Programar la adquisición de imágenes [18F] FDG-PET/CT cerca el día de la evaluación clínica.
2. preparación del trazador [18F] de FDG en el laboratorio caliente
- En el laboratorio caliente, comenzar a fabricar kits de reactivos para la producción automatizada de FDG a medida para el sintetizador FDG (véase Tabla de materiales). Asegúrese de usar el programa automático para comprobar la movilidad del sistema de bombeo en el sintetizador FDG y para asegurarse de que aire no escape del kit reactivo. Esterilizar el área de contacto de la máquina (esta es la hora de salida).
Nota: Asegúrese de comprobar al monitor de radiación en el laboratorio caliente y utilizar los dosímetros de radiación portátil para verificar los niveles de radiación de cada persona antes de entrar en el laboratorio caliente. - Compruebe el volumen de [1,6O] - agua y [18O] - agua y el volumen de helio, hidrógeno y nitrógeno en el tanque de gas. Compruebe si la temperatura del agua de refrigeración primaria es menos de 25 ° C y de enfriamiento secundario debajo de 22 ° C. Utilice toda el agua en el sistema cerrado (30 minutos después del comienzo) para la producción.
- Comenzar la irradiación preliminar [16O]-agua en el ciclotrón (1 h después del inicio). Compruebe el monitor que eso 2-3 mL de [1,6O]-agua es irradiado en óptimas condiciones (e.g., 20 μA, a 5 minutos) en el área de la blanco del ciclotrón. Después de la irradiación, instalar el frasco [16O]-de agua en un calibrador de dosis de radioisótopos y medir el nivel de radiactividad (véase Tabla de materiales).
Nota: El decaimiento radiactivo se calculará utilizando la siguiente fórmula.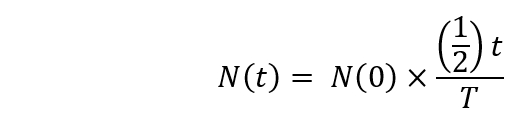
Aquí,
N (t) es el número núcleos radioactivos en t = t segundos;
N(0) es el número núcleos radioactivos en t = 0 segundos;
T = el período. - Comenzar la irradiación [18O]-agua en el ciclotrón (1 h 30 min después del comienzo). Configurar el tiempo de bombardeo para hasta 20 min y la energía de los protones inmiscuían a 16.5 MeV.
- Iniciar el sintetizador FDG según el manual de operador22 (a 2 h después del inicio). Un procedimiento modificado se da abajo.
- Después de la irradiación, usar gas helio para 2-3 ml de la [18O]-agua de ciclotrón al receptor polipropileno del sintetizador FDG.
- Gancho de jeringas en los correspondientes conductores de jeringuilla, presurice viales de los reactivos, disolver el 1,3,4,6-Tetra-O-acetyl-2-O-trifluoromethanesulfonyl-β-D-mannopyranose en un vial (7 ± 0,2 mL) de acetonitrilo (pureza ≥ 99.5%) y enjuague el casete con acetonitrilo.
- Después del bombardeo, transferir los irradiados [16O] - agua y [18O] - de agua para el sintetizador FDG.
Nota: Una vez que ha iniciado la síntesis, la irradiación [18O]-el agua se mueve a través de un cartucho de intercambio aniónico (véase Tabla de materiales). Asegúrese de acondicionar y convertir el cartucho en el carbonato de antes de la síntesis. - Después de transferir el eluyente que contienen la actividad [18F] sin el líquido en los vasos de reacción, permitir que los solventes se evapore hasta que se seque. Durante el proceso de secado, agregue pequeñas cantidades de acetonitrilo al recipiente de reacción 3 x (cada vez, agregar 80 μL). Realizar la evaporación a 95 ° C en vacío y corriente de nitrógeno.
- Añadir el precursor triflate manosa (25 mg) en el residuo seco después de disolver en aproximadamente 3,5 mL de acetonitrilo (con una pureza del 99,5% ≥). Una reacción de sustitución nucleofílica ocurre a 85 ° C en el sintetizador FDG.
- Como una purificación preliminar, mezclar la solución marcada con 26 mL de agua destilada. Enviar unos 4 mL de la solución diluida de etiquetado hacia el recipiente de la reacción para recuperar la actividad restante. Pasar la solución a través del cartucho de fase inversa (véase Tabla de materiales). Enjuague el cartucho que contiene el atrapado etiquetado precursor 4 x usando 10 mL, 10 mL, 13 mL y 13 mL de agua destilada en los sucesivos lavados.
- Convertir el compuesto acetilado (etiquetado precursor) en FDG dentro el cartucho a través de hidrólisis alcalina, con 750 μl de NaOH N 2 por 2 min a temperatura ambiente.
- Después de la hidrólisis, recoger la solución alcalina de la FDG en 7 mL de agua y se mezcla con la solución de neutralización (5 mL de tampón citrato y 1 mL de ácido clorhídrico N 2).
- Purificar la solución FDG neutralizada resultante.
- Pasar la solución neutralizada de FDG a través de un segundo cartucho de fase inversa (véase Tabla de materiales), reteniendo los compuestos parcialmente hidrolizados y subproductos no polares.
- Pasar por un cartucho de alúmina N (véase Tabla de materiales), conservando los últimos restos de los iones de fluoruro [18F]. Luego, pasarlo por un filtro de 0,22 μm.
- Enjuague los cassettes y cartuchos de filtro con 3 mL de agua para recuperar la FDG residual que queda en las líneas y, luego, escurra la FDG en el último frasco, que contiene 15-17 mL de líquido.
- Realizar un análisis cualitativo del tracer [18F] de FDG (2 h 30 min después del comienzo).
- Observar visualmente el frasco. Confirman que es transparente y que no incluye todas las partículas.
- Medir la cantidad de líquidos con balanza de Roberval (debe ser de 15-17 mL).
- Medir la radioactividad y vida media usando un calibrador de dosis de radioisótopos (el mismo que en el paso 2.3, véase Tabla de materiales) (criterio: 105-115 min).
- Pipetear 0.5 mL del frasco. Realizar una prueba de pureza radioquímica mediante análisis de hidratos de carbono. Utilizar columnas de 3.9 x 300 mm para cromatografía líquida de alto rendimiento (véase Tabla de materiales) para detectar la radiactividad máxima (más de 95).
Nota: Un solo pico significa pureza elevada. - Medir el pH (pH 5.0-8.0) mediante el uso de papel de prueba pH (véase Tabla de materiales). Medir el hexacosane residual 4,7,13,16,21,24-Hexaoxa-1, 10-Diazabiciclo [8.8.8] (véase Tabla de materiales) (< 40 ppm) usando papel de prueba (véase Tabla de materiales). Medir las endotoxinas con el dispositivo adecuado de medición de endotoxinas a través de la medición de absorbancia (véase Tabla de materiales) (0.25 UE/mL). Hacer una prueba de esterilidad (encontrar ningunas bacterias después d 8 a 37 ° C).
- Llenar la cubeta de plomo y tungsteno con trazador [18F] de FDG en una dosificación de 5 MBq/kg de peso corporal.
- Transferencia de trazador FDG [18F] del laboratorio caliente a la sala de trabajo (3 h 25 min después del comienzo).
3. tiempo curso para la adquisición de las imágenes de FDG-PET/CT cerebral de [18F]
- Programar a los pacientes. Asegúrese de informar al personal para detener la nutrición y alimentación mediante gastrostomía. No deje de suministro de agua. Los pacientes deben ayunar a partir 7 h antes de la adquisición de la imagen.
- Preparar la ruta intravenosa para la administración de trazador FDG [18F]. Asegure una aguja de 22 - 24 G con 5 mL de heparina sódica (10 unidades/mL) en uno de los miembros inferiores antes de ingresar a la zona controlada por la radiación.
- Tienen los pacientes acostarse en una camilla ligera antes de entrar en la zona controlada por la radiación. Traer a los pacientes al área de control de radiación y espere 30 minutos, en silencio, mientras que en el stand de personal médico.
- Vuelva a verificar la permeabilidad de la vía intravenosa por extraer la sangre con una jeringa de 10 mL. Medir los niveles de glucosa en sangre con un medidor de glucosa.
- Después de transferir el palpador FDG [18F] del laboratorio caliente a la sala de trabajo, lo establecido en el sistema automático de dispensación y de la inyección (véase Tabla de materiales).
- Vuelva a verificar la siguiente información (a través del personal médico): número de identificación de paciente, nombre, cumpleaños, altura y peso corporal; el nombre del palpador, la cantidad de trazador (agua con 3,5 mL de trazador FDG de [18F] + 12 mL de solución salina), la radiactividad programada (5 MBq/kg), el tiempo de inyección, el número de lote tracer [18F] FDG, la velocidad de inyección (normalmente, 0,3 mL/s) y la nivel de radiactividad que se midió en el laboratorio caliente.
- Registrar la medición automática de radiactividad preinjected que aparece en la pantalla del sistema automático de dispensación y de la inyección.
- Inyectar la [18F] FDG trazador a través de la vía intravenosa preparada en el paso 3.2 (3 h 30 min después del comienzo).
- Registrar el volumen residual del trazador [18F] de FDG, que se muestra automáticamente en la pantalla del sistema automático de dispensación y de la inyección.
- Tienen los pacientes esperar en la sala de espera de la zona controlada de radiación durante 50 minutos.
- Transferir los pacientes desde la sala de espera a la máquina de PET/TC (véase Tabla de materiales). Grabar las imágenes del cerebro durante 10 min (4 h 30 min después del comienzo).
Nota: Los parámetros de proyección de imagen para imágenes de FDG-PET/CT [18F] son el modo de lista de 10 min. Reconstruir los datos de cubos de 10 minutos. Los datos en 3 minutos no se utilizan porque las señales de baja intensidad no son adecuadas. Establecer la imagen parámetros de reconstrucción: un algoritmo de reconstrucción de bloque secuencial expectativa regularizados maximización (véase Tabla de materiales); el tamaño de la matriz = 192; el campo de visión = 25 cm; Β valor: 100-200; filtro eje z: ninguno. - Después de tomar las imágenes, compruebe el área de inyección de extravasación. Deseche toda la orina si el paciente tiene un catéter urinario con bolsa de orina.
- Retire al paciente de la zona controlada de radiación (4 h 50 min después del comienzo).
Nota: Vea la figura 1 para un esquema del calendario de eventos (procedimiento de paciente y síntesis del trazador FDG [18F]).
4. Análisis de las imágenes de FDG-PET/CT [18F]
- Evaluar todos los datos de imagen para una medida de valor (SUV) de captación estandarizado utilizando el software de proyección de imagen (véase Tabla de materiales).
- Seleccionar a los pacientes.
- Asignar los datos al flujo de trabajo de Oncología MM .
- Haga clic en el botón Functional navegadores.
- Haga clic en el VOI (volumen de interés) umbral botón.
- Ajuste lo VOI al navegador tridimensional.
Nota: El SUV máximo (SUVmax) y medio SUV (SUVmean) automáticamente se miden por el VOI según el umbral SUVmax solicitado. Asegúrese de dibujar un borde alrededor del VOI dirigido en el navegador usando la esfera tridimensional, excluyendo otros objetivos, los músculos extraoculares y el cuero cabelludo porque tienden a perturbar el umbral establecido de SUV. Compruebe el área de la blanco en cortes axiales, coronales y sagitales. - Después de seleccionar todos los ajustes necesarios, haga clic en el botón Editar de la medida .
- Cambiar el valor de umbral (por ejemplo, 50%) del VOI y haga clic en Aceptar.
- Grabar el SUVmax, SUVmean, volumen de destino y umbral de la zona de destino, que se miden automáticamente.
- Para sterically visualizar el metabolismo de la glucosa de la superficie de todo el cerebro, usar el software (véase Tabla de materiales) para establecer un mapa de color para las imágenes de FDG-PET/CT [18F] basado en glucosa en la sangre.
- Por último, comparar la evaluación clínica con las imágenes de FDG-PET/CT [18F].
Access restricted. Please log in or start a trial to view this content.
Resultados
Un hombre de 63 años de edad que había sido atropellado por un auto mientras voy en bicicleta fue traído a la sala de emergencia por ambulancia. La examinación reveló una puntuación de la escala de Coma de Glasgow de 7 (apertura del ojo = 1, mejor respuesta verbal = 2, mejor respuesta de motor = 4), anisocoria (derecha: 2 mm y a la izquierda: 3 mm) y una respuesta negativa corneal17. Una tomografía de la cabeza demostrada subaracnoidea y hemorragia ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este protocolo proporciona los medios para llevar a cabo una serie de glucosa cerebral las evaluaciones metabólicas [18F] FDG-PET/CT usando uno mismo-producidas [18F] trazador FDG en una sola institución.
La producción de trazador FDG [18F] sigue el procedimiento descrito en el manual del operador FDG sintetizador; sin embargo, la precaución es necesaria con respecto a tres puntos. En primer lugar, el tiempo del bombardeo y la energía (paso 2.5) deben ajus...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Dr. Uchino Sousen hospital para todos los procedimientos. Los autores agradecen también Adam Phillips de la Edanz Group (www.edanzediting.com/ac) para la edición de una versión preliminar de este manuscrito.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 20ml syringe | Terumo | SS-20ESZ | |
| 10ml syringe | Terumo | SS-10ESZ | |
| 1ml syringe | Terumo | SS-01T | |
| Protective plug | Top | ML-KS | |
| Three-way cock L type 180° | Terumo | TS-TL2K | |
| Extension tube | Top | X1-50 | |
| Indwelling needle 22G or 24G | Terumo | SR-OT2225C | |
| Tegaderm transparent dressing | 3M | 1624W | |
| Hepaflash 10U/ml 10ml | Terumo | PF-10HF10UA | |
| Auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01 | |
| Fluid for auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01-001 | |
| Millex-GS Syringe Filter Unit | Millipore | SLGSV255F | |
| Air needle | Terumo | XX-MFA2038 | |
| Check valve | Hakko | 23310100 | |
| Saline 500ml | HIKARI pharmaceutical Co., Ltd. | 18610155-3 | |
| Yukiban 25x7mm | Nitto | 3252 | |
| Elascot No.3 | Alcare | 44903221 | |
| Presnet No.3 27x20mm | Alcare | 11674 | |
| Steri Cotto a 4x4cm | Kawamoto | 023-720220-00 | |
| StatstripXp3 | Nova Biomedical | 11-110 | |
| Statstrip Glucose strips | Nova Biomedical | 11-106 | |
| JMSsheet | JMS | JN-SW3X | |
| Injection pad | Nichiban | No.30-N | |
| Stepty | Nichiban | No.80 | |
| Advantage Workstation | GE Healthcare | Volume Share 7. version 4.7 | |
| Discovery MI PET/CT | GE Healthcare | ||
| EV Insite | PSP | ||
| GE TRACERlab MXFDG synthesizer reagent kit | ABX | K-105TM | |
| TRACERlab MXFDG cassette | GE Healthcare | P5150ME | |
| Extension tube | Universal Giken Co., Ltd | AT511-ST-001 | |
| TSK sterilized injection needle 18x100 | Tochigiseiko | AT511-ST-004 | |
| TSK sterilized injection needle 18x60 | Tochigiseiko | AT511-ST-002 | |
| TSK sterilized injection needle 21x65 | Tochigiseiko | AT511-ST-003 | |
| Seal sterile vial -N 5ml | Mita Rika Kogyo Co., Ltd. | SSVN5CBFA | |
| k222 TLC plate | Universal Giken Co., Ltd. | AT511-01-005 | |
| Anion-cation test paper | Toyo Roshi Kaisha | 7030010 | |
| Endospecy ES-24S set | Seikagaku corporation | 20170 | |
| Sterile evacuated vial | Gi phama | 10214 | |
| 5ml syringe | Terumo | SS-05SZ | |
| Extension tube | Top | X-120 | |
| Finefilter F | Forte grow medical Co.Ltd. | F162 | |
| Millex FG | Merck | SLFG I25 LS | |
| Vented Millex GS | Merck | SLGS V25 5F | |
| Injection needle 18x38 | Terumo | NN-1838R | |
| Injection needle 21x38 | Terumo | NN-2138R | |
| Water-18O | Taiyo Nippon Sanso | F03-0027 | |
| Distilled water | Otsuka phrmaceutical | ||
| Hydrogen gas G1 | Hosi Iryou Sanki | ||
| Helium gas G1 | Hosi Iryou Sanki | ||
| Nitrogen G1 | Hosi Iryou Sanki | ||
| TRACERlabMXFDG | GE Healthcare | ||
| Sep-Pak Light Accell Plus QMA | WATERS | ||
| Sep-Pak Plus tC18 | WATERS | ||
| Sep-Pak Plus Alumina N | WATERS | ||
| HPLC with 3.9 X 300 mm columns | WATERS | ||
| US-2000 | Universal Giken CO. Ltd. | ||
| Kryptofix222 | Merck | ||
| EG Reader SV-12 | Seikagaku Corporation | ||
| UG-01 | Universal Giken Co., Ltd. | ||
| syngo.via | Siemens Healthineers | ||
| Advantage Workstation Volume Share 7, version 4.7 | GE Healthcare | ||
| Q clear | GE Healthcare | ||
| CRC-15PET dose calibrator | CAPINTEC, INC. |
Referencias
- Godbolt, A. K., et al. Disorders of consciousness after severe traumatic brain injury: a Swedish-Icelandic study of incidence, outcomes and implications for optimizing care pathways. Journal of Rehabilitation Medicine. 45 (8), 741-748 (2013).
- Klingshirn, H., et al. Quality of evidence of rehabilitation interventions in long-term care for people with severe disorders of consciousness after brain injury: A systematic review. Journal of Rehabilitation Medicine. 47 (7), 577-585 (2015).
- Fischer, D. B., Truog, R. D. What is a reflex? A guide for understanding disorders of consciousness. Neurology. 85 (6), 543-548 (2015).
- Klingshirn, H., et al. RECAPDOC - a questionnaire for the documentation of rehabilitation care utilization in individuals with disorders of consciousness in long-term care in Germany: development and pretesting. BMC Health Services Research. 18 (1), 329(2018).
- Stéfan, A., Mathé, J. F. SOFMER group. What are the disruptive symptoms of behavioral disorders after traumatic brain injury? A systematic review leading to recommendations for good practices. Annals of Physical and Rehabilitation. 59, 5-17 (2016).
- Liu, S., et al. Multimodal neuroimaging computing: a review of the applications in neuropsychiatric disorders. Brain Informatics. 2 (3), 167-180 (2015).
- Wong, K. P., et al. A semi-automated workflow solution for multimodal neuroimaging: application to patients with traumatic brain injury. Brain Informatics. 3 (1), 1-15 (2016).
- Chennu, S., et al. Brain networks predict metabolism, diagnosis and prognosis at the bedside in disorders of consciousness. Brain. 140 (8), 2120-2132 (2017).
- Di Perri, C., et al. Neural correlates of consciousnes s in patients who have emerged from a minimally conscious state: a cross-sectional multimodal imaging study. The Lancet Neurology. 15 (8), 830-842 (2016).
- Erecińska, M., Silver, I. A. ATP and brain function. Journal of Cerebral Blood Flow & Metabolism. 9 (1), 2-19 (1989).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807(2015).
- Byrnes, K. R., et al. FDG-PET imaging in mild traumatic brain injury: a critical review. Frontiers in Neuroenergetics. 5, 13(2014).
- Mortensen, K. N., et al. Impact of Global Mean Normalization on Regional. Glucose Metabolism in the Human Brain. Neural Plasticity. , 6120925(2018).
- Wagatsuma, K., et al. Comparison between new-generation SiPM-based and conventional PMT-based TOF-PET/CT. Physica Medica. 42, 203-210 (2017).
- Fukukita, H., et al. Japanese guideline for the oncology FDG-PET/CT data acquisition protocol: synopsis of Version 2.0. Annals of Nuclear Medicine. 28 (7), 693-705 (2014).
- Varrone, A., et al. European Association of Nuclear Medicine Neuroimaging Committee. EANM procedure guidelines for PET brain imaging using [18F]FDG, version 2. European Journal of Nuclear Medicine and Molecular Imaging. 36 (12), 2103-2110 (2009).
- Teasdale, G., Jennett, B. Assessment of coma and impaired consciousness. A practical scale. The Lancet. 2 (7872), 81-84 (1974).
- Valadka, A. B. Injury to the cranium. Trauma. Moore, E. J., Feliciano, D. V., Moore, E. E. , McGraw-Hill. New York, NY. 377-399 (2000).
- Carney, N., et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 80 (1), 6-15 (2017).
- Giacino, J. T., Kalmar, K., Whyte, J. The JFK Coma Recovery Scale-Revised: measurement characteristics and diagnostic utility. Archives of Physical Medicine and Rehabilitation. 85 (12), 2020-2029 (2004).
- Schnakers, C., et al. The Nociception Coma Scale: a new tool to assess nociception in disorders of consciousness. Pain. 148 (2), 215-219 (2010).
- Shiel, A., et al. The Wessex Head Injury Matrix (WHIM) main scale: a preliminary report on a scale to assess and monitor patient recovery after severe head injury. Clinical Rehabilitation. 14 (4), 408-416 (2000).
- GE Healthcare. TRACERlabMXFDG operator manual, Version 1. , (2003).
- Yamaki, T., et al. Association between uncooperativeness and the glucose metabolism of patients with chronic behavioral disorders after severe traumatic brain injury: a cross-sectional retrospective study. BioPsychoSocial Medicine. 12, 6(2018).
- Schwaiger, M., Wester, H. J. How many PET tracers do we need? Journal of Nuclear Medicine. 52, Suppl 2, 36S-41S (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados