Method Article
h3 和 h4 组蛋白的纯化及细胞和脑组织中乙酰化组蛋白标记的定量
摘要
本文的目的是为组蛋白 h3 和 h4 的有效纯化以及乙酰化组蛋白残留量的定量提供全面、系统的指导。
摘要
在所有真核生物中, 染色质是所有遗传信息的生理模板, 对遗传至关重要。染色质是受一系列不同的翻译后修饰 (ptm), 主要发生在组蛋白 (即组蛋白尾巴) 的氨基端, 并调节基础 dna 的可及性和功能状态。组蛋白尾从核糖体的核心延伸, 并受组蛋白乙酰转移酶 (hat) 的添加和组蛋白去乙酰基 (hdac) 在细胞生长和分化过程中的去除乙酰基。组蛋白尾赖氨酸 (k) 残留物上的特定乙酰化模式决定了转录活性或转录抑制染色质之间的动态稳态, 方法是 (1) 影响核心组蛋白组合和 (2) 招募协同作用或拮抗铬酸相关蛋白的转录位点。组蛋白尾 ptm 复杂性质的基本调控机制影响大多数色谱模板化过程, 并导致正常和病理发育中细胞成熟和分化的变化。本报告的目的是为新手提供一种有效的方法, 从细胞和脑组织中纯化核心组蛋白蛋白, 并可靠地量化组蛋白 h3 和 h4 上的乙酰化标记。
引言
表观遗传学一词是指独立于 dna 序列1,2的变化而发生的基因活性的遗传变化。基因转录和抑制是由 (1) 包裹在核组蛋白的8amer 上的染色体 dna 的可及性 (h2a、H2A、h3 和 h4 各两个拷贝) 以及 (2) 转录因子和支架蛋白的可用性决定的被招募到特定的促进点站点3,4。基因转录是由酶介导的修饰特定 dna 启动子位和 ptm 的组织标记 5,6,7调节。组蛋白 h3 和 h4 的 n-终止是真核生物3中已知的最保守的序列之一, 它们的翻译后修饰已被广泛记录, 以在确定染色质结构和功能8,9。组蛋白尾巴 (即乙酰化、甲基化、磷酸化和泛化) 处的 ptm 改变了尾巴的相互作用潜力, 影响了染色质纤维的结构状态和折叠, 从而调节了 dna 的可获得性和处理4,10,11,12。乙酰基通过一组特定的组蛋白相互作用的表观遗传酶, 即 hat 和 hdac, 分别在组蛋白尾巴上的 k 残基中添加和去除.例如, 在赖氨酸 12 (h4k12ac) 上对组蛋白 h4 的乙酰化已被证明能激活与记忆习得和巩固有关的基因的转录 14.此外, 一些证据表明, 酶介导的基因转录表观遗传控制是健康细胞生长和分化的一个重要方面 6,15.基因表达的表观遗传调控中的交替, 无论是通过 dna 的表观遗传修饰, 还是通过表观遗传酶本身的突变, 都被证明在人类疾病中被失调, 在人类疾病中, 特定基因活性的变化是一个标志6,16, 17.因此, 对核心组蛋白 ptm 变化的评价正在成为潜在治疗干预措施的高价值目标。然而, 确定丰富, 相互作用的伙伴, 和特定的作用, 组蛋白 ptm 已被证明具有挑战性18。
在本报告中, 描述了一种优化的中等吞吐量策略, 以单组分的比例从细胞和脑组织中纯化核心组蛋白, 并描述了一个完整的组蛋白 h3 和 h4 ptm 量化方案。值得注意的是, 尽管目前公布的基于酸的纯化技术和基于抗体的组蛋白检测策略已被广泛采用的组蛋白表征, 他们缺乏描述性细节的关键步骤的程序, 因此阻碍快速和可复制的组蛋白提取和定量。例如, 细胞提取物和组织活检的处理需要不同的工具和技术才能成功提取。此外, 目前手稿中提出的优化协议演示了一种实用的、中等吞吐量的方法。核心组蛋白被提取为一个单一的, 纯分数, 这使得可靠的下游抗体介导的 ptm 检测没有任何干扰的杂质。此外, 在目前的手稿中, 由于组蛋白的分子量较小, 在组蛋白检测方面的挑战也被规避了。通常情况下, 纯化、定量和凝胶电泳协议之间缺乏兼容性, 阻碍科学家获得可复制的决定性结果。在这里, 提出了一个优化的工作流程, 以净化核心组蛋白从细胞和组织, 并准备他们的下游 ptm 分析通过西方印迹。
目前的协议允许纯化核心组蛋白蛋白, 同时保留其本地翻译后修饰 (即乙酰化, 甲基化, 磷酸化)。图 1描述了组蛋白纯化协议的时间线。
研究方案
所有的老鼠都被安置在迈阿密大学米勒医学院的一个湿度和温度控制的、aaalac 认可的动物设施中。所有实验都得到了迈阿密大学米勒医学院机构动物护理和使用委员会 (iacuc) 的批准, 并根据国家卫生研究院的规格进行.
1. 样品提取物的制备
-
附属细胞
- 在10厘米的盘子中, 板细胞在适当的培养基中 (每个培养皿1 x 10 6 至 1 x10 9细胞, 如 bv2、hek-293 和 sh-sy5y, 但对于原代细胞, 如原代皮质神经元, 每个盘子约 1x 10 15个细胞)。确保细胞均匀分布在板的整个表面, 并允许细胞生长 48小时, 达到 ~ 100% 汇合 (37°c, 5% co2)。
- 一旦细胞达到所需的融合, 轻轻吸气培养基, 用预热的无血清介质在组织培养罩下清洗细胞2倍。
- 从盘中吸收无血清介质, 并在每个盘中加入1毫升的冰冷萃取缓冲液 (0.4 m 硫酸、1 mm kcl、1 mm mgcl 2、50mm tris-hcl [ph 8.0] 和1x 蛋白酶抑制剂)。
- 使用塑料刮板收集提取缓冲液中的所有电池 (通过刮), 并将其转移到带有 1, 000μl 移液器的 1.5 ml 标记管中。向上和向下对细胞进行向上和向下的向上和向下 3x, 以促进同质化。
- 关闭所有的管子, 立即把它们放在冰上。
-
脑组织
- 如果正在使用冷冻组织, 将组织放入预冷 1.5 ml 管中, 并在冰上短暂解冻。如果正在使用新鲜的组织, 请立即开始1.2.2。
注: 目前的协议描述了使用冷冻小鼠大脑和前额叶皮层样本的程序。 - 使用使用适当数量的提取缓冲液和建议的笔划次数的手持式弹跳均质机对组织进行均质 (表 1)。为避免过多的染色质切碎, 请不要超过建议的笔划次数。
- 使用单通道 1, 000μl 移液器, 将均质化转移到预冷 1.5 ml 管。关闭所有的管子, 立即把它们放在冰上。
- 如果正在使用冷冻组织, 将组织放入预冷 1.5 ml 管中, 并在冰上短暂解冻。如果正在使用新鲜的组织, 请立即开始1.2.2。
2. 粗组蛋白提取物的制备
- 将含有悬浮在萃取缓冲液中的细胞或组织的 1.5 ml 管放置在旋转平台上, 并在4°c 时以15转/分旋转, 以便提取粗组蛋白。
注: 提取时间可能因不同的细胞和组织类型而异, 并且必须针对每个过程进行优化。当前协议显示了在提取15分钟、2小时和24小时后获得的结果 (图 2、图 3、图 4和图 5)。 - 将微型离心机预冷至4°c。在所需的提取时间过后, 在4°c 下, 以最高速度离心管10分钟。
- 将包括粗组蛋白在内的上清剂转移到新的预冷 1.5 ml 管中。丢弃颗粒。
- 将上清液存储在-80°c (提取可在此步骤中停止, 请参阅图1中的"停止步骤"), 或立即继续执行下一步。
- 用5倍中和缓冲液的1体积中和粗组蛋白 (例如, 将250μl 的5倍中和缓冲液添加到1毫升粗组蛋白中和)。通过向上和向下移液6倍很好地混合。
- 用 ph 条检查混合物的 ph 值。通过添加更多中和缓冲液进行相应调整, 以达到7的 ph 值。
- 评估粗组蛋白提取物中是否存在组蛋白和非组蛋白 (图 2)。
- 在455μl 样品中加入 37.5μl, 加入 4x (laemmli) 样品缓冲液, 并在99°c 下变性10分钟。
- 将样品加载到 sds-page 凝胶上, 并以 100 v 的速度运行1小时的凝胶。
- 用库马西明亮的蓝 r-250 染色溶液和去染色在连续三次洗涤 (1 hw 洗) 与库马西明亮的蓝色 r-250 破坏溶液的情况下, 在一夜之间染色凝胶。
注: 粗组蛋白 (图 2) 可与洗脱和纯化的组蛋白 (即柱输入 [图 5 a]) 进行比较。
3. 核心组蛋白的净化
-
自旋柱平衡
- 在所使用的每个旋转柱中添加500μl 平衡缓冲液。不要触摸柱膜。
- 在4°c 离心 3分钟, 800 x g. 放弃流通。重复1x。
-
组蛋白纯化
- 在色谱柱中添加从步骤2.6 到感兴趣的样品的500μl。在4°c 离心 3分钟, 800 x g. 收集流经。
- 根据需要重复上一步, 多次将整个示例加载到列中。不要过度填充旋转列。
- 结合每个离心步骤的流经来分析柱结合效率 (图 3)。
- 按照步骤2.7 分析列的流通法。
-
柱状清洗
- 在每根色谱柱上添加500μl 的洗涤缓冲液。在4°c 离心 3分钟, 800 x g. 收集流动清洗 (清洗 #1)。
- 重复步骤3.3.1 共洗三次。收集流经清洗 #2 和 #3。不要将连续的列流动清洗池集中。
- 若要进一步评估列的组蛋白绑定效率, 请按照步骤 2.7 (图 4) 分析三列洗。
-
组蛋白洗脱
- 将色谱柱转移到一个新的标记 1.5 ml 管中。
- 加入50微米的组蛋白洗脱缓冲液。在4°c 离心 3分钟, 800 x g. 保存含有组蛋白蛋白的流动。
- 对于额外的洗脱, 重复步骤3.4.2。不要结合第一和第二流经精灵, 因为它们在组蛋白数量和纯度上不同。
4. 核心组的降水
- 在纯化组蛋白中加入高氯酸 (pca), 最终浓度为4% 的五氯苯二酚 (例如,从步骤3.4.2 将300μl 的 70% pca 添加到50μl 的纯化组蛋白中。
- 离心 3秒, 从管壁收集所有残留液体。通过向上和向下移液6倍进行混合。
- 将管材放在机架中, 在4°c 下孵育24小时。
- 第二天, 将微型离心机预冷至 4°c, 并在4°c 下以最高速度离心样品75分钟。
- 离心完成后, 在管的底部可以看到一个含有沉淀组蛋白的白色小颗粒。不要对样品进行涡旋。
- 小心吸气上清液, 在不干扰颗粒的情况下, 在样品中加入500μl 的冰凉 4% pca。
- 在4°c 离心 10分钟, 最高速度。小心吸气上清液。
- 重复步骤 4.7 2 x。
- 在不干扰颗粒的情况下, 加入500μl 的冰凉丙酮。在4°c 离心 10分钟, 最高速度。小心吸气上清液。
- 重复步骤 4.9 2x。
- 仔细吸气上清液, 让管子不封顶, 让样品在冰上干燥 3 0分钟, 检查是否所有残留的丙酮都蒸发了。
- 保持管不封盖, 并允许样品在室温 (rt) 下干燥5分钟。
- 将颗粒重新装入30μl 的无菌水中。不要上下移管。用手指轻轻地滑动管子。
- 根据颗粒大小, 在冰上重新构建所有管, 并允许组蛋白重建30-50分钟。检查颗粒是否重新悬浮。
- 封盖所有管, 并允许颗粒在 rt 处进一步重新悬浮5分钟。
注: 此溶液 (第一和第二洗脱步骤 3.4.3) 是由纯化和脱盐的组蛋白组成, 可用于进一步定量和组蛋白乙酰化分析。
5. 洗脱组蛋白的定量
- 根据制造商的协议使用分光光度计来量化步骤4.15 中最后洗脱后获得的组蛋白总数。测量230纳米的吸收率。记录 a260/a280 比例, 表明样品受到核酸污染。
- 使用以下公式计算组蛋白浓度 (x):
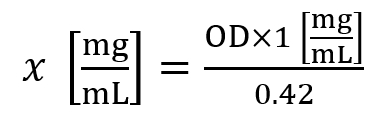
在这里, od 是在 a230 纳米测量的光学密度。 - 组蛋白浓度 ~ 1.5 mg/ml 被认为是细胞系的平均产量, 而组蛋白浓度 ~ 5.0 mg/ml 被认为是30毫克组织的平均产量。
6. 西方剧情分析
- 将纯化和洗脱的组蛋白从步骤4.15 调整到 ~ 10μg 的组蛋白蛋白/样品。
- 添加适当的水量和4倍莱姆利样品缓冲器, 以调整装载量。
- 在99°c 下对样品进行10分钟的变性。在冰上冷却它们。离心为 3秒, 以收集所有残留的液体和冷凝从管壁。
- 将样品装入 sds-page 凝胶上, 并以 100 v 的速度运行1小时的凝胶。
- 要可视化总组蛋白, 用库马西明亮的蓝色 r-250 染色溶液染色凝胶一夜, 并在连续三次清洗 (1 hw 洗) 中使用 coomassie 辉煌蓝 r-250 坚定的溶液进行染色。
注: 组蛋白的第一洗脱液包含高质量的组蛋白 (图 5a), 而第二洗脱蛋白包含低至无组蛋白水平 (图 5A)。 - 要量化组蛋白 ptm, 请使用转移系统 (见材料表) 将组蛋白从 sds-page 凝胶 (步骤 6.4) 转移到 pvdf 膜上。
- 要组装转移三明治, 打开传输系统盒式磁带, 并将 pvdf 膜堆栈 (标记为底部 +) 放在盒式磁带底部, 膜朝上。用吹风辊轻轻滚动膜, 去除堆栈和膜之间的任何空气。
- 将凝胶放在膜顶部, 用印迹辊轻轻滚动凝胶, 去除膜和凝胶之间的任何空气, 并将顶部堆栈放在凝胶上。再次轻轻地滚动, 并将盒式磁带盖放在三明治的顶部, 用力按下, 并顺时针转动旋钮锁定。
- 将盒式磁带插入传输系统插槽。在设备屏幕上, 选择 "涡轮协议"。使用3分钟的协议为一个单一的迷你凝胶或7分钟的协议超过两个迷你凝胶。
- 用 ponceau s 染色膜 5分钟, 并显示总组蛋白。
- 用0.1% 补水盐水 (tbs) 清洗, 用0.1% 补间20为 2小时, 并将其在5% 的牛奶中阻挡 1小时. 用原生抗体和二级抗体 (分别在 rt 4°c 或1小时过夜) 或根据先前优化的协议将其阻断在5% 的牛奶中。
注: 在现行协议中, 使用了抗乙酰化组蛋白 h4k12 (图 6和图 7) 和 h3k27 抗体 (图 8)。
结果
为了说明组蛋白纯化方案的进展和所有分析组分的组成, 我们评估了不同的组蛋白提取物从人类微胶质 bv2 细胞。为了证明组蛋白 h3 和 h4 ptm (即乙酰化) 的定量, 我们使用脑组织裂解液。
bv2 细胞在10厘米组织培养处理的盘子中, 每盘 5 x10 6细胞被镀镀, 并允许生长到48小时的融合状态, 然后收集细胞, 并通过在含有 0.4 m 的提取缓冲液中的孵育释放染色质, 释放组蛋白硫酸、1 mm kcl、1 mm mgcl2、50 mm Tris-HCl (ph 值 8.0) 和1个蛋白酶抑制剂。提取时间在15分钟至24小时之间, 并不影响由库马西明亮蓝染色测定的粗组蛋白提取物的整体成分 (图 2)。然后, 粗组蛋白通过均衡组蛋白柱, 并对其流动进行分析。通过 coomassie 明亮的蓝色染色分析, 由于流动中缺乏组蛋白, 决定了高柱结合效率。我们确定柱结合效率为 100%, 因为在分析的流经中没有可检测到的组蛋白 (图 3)。然后用洗涤缓冲液清洗三次所有具有结合组蛋白的膜, 以去除任何残留的杂质, 只留下将组蛋白与硅胶结合。我们确定, 对于所有组蛋白提取时间 (即15分钟、2小时和 24小时), 第一膜清洗是从色谱柱中去除非组蛋白污染的最重要的方法, 而第二次和第三次清洗并不影响样品的纯度。因此, 根据示例类型的不同, 最后两次洗并可能会被省略。在首次从柱中洗脱组蛋白 (使用含有1mm 氯化钠和 edta 的洗脱缓冲液) 后, 用4% 的高氯酸沉淀一夜, 然后进行颗粒化、洗涤, 并进行分析, 以浓缩纯化的组蛋白 h3 和h4。我们观察到, 24小时的提取时间增加了纯化分数中的 h3 和 h4 组蛋白的含量, 而提取时间为15分钟和 2小时 (图 5a)。列中的第二洗脱没有产生高质量或高数量的组蛋白 (图 5b)。
接下来, 我们使用脑组织同质化来量化组蛋白 h3 和 h4 ptm, 即乙酰化。对野生小鼠 (c57bl6/) 雄性小鼠进行了广泛作用的 hdac 抑制剂 (三丁胺), 口服剂量为 5 g/kg, 为 3d, 第4天采集全脑组织, 并根据所述方案提取粗组蛋白。通过未配对t-试验, 我们确定三丁胺增加粗提取物中组蛋白的乙酰化 (t (6) = 6.184, p = 0.0004);但是, 在提取物中检测到杂质 (组蛋白带没有明确定义)。因此, h4k12ac 抗体没有很高的特异性 (图 6)。为了进一步评估所提出的方案对较小组织切片的适用性, 我们收集了每日用 10 mg kg m344 (i 类和 iib hdac 抑制剂) 治疗的三重转基因阿尔茨海默病 (3 x tg-ad) 小鼠前额叶皮层。月。组蛋白的纯化和沉淀是根据本文描述的协议进行的。利用纯化的组蛋白 h3 和 h4 分数, 我们确定 m344 增加 h4k12 乙酰化 2.4倍 (t) = 13.03, p & lt; 0.0001), h4k12ac 抗体的特异性较高 (图 7)。同样, 我们观察到 bv2 细胞中的组蛋白 h3 乙酰化增加, 以应对另一种 hdac 抑制剂, 即选择性 hdac3 抑制剂 rgfp-966。10μm 的 rgfp-966 在24小时治疗后, 导致组蛋白 h3k27 的乙酰化增加约两倍。学生的未配对t-测试被用来比较对照与治疗过的细胞。
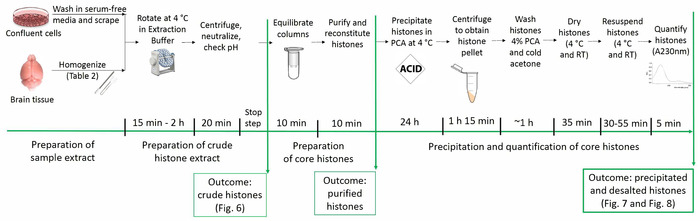
图 1: 组蛋白纯化协议的时间轴.下面显示了组蛋白分析的所有步骤以及每个步骤所需的估计时间。括号中提到了描述特定步骤的结果并在手稿中呈现的数字。请点击这里查看此图的较大版本.
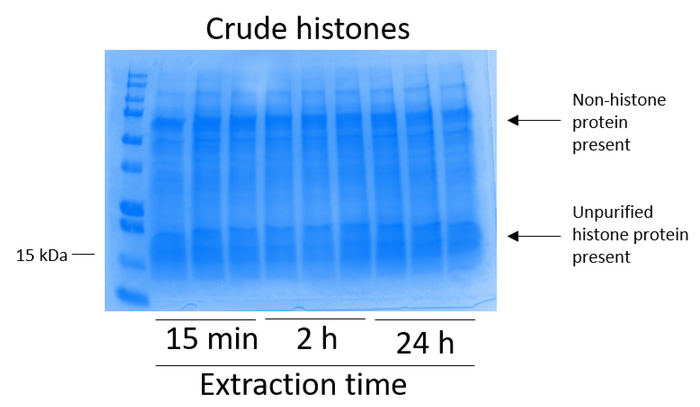
图 2: 代表性的库莫西明亮的蓝染凝胶, 展示了从 bv2 细胞中提取的粗组蛋白.在组蛋白提取方案开始前, bv2 细胞被培养48小时。粗组蛋白被提取15分钟、2小时和 24小时, 每个时间点有三个重复 (图 3、 图 4和图 5中的情况也是如此)。粗组蛋白提取物中既有非组蛋白, 也有组蛋白。请点击这里查看此图的较大版本.
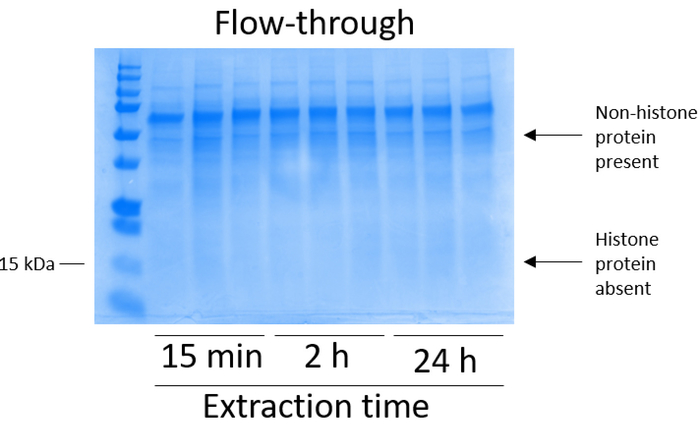
图 3: 代表性的库莫西明亮的蓝染凝胶, 展示了从 bv2 细胞的组蛋白纯化步骤后的柱流动.在粗组蛋白通过组蛋白结合柱之后, 流经中只存在非组蛋白。组蛋白在这一比例中不存在。请点击这里查看此图的较大版本.
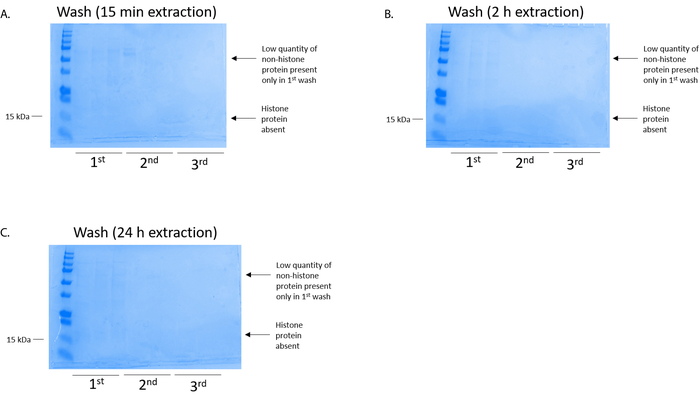
图 4: 代表 coomassie 明亮的蓝染凝胶, 演示 bv2 细胞组蛋白纯化步骤后的柱状清洗.无论组蛋白提取时间 (a) 15分钟、(b) 2小时或 (c) 24小时, 低数量的非组蛋白只存在于第一次清洗组蛋白结合柱中。组蛋白在所有洗涤中都不存在。请点击这里查看此图的较大版本.
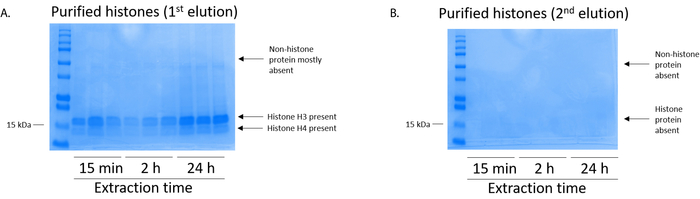
图 5: 代表 coomassie 明亮的蓝染凝胶, 演示 bv2 细胞组蛋白纯化步骤后的隐蔽性.(a) 在组蛋白纯化柱的第一次洗脱后, 检测到高质量的纯化和脱盐组蛋白 h3 和 h4。(b) 从组蛋白纯化柱中的第二洗脱物没有产生高质量或高质量的组蛋白 h3 或 h4。请点击这里查看此图的较大版本.
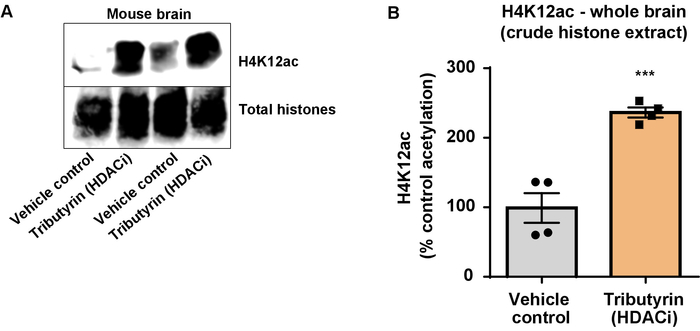
图 6: 广泛作用的 hdac 抑制剂三丁林增加了野生小鼠整个大脑中的 h4k12 乙酰化.(a) 这个面板显示了一个具有代表性的西方印迹, 描绘了从野生小鼠整个大脑中收集的粗组蛋白提取物中 h4k12 乙酰化的增加, 以响应广泛作用的 hdac 抑制剂----三系。(b) 该面板显示了体内h4k12 乙酰化增加的量化。采用未配对t检验方法对组进行比较 (t(6) = 6.0 76, p = 0.0005)。条形表示均值±的平均值 (sem) 的标准误差。n = 8。p & lt; 0.0001。请点击这里查看此图的较大版本.
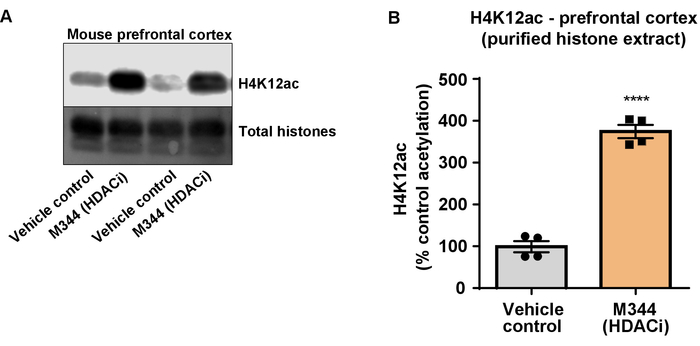
图7:i 类和 iib hdac 抑制剂 m344 增加了三重转基因阿尔茨海默病 (3 x tg-ad) 小鼠前额叶皮层的 h4k12 乙酰化.(a) 这个面板显示了一个具有代表性的西方印迹, 描绘了从 3 x tg-ad 小鼠前额叶皮层收集的纯化和脱盐组蛋白提取物中 h4k12 乙酰化的增加, 以应对 m344 对 hdac 的抑制。(b) 该面板显示 h4k12 乙酰化增加的数量, 以响应按每天 10 mg kg 剂量服用的 m344, 为期4个月。未配对t检验用于比较组 (t (6) = 13.30, p & lt; 0.0001)。条形表示平均± sem. n = 8 。p & lt; 0.00001。请点击这里查看此图的较大版本.
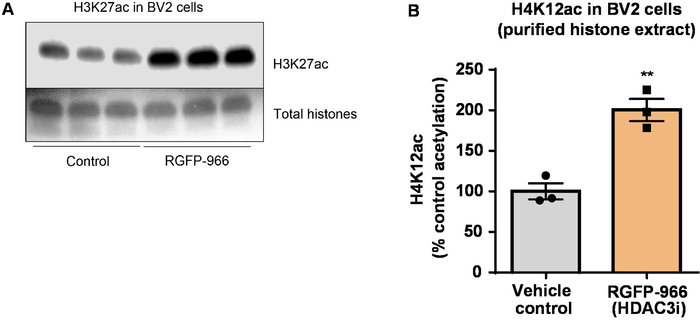
图 8: 选择性 hdac3 抑制剂 rgfp-966 增加 bv2 微胶质细胞中的 h3k27 乙酰化.(a) 该面板显示了一个具有代表性的西方印迹, 描述了从 bv2 细胞中收集的纯化和脱盐组蛋白提取物中 h3k27 乙酰化的增加, 以应对 rgfb-966 对 hdac3 的抑制作用。(b) rgfb-966 在24小时治疗后, 导致组蛋白 h3 和赖氨酸 (k) 27 的乙酰化增加约两倍。未配对t-试验用于比较对照与处理过的细胞 (t (4) = 5.981, p = 0.002)。条形表示平均± sem. n = 6 。* *p & lt; 0.01。请点击这里查看此图的较大版本.
| 代表性组织 (一个半球) * | 平均组织重量 (毫克) | 萃取缓冲器 (ml) | 笔画数 |
| 小鼠小脑 | 40 | 1 | 40 |
| 小鼠额叶皮层 | 30 | 0。3 | 20 |
| 小鼠海马体 | 27 | 0。3 | 18 |
| 小鼠内皮 | 19 | 0。3 | 17 |
| * 所有实验都是在成年雄性小鼠身上进行的。 | |||
| 平均年龄: 16个月。平均体重:30 克。 | |||
表 1: 脑组织同质化的优化条件。
讨论
在目前的工作中, 我们展示了一种纯化核心组蛋白蛋白和量化组蛋白 h3 和 h4 ptm (例如, 乙酰化) 的优化方法。该协议是一个全面的工作流程, 其中包括有关细胞和脑组织制备、粗组蛋白纯化以及详细的组蛋白沉淀、洗脱和定量的优化程序, 然后是组蛋白电泳和鲁棒组蛋白 ptm 定量。这里提供的大量细节允许可复制地生成高质量的数据, 尽管需要对组蛋白样本进行长时间的操作。
许多目前公布的协议要求使用高效液相色谱法分离组蛋白 h3 和 h419 的纯组分。尽管高效液相色谱是一项强大的技术, 但其复杂性和低吞吐量阻碍了大多数分子生物学家和非专家的频繁使用。事实上, 许多实验室都无法使用高效液相色谱, 操作该仪器需要高技能人员。高效液相色谱通常耗时、昂贵且具有潜在危险性。这里提出的是一个廉价的, 中等吞吐量的战略, 以实现类似的质量, 绕过 hplc 的结果。所报告的策略也更实用, 适用于几乎任何实验室, 因为它使用简单的自旋柱方法, 不需要专门的仪器操作技能。此外, 组蛋白 hh/四聚体被提取为一个单一的, 纯, 和丰富的分数, 使保存的 ptm 在每个蛋白质上的可靠定量。
ptm 对氧化应激的变化和 ph 值的变化 20,21极为敏感。因此, 与以前公布的方法18不同, 我们报告了一种有效的策略, 即在无血清介质中冲洗细胞, 以确保细胞的代谢干扰最小, 并避免原生 ptm 对血清成分的干扰。目前的协议不仅绕过了传统的核隔离, 而且还提供了细胞裂解的最佳时间和精确的组织同质化程序, 允许保存核包络, 同时避免核聚集。虽然提取时间可以根据细胞的数量, 使用的细胞类型, 组织大小等, 延长裂解是不可取的, 因为它可能会导致细胞核和 dna 释放, 使样品难以处理。重要的是, 协议中存在多个检查点, 用于验证成功的组蛋白纯化 (例如步骤2.7 和 3.2.3)。此策略还有助于在整个漫长的过程中进行故障排除。
所介绍的协议的另一个重要而独特的特点是, 它与下游的西方印迹分析工具和其他工具完全兼容 (如果需要)。组蛋白检测在 ~ 15 kda13,22,23, 与其他小分子量蛋白质一样, 已被证明具有挑战性的检测标准免疫印迹技术。使用高性能和高吞吐量的传输系统, 结合最佳分辨率的蛋白质凝胶, 可以保持蛋白质原生确认 (在没有 sds 的情况下) 和活动, 在没有 sds 和高传输效率的情况下低分子量组蛋白, 从而保证了可靠的组蛋白 ptm 定量。
披露声明
作者没有什么可透露的。
致谢
提交人感谢佛罗里达州卫生部 ed 和 ethel moore 阿尔茨海默氏症研究方案 (赠款6az08 和 7az26)、nih-niaaa (赠款 5r0a023281-03) 和美国心脏协会 (赠款 17pre3660831)。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | ThermoFiser Scientific | 05-408-129 | or equivalent from other sources |
| Sterile water | Gibco | 15-230-204 | or equivalent from other sources |
| 70% perchloric acid | Sigma Aldrich | 311421 | or equivalent from other sources |
| 100% acetone | Sigma Aldrich | 270725 | or equivalent from other sources |
| pH-indicator strips, non-bleeding | Milliipore Sigma | 1095310001 | |
| 4x SDS sample buffer | BIO-RAD | 161-0747 | |
| Benchtop rotor | Cole-Parmer | UX-04397-34 | or equivalent from other sources |
| 1.5 mL tube rack | ThermoFiser Scientific | 05-541 | or equivalent from other sources |
| Histone purification mini kit | Active Motif | 40026 | spin columns included in the kit |
| Protease Inhibitor Cocktail | ThermoFiser Scientific | 78430 | or equivalent from other sources |
| Nanodrop instrument | ThermoFiser Scientific | ND-2000 | |
| Tissue culture dishes | VWR | 10062-880 | required for histone extraction from cultured cells |
| Tissue culute media | varies based on cell line used | varies based on cell line used | required for histone extraction from cultured cells |
| Low-serum media | ThermoFiser Scientific | 51985091 | required for histone extraction from cultured cells |
| Plastic cell scraper | Falcon | 353086 | required for histone extraction from cultured cells |
| SDS-PAGE gradient gel | BIO-RAD | 456-9035 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Staining Solution | BIO-RAD | 1610436 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Destaining Solution | BIO-RAD | 1610438 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BIO-RAD | 1704156 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Transfer System | RIO-RAD | 1704150 | required for histone extraction from cultured cells |
| Ponceau S stain | CellSignalling | 59803S | required for histone extraction from cultured cells |
| Dounce homogenizer (size/cap sc 7mL) with a small size clearance | Kimble Chase | 885302-0007 | required for histone extraction from tissues |
| 100% bleach | Clorox | 68973 | required for histone extraction from tissues |
| H4K12ac antibody | Active Motif | 39166 | required for PTMs quantification via WB |
| H3K27ac antibody | Active Motif | 39134 | required for PTMs quantification via WB |
参考文献
- Holliday, R. Is there an Epigenetic Component in Long-term Memory? Journal of Theoretical Biology. 200, 339-341 (1999).
- DeWoskin, V. A., Million, R. P. The epigenetics pipeline. Nature Reviews Drug Discovery. 12, 661-662 (2013).
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO Reports. 3, 224-229 (2002).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389, 349-352 (1997).
- Sartor, G. C., Powell, S. K., Brothers, S. P., Wahlestedt, C. Epigenetic Readers of Lysine Acetylation Regulate Cocaine-Induced Plasticity. The Journal of Neuroscience. 35, 15062-15072 (2015).
- Komatsu, N., et al. SAHA, a HDAC inhibitor, has profound anti-growth activity against non-small cell lung cancer cells. Oncology Reports. 15, 187-191 (2006).
- Bahari-Javan, S., Sananbenesi, F., Fischer, A. Histone-acetylation: a link between Alzheimer's disease and post-traumatic stress disorder. Frontiers in Neuroscience. 8, 160(2014).
- Roh, T. -Y., Cuddapah, S., Zhao, K. Active chromatin domains are defined by acetylation islands revealed by genome-wide mapping. Genes & Development. 19, 542-552 (2005).
- Mutskov, V., Felsenfeld, G. Silencing of transgene transcription precedes methylation of promoter DNA and histone H3 lysine 9. The EMBO Journal. 23, 138-149 (2004).
- Howe, L., Brown, C. E., Lechner, T., Workman, J. L. Histone acetyltransferase complexes and their link to transcription. Critical Reviews in Eukaryotic Gene Expression. 9, 231-243 (1999).
- Jenuwein, T., Allis, C. D. Translating the histone code. Science. 293, 1074-1080 (2001).
- Bowman, G. D., Poirier, M. G. Post-Translational Modifications of Histones That Influence Nucleosome Dynamics. Chemical Reviews. 115, 2274-2295 (2015).
- Volmar, C. -H., Wahlestedt, C. Histone deacetylases (HDACs) and brain function. Neuroepigenetics. 1, 20-27 (2015).
- Plagg, B., Ehrlich, D., Kniewallner, K. M., Marksteiner, J., Humpel, C. Increased Acetylation of Histone H4 at Lysine 12 (H4K12) in Monocytes of Transgenic Alzheimer's Mice and in Human Patients. Current Alzheimer Research. 12, 752-760 (2015).
- Bhaskara, S., et al. Hdac3 is essential for the maintenance of chromatin structure and genome stability. Cancer Cell. 18, 436-447 (2010).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone Deacetylase Inhibitors in Clinical Studies as Templates for New Anticancer Agents. Molecules. 20, 3898-3941 (2015).
- Ramakrishnan, S., et al. HDAC 1 and 6 modulate cell invasion and migration in clear cell renal cell carcinoma. BMC Cancer. 16, 617(2016).
- Wapenaar, H., Dekker, F. J. Histone acetyltransferases: challenges in targeting bi-substrate enzymes. Clinical Epigenetics. 8, 59(2016).
- Klinker, H., Haas, C., Harrer, N., Becker, P. B., Mueller-Planitz, F. Rapid Purification of Recombinant Histones. PLoS ONE. 9, e104029(2014).
- Chen, K., et al. Neurodegenerative Disease Proteinopathies Are Connected to Distinct Histone Post-translational Modification Landscapes. ACS Chemical Neuroscience. 9, 838-848 (2018).
- Simithy, J., Sidoli, S., Garcia, B. A. Integrating Proteomics and Targeted Metabolomics to Understand Global Changes in Histone Modifications. Proteomics. , e1700309 (2018).
- Volmar, C. -H., et al. An Epigenetic Approach for the Modulation of Amyloid Precursor Protein (APP) Processing and Improvement of Memory in Alzheimer's Disease. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. 40, S470(2015).
- Volmar, C. -H., et al. M344 promotes nonamyloidogenic amyloid precursor protein processing while normalizing Alzheimer’s disease genes and improving memory. Proceedings of the National Academy of Sciences. 114 (43), E9135-E9144 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。