Method Article
H3 및 H4 히스톤 단백질 및 세포와 뇌 조직 Acetylated 히스톤 부호의 부 량의 정화
요약
이 문서의 목적은 acetylated 히스톤 잔류물의 정량화와 H3 및 H4 히스톤의 효율적인 정화를 종합적이 고 체계적인 가이드를 제공 하는 것입니다.
초록
모든 진 핵 유기 체, 염색 질, 생리 서식 파일의 모든 유전 정보를 유전에 대 한 필수적입니다. Chromatin는 다양 한 posttranslational 수정 (PTMs) 발생 하는 대부분 (즉, 히스톤 꼬리) 히스톤 단백질의 아미노 termini에 기본 DNA의 기능 상태 및 내게 필요한 옵션의 배열. 히스톤 꼬리는 nucleosome의 코어에서 확장 하 고 히스톤 acetyltransferases (모자)에 의해 아 세 틸 그룹의 추가 세포 성장과 분화 시 아 세 틸 그룹 히스톤 deacetylases (HDACs)에 의해 제거 될 수 있습니다. 히스톤 꼬리에 리 (K) 잔류물에 특정 acetylation 패턴 결정 (1) 영향을 미치는 핵심 히스톤 어셈블리에 의해 transcriptionally 활성 또는 transcriptionally 억압 chromatin와 (2) 모집 시너지 사이의 동적 항상성 또는 전사 사이트에 대립 chromatin 관련 단백질. 히스톤 꼬리 PTMs의 복잡 한 자연의 근본적인 규제 메커니즘 셀 성숙에 정상 및 병 적인 모두 개발 차별화 chromatin 템플릿 기반 프로세스와 변경의 대부분을 좌우 한다. 현재 보고서의 목표 세포와 뇌 조직에서 핵심 히스톤 단백질을 순화 하 고 안정적으로 히스톤 H3 및 H4 acetylation 표시를 계량 하는 효율적인 방법으로 초보자를 제공 하는입니다.
서문
기간 epigenetics 변화 DNA 시퀀스1,2에서 독립적으로 발생 하는 유전자 활동에 상속 변화를 말합니다. 유전자 전사와 억압 (1) 염색체 DNA는 octamer 코어 히스톤 단백질 (2 복사 각 H2A, H2B, H3, H4)의 주위에의 접근에 의해와 (2) 녹음 방송 요인의 가용성에 의해 결정 된다 단백질 발판 특정 발기인 사이트3,4를 채용. 유전자 녹음 방송 특정 DNA 발기인 사이트의 수정 효소 중재 및 히스톤 꼬리5,,67의 PTMs에 의해 통제 된다. N-테르미니 히스톤 H3 및 H4 진 핵 유기 체3, 알려진 가장 높은 보존된 시퀀스 중 그리고 posttranslational 수정 chromatin 구조 결정에서 중심 역할을 광범위 하 게 문서화 되었습니다 및 기능8,9. PTMs (즉, acetylation, 메 틸 화, 인 산화, 및 ubiquitination) 히스톤 꼬리에 꼬리의 상호 작용 잠재력을 변경, 구조 상태에 영향을 미칠 및 DNA 접근 통제 접히는 chromatin 섬유의 및 그로 인하여, 그리고4,10,,1112처리. 아 세 틸 그룹에 추가 하 고 특정 상호 작용 하는 히스톤 epigenetic 효소, 즉 모자와 HDACs, 각각13의 집합에 의해 히스톤 꼬리에 K 잔류물에서 제거 됩니다. 예를 들어 (H4K12ac) 리 12에서 H4 히스톤의 acetylation 이전 표시 되었습니다 메모리 수집 및 통합14에 관련 된 유전자의 녹음 방송을 활성화 하. 또한, 여러 줄 증거의 유전자 전사의 효소 중재 후 제어 건강 한 세포 성장과 분화6,15의 중요 한 측면은 것이 좋습니다. 유전자 발현, DNA의 후 성적인 수정 하거나, epigenetic 효소의 돌연변이 의해의 후 성적인 규정에 교대 어디 특정 유전자의 활동에 변화는 각 인은 인간의 질병에 dysregulated로 표시 되었습니다. 병 리 (예를 들어, 암)6,,1617. 따라서, 코어 히스톤 변화의 평가 PTMs 잠재적인 치료 내정간섭에 대 한 높은 가치의 대상으로 떠오르고 있다. 그러나, 풍부를 결정, 상호 작용 파트너 및 히스톤 PTMs의 특정 역할 입증 되었습니다 도전18.
현재 보고서에서 세포와 단일 분수와 히스톤 H3 및 H4 PTMs의 정량화에 대 한 완전 한 프로토콜에서 뇌 조직에서 핵심 히스톤을 정화 하는 최적화 된, 매체 처리량 전략을 설명 합니다. 메모의 현재 산 기반 출판 비록 정화 기술 및 히스톤 항 체 기반 탐지 전략 널리 채택 히스톤 특성화에 대 한, 그들은 따라서 절차의 중요 한 단계에 대해 설명 세부 정보 부족 신속 하 고 복제할 히스톤 추출 및 정량화를 방해. 예를 들어 셀의 처리 추출 하 고 조직 생 검 필요 합니다 다른 도구와 기술을 추출에 대 한. 또한, 현재 원고에 최적화 된 프로토콜에서는 중간 처리량 실용적인 접근 방식을 보여 줍니다. 코어 히스톤 하면 신뢰할 수 있는 다운스트림 항 체 중재 PTM 감지 불순물에서 어떤 간섭 없이 단일, 순수한 부분으로 추출 됩니다. 또한, 현재 원고에 그들의 작은 분자량으로 인해 히스톤 탐지에 관한 과제 피할 되었습니다 있다. 일반적으로, 정화, 정량화, 및 젤 전기 이동 법 프로토콜 간의 호환성 부족 복제할 및 결정적인 결과 얻기에서 과학자를 방해. 여기, 세포와 조직에서 핵심 히스톤을 정화 하 고 다운스트림 PTM 분석을 통해 서쪽 오 점을 위해 그들을 준비 하는 최적화 된 워크플로 제공 됩니다.
현재 프로토콜 (즉, acetylation, 메 틸 화, 및 인 산화) 그들의 네이티브 posttranslational 수정 유지 하면서 코어 히스톤 단백질의 정화 수 있습니다. 그림 1 히스톤 정화 프로토콜의 타임 라인을 보여 줍니다.
프로토콜
모든 마우스는 습도 및 온도-제어, AAALAC 공인 동물 시설에서 대학 마이애미 밀러 의과대학에 보관 되어 있었다. 모든 실험 마이애미 밀러 학교의 약 기관 동물 관리 및 사용 위원회 (IACUC)의 대학에 의해 승인 되었고 NIH. 의 사양에 따라 실시
1입니다. 샘플 추출의 준비
-
부착 세포
- 적절 한 배양 (1 x 106 BV2, HEK 293, 그리고 SH-SY5Y, 하지만 기본 대뇌 피 질의 뉴런 등 1 차 셀에 대 한 접시 당 1015 셀 x ~ 1 등 셀 라인에 대 한 접시 당 1 x 109 셀에)에 10 cm 요리 접시 셀. 셀 똑같이 접시의 표면 전체에 배포 하 고 ~ 100% 합류 (37 ° C, 5% CO2)에 도달 하는 48 h에 대 한 성장 하는 세포를 허용 확신 합니다.
- 셀에 원하는 confluency에 도달 했습니다, 일단 부드럽게 발음 문화 미디어와 셀 2 세척 조직 문화 후드 prewarmed 혈 청 자유로운 미디어와 x.
- 접시에서 혈 청 자유로운 미디어를 발음 하 고 얼음 추출 버퍼의 1 mL을 추가 (0.4 M 황산, 1 m m KCl, 1 mM MgCl2, 50 mM Tris HCl [pH 8.0] 프로 테아 제 억제 물 칵테일 1) 각 접시.
- 플라스틱 셀 스 크레이 퍼를 사용 하 여 (된다고) 하 여 추출 버퍼에 있는 모든 셀을 수집 하 고 표시 1000 µ L 피 펫 튜브 1.5 mL를 그들을 전송. 피펫으로 세포 고 균질 화를 촉진 하기 위하여 3 배 아래로.
- 모든 튜브 닫고 즉시 얼음에 넣어.
-
뇌 조직
- 냉동된 조직 사용 되 고, 조직 prechilled 1.5 mL 튜브에 놓고 잠시 얼음에 녹여. 신선한 조직 사용 되 고, 경우 1.2.2 단계로 바로 진행 합니다.
참고: 현재 프로토콜 냉동된 쥐의 뇌와 전 두 엽 피 질 샘플을 마우스를 사용 하 여 프로시저를 설명 합니다. - 조직 추출 버퍼의 적절 한 금액 및 스트로크 (표 1)의 권장 되는 수를 사용 하 여 휴대용 Dounce 균질 화기를 사용 하 여 균질 과도 한 chromatin 분쇄를 방지 하려면 권장된 획 수를 초과 하지 마십시오.
- 단일 채널 1000 µ L 피 펫을 사용 하 여 prechilled 1.5 mL 튜브에는 homogenate 전송. 모든 튜브 닫고 즉시 얼음에 넣어.
- 냉동된 조직 사용 되 고, 조직 prechilled 1.5 mL 튜브에 놓고 잠시 얼음에 녹여. 신선한 조직 사용 되 고, 경우 1.2.2 단계로 바로 진행 합니다.
2입니다. 원유 히스톤 추출의 준비
- 포함 하는 셀 또는 회전 하는 플랫폼에 추출 버퍼에 조직 1.5 mL 튜브를 배치 하 고 원유 히스톤의 추출 수 있도록 4 ° C에서 15 rpm에 회전.
참고: 추출 시간이 다른 세포 및 조직에 대 한 다를 수 있습니다 및 각 절차에 대 한 최적화 해야 합니다. 현재 프로토콜 다음 15 분, 2 시간, 그리고 24 시간 추출 (그림 2, 그림 3, 그림 4및 그림 5)의 결과를 선물 한다. - 4 ° c microcentrifuge prechill 원하는 추출 시간이 지나면 원심 4 ° c.에서 10 분 동안 최대 속도로 튜브
- 상쾌한 새, prechilled 1.5 mL 튜브에 원유 히스톤을 포함 하 여 전송 합니다. 펠 릿을 삭제 합니다.
- -80 ° C에서 상쾌한 저장 (추출이이 단계에서 중지 될 수 있습니다 "중지 단계" 그림1에서 참조) 또는 즉시 다음 단계를 수행 하십시오.
- 중화 중화 버퍼 x 5 1/4 볼륨 원유 히스톤 (예를 들어, 원유 히스톤의 1 mL를 중화 버퍼 x 5의 250 µ L을 추가). 6 x 위아래로 pipetting으로 잘 섞는다.
- 산도 스트립으로 혼합물의 pH를 확인 하십시오. 그에 따라 조정 7의 pH에 도달 더 많은 중화 버퍼를 추가 하 여.
- 히스톤의 존재를 평가 하 고 원유 히스톤에 nonhistone 단백질 추출 다음과 같습니다 (그림 2).
- 4x (Laemmli) 샘플 버퍼의 12.5 µ L을 샘플의 37.5 µ L을 추가 하 고 99 ° c.에서 10 분 변성
- SDS 페이지 젤에 샘플을 로드 하 고 100 V에 1 시간을 위한 젤을 실행.
- 얼룩 Coomassie 화려한 블루 R-250 얼룩 솔루션과 하룻밤 젤 고 Coomassie 화려한 블루 R-250 destaining 솔루션으로 3 연속 세척 (1 h/워시) 동안 destain.
참고: 원유 히스톤 (그림 2)는 eluted 및 순화 된 히스톤 (즉, 열 입력 [그림 5A])와 비교할 수 있습니다.
3입니다. 코어 히스톤의 정화
-
스핀 열 평형
- 사용 되 고 각 회전 열 평형 버퍼의 500 µ L를 추가 합니다. 열 막을 만지지 마십시오.
- 800 x g에서 3 분 4 ° C에서 원심 분리기. 흐름을 통해 삭제 합니다. 1 x를 반복 합니다.
-
히스톤 정화
- 열 단계 2.6에서에서 관심의 샘플의 500 µ L를 추가 합니다. 800 x g에서 3 분 4 ° C에서 원심 분리기. 흐름 통해 수집 합니다.
- 열에 전체 샘플을 로드 하는 데 필요한 횟수 만큼 이전 단계를 반복 합니다. 스핀 열을 연극 하지 마십시오.
- 각 원심 분리 단계 열 바인딩 효율 (그림 3) 분석에서 흐름 통해 결합.
- 통해 열 흐름 분석에 2.7 단계를 따릅니다.
-
열 세척
- 각 열에 워시 버퍼의 500 µ L를 추가 합니다. 800 x g에서 3 분 4 ° C에서 원심 분리기. 흐름을 통해 세척 (세척 #1)를 수집 합니다.
- 3 세척 총 3.3.1 단계를 반복 합니다. 흐름을 통해 세척 # 2와 # 3를 수집 합니다. 세척 흐름을 통해 연속 열 풀 하지 않습니다.
- 추가 열의 히스톤 바인딩 효율성을 평가, 분석 (그림 4) 다음 단계 2.7 3 열 세척.
-
히스톤 차입
- 새로운 이라는 1.5 mL 튜브에 열을 전송 합니다.
- 히스톤 차입 버퍼의 50 µ L를 추가 합니다. 800 x g에서 3 분 4 ° C에서 원심 분리기. 흐름을 통해 포함 된 히스톤 단백질을 저장 합니다.
- 추가 차입에 대 한 단계 3.4.2 반복 합니다. 그들은 히스톤 수량 및 순도에 다는 첫 번째 및 두 번째 흐름을 통해 있다를 결합 하지 마십시오.
4입니다. 코어 히스톤의 강 수
- 4%의 최종 농도에 순화 된 히스톤과 염소 산 (PCA) 추가 PCA (예를 들어, 70%의 3 µ L 추가 단계 3.4.2에서에서 순화 된 히스톤의 50 µ L PCA.
- 3 원심 분리기 튜브 벽에서 모든 잔여 액체를 수집 하는 s. 6 x 위아래로 pipetting으로 혼합.
- 랙에서 튜브를 놓고 4 ° c.에 24 h에 대 한 품 어
- 다음 날, 4 ° C에 microcentrifuge prechill 및 4 ° c.에 최고 속도 75 분에 대 한 샘플을 원심
- 원심 분리를 완료 한 후 침전 된 히스톤을 포함 하는 작은 흰색 펠 렛 튜브의 아래쪽에 표시 됩니다. 샘플 소용돌이 하지 마십시오.
- 신중 하 게는 상쾌한 발음과, 500 µ L 얼음 4%의 추가 펠 렛을 방해 하지 않고 샘플을 PCA.
- 10 분 최대 속도에서 4 ° C에서 원심. 신중 하 게는 상쾌한 발음.
- 반복 단계 4.7 2 x.
- 펠 릿을 방해 하지 않고 얼음 아세톤의 500 µ L를 추가 합니다. 10 분 최대 속도에서 4 ° C에서 원심. 신중 하 게는 상쾌한 발음.
- 반복 단계 4.9 2 x.
- 신중 하 게는 상쾌한 발음, 세척제, 관 두고 30 분 검사에 대 한 얼음에 건조 하는 모든 잔여 아세톤이 증발 하는 경우 샘플을 허용.
- 튜브 세척제와 5 분 건조 실 온 (RT)에서 샘플을 수 있도록 둡니다.
- 메 마른 물 30 µ L에 펠 릿을 resuspend. 위쪽 및 아래쪽 피펫으로 하지 마십시오. 손가락으로 부드럽게 튜브를 터치 합니다.
- 모든 튜브 캡 고 히스톤 펠 릿 크기에 따라 30-50 분 동안 얼음에 다시 구성할 수 있습니다. 펠 릿 resuspended 경우 확인 하십시오.
- 모든 튜브 캡 고 추가 resuspend RT에 5 분 동안에 펠 릿을 허용 합니다.
참고:이 솔루션 (3.4.3 단계에서 첫 번째 및 두 번째 차입) 순화 하 고 desalted 히스톤의 구성 및 추가 정량화 및 histone acetylation 분석에 사용할 수 있습니다.
5입니다. Eluted 히스톤 단백질의 정량화
- 제조 업체의 프로토콜에 따라 분 광 광도 계를 사용 하 여 계량 4.15 단계에서 최종 차입 후 얻은 총 히스톤 단백질. 230에서 흡 광도 측정 nm. 핵 산 샘플 오염의 지표 A260/A280 비율을 기록 합니다.
- 히스톤 농도 (x)를 계산 하려면 다음 수식을 사용:
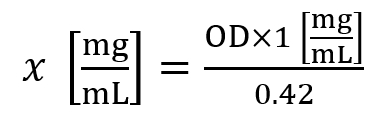
여기, OD A230 nm에서 측정 하는 광학 밀도입니다. - ~1.5 mg/mL의 히스톤 농도 ~5.0 mg/mL의 히스톤 농도가 30 mg의 조직에 대 한 평균 수율 간주 됩니다 동안 셀 라인에 대 한 평균 수익률을 간주 됩니다.
6. 서쪽 오 점 분석
- 히스톤 단백질/샘플의 µ g 4.15 ~ 10 단계에서에서 순화 하 고 eluted 히스톤을 조정 합니다.
- 물과 4 x Laemmli 샘플 버퍼 로드 볼륨을 조정 하려면 적절 한 볼륨을 추가 합니다.
- 99 ° c.에서 10 분에 대 한 샘플을 변성 얼음에 그들을 냉각 하십시오. 3 원심 분리기 튜브 벽에서 모든 잔여 액체 및 응축을 수집 하는 s.
- SDS 페이지 젤에 샘플을 로드 하 고 100 V에 1 시간을 위한 젤을 실행.
- 총 히스톤 단백질을 시각화 하기 위해 얼룩 Coomassie 화려한 블루 R-250 얼룩 솔루션과 하룻밤 젤 하 고 3 연속 세척 (1 h/워시) Coomassie 화려한 블루 R-250 destaining 솔루션 중 destain.
참고: 히스톤 단백질의 첫 번째 차입 되어 높은 품질 히스톤 (그림 5A) 두 번째 차입 히스톤 (그림 5B)의 아무 수준 낮은 포함 됩니다. - 히스톤 PTMs 계량 하려면 전송 시스템 ( 재료의 표참조) PVDF 막에 SDS 페이지 젤 (단계 6.4)에서 히스톤 단백질을 전송.
- 전송 샌드위치를, 전송 시스템 카세트 열고 향하도록 막 카세트의 바닥에 PVDF 막 스택 ( 하단 +로 표시)를 배치 합니다. 부드럽게 스택 사이에서 공기를 제거 하는 오 점 롤러와 멤브레인과 멤브레인을 롤.
- 막 위에 젤, 막 사이 있는 공기를 제거 하는 오 점 롤러로 부드럽게 젤 고 젤, 롤을 젤에 최고 스택 장소. 다시 부드럽게 롤과 샌드위치 위에 카세트 덮개, 단단히 눌러 놓고는 노브를 자물쇠를 시계 방향으로 돌려.
- 전송 시스템 슬롯에 카세트를 삽입 합니다. 장치 화면에 터보 프로토콜을 선택 합니다. 단일 미니 젤 또는 두 개 이상의 미니 젤에 대 일 분 프로토콜에 대 일 분 프로토콜을 사용 합니다.
- 막 5 분 Ponceau S 얼룩과 얼룩 하 고 총 히스톤 단백질을 시각화.
- Tris 버퍼 염 분 (TBS) 0.1% x 1에서 그들을 씻어 2 시간 및 블록 5%에 1 차 및 2 차 항 체로 1 헤 품에 대 한 우유에 대 한 트윈 20 (4 ° C 또는 RT에서 1 h에서 각각 하룻밤) 또는 이전 최적화 된 프로토콜.
참고: 현재 프로토콜, (그림 6 및 그림 7) acetylated 히스톤 H4K12에 대 한 항 체 및 H3K27에서 (그림 8) 사용 되었다.
결과
히스톤 정화 프로토콜의 진행 및 모든 분석된 분수의 구성 설명, 우리는 인간 microglial BV2 셀에서 다른 히스톤 추출 평가. 히스톤 H3 및 H4 PTMs (즉, acetylation)의 정량화를 보여, 우리는 뇌 조직 lysates 사용.
BV2 셀 10cm 조직 문화 취급 요리에 접시 당 5 x 106 셀에서 도금 되었고 48 헤에 대 한 confluency에 성장 셀 다음 수집, 히스톤 추출 버퍼 0.4 M를 포함 하는 인큐베이션 chromatin에서 발표 됐다 허용 황산, 1 m KCl m, 1 mM MgCl2, 50 mM Tris HCl (pH 8.0), 및 프로 테아 제 억제제 x 1. 추출 시간이 15 분 사이의 24 h Coomassie 화려한 블루 얼룩 (그림 2)에 의해 결정으로 원유 히스톤 추출의 전반적인 구성에 영향을 미치지 않았다. 다음, 원유 히스톤 equilibrated 히스톤 열 통과 했다 그리고 흐름을 통해 분석 했다. 고효율 열 바인딩은 흐름-통해 Coomassie 화려한 블루 얼룩에 의해 분석 하면 히스톤 단백질의 부재에 의해 결정 됩니다. 우리를 100%로 없습니다 감지 히스톤 단백질 분석 흐름-(그림 3) 통해에 처럼 열 바인딩 효율 결정. 바인딩된 히스톤과 모든 막 다음 워시 버퍼 실리 카 젤에 바인딩된 유일한 히스톤 단백질을 떠나 모든 나머지 불순물을 제거 하 세 번을 세척 했다. 우리 모든 히스톤 추출 (즉, 15 분, 2 시간, 그리고 24 시간) 시간에 대 한 첫 번째 막 세척 했다 가장 중요 한 두 번째 및 세 번째 세척 샘플 순도 영향을 주지 않았다 하는 동안 열에서 nonhistone 오염 제거, 결정 했다. 따라서, 샘플 유형에 따라 마지막 두 세척 생략 될 수 있습니다. (1 mM NaCl과 EDTA를 포함 하는 차입 버퍼를 사용 하 여) 열에서 히스톤 단백질의 첫 번째 차입에 따라 히스톤 했다 하룻밤 4%과 염소 산 시 켰 던 일지도, 그리고 순화 된 히스톤 H3의 농축에 대 한 분석 및 H4입니다. 추출 시간이 증가 순화 분수에 H3 및 H4 히스톤의 금액에 비해 15 분 (그림 5A) 추출 시간 2 h의 그 24 시간 관찰 합니다. 높은-품질 또는 높은 수량 히스톤 (그림 5B)는 열에서 두 번째 차입 발생 하지 않았다.
다음, 우리는 히스톤 H3 및 H4 PTMs, 즉 acetylation 척도를 뇌 조직 homogenates를 사용. 야생-타입 (C57BL6/J) 남성 생쥐 광범위 행동 관리 HDAC 억제제 (tributyrin) 3 d. 전체 뇌 조직에 대 한 구두 5 g/kg의 복용량은 하루에 4 수집과 원유 히스톤 설명된 프로토콜에 따라 추출 되었다. 짝이 없는 t를 사용 하 여-테스트, 우리는 그의 tributyrin 증가 원유 추출에서 히스톤의 acetylation 결정 (t(6) = 6.184, P = 0.0004); 그러나, 불순물 (히스톤 밴드는 명확 하 게 정의 되지) 추출 물에서 검색 됩니다. 따라서, H4K12ac 항 체는 높은 특이성 (그림 6)는 없습니다. 더 작은 조직 단면도를 제시 프로토콜의 적용 평가, 우리는 트리플 유전자 변형 알 츠 하이 머 병에서 전 두 엽 피 질을 수집 (3 안내 광고 x) 쥐 치료 매일 10 mg/kg M344, 클래스 I 및 IIb HDAC 억제제, 4 개월입니다. 히스톤 정화와 강 수는 여기 설명 된 프로토콜에 따라 수행 되었다. 순화 된 히스톤 H3 및 H4 분수를 사용 하 여, 우리 M344 증가 2.4-fold H4K12 acetylation 결정 (t(6) 13.03, P = 0.0001 <), H4K12ac 항 체 (그림 7)의 높은 특이성으로. 마찬가지로, 다른 HDAC 억제제, 즉는 선택적 HDAC3 억제제, RGFP-966 응답 BV2 셀에 히스톤 H3 acetylation 증가 관찰합니다. RGFP-966 원인의 10 µ M는 치료 후 24 h 히스톤 H3K27에서 acetylation의 약 두 증가. 학생의 짝이 없는 t-테스트 제어 대 치료 세포를 비교 하는 데 사용 되었다.
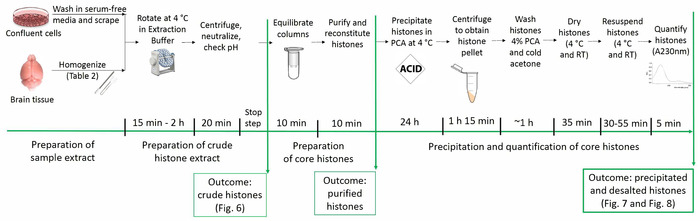
그림 1: 히스톤 정화 프로토콜 연대표. 히스톤 분석에 대 한 모든 단계는 각 단계에 필요한 예상된 시간 함께 아래 표시 됩니다. 특정 단계의 결과 묘사 하 고 원고 내 그림은 괄호에서 불린다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
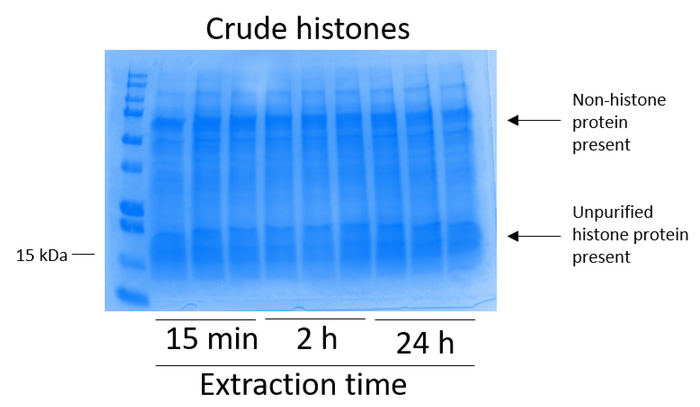
그림 2: BV2 세포에서 추출한 원유 히스톤을 보여주는 대표적인 스테인드 Coomassie 화려한 블루 젤. BV2 세포는 히스톤 추출 프로토콜을 시작 하기 전에 48 h에 대 한 교양 했다. 원유 히스톤 (이것은 또한 그림 3, 그림 4및 그림 5에 있는 경우) 각 시간 지점에 대해 3 복제와 15 분, 2 시간, 그리고 24 h에 대 한 추출 되었다. Nonhistone 및 히스톤 단백질은 히스톤 원유 추출 물에 존재 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
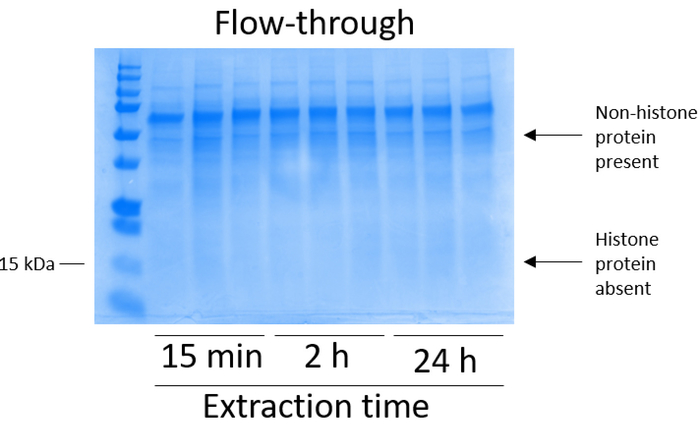
그림 3: BV2 셀에서 다음 히스톤 정화 흐름을 통해 열을 보여주는 대표적인 스테인드 Coomassie 화려한 블루 젤 단계. 히스톤 바인딩 열을 통과 하는 원유 히스톤, 다음만 nonhistone 단백질에 있습니다 통해 흐름. 히스톤 단백질은 결 석이 분수에. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
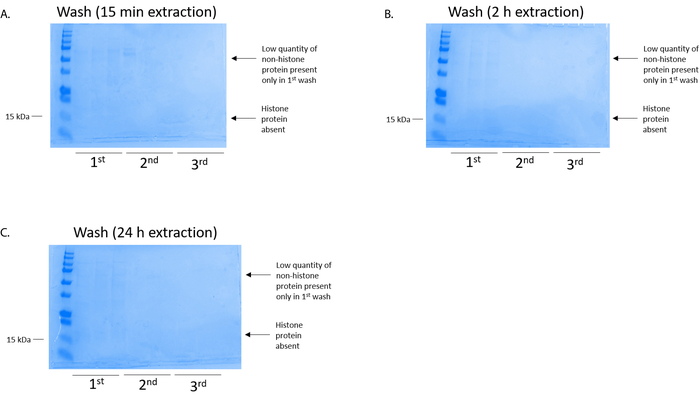
그림 4: 대표 시연 BV2 셀에서 히스톤 정화 단계를 다음 열 세척 얼룩진 Coomassie 화려한 블루 젤. 히스톤 추출 시간에는 (A) (B) 2 시간, 15 분 또는 (C) 24 h, nonhistone 단백질의 낮은 수량 했다 첫 번째 워시 histonebinding 열에만. 히스톤 단백질 결 석 했다 모든 세척에. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
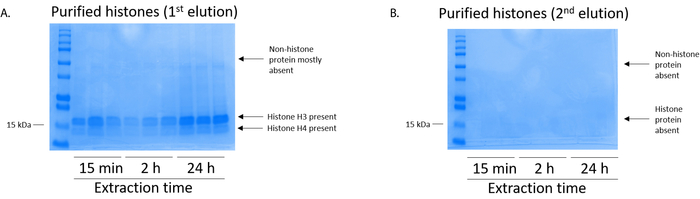
그림 5: elutions BV2 셀에서 히스톤 정화 단계를 다음을 보여 주는 대표적인 Coomassie 화려한 블루 스테인드 젤. (A) 높은-품질 정화 desalted 히스톤 H3 및 H4 히스톤 정화 열에서 첫 번째 차입 후 발견 된. 높은 품질 또는 수량 또는 H4 H3 히스톤의 (B) 두 번째 차입 히스톤 정화에서 열 생성 하지 않았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
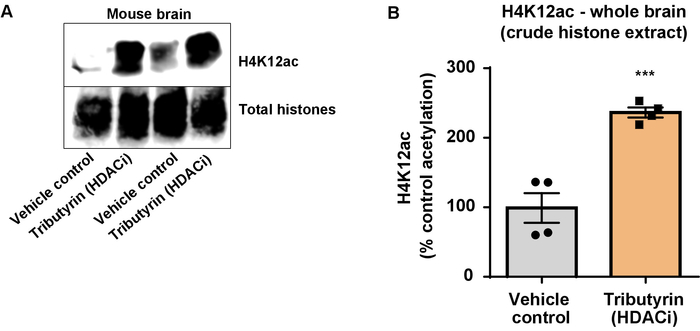
그림 6:는 광범위 하 게 행동 하는 HDAC 억제제, tributyrin, 증가 야생-타입 마우스의 전체 두뇌에 있는 H4K12 acetylation. (A)이이 패널 대표 서쪽 오 점 묘사 H4K12 acetylation 원유 히스톤에의 증가 추출 수집 된 표시에 광범위 하 게 행동 HDAC 야생-타입 마우스의 전체 두뇌에서 억제 물, tributyrin. (B)이이 패널 H4K12 acetylation vivo에서 증가의 정량화를 보여줍니다. 홀 t-테스트 그룹을 비교 하는 데 사용 되었다 (t(6) = 6.076, P = 0.0005). 막대는 평균 ±를 표준 오차 (SEM) 의미의를 나타냅니다. N = 8. P < 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
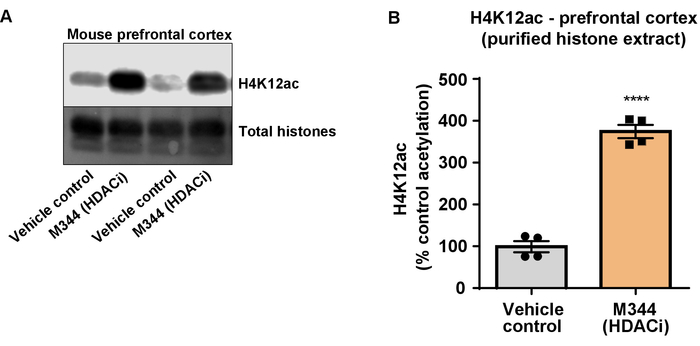
그림 7: 난 및 IIb HDAC 억제제, M344, 증가 트리플 유전자 변형 Alzheimer의 질병의 전 두 엽 피 질에서 H4K12 acetylation 클래스 (3 안내 광고 x) 쥐. (A)이이 패널 표시 대표 서쪽 H4K12 acetylation는 정제에서 증가 묘사한 오 점 및 desalted 히스톤 추출 물 M344 HDACs의 억제에 대 한 응답에서 안내 광고 마우스 x 3의 전 두 엽 피 질에서 수집한. (B)이이 패널 4 개월 동안 10 mg/kg의 매일 복용량에서 관리 하는 M344에 대 한 응답에서 H4K12 acetylation의 증가의 정량화를 보여줍니다. 홀 t-테스트 그룹을 비교 하는 데 사용 되었다 (t(6) 13.30, P = 0.0001 <). 바 대표 평균 ± SEM. N = 8. P < 0.00001. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
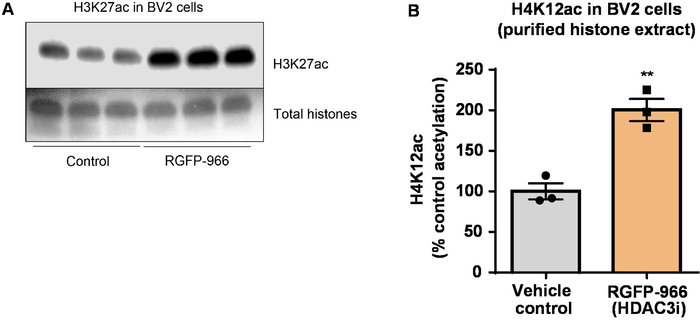
그림 8: 선택적 HDAC3 억제제, RGFP-966, 증가 H3K27 acetylation BV2 microglial 셀에. (A)이이 패널 표시 RGFP-966 여 HDAC3 저해에 대 한 응답에서 BV2 셀에서 수집 하는 대표적인 서쪽 오 점 H3K27 acetylation 순화 desalted 히스톤 추출에서의 증가 묘사 합니다. (B) RGFP-966 발생 한 acetylation 히스톤 H3 리 (K) 27 24 h 후 치료의 신에의 약 두 증가. 홀 t-테스트 제어 대 치료 세포를 비교 하는 데 사용 되었다 (t(4) = 5.981, P = 0.002). 바 대표 평균 ± SEM. N = 6. P < 0.01. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 대표 조직 (한 반구) * | 평균 조직 무게 (mg) | 추출 버퍼 (mL) | 스트로크 수 |
| 마우스 소 뇌 | 40 | 1 | 40 |
| 마우스 담당 | 30 | 0.3 | 20 |
| 마우스 마 | 27 | 0.3 | 18 |
| 마우스 entorhinal 외피 | 19 | 0.3 | 17 |
| * 모든 실험은 성인 남성 생쥐에 수행 했다. | |||
| 평균 나이: 16 개월. 평균 중량: 30 그램. | |||
표 1: 뇌 조직 균질에 대 한 최적화 된 상태.
토론
현재 작업에서 우리는 코어 히스톤 단백질을 순화 하 고 히스톤 H3 및 H4 PTMs (예를 들어, acetylation)을 계량 하는 최적화 된 방법 시연. 제시 프로토콜은 통합 하는 포괄적인 워크플로 최적화 셀 및 뇌 조직 준비, 원유 히스톤 정화, 그리고 상세한 히스톤 강수량, 차입 및 정량화, 뒤에 관한 절차 히스톤 전기 이동 법 그리고 강력한 히스톤 PTM 정량화입니다. 여기에 제공 된 내용의 다량 히스톤 샘플의 긴 조작에 대 한 필요에도 불구 하 고 높은-품질 데이터의 복제 가능 세대 수 있습니다.
많은 현재 게시 된 프로토콜 히스톤 H3 및 H419의 순수한 분수를 분리 하는 HPLC 사용을 해야 합니다. HPLC는 강력한 기술 이지만, 그 복잡성과 낮은 처리량 대부분의 분자 생물학 및 그것의 빈번한 사용에서 유추 억제. 실제로, HPLC는 많은 실험실을 사용할 수 없습니다 그리고 고도로 숙련 된 인력 악기를 작동 하는 데 필요한. HPLC는 자주 소모, 비싼, 그리고 잠재적으로 위험한. 여기에 제시 된 HPLC 무시는 비슷한 품질의 결과 달성 하는 저렴 한, 중간 처리 전략이 이다. 특수 악기 작업 능력을 필요로 하지 않는 간단한 스핀 열 접근 방식을 사용 하 여 보고 된 전략은 또한 더 실용적이 고 거의 모든 실험실에서 사용 하기에 적합. 또한, 히스톤 H3/H4 tetramer 단일, 순수, 그리고 풍부한 분수, 각 단백질에 보존된 PTMs의 신뢰할 수 있는 정량화 사용으로 추출 됩니다.
PTMs 산화 스트레스와 pH20,21에 변화에 변화에 매우 민감합니다. 따라서, 이전에 게시 방법18, 달리 우리 세포의 최소 변화 소요 보장 혈 청 구성 요소와 네이티브 PTMs의 간섭을 방지 하 고 혈 청 자유로운 미디어에 셀 rinsing의 효율적인 전략을 보고 합니다. 현재 프로토콜 뿐만 아니라 전통적인 핵 격리를 무시 하지만 또한 세포 세포의 용 해 및 핵 집계를 피하 면 서 핵의 보존에 대 한 수 있는 정확한 조직 균질 절차에 대 한 최적의 시간을 제공 합니다. 셀, 셀 형식을 사용, 조직의 크기, 등등의 수에 따라 추출 시간을 조작할 수 있습니다, 비록 확장된 세포 바람직하지 않다로 핵 DNA 자료, 샘플 처리 하기 어려운 하의 lysis로 이어질 수 있습니다. 중요 한 것은, 여러 검문소는 프로토콜 내에서 성공적인 히스톤 정화 (예를 들어, 단계 2.7와 3.2.3)의 유효성 검사에 대 한 존재합니다. 이 전략은 또한 긴 절차를 통해 문제 해결을 지원 합니다.
또 다른 중요 하 고 독특한 제시 프로토콜의 기능은 다운스트림 서쪽 오 점 분석 도구와 다른 사람 그것의 완전 한 호환성 원할 경우. 히스톤 단백질은 ~ 15 kDa13,,2223 에서 검색 되며, 마찬가지로 다른 작은 분자 무게 단백질에 입증 된 표준 immunoblotting 기법에 의해 감지 하는 도전. 최적 해상도 단백질 젤과 함께에서 높은 성능 및 높은 처리량 전송 시스템의 사용 (에 SDS의 부재) 단백질 네이티브 확인 및 SDS 및 높은 전송 효율의 부재에서 활동의 유지 보수에 대 한 허용 따라서 신뢰할 수 있는 히스톤 PTM 정량화를 확보는 낮은 분자량 히스톤 단백질의.
공개
저자는 공개 없다.
감사의 말
저자는 플로리다 학과의 건강에 드와 델 Moore 알츠하이머병 연구 프로그램 (보조금 6AZ08 및 7AZ26), NIH NIAAA (그랜트 5R01AA023781-03)와 미국 심장 협회 (그랜트 17PRE33660831) 그들의 감사를 표현 한다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | ThermoFiser Scientific | 05-408-129 | or equivalent from other sources |
| Sterile water | Gibco | 15-230-204 | or equivalent from other sources |
| 70% perchloric acid | Sigma Aldrich | 311421 | or equivalent from other sources |
| 100% acetone | Sigma Aldrich | 270725 | or equivalent from other sources |
| pH-indicator strips, non-bleeding | Milliipore Sigma | 1095310001 | |
| 4x SDS sample buffer | BIO-RAD | 161-0747 | |
| Benchtop rotor | Cole-Parmer | UX-04397-34 | or equivalent from other sources |
| 1.5 mL tube rack | ThermoFiser Scientific | 05-541 | or equivalent from other sources |
| Histone purification mini kit | Active Motif | 40026 | spin columns included in the kit |
| Protease Inhibitor Cocktail | ThermoFiser Scientific | 78430 | or equivalent from other sources |
| Nanodrop instrument | ThermoFiser Scientific | ND-2000 | |
| Tissue culture dishes | VWR | 10062-880 | required for histone extraction from cultured cells |
| Tissue culute media | varies based on cell line used | varies based on cell line used | required for histone extraction from cultured cells |
| Low-serum media | ThermoFiser Scientific | 51985091 | required for histone extraction from cultured cells |
| Plastic cell scraper | Falcon | 353086 | required for histone extraction from cultured cells |
| SDS-PAGE gradient gel | BIO-RAD | 456-9035 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Staining Solution | BIO-RAD | 1610436 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Destaining Solution | BIO-RAD | 1610438 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BIO-RAD | 1704156 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Transfer System | RIO-RAD | 1704150 | required for histone extraction from cultured cells |
| Ponceau S stain | CellSignalling | 59803S | required for histone extraction from cultured cells |
| Dounce homogenizer (size/cap sc 7mL) with a small size clearance | Kimble Chase | 885302-0007 | required for histone extraction from tissues |
| 100% bleach | Clorox | 68973 | required for histone extraction from tissues |
| H4K12ac antibody | Active Motif | 39166 | required for PTMs quantification via WB |
| H3K27ac antibody | Active Motif | 39134 | required for PTMs quantification via WB |
참고문헌
- Holliday, R. Is there an Epigenetic Component in Long-term Memory? Journal of Theoretical Biology. 200, 339-341 (1999).
- DeWoskin, V. A., Million, R. P. The epigenetics pipeline. Nature Reviews Drug Discovery. 12, 661-662 (2013).
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO Reports. 3, 224-229 (2002).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389, 349-352 (1997).
- Sartor, G. C., Powell, S. K., Brothers, S. P., Wahlestedt, C. Epigenetic Readers of Lysine Acetylation Regulate Cocaine-Induced Plasticity. The Journal of Neuroscience. 35, 15062-15072 (2015).
- Komatsu, N., et al. SAHA, a HDAC inhibitor, has profound anti-growth activity against non-small cell lung cancer cells. Oncology Reports. 15, 187-191 (2006).
- Bahari-Javan, S., Sananbenesi, F., Fischer, A. Histone-acetylation: a link between Alzheimer's disease and post-traumatic stress disorder. Frontiers in Neuroscience. 8, 160(2014).
- Roh, T. -Y., Cuddapah, S., Zhao, K. Active chromatin domains are defined by acetylation islands revealed by genome-wide mapping. Genes & Development. 19, 542-552 (2005).
- Mutskov, V., Felsenfeld, G. Silencing of transgene transcription precedes methylation of promoter DNA and histone H3 lysine 9. The EMBO Journal. 23, 138-149 (2004).
- Howe, L., Brown, C. E., Lechner, T., Workman, J. L. Histone acetyltransferase complexes and their link to transcription. Critical Reviews in Eukaryotic Gene Expression. 9, 231-243 (1999).
- Jenuwein, T., Allis, C. D. Translating the histone code. Science. 293, 1074-1080 (2001).
- Bowman, G. D., Poirier, M. G. Post-Translational Modifications of Histones That Influence Nucleosome Dynamics. Chemical Reviews. 115, 2274-2295 (2015).
- Volmar, C. -H., Wahlestedt, C. Histone deacetylases (HDACs) and brain function. Neuroepigenetics. 1, 20-27 (2015).
- Plagg, B., Ehrlich, D., Kniewallner, K. M., Marksteiner, J., Humpel, C. Increased Acetylation of Histone H4 at Lysine 12 (H4K12) in Monocytes of Transgenic Alzheimer's Mice and in Human Patients. Current Alzheimer Research. 12, 752-760 (2015).
- Bhaskara, S., et al. Hdac3 is essential for the maintenance of chromatin structure and genome stability. Cancer Cell. 18, 436-447 (2010).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone Deacetylase Inhibitors in Clinical Studies as Templates for New Anticancer Agents. Molecules. 20, 3898-3941 (2015).
- Ramakrishnan, S., et al. HDAC 1 and 6 modulate cell invasion and migration in clear cell renal cell carcinoma. BMC Cancer. 16, 617(2016).
- Wapenaar, H., Dekker, F. J. Histone acetyltransferases: challenges in targeting bi-substrate enzymes. Clinical Epigenetics. 8, 59(2016).
- Klinker, H., Haas, C., Harrer, N., Becker, P. B., Mueller-Planitz, F. Rapid Purification of Recombinant Histones. PLoS ONE. 9, e104029(2014).
- Chen, K., et al. Neurodegenerative Disease Proteinopathies Are Connected to Distinct Histone Post-translational Modification Landscapes. ACS Chemical Neuroscience. 9, 838-848 (2018).
- Simithy, J., Sidoli, S., Garcia, B. A. Integrating Proteomics and Targeted Metabolomics to Understand Global Changes in Histone Modifications. Proteomics. , e1700309 (2018).
- Volmar, C. -H., et al. An Epigenetic Approach for the Modulation of Amyloid Precursor Protein (APP) Processing and Improvement of Memory in Alzheimer's Disease. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. 40, S470(2015).
- Volmar, C. -H., et al. M344 promotes nonamyloidogenic amyloid precursor protein processing while normalizing Alzheimer’s disease genes and improving memory. Proceedings of the National Academy of Sciences. 114 (43), E9135-E9144 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유