Method Article
Reinigung des H3 und H4-Histon-Proteine und die Quantifizierung der acetylierte Histone Noten in Zellen und Hirngewebe
In diesem Artikel
Zusammenfassung
Der Zweck dieses Artikels ist es, eine umfassende, systematische Leitfaden für die effiziente Reinigung der Histone H3 und H4 und die Quantifizierung von Schimmelpilzschäden Histon-Rückständen.
Zusammenfassung
In allen Eukaryonten unbedingt Chromatin, die physiologische Vorlage alle genetischen Informationen, Vererbung. Chromatin ist abhängig von einer Reihe von unterschiedlichen posttranslationale Modifikationen (PTMs), die meist in die amino Termini von Histonproteine (d.h. Histon-Tail) auftreten und regulieren die Zugänglichkeit und Funktionszustand der zugrunde liegenden DNA. Histone Tails aus dem Kern der Nukleosom zu verlängern und die Zugabe von Acetyl-Gruppen von Histon-Acetyltransferases (Hüte) und die Beseitigung von Acetyl-Gruppen von Histon Deacetylases (HDACs) beim Zellwachstum und Differenzierung unterliegen. Spezifische Acetylierung Muster auf Lysin (K) Rückstände auf Histone Tails bestimmen eine dynamische Homöostase zwischen transcriptionally aktiv oder transcriptionally verdrängten Chromatin durch (1) Beeinflussung der Rumpfgruppe Histon und (2) recruiting synergistische oder antagonistische Chromatin-assoziierte Proteine auf die Transkription-Website. Der grundlegende Regulierungsmechanismus der komplexen Natur der Histon-Rute PTMs beeinflusst die Mehrheit der Chromatin-templated Prozesse und führt zu Veränderungen in Zelle Reifung und Differenzierung in der normalen und pathologischen Entwicklung. Der vorliegende Bericht soll Anfänger bieten eine effiziente Methode, Kern Histonproteine von Zellen und Hirngewebe zu reinigen und zu zuverlässig Acetylierung Markierungen auf Histone H3 und H4 quantifizieren.
Einleitung
Der Begriff Epigenetik bezieht sich auf vererbbare Veränderungen im Gen-Aktivität, die unabhängig von Veränderungen in der DNA-Sequenz1,2auftreten. Gentranskription und Unterdrückung werden bestimmt durch (1) die Zugänglichkeit der chromosomalen DNA umwickelt ein Octamer Kern-Histon-Proteine (zwei Exemplare jeder H2A, H2B, H3 und H4) und (2) die Verfügbarkeit von Transkriptionsfaktoren und Gerüst Proteine rekrutiert zu spezifischen Promotor Seiten3,4. Gentranskription wird durch Enzym-vermittelten Änderungen spezifischer DNA-Promotor-Standorte und das PTMs Histone Tails5,6,7geregelt. Die N-Termini der Histon H3 und H4 gehören die meisten hoch konservierten Sequenzen in Eukaryonten3bekannt, und ihre posttranslationale Modifikationen haben ausführlich dokumentiert, um eine zentrale Rolle bei der Bestimmung der Chromatinstruktur und 8,9funktionieren. PTMs an die Histone Tails (d.h., Acetylierung, Methylierung, Phosphorylierung und Ubiquitination) das Interaktion Potential der Enden zu ändern, beeinflussen den baulichen Zustand und Faltung der Chromatin Faser, und damit, regulieren DNA-Barrierefreiheit und Verarbeitung von4,10,11,12. Acetyl-Gruppen werden hinzugefügt und entfernt von K Rückstände auf Histone Tails durch eine Reihe von spezifischen Histon interagierende epigenetische Enzyme, nämlich Hüte und HDACs, bzw.13. Z. B. nachweislich die Acetylierung der Histone H4 an Lysin 12 (H4K12ac) zuvor die Transkription von Genen im Zusammenhang mit Speicher-Übernahme und Konsolidierung14aktivieren. Darüber hinaus empfehlen einige Linien des Beweises, dass die Enzym-vermittelten epigenetische Kontrolle der Gentranskription ein wesentlicher Aspekt der gesund-zelluläre Wachstum und Differenzierung6,15 ist. Wechsel in der epigenetischen Regulation der Genexpression durch epigenetische Modifikationen der DNA oder durch eine Mutation der epigenetischen Enzyme selbst nachweislich Dysregulated bei menschlichen Erkrankungen, wo Veränderungen in einem bestimmten Gen-Aktivität ein Markenzeichen ist die Pathologie (z.B. Krebs)6,16,17. Damit die Bewertung der Veränderungen beim Kern Histon PTMs entsteht als hochwertige Zielscheibe für mögliche therapeutische Interventionen. Jedoch wurde bestimmen die Fülle, Interaktionspartnern und bestimmte Rollen der Histone PTMs nachgewiesen herausfordernden18.
In dem vorliegenden Bericht wird eine optimierte, Medium-Durchsatz Strategie Core Histone von Zellen und Gehirn Gewebe in einem einzigen Bruchteil und ein vollständiges Protokoll für die Quantifizierung der Histone H3 und H4 PTMs reinigen beschrieben. Der Hinweis Obwohl derzeit veröffentlicht Säure-basierte Reinigungstechniken und Histon Antikörper-basierte Erkennung Strategien wurden für Histon Charakterisierung weithin angenommen, ihnen fehlen beschreibende Angaben wichtige Schritte des Verfahrens, so schnelle und reproduzierbare Histon-Extraktion und Quantifizierung zu behindern. Zum Beispiel die Verarbeitung von Zelle extrahieren und Gewebebiopsien erfordert verschiedene Tools und Technologien für die erfolgreiche Extraktion. Darüber hinaus zeigt das optimierte Protokoll präsentiert im aktuellen Manuskript einen praktischen, Medium-Durchsatz Ansatz. Core-Histone werden als einen einzigen, reinen Bruch extrahiert ermöglicht zuverlässige nachgelagerten Antikörper-vermittelten PTM Erkennung ohne Einmischung von Verunreinigungen. Darüber hinaus haben in der aktuellen Handschrift, die Herausforderungen in Bezug auf Histon-Erkennung durch ihre kleinen Molekulargewicht umgangen worden. In der Regel die mangelnde Kompatibilität zwischen Reinigung, Quantifizierung und Gel-Elektrophorese Protokolle hindern Wissenschaftler replizierbar und aussagekräftige Ergebnisse zu erhalten. Hier ist ein optimierter Workflow Core Histone von Zellen und Gewebe zu reinigen und bereiten sie für nachgeschaltete PTM Analysen über western-Blot präsentiert.
Das aktuelle Protokoll ermöglicht die Reinigung von Kern-Histon-Proteine unter Beibehaltung ihrer nativen posttranslationale Modifikationen (d.h., Acetylierung, Methylierung und Phosphorylierung). Abbildung 1 zeigt die Zeitleiste des Protokolls Histon-Reinigung.
Protokoll
Alle Mäuse wurden in eine feuchte und Temperatur-gesteuert, AAALAC-akkreditierten Tierhaus an der University of Miami Miller School of Medicine untergebracht. Alle Experimente wurden von der University of Miami Miller Schule von Medizin institutionelle Animal Care und Nutzung Committee (IACUC) genehmigt und durchgeführt nach Vorgaben des NIH.
1. Vorbereitung der Beispiel-Extrakt
-
Adhärente Zellen
- Platte Zellen in 10 cm-Gerichte in geeignete Kulturmedien (1 x 106 bis 1 x 109 Zellen pro Schale für Zell-Linien, wie BV2, HEK-293, und SH-SY5Y, aber ~ 1 x 1015 Zellen pro Schale für primäre Zellen, wie z. B. primären kortikalen Neuronen). Versichern Sie, dass die Zellen sich gleichmäßig auf der gesamten Oberfläche der Platte verteilen und die Zellen lassen wachsen für 48 h, ~ 100 % Zusammenfluss (37 ° C, 5 % CO2) zu erreichen.
- Wenn die Zellen die gewünschte Konfluenz erreicht haben, vorsichtig Aspirieren der Nährmedien und waschen die Zellen 2 X mit vorgewärmte serumfreie Medien unter einer Gewebekultur-Haube.
- Aspirieren serumfreie Medien aus der Schale und 1 mL eiskaltes Extraktionspuffer (0,4 M Schwefelsäure, 1 mM KCl, 1 mM MgCl2, 50 mM Tris-HCl [pH 8.0] und 1 x cocktail-Proteasehemmer) zu jedem Gericht.
- Verwenden Sie Schabeisen Kunststoff Zelle zu sammeln alle Zellen in dem Extraktionspuffer (durch Kratzen) und übertragen Sie sie auf eine 1,5 mL Röhrchen mit einer 1.000 µL Pipette beschriftet. Pipettieren der Zellen nach oben und unten 3 X Homogenisierung zu erleichtern.
- Schließen Sie alle Rohre und sofort auf Eis gelegt.
-
Hirngewebe
- Wenn gefrorenes Gewebe verwendet wird, legen Sie das Gewebe in der prechilled 1,5 mL Tube und tauen Sie es kurz auf Eis. Wenn frische Gewebe verwendet wird, gehen Sie sofort zum 1.2.2 Schritt.
Hinweis: Das aktuelle Protokoll beschreibt Verfahren mit gefrorenen Mäusegehirn und Maus präfrontalen Kortex Proben. - Homogenisieren des Gewebes mit einem handheld Dounce-Homogenisator mit der entsprechenden Menge an Extraktionspuffer und die empfohlene Anzahl von Strichen (Tabelle 1). Zur Vermeidung von übermäßigen Chromatin Zerkleinerung überschreiten Sie der empfohlene Hubzahl nicht.
- Mit einer einzigen Kanal 1.000 µL Pipette übertragen Sie das Homogenat zu einem prechilled 1,5 mL-Tube. Schließen Sie alle Rohre und sofort auf Eis gelegt.
- Wenn gefrorenes Gewebe verwendet wird, legen Sie das Gewebe in der prechilled 1,5 mL Tube und tauen Sie es kurz auf Eis. Wenn frische Gewebe verwendet wird, gehen Sie sofort zum 1.2.2 Schritt.
2. Vorbereitung der rohen Histon-Extrakt
- Legen Sie die 1,5 mL Röhrchen mit den Zellen oder Gewebe im Extraktionspuffer auf einer rotierenden Plattform ausgesetzt und bei 15 u/min bei 4 ° C ermöglicht die Gewinnung von Rohöl Histone drehen.
Hinweis: Die Extraktionszeit variieren für verschiedene Zell- und Gewebetypen und muss für jede Prozedur optimiert werden. Das aktuelle Protokoll präsentiert Ergebnisse nach 15 min, 2 h und 24 h der Extraktion (Abbildung 2, Abbildung 3, Abbildung 4und Abbildung 5). - Prechill Microcentrifuge bis 4 ° C. Nach Ablauf der gewünschten Extraktionszeit Zentrifugieren Sie die Rohre mit maximaler Geschwindigkeit für 10 min bei 4 ° C.
- Übertragen des Überstands einschließlich Rohöl Histone, eine neue, prechilled 1,5 mL-Tube. Entsorgen Sie das Pellet.
- Den Überstand bei-80 ° C zu speichern (die Extraktion kann an dieser Stelle gestoppt werden siehe "Stop Schritt" in Abbildung 1) oder sofort mit dem nächsten Schritt fortfahren.
- Neutralisieren der rohen Histone mit einem Volumen von 1/4 von 5 x Neutralisation Puffer (z.B.1 mL Rohöl Histone 250 µL 5 x Neutralisation Puffer hinzufügen). Mischen Sie gut durch nach oben und unten 6 X pipettieren.
- Überprüfen Sie den pH-Wert des Gemisches mit pH-Streifen. Passen Sie entsprechend durch Zugabe von mehr Neutralisation Puffer um einen pH-Wert von 7 zu erreichen.
- Das Vorhandensein von Histon bewerten und Nonhistone Protein in der rohen Histon extrahieren wie folgt (Abb. 2).
- 12,5 µL 4 x Probenpuffer (Laemmli) 37,5 µL der Probe hinzufügen und 10 Minuten bei 99 ° c denaturieren
- Laden Sie die Probe auf einem SDS-PAGE-Gel und führen Sie das Gel für 1 h bei 100 V.
- Das Gel über Nacht mit Coomassie Brilliant Blue R-250 Färbelösung zu beflecken und destain während drei aufeinander folgenden wäscht (1 h/Waschgang) mit Coomassie Brilliant Blue R-250 entfärben Lösung.
Hinweis: Grobe Histone (Abbildung 2) können mit eluierten und gereinigten Histone (d.h.Spalte Eingabe [Abbildung 5A]) verglichen werden.
3. Reinigung des Core-Histone
-
Spalte Gleichgewichtherstellung Spin
- Fügen Sie 500 µL Puffer Gleichgewichtherstellung zu jeder Spin-Spalte verwendet wird. Berühren Sie nicht die Spalte-Membran.
- Zentrifuge bei 4 ° C für 3 min bei 800 X g. Entsorgen Sie den Durchfluss. Wiederholen Sie 1 X.
-
Histon-Reinigung
- Die Spalte 500 µL der Probe von Interesse aus Schritt 2.6 hinzufügen. Zentrifuge bei 4 ° C für 3 min bei 800 X g. Die Flow-through zu sammeln.
- Wiederholen Sie den vorherigen Schritt so oft wie erforderlich, die gesamte Probe auf die Säule zu laden. Überfüllen Sie die Spin-Spalte nicht.
- Kombinieren Sie die Durchströmung von jedem Zentrifugationsschritt Spaltenbindung Effizienz (Abbildung 3) zu analysieren.
- Folgen Sie Schritt 2.7, die Spalte Durchströmung zu analysieren.
-
Spalte-Waschanlagen
- Jede Spalte 500 µL der Waschpuffer hinzufügen. Zentrifuge bei 4 ° C für 3 min bei 800 X g. Sammeln der durchströmten Wäsche (Waschen #1).
- Wiederholen Sie Schritt 3.3.1 für eine Gesamtmenge von drei Wäschen. Sammeln Sie durchströmten Waschungen #2 und #3. Bündeln Sie die aufeinander folgenden Spalte fließen-durch Waschungen nicht.
- Um die Spalte Histon-Bindung Effizienz weiter zu bewerten, analysieren Sie die drei Spalten Waschungen durch folgende Schritt 2.7 (Abbildung 4).
-
Histon-elution
- Übertragen Sie die Spalte in eine neue beschriftete 1,5 mL Tube.
- Fügen Sie 50 µL des Puffers Histon Elution. Zentrifuge bei 4 ° C für 3 min bei 800 X g. Speichern der durchströmten enthaltenden Histonproteine.
- Wiederholen Sie für eine zusätzliche Elution Schritt 3.4.2. Kombinieren Sie der ersten und zweiten durchströmten Eluate nicht, da sie in Histon-Menge und Reinheit unterscheiden.
4. die Ausfällung von Core-Histone
- Die gereinigten Histone, eine Endkonzentration von 4 % Perchlorsäure (PCA) hinzufügen PCA (z. B.hinzufügen 3 µL 70 % PCA zu 50 µL der gereinigten Histone aus Schritt 3.4.2.
- Zentrifuge für 3 s, alle Restflüssigkeit aus der Rohrwand zu sammeln. Mischen Sie, indem Sie nach oben und unten 6 X pipettieren.
- Legen Sie die Rohre in einem Rack und 24 h bei 4 ° c inkubieren
- Am nächsten Tag, einem Microcentrifuge bis 4 ° C prechill und Zentrifugieren Sie Proben für 75 min. bei maximaler Geschwindigkeit bei 4 ° C.
- Nach der Zentrifugation abgeschlossen ist, wird ein kleine weiße Pellet mit gefälltem Histone auf der Unterseite des Rohres sichtbar. Tun Sie nicht Strudel der Probenmaterials.
- Sorgfältig Aspirieren überstand und ohne zu stören das Pellet, fügen 500 µL eiskalte 4 % PCA zur Probe.
- Zentrifugieren Sie bei 4 ° C für 10 min bei maximaler Geschwindigkeit. Aspirieren Sie sorgfältig den überstand.
- Wiederholen Sie Schritt 2 4,7 X.
- Fügen Sie ohne zu stören das Pellet, 500 µL eiskaltem Aceton. Zentrifugieren Sie bei 4 ° C für 10 min bei maximaler Geschwindigkeit. Aspirieren Sie sorgfältig den überstand.
- Wiederholen Sie Schritt 4,9 2 X.
- Sorgfältig Aspirieren des Überstands, lassen Sie die Röhren verschlossen und ermöglichen die Probe auf Eis für 30 min. Check zu trocknen, wenn alle verbleibenden Aceton verdunstet ist.
- Lassen Sie die Röhren verschlossen und ermöglichen die Probe trocken bei Raumtemperatur (RT) für 5 min.
- Das Pellet in 30 µL steriles Wasser Aufschwemmen. Tun Sie nicht Pipettieren rauf und runter. Streichen Sie das Rohr vorsichtig mit einem Finger.
- Verschließen Sie alle Rohre und erlauben Sie die Histonen, für 30-50 min, abhängig von der Größe der Pellets auf Eis wiederherzustellen. Überprüfen Sie, ob das Pellet Nukleinsäuretablette ist.
- Verschließen Sie alle Rohre und ermöglichen Sie das Pellet, weiter bei RT 5 min aufzuwirbeln.
Hinweis: Diese Lösung (erste und zweite Elution von Schritt 3.4.3) besteht aus gereinigtem und entsalzten Histone und für weitere Quantifizierung und Histon Acetylierung Analyse verwendet werden.
(5) Quantifizierung der eluierten Histonproteine
- Verwenden Sie ein Spektralphotometer gemäß Protokoll des Herstellers, um die total Histonproteine erhalten, nachdem die endgültige Elution in Schritt 4.15 zu quantifizieren. Messung der Extinktion bei 230 nm. Bezeichnend für die Kontamination der Probe mit Nukleinsäure-A260/A280 Verhältnis aufzeichnen.
- Verwenden Sie die folgende Formel zur Berechnung der Histon-Konzentration (X):
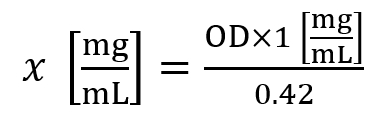
OD ist hier die optische Dichte bei A230 nm gemessen. - Eine Histon-Konzentration von ~1.5 mg/mL gilt eine Durchschnittsrendite für Zell-Linien, während eine Histon-Konzentration von ~5.0 mg/mL als eine Durchschnittsrendite von 30 mg des Gewebes gilt.
6. Western-Blot Analyse
- Passen Sie die gereinigten und eluierten Histon aus Schritt 4.15 bis ~ 10 µg Histon Protein/Probe.
- Fügen Sie das entsprechende Volumen von Wasser und 4 X Laemmli Probenpuffer laden Volumen einstellen.
- Denaturieren Sie die Proben 10 min bei 99 ° C. Kühlen sie auf Eis. Zentrifuge für 3 s, alle Restflüssigkeit und Kondensation von der Rohrwand zu sammeln.
- Laden Sie die Proben auf einem SDS-PAGE-Gel und führen Sie das Gel für 1 h bei 100 V.
- Um insgesamt Histon Protein zu visualisieren, das Gel über Nacht mit Coomassie Brilliant Blue R-250 Färbelösung zu beflecken und destain während drei aufeinander folgenden wäscht (1 h/Waschgang) mit Coomassie Brilliant Blue R-250 entfärben Lösung.
Hinweis: Der ersten Elution von Histonproteine enthält qualitativ hochwertige Histone (Abb. 5A), während die zweite Elution niedrig, um keine Ebenen der Histone (Abb. 5 b) enthält. - Zur Quantifizierung von Histon PTMs verwenden ein Transfersystem (siehe Tabelle der Materialien), die Histon-Proteine von der SDS-PAGE-Gel (Schritt 6.4) auf einer PVDF-Membran übertragen.
- Zur Montage der Transfer-Sandwich öffnen Sie die Transfer System Kassette und legen Sie PVDF Membran Stapel (gekennzeichnet als unten +) auf den Boden der Kassette mit der Membran nach oben. Rollen Sie die Membran vorsichtig mit einem Fleck Roller, alle Luft aus dem Stapel zu entfernen und die Membran.
- Legen Sie das Gel auf die Membran, Rollen Sie das Gel sanft mit einem Fleck Roller, keine Luft zwischen der Membran zu entfernen und das Gel und legen Sie den oberen Stapel auf das Gel. Rollen sanft wieder und legen Sie die Kassettenabdeckung auf das Sandwich, fest nach unten drücken und drehen der Nob zu sperren.
- Legen Sie die Kassette in den Transfer-System-Steckplatz. Wählen Sie im Fenster Geräte Turbo-Protokoll. Verwenden Sie ein 3 min-Protokoll für ein einziges Mini-Gel oder eine 7 min-Protokoll für mehr als zwei Mini-Gele.
- Färben Sie die Membran mit Ponceau S Fleck für 5 min und visualisieren Sie die gesamte Histonproteine.
- Waschen Sie sie 1 x Tris gepufferte Kochsalzlösung (TBS) mit 0,1 % Tween 20 für 2 h und Block in 5 % für 1 h Inkubation mit primären und sekundären Antikörper Milch (über Nacht bei 4 ° C oder 1 h bei RT, beziehungsweise) oder nach einem zuvor optimiertes Protokoll.
Hinweis: In der aktuellen Protokoll, Antikörper gegen acetylierte Histone H4K12 (Abbildung 6 und Abbildung 7) und H3K27 (Abbildung 8) dienten.
Ergebnisse
Um das Fortschreiten der Histon-Reinigung-Protokoll und die Zusammensetzung aller analysierten Fraktionen zu veranschaulichen, haben wir verschiedene Histon Auszüge aus menschlichen Mikroglia BV2 Zellen ausgewertet. Um die Quantifizierung der Histone H3 und H4 PTMs (d.h. Acetylierung) zu demonstrieren, haben wir Gehirn Gewebe Lysates verwendet.
BV2 Zellen waren vergoldet 5 x 106 Zellen pro Schale 10 cm Gewebekultur-behandelten Gerichte und erlaubte es zu Konfluenz für 48 h wachsen Zellen wurden dann gesammelt und Histone erschienen von Chromatin durch eine Inkubation im Extraktionspuffer mit 0,4 M Schwefelsäure, 1 mM KCl 1 mM MgCl2, 50 mM Tris-HCl (pH 8,0) und 1 x Protease-Inhibitor. Die Extraktionszeit von 15 min bis 24 h, hatte keinen Einfluss auf die Gesamtkomposition des rohen Histon Extrakte von Coomassie Brilliant Blue Färbung (Abbildung 2). Nächste, rohen Histone waren äquilibriert Histon Spalten durchlaufen und der Durchfluss wurde analysiert. Spaltenbindung hocheffiziente richtet sich nach der Abwesenheit von Histon Protein in die Durchströmung von Coomassie Brilliant Blue Färbung analysiert. Wir entschlossen die Spaltenbindung Effizienz zu 100 % sein, da gab es keine nachweisbaren Histonproteine vorhanden in den analysierten durchströmten (Abbildung 3). Alle Membranen mit gebundenen Histone wurden dann drei Mal mit Waschpuffer restlichen Verunreinigungen, verlassen nur Histonproteine verpflichtet das Silica-Gel entfernen gewaschen. Wir festgestellt, dass für alle Histon-Extraktion Zeit (d. h., 15 min, 2 h und 24 h), die erste Membran-Wäsche das wichtigste war, Nonhistone Verunreinigungen aus den Spalten zu entfernen, während der zweiten und dritten Wäschen keinen auf die Reinheit der Probe Einfluss. So könnte je nach Probentyp, die letzten zwei Wäschen weggelassen werden. Nach der ersten Elution von Histon-Proteine aus der Spalte (mit Elution Puffer mit 1mM NaCl und EDTA), Histone wurden über Nacht mit 4 % Perchlorsäure ausgefällt dann pelleted, gewaschen und zur Bereicherung der gereinigten Histone H3 analysiert und H4. Wir haben beobachtet, dass 24 Stunden nach der Extraktion Zeit erhöht sich die Menge der H3 und H4 Histone in der gereinigten Fraktion auf 15 min und 2 h Extraktionszeit (Abbildung 5A) verglichen. Die zweite Elution aus der Spalte ergab sich nicht in hoher Qualität oder hohe Menge Histone (Abb. 5 b).
Als nächstes haben wir Gehirn Gewebe Homogenates um Histon H3 und H4 PTMs, nämlich Acetylierung zu quantifizieren. Wildtyp (C57BL6/J) männliche Mäuse wurden verabreicht ein breit wirkenden HDAC-Inhibitor (Tributyrin) in einer Dosis von 5 g/kg oral für 3 d. ganzen Gehirn Gewebe war am 4. Tag gesammelt und roh Histone wurden nach dem beschriebenen Protokoll extrahiert. Mit einem ungepaarten t-Test, wir entschlossen, dass Tributyrin erhöht die Acetylierung der Histone im Rohöl Extrakt (t(6) = 6.184, P = 0,0004); jedoch werden Verunreinigungen im Extrakt erkannt (die Histon-Bänder sind nicht klar definiert). H4K12ac Antikörper muss also keine hohe Spezifität (Abbildung 6). Um die Anwendbarkeit des vorgestellten Protokolls zum kleineren Gewebeschnitte weiter zu bewerten, haben wir den präfrontalen Cortex von Dreifach transgenen Alzheimer-Krankheit erfasst (3 x Tg-AD) behandelten Mäuse täglich mit 10 mg/kg M344, eine Klasse ich und IIb HDAC-Inhibitor, für vier Personen Monaten. Histon-Reinigung und Niederschlag erfolgte gemäß der hierin beschriebenen Protokoll. Mit dem gereinigten Histon H3 und H4 Bruchteil, wir festgestellt, dass M344 H4K12 Acetylierung 2.4-fold erhöht (t(6) = 13.03, P < 0,0001), mit einer hohen Spezifität der H4K12ac Antikörper (Abbildung 7). In ähnlicher Weise, beobachteten wir eine Zunahme der Histon H3 Acetylierung in BV2 Zellen als Reaktion auf eine weitere HDAC-Inhibitor, nämlich der selektiven HDAC3 Inhibitor, RGFP-966. 10 µM RGFP-966 Ursachen eine ca. Verdoppelung der Acetylierung auf Histon H3K27 nach 24 Stunden der Behandlung. Student der ungepaarten t-Test wurde verwendet, um gegen behandelt Kontrollzellen vergleichen.
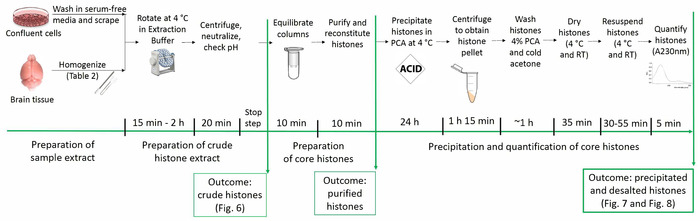
Abbildung 1: Timeline des Protokolls Reinigung Histon. Alle Schritte zur Histon Analysen sehen Sie unten zusammen mit der geschätzte Zeitaufwand für jeden Schritt. Figuren zeigt das Ergebnis von bestimmten Schritten und innerhalb der Handschrift vorgestellt werden in Klammern bezeichnet. Bitte klicken Sie hier für eine größere Version dieser Figur.
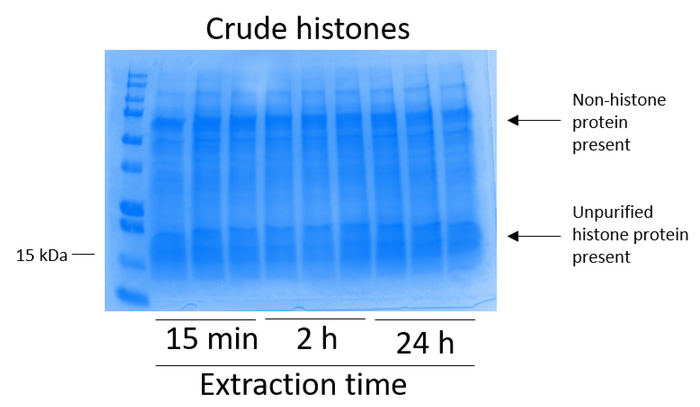
Abbildung 2: repräsentative Coomassie Brilliant blau gefärbt Gel zeigt grobe Histone BV2 Zellen entnommen. BV2 Zellen waren für 48 h kultiviert, bevor das Histon-Extraktion-Protokoll begann. Grobe Histone wurden extrahiert für 15 min, 2 h und 24 h, mit drei Wiederholungen für jeden Zeitpunkt (Dies ist auch der Fall in Abbildung 3, Abbildung 4und Abbildung 5). Nonhistone und Histon-Proteine sind in der rohen Histon-Extrakt. Bitte klicken Sie hier für eine größere Version dieser Figur.
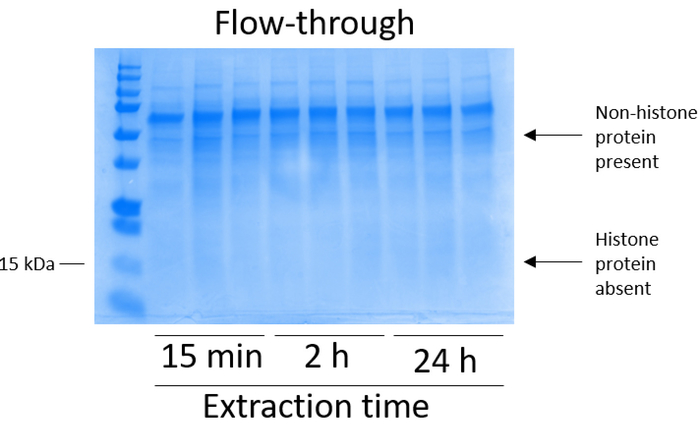
Abbildung 3: repräsentative Coomassie Brilliant blau gefärbt Gel demonstrieren Spalte fließen-durch folgende Histon Reinigung Schritte vom BV2 Zellen. Nach Rohöl Histon passieren der Histon-Bindung-Spalte sind nur Nonhistone Proteine in den durchströmten. Histonproteine fehlen in dieser Fraktion. Bitte klicken Sie hier für eine größere Version dieser Figur.
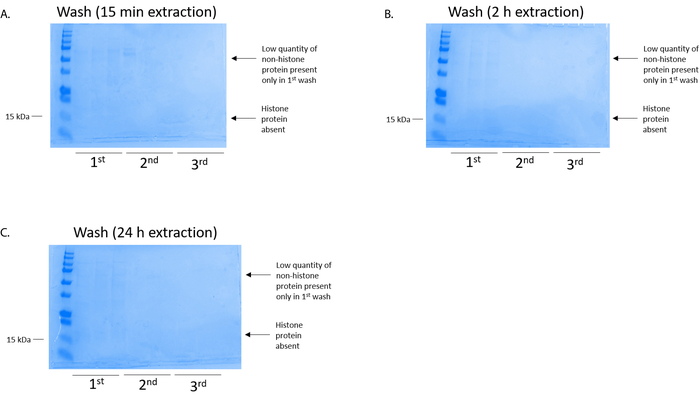
Abbildung 4: Vertreter zeigen eine Spalte Waschen nach einem Histon Reinigungsstufe aus BV2 Zellen Coomassie Brilliant blau gefärbt Gel. Unabhängig von der Histon-Extraktion waren oder (C) 24 h, geringe Mengen von Nonhistone Proteinen (A) (B) 2 h 15 min waren nur in der ersten Wäsche Histonebinding Spalte. Histonproteine fehlten in allen Waschungen. Bitte klicken Sie hier für eine größere Version dieser Figur.
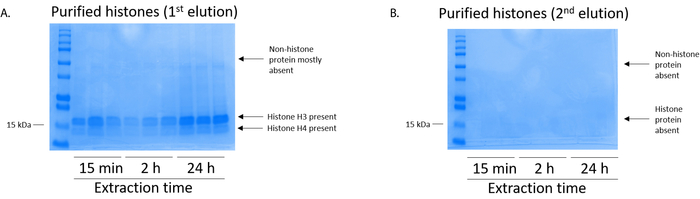
Abbildung 5: repräsentative Coomassie Brilliant blau gefärbt Gel Elutions nach einem Histon Reinigungsstufe aus BV2 Zellen demonstriert. (A) qualitativ hochwertige gereinigt und entsalzt Histon H3 und H4 wurden nach der ersten Elution aus der Histon-Reinigung-Spalte. (B) die zweite Elution von Histon-Reinigung-Säule eine hohe Qualität oder Quantität der Histone H3 oder H4 nicht nachgeben. Bitte klicken Sie hier für eine größere Version dieser Figur.
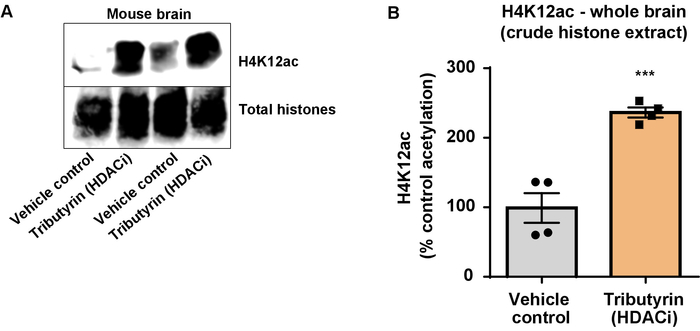
Abbildung 6: die breit wirkenden HDAC Inhibitor, Tributyrin, H4K12 Acetylierung in das ganze Gehirn von Wildtyp Mäusen erhöht. (A) dieses Panel zeigt einem Vertreter westlichen Fleck zeigt eine Erhöhung der H4K12 Acetylierung in der rohen Histon extrahieren abgeholt das ganze Gehirn von Wildtyp Mäusen als Reaktion auf die im großen und ganzen Schauspiel HDAC-Inhibitor, Tributyrin. (B) dieses Panel zeigt die Quantifizierung des Zuwachses im H4K12 Acetylierung in Vivo. Ungepaarten t-Test wurde verwendet, um Gruppen zu vergleichen (t(6) = 6.076, P = 0,0005). Die Balken repräsentieren den Mittelwert ± Standardfehler des Mittelwertes (SEM). N = 8. P < 0,0001. Bitte klicken Sie hier für eine größere Version dieser Figur.
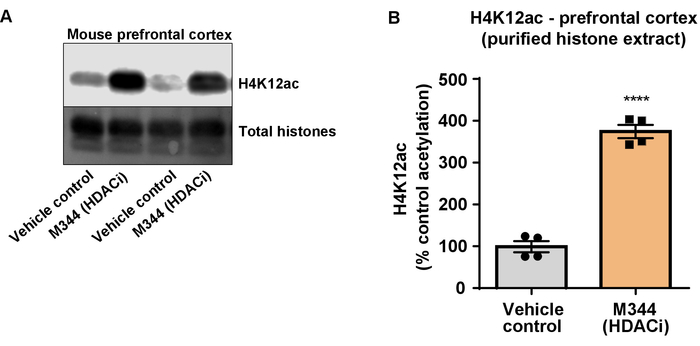
Abbildung 7: die Klasse ich und IIb HDAC-Inhibitor, M344, erhöht H4K12 Acetylierung im präfrontalen Kortex der Dreifach transgenen Alzheimer-Krankheit (3 x Tg-AD) Mäuse. (A) dieses Panel zeigt einem Vertreter western blot mit einem Anstieg von H4K12 Acetylierung in den gereinigten und entsalzten Histon-Extrakt aus der präfrontale Kortex von 3 x Tg-AD Mäuse als Reaktion auf die Hemmung der HDACs von M344 gesammelt. (B) zeigt dieses Fenster die Quantifizierung des Anstiegs der H4K12 Acetylierung als Reaktion auf M344 für vier Monate bei einer täglichen Dosis von 10 mg/kg verabreicht. Ungepaarten t-Test wurde verwendet, um Gruppen zu vergleichen (t(6) = 13.30, P < 0,0001). Die Balken repräsentieren den Mittelwert ± SEM N = 8. P < 0.00001. Bitte klicken Sie hier für eine größere Version dieser Figur.
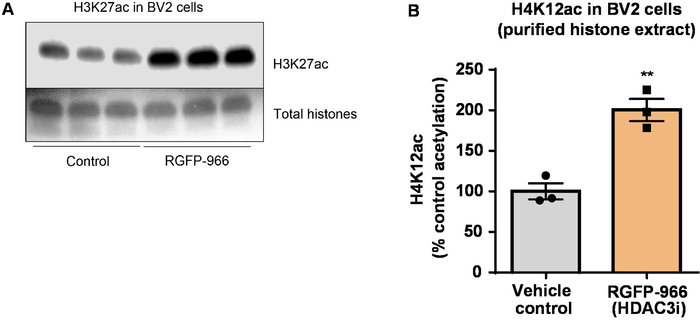
Abbildung 8: die selektive HDAC3-Hemmer, RGFP-966, erhöht H3K27 Acetylierung in BV2 Microglial Zellen. (A) dieses Panel zeigt eine repräsentative western-Blot Darstellung eine Erhöhung der H3K27 Acetylierung in den gereinigten und entsalzten Histon-Extrakt aus BV2 Zellen als Reaktion auf die HDAC3 Hemmung von RGFP-966 gesammelt. (B) RGFP-966 führt ein ca. Verdoppelung der Acetylierung Histon H3 und Lysin (K) 27 nach 24 Stunden der Behandlung. Ungepaarten t-Test wurde verwendet, um gegen behandelt Kontrollzellen vergleichen (t(4) = 5.981, P = 0,002). Die Balken repräsentieren den Mittelwert ± SEM N = 6. P < 0,01. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Repräsentative Gewebe (eine Hemisphäre) * | Durchschnittliche Gewebe Gewicht (mg) | Extraktionspuffer (mL) | Anzahl der Hübe |
| Maus Kleinhirn | 40 | 1 | 40 |
| Frontalen Kortex Maus | 30 | 0,3 | 20 |
| Maus-hippocampus | 27 | 0,3 | 18 |
| Maus entorhinalen Kortex | 19 | 0,3 | 17 |
| * Alle Experimente wurden an erwachsenen männlichen Mäusen durchgeführt. | |||
| Durchschnittliches Alter: 16 Monate. Durchschnittliches Gewicht: 30 Gramm. | |||
Tabelle 1: Optimierte Voraussetzung für Gehirn Gewebe Homogenisierung.
Diskussion
Bei den laufenden Arbeiten haben wir eine optimierte Methode zum Kern-Histon-Proteine zu reinigen und zu quantifizieren, Histon H3 und H4 PTMs (z.B. Acetylierung) gezeigt. Die vorgestellte Protokoll ist ein umfassender Workflow, der enthält optimierte Verfahren in Bezug auf Zellen und Gehirn Gewebe Vorbereitung, grobe Histon Reinigung und detaillierte Histon Niederschlag, Elution und Quantifizierung, gefolgt sind Histon-Elektrophorese und robuste Histon PTM Quantifizierung. Die große Menge an Details, die hier zur Verfügung gestellten ermöglicht eine reproduzierbare Generation qualitativ hochwertige Daten, trotz des Bedarfs an langen Manipulationen der Histon-Proben.
Viele derzeit veröffentlichten Protokolle erfordern den Einsatz von HPLC, sortenreine Fraktionen der Histone H3 und H419zu isolieren. Obwohl HPLC eine leistungsstarke Technik ist, abschrecken der Komplexität und der niedrigen Durchsatz die meisten Molekularbiologen und unverständliche von seiner häufigen Verwendung. In der Tat HPLC ist nicht zur Verfügung, um viele Labore und hoch qualifiziertem Personal benötigt, um das Gerät zu betreiben. HPLC ist oft zeitaufwendig, teuer und potenziell gefährlich. Präsentiert hier ist eine preiswerte, Medium-Durchsatz Strategie, um Ergebnisse von ähnlicher Qualität erzielen, die HPLC umgeht. Die gemeldeten Strategie ist auch praktisch und geeignet für den Einsatz in fast jedem Labor, da sie einen einfache Drehung Spalte Ansatz verwendet, der keine spezielle Instrument Betrieb Fähigkeiten erfordert. Darüber hinaus wird Histon H3/H4 Tetramer als einen einzigen, reinen, und reichlich Bruchteil, ermöglicht eine zuverlässige Quantifizierung der erhaltenen PTMs auf jedem der Proteine extrahiert.
PTMs reagieren extrem empfindlich auf Änderungen in oxidativen Stress und Veränderungen im pH-Wert20,21. So berichten wir im Gegensatz zu den zuvor veröffentlichten Methoden18, eine wirksame Strategie der Spülung der Zellen in serumfreien Medien, eine minimale metabolische Störung der Zellen zu gewährleisten und die Einmischung der native PTMs mit Serumkomponenten zu vermeiden. Das aktuelle Protokoll nicht nur umgeht die traditionellen Kerne Isolation, sondern bietet auch optimale Zeiten für Zelle lyse und die genaue Gewebe Homogenisierung-Prozedur, die für die Erhaltung der Kernhülle unter Vermeidung nuklearer Aggregation ermöglicht. Obwohl die Extraktionszeit manipuliert werden kann, basierend auf der Anzahl von Zellen, der Zelltyp verwendet, Gewebe-Größe, etc.ist erweiterte Lyse nicht wünschenswert, da es zu der Lyse der Kerne und der DNA-Release, machen die Probe schwierig zu handhaben führen kann. Wichtig ist, gibt es mehrere Kontrollpunkte innerhalb des Protokolls für die Validierung der erfolgreichen Histon-Reinigung (z.B. Schritte 2.7 und 3.2.3). Diese Strategie ermöglicht auch Fehlersuche während des langwierigen Verfahrens.
Eine weitere wichtige und einzigartige Funktion des vorliegenden Protokolls ist seine volle Kompatibilität mit nachgeschalteten western-Blot-Analyse-Tools und andere, falls gewünscht. Histonproteine werden bei ~ 15 kDa13,22,23 erkannt und ebenso zu anderen kleinen Molekulargewicht Proteinen nachgewiesen anspruchsvollen standard Immunoblotting Techniken erkennen. Die Verwendung eines High-Performance und Hochdurchsatz-Transfersystems in Kombination mit optimalen Auflösung Protein Gele ermöglicht die Aufrechterhaltung der Protein native Bestätigung (in Abwesenheit von SDS) und Aktivität in der Abwesenheit von SDS und hoher Auftragswirkungsgrad der niedermolekularen Histon-Proteine, somit gewährleisten eine zuverlässige Histon-PTM-Quantifizierung.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken ihre Florida Department of Health Ed und Ethel Moore Alzheimer Research Program (Zuschüsse 6AZ08 und 7AZ26), der NIH-NIAAA (Grant 5R01AA023781-03) und der American Heart Association (Grant 17PRE33660831).
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | ThermoFiser Scientific | 05-408-129 | or equivalent from other sources |
| Sterile water | Gibco | 15-230-204 | or equivalent from other sources |
| 70% perchloric acid | Sigma Aldrich | 311421 | or equivalent from other sources |
| 100% acetone | Sigma Aldrich | 270725 | or equivalent from other sources |
| pH-indicator strips, non-bleeding | Milliipore Sigma | 1095310001 | |
| 4x SDS sample buffer | BIO-RAD | 161-0747 | |
| Benchtop rotor | Cole-Parmer | UX-04397-34 | or equivalent from other sources |
| 1.5 mL tube rack | ThermoFiser Scientific | 05-541 | or equivalent from other sources |
| Histone purification mini kit | Active Motif | 40026 | spin columns included in the kit |
| Protease Inhibitor Cocktail | ThermoFiser Scientific | 78430 | or equivalent from other sources |
| Nanodrop instrument | ThermoFiser Scientific | ND-2000 | |
| Tissue culture dishes | VWR | 10062-880 | required for histone extraction from cultured cells |
| Tissue culute media | varies based on cell line used | varies based on cell line used | required for histone extraction from cultured cells |
| Low-serum media | ThermoFiser Scientific | 51985091 | required for histone extraction from cultured cells |
| Plastic cell scraper | Falcon | 353086 | required for histone extraction from cultured cells |
| SDS-PAGE gradient gel | BIO-RAD | 456-9035 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Staining Solution | BIO-RAD | 1610436 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Destaining Solution | BIO-RAD | 1610438 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BIO-RAD | 1704156 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Transfer System | RIO-RAD | 1704150 | required for histone extraction from cultured cells |
| Ponceau S stain | CellSignalling | 59803S | required for histone extraction from cultured cells |
| Dounce homogenizer (size/cap sc 7mL) with a small size clearance | Kimble Chase | 885302-0007 | required for histone extraction from tissues |
| 100% bleach | Clorox | 68973 | required for histone extraction from tissues |
| H4K12ac antibody | Active Motif | 39166 | required for PTMs quantification via WB |
| H3K27ac antibody | Active Motif | 39134 | required for PTMs quantification via WB |
Referenzen
- Holliday, R. Is there an Epigenetic Component in Long-term Memory?. Journal of Theoretical Biology. 200, 339-341 (1999).
- DeWoskin, V. A., Million, R. P. The epigenetics pipeline. Nature Reviews Drug Discovery. 12, 661-662 (2013).
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO Reports. 3, 224-229 (2002).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389, 349-352 (1997).
- Sartor, G. C., Powell, S. K., Brothers, S. P., Wahlestedt, C. Epigenetic Readers of Lysine Acetylation Regulate Cocaine-Induced Plasticity. The Journal of Neuroscience. 35, 15062-15072 (2015).
- Komatsu, N., et al. SAHA, a HDAC inhibitor, has profound anti-growth activity against non-small cell lung cancer cells. Oncology Reports. 15, 187-191 (2006).
- Bahari-Javan, S., Sananbenesi, F., Fischer, A. Histone-acetylation: a link between Alzheimer's disease and post-traumatic stress disorder. Frontiers in Neuroscience. 8, 160 (2014).
- Roh, T. -. Y., Cuddapah, S., Zhao, K. Active chromatin domains are defined by acetylation islands revealed by genome-wide mapping. Genes & Development. 19, 542-552 (2005).
- Mutskov, V., Felsenfeld, G. Silencing of transgene transcription precedes methylation of promoter DNA and histone H3 lysine 9. The EMBO Journal. 23, 138-149 (2004).
- Howe, L., Brown, C. E., Lechner, T., Workman, J. L. Histone acetyltransferase complexes and their link to transcription. Critical Reviews in Eukaryotic Gene Expression. 9, 231-243 (1999).
- Jenuwein, T., Allis, C. D. Translating the histone code. Science. 293, 1074-1080 (2001).
- Bowman, G. D., Poirier, M. G. Post-Translational Modifications of Histones That Influence Nucleosome Dynamics. Chemical Reviews. 115, 2274-2295 (2015).
- Volmar, C. -. H., Wahlestedt, C. Histone deacetylases (HDACs) and brain function. Neuroepigenetics. 1, 20-27 (2015).
- Plagg, B., Ehrlich, D., Kniewallner, K. M., Marksteiner, J., Humpel, C. Increased Acetylation of Histone H4 at Lysine 12 (H4K12) in Monocytes of Transgenic Alzheimer's Mice and in Human Patients. Current Alzheimer Research. 12, 752-760 (2015).
- Bhaskara, S., et al. Hdac3 is essential for the maintenance of chromatin structure and genome stability. Cancer Cell. 18, 436-447 (2010).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone Deacetylase Inhibitors in Clinical Studies as Templates for New Anticancer Agents. Molecules. 20, 3898-3941 (2015).
- Ramakrishnan, S., et al. HDAC 1 and 6 modulate cell invasion and migration in clear cell renal cell carcinoma. BMC Cancer. 16, 617 (2016).
- Wapenaar, H., Dekker, F. J. Histone acetyltransferases: challenges in targeting bi-substrate enzymes. Clinical Epigenetics. 8, 59 (2016).
- Klinker, H., Haas, C., Harrer, N., Becker, P. B., Mueller-Planitz, F. Rapid Purification of Recombinant Histones. PLoS ONE. 9, e104029 (2014).
- Chen, K., et al. Neurodegenerative Disease Proteinopathies Are Connected to Distinct Histone Post-translational Modification Landscapes. ACS Chemical Neuroscience. 9, 838-848 (2018).
- Simithy, J., Sidoli, S., Garcia, B. A. Integrating Proteomics and Targeted Metabolomics to Understand Global Changes in Histone Modifications. Proteomics. , (2018).
- Volmar, C. -. H., et al. An Epigenetic Approach for the Modulation of Amyloid Precursor Protein (APP) Processing and Improvement of Memory in Alzheimer's Disease. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. 40, S470 (2015).
- Volmar, C. -. H., et al. M344 promotes nonamyloidogenic amyloid precursor protein processing while normalizing Alzheimer’s disease genes and improving memory. Proceedings of the National Academy of Sciences. 114 (43), E9135-E9144 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten