Method Article
Purificação de H3 e H4 histona proteínas e a quantificação do Histone acetilado marcas em células e tecidos cerebrais
Neste Artigo
Resumo
O objetivo deste artigo é fornecer um guia abrangente, sistemático para a purificação eficiente das histonas H3 e H4 e quantificação dos resíduos de histona acetilado.
Resumo
Em todos os organismos eucarióticos, cromatina, o modelo fisiológico da informação genética de tudo, é essencial para a hereditariedade. Cromatina está sujeita a uma matriz de diversas modificações posttranslational (PTMs) que geralmente ocorrem da termini amino de proteínas histonas (ou seja, cauda de histona) e regulam a acessibilidade e o estado funcional do DNA subjacente. Caudas de histona estendem do núcleo do nucleossoma e estão sujeitos a adição de grupos acetila por histona acetiltransferases (chapéus) e a remoção de grupos acetila por histona deacetilases (HDACs) durante o crescimento celular e diferenciação. Padrões específicos de acetilação em resíduos de lisina (K) nas caudas de histona determinar uma homeostase dinâmica entre cromatina transcricionalmente ativa ou transcricionalmente reprimida por (1) influenciando o conjunto do núcleo de histona e (2) recrutamento sinérgico ou antagônicas proteínas da cromatina associada ao site da transcrição. O mecanismo regulador fundamental da natureza complexa da cauda do histone PTMs influencia a maioria dos processos de cromatina-modelo e resulta em alterações na maturação da célula e diferenciação no desenvolvimento normal e patológico. O objetivo do relatório atual é fornecer um método eficiente para purificar as proteínas de histona do núcleo das células e tecidos cerebrais e confiantemente quantificar marcas de acetilação de histonas H3 e H4 noviços.
Introdução
A termo epigenética refere-se a alterações hereditárias na atividade do gene que ocorrem independentemente de mudanças no DNA sequência1,2. Repressão e a transcrição do Gene são determinadas por (1) a acessibilidade do DNA cromossômico envolvido em torno de um octamer de proteínas histonas de núcleo (duas cópias de cada H2A, H2B, H3 e H4) e (2) a disponibilidade de fatores de transcrição e proteínas do andaime recrutados para promotor específico sites3,4. Transcrição do gene é regulada pela enzima mediada por modificações de sites específicos de promotor de DNA e as PTMs de caudas de histona a5,6,7. O N-termini de histona H3 e H4 estão entre as sequências mais altamente conservadas conhecidas em organismos eucarióticos3, e suas modificações posttranslational foram documentadas extensivamente para jogar um papel central na determinação da estrutura da cromatina e função8,9. PTMs nas caudas de histona (i.e., acetilação, metilação, fosforilação e ubiquitination) alterar o potencial de interação das caudas, influenciam o estado estrutural e dobramento da fibra de cromatina e, assim, regulam a acessibilidade de DNA e4,10,11,12de processamento. Grupos acetila são adicionados ao e removidos do K resíduos nas caudas de histona por um conjunto de histona-interagindo epigenéticas enzimas específicas, ou seja, chapéus e HDACs, respectivamente13. Por exemplo, a acetilação da histona H4 em lisina 12 (H4K12ac) tem demonstrada anteriormente para ativar a transcrição de genes relacionados com a memória de aquisição e consolidação de14. Além disso, várias linhas de evidências sugerem que o controle epigenético mediada por enzimas de transcrição do gene é um aspecto crucial da saudável celular crescimento e diferenciação6,15. Alternância na regulação epigenética da expressão do gene, modificações epigenéticas do DNA ou por uma mutação das enzimas epigenéticas, foi mostrada para ser prejudicado em doenças humanas, onde a mudança em uma atividade de determinado gene é uma marca registrada a patologia (por exemplo, câncer)6,16,17. Assim, a avaliação das alterações na histona núcleo PTMs está emergindo como um alvo de alto valor para possíveis intervenções terapêuticas. No entanto, determinar a abundância, parceiros de interação e funções específicas de histonas PTMs comprovou desafiador18.
No relatório atual, é descrita uma estratégia otimizada, o rendimento médio para purificar histones do núcleo das células e tecidos do cérebro em uma única fração e um protocolo completo para a quantificação das histonas H3 e H4 PTMs. Digno de nota, embora atualmente publicado à base de ácido baseados em anticorpo histona deteção estratégias e técnicas de purificação foram amplamente adoptadas para caracterização de histona, falta-lhes detalhes descritivos sobre etapas críticas do processo, assim dificultando a quantificação e extração de histona rápida e replicável. Por exemplo, extrair o processamento de célula e biópsias do tecido requer diferentes ferramentas e tecnologias para a extração de sucesso. Além disso, o protocolo otimizado apresentado no manuscrito atual demonstra uma abordagem prática, médio-taxa de transferência. Histones do núcleo são extraídos como uma fração simples, pura, que permite confiável a jusante mediada por anticorpos PTM detecção sem qualquer interferência de impurezas. Além disso, no manuscrito atual, os desafios em matéria de deteção de histona devido ao seu pequeno peso molecular tem sido contornados. Normalmente, a falta de compatibilidade entre a purificação, quantificação e os protocolos da electroforese do gel de impedir os cientistas obter resultados conclusivos e replicáveis. Aqui, apresenta-se um fluxo de trabalho otimizado para purificar histones do núcleo das células e tecidos e prepará-los para jusante PTM análises através de borrão ocidental.
O protocolo atual permite a purificação de proteínas de histona núcleo preservando suas modificações posttranslational nativas (ou seja, acetilação, metilação e fosforilação). Figura 1 descreve o cronograma do protocolo de purificação de histona.
Protocolo
Todos os ratos foram alojados em uma umidade e temperatura-controlado, acreditados AAALAC animal instalação da Universidade de Miami Miller School of Medicine. Todos os experimentos foram aprovados pela Universidade de Miami Miller School de medicina institucional Cuidado Animal e Comissão de utilização (IACUC) e conduzidos de acordo com especificações de NIH.
1. preparação da amostra de extracto
-
Células aderentes
- Células de placa em pratos de 10 cm nos meios de cultura apropriados (1 x 106 a 1 x 109 células por prato para linhas de celular, como BV2, HEK-293 e SH-SY5Y, mas ~ 1 x 1015 células por prato para as células primárias, tais como os neurônios corticais primárias). Assegura que as células são igualmente distribuídas em toda a superfície da placa e permitem que as células a crescer durante 48 h alcançar a confluência de ~ 100% (37 ° C, 5% CO2).
- Uma vez que as células chegaram a confluência desejada, delicadamente aspirar os meios de cultura e lavar as células 2 x com escaldadas mídia livre de soro sob uma capa de cultura de tecidos.
- Aspire o media serum-free do prato e adicionar 1 mL de tampão de extração gelada (ácido sulfúrico de 0,4 M, 1 mM KCl, 1 mM MgCl2, 50 mM Tris-HCl [pH 8.0] e 1 x coquetel de inibidor de protease) para cada prato.
- Use uma espátula de plástico celular para coletar todas as células no buffer de extração (raspando) e transferi-los para um 1,5 mL rotulado tubo com uma pipeta de 1.000 µ l. Pipetar as células acima e abaixo de 3 x para facilitar a homogeneização.
- Feche todos os tubos e imediatamente colocá-los no gelo.
-
Tecido cerebral
- Se estiver sendo usado tecido congelado, coloque o tecido em um tubo de prechilled 1,5 mL e derretê-lo brevemente no gelo. Se estiver sendo usado tecido fresco, dirijam-se para a etapa 1.2.2.
Nota: O atual protocolo descreve procedimentos usando o cérebro de rato congelado e amostras do córtex pré-frontal do mouse. - Homogeneizar o tecido usando um homogeneizador de homogenizacao portátil usando a quantidade adequada de solução tampão e o número recomendado de traços (tabela 1). Para evitar a fragmentação excessiva da cromatina, não exceda o número de traços recomendados.
- Com uma único canal 1.000 µ l pipeta, transfira o homogeneizado para um tubo de prechilled 1,5 mL. Feche todos os tubos e imediatamente colocá-los no gelo.
- Se estiver sendo usado tecido congelado, coloque o tecido em um tubo de prechilled 1,5 mL e derretê-lo brevemente no gelo. Se estiver sendo usado tecido fresco, dirijam-se para a etapa 1.2.2.
2. preparação do extrato bruto de histona
- Coloque os tubos de 1,5 mL contendo as células ou tecidos suspendido em solução tampão em uma plataforma giratória e girar a 15 rpm a 4 ° C, para permitir a extração das histonas brutas.
Nota: O tempo de extração pode variar para diferente tipos de célula e tecido e deve ser otimizado para cada procedimento. O protocolo atual apresenta os resultados obtidos após 15 min, 2 h e 24 h de extração (Figura 2, Figura 3, Figura 4e Figura 5). - Prechill o microcentrifuge para 4 ° C. Depois que passou o tempo de extração desejada, centrifugar os tubos na velocidade máxima durante 10 minutos a 4 ° C.
- Transferi o sobrenadante, incluindo as histonas brutas para um tubo novo, prechilled 1,5 mL. Descarte a pelota.
- Armazenar o sobrenadante a-80 ° C (a extração pode ser interrompida a este passo, consulte "Passo de parada", na Figura 1) ou imediatamente prosseguir para a próxima etapa.
- Neutralizar as histonas brutas com um volume de 1/4 de 5x buffer de neutralização (por exemplo, adicionar 250 µ l de 5x buffer de neutralização a 1 mL de histonas brutas). Misture bem por pipetagem e descer 6 x.
- Verifica o pH da mistura com tiras de pH. Ajustar de acordo com a adição de buffer de neutralização mais para chegar a um pH de 7.
- Avaliar a presença de histona e proteína de HMG4L2 na histona bruto extrair da seguinte forma (Figura 2).
- Adicionar 37,5 µ l da amostra a 12,5 µ l de tampão de amostra (Laemmli) de 4x e desnaturar por 10 min a 99 ° C.
- Carregar a amostra em um gel de SDS-PAGE e funcione o gel durante 1 h a 100 V.
- Manchar o gel durante a noite com a solução de coloração azul brilhante de Coomassie R-250 e destain durante três lavagens consecutivas (1 h/lavagem) com solução de azul de Coomassie brilhante R-250 descoloração.
Nota: Histonas brutas (Figura 2) podem ser comparadas com histonas eluted e purificadas (ou seja, entrada de coluna [Figura 5A]).
3. purificação dos Histones do núcleo
-
Equilíbrio da coluna de rotação
- Adicione 500 µ l de tampão de equilíbrio para cada coluna de rotação sendo usada. Não toque na membrana da coluna.
- Centrifugar a 4 ° C por 3 min a 800 x g. Descarte o escoamento. Repita 1 x.
-
Purificação de histona
- Adicione 500 µ l da amostra de interesse da etapa 2.6 para a coluna. Centrifugar a 4 ° C por 3 min a 800 x g. Colete o escoamento.
- Repita o passo anterior quantas vezes forem necessárias para carregar a amostra inteira na coluna. Não encha demais a coluna de rotação.
- Combine o fluxo através de cada etapa de centrifugação para analisar a eficiência da ligação de coluna (Figura 3).
- Siga o passo 2.7 para analisar a coluna de passagem.
-
Lavagem de coluna
- Adicione 500 µ l de tampão de lavagem a cada coluna. Centrifugar a 4 ° C por 3 min a 800 x g. Colete a escoamento e lavagem (lavagem #1).
- Repita a etapa 3.3.1 para um total de três lavagens. Colete as escoamento lavagens #2 e #3. Não juntar as coluna consecutivos escoamento lavagens.
- Para avaliar mais eficiência de histona-ligação da coluna, analise as lavagens de três colunas a seguir passo 2.7 (Figura 4).
-
Eluição de histona
- Transferi a coluna para um novo tubo rotulado de 1,5 mL.
- Adicione 50 µ l de tampão de eluição da histona. Centrifugar a 4 ° C por 3 min a 800 x g. Salve as proteínas escoamento contendo histona.
- Para uma eluição adicional, repita a etapa 3.4.2. Não combine os primeiros e segundo passagem eluídos como eles diferem em pureza e quantidade de histona.
4. precipitação de Histones do núcleo
- Adicionar o ácido perclórico (PCA) para as histonas purificadas para uma concentração final de 4% PCA (por exemplo, adicionar 3 µ l de 70% PCA de 50 µ l de histonas purificadas da etapa 3.4.2.
- Centrífuga para 3 s para coletar todo o líquido residual da parede do tubo. Misture por pipetagem e descer 6 x.
- Coloque os tubos em um rack e incubar por 24 h a 4 ° C.
- No dia seguinte, prechill microcentrifuga a 4 ° C e centrifugar as amostras para 75 min na velocidade máxima a 4 ° C.
- Após a centrifugação é completa, um pequeno sedimento branco contendo precipitadas histonas será visível na parte inferior do tubo. Fazer não o vórtice da amostra.
- Cuidadosamente, aspirar o sobrenadante e, sem perturbar a pelota, adicionar 500 µ l de gelado 4% PCA para a amostra.
- Centrifugar a 4 ° C por 10 min na velocidade máxima. Aspire cuidadosamente o sobrenadante.
- Repita a etapa 4,7 2 x.
- Sem perturbar o sedimento, adicione 500 µ l de acetona gelada. Centrifugar a 4 ° C por 10 min na velocidade máxima. Aspire cuidadosamente o sobrenadante.
- Repita a etapa 4,9 2 x.
- Aspirar o sobrenadante cuidadosamente, deixar os tubos estreantes e permitir que a amostra secar no gelo por 30 min. cheque se evaporou-se toda acetona residual.
- Deixe os tubos estreantes e permitir que a amostra secar à temperatura ambiente (RT) por 5 min.
- Resuspenda o pellet em 30 µ l de água estéril. Fazer não Pipetar para cima e para baixo. Agite o tubo delicadamente com um dedo.
- Todos os tubos do tampão e permitir que as histonas reconstituir no gelo por 30-50 min, dependendo do tamanho da pelota. Verifique se a pelota é resuspended.
- Todos os tubos do tampão e permitir a pelota para mais Resuspenda em RT por 5 min.
Nota: Esta solução (primeira e segunda eluição da etapa 3.4.3) é constituída de histonas purificadas e demolhadas e pode ser utilizada para uma quantificação e histona acetilação análise mais aprofundada.
5. quantificação das proteínas Eluted de histona
- Use um Espectrofotômetro de acordo com o protocolo do fabricante para quantificar as proteínas histonas total obtidas após a eluição final na etapa 4.15. Medir a absorvância a 230 nm. Grave a relação A260/A280 indicativa da contaminação da amostra com ácido nucleico.
- Use a seguinte fórmula para calcular a concentração de histona (x):
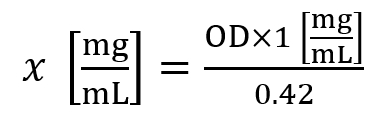
Aqui, o OD é a densidade óptica medida a A230 nm. - Uma concentração de histona de ~1.5 mg/mL é considerada um rendimento médio para linhas de celular, enquanto uma concentração de histona de ~5.0 mg/mL é considerada um rendimento médio de 30 mg de tecido.
6. Western Blot Analysis
- Ajuste o histona purificado e eluted de passo 4.15 a ~ 10 µ g de proteína/amostra de histona.
- Adicione o volume adequado de água e 4 amortecedor da amostra x Laemmli para ajustar os volumes de carga.
- Desnaturar as amostras por 10 min a 99 ° C. Resfriá-los no gelo. Centrífuga para 3 s para coletar todo o líquido residual e condensação da parede do tubo.
- Carregar as amostras em um gel de SDS-PAGE e funcione o gel durante 1 h a 100 V.
- Para visualizar a proteína total do histone, manchar o gel durante a noite com a solução de coloração azul brilhante de Coomassie R-250 e destain durante três lavagens consecutivas (1 h/lavagem) com solução de azul de Coomassie brilhante R-250 descoloração.
Nota: A primeira eluição das proteínas histonas contém alta qualidade histonas (Figura 5A) enquanto a segunda eluição contém baixa a nenhum nível de histonas (Figura 5B). - Para quantificar PTMs de histona, use um sistema de transferência (consulte a Tabela de materiais) para transferir a proteína histona de gel SDS-PAGE (etapa 6.4) para uma membrana PVDF.
- Para montar o sanduíche de transferência, abrir a gaveta do sistema de transferência e coloque a pilha de membrana PVDF (rotulada como fundo +) na parte inferior da fita com a membrana voltada para cima. Rolo a membrana suavemente com um rolo de borrão para remover todo o ar entre a pilha e a membrana.
- Colocar o gel em cima da membrana, o gel suavemente com um rolo de borrão para remover todo o ar entre a membrana e o gel do rolo e coloque a pilha superior sobre o gel. Rolar suavemente novamente e coloque a tampa da gaveta em cima do sanduíche, pressione firmemente para baixo e rode o nob para bloqueio.
- Insira a fita para o slot do sistema de transferência. Na tela do aparelho, selecione Protocolo Turbo. Use um protocolo de 3 min para um único mini gel ou um protocolo de 7 min para mais de dois mini geles.
- Manchar a membrana com mancha de Ponceau S por 5 min e visualizar as proteínas histonas total.
- Lave-os com 1 x salino Tris (TBS) com 0,1% Tween 20 por 2h e bloco-los em 5% do leite por 1 h. Incubar com anticorpo primário e secundário (durante a noite a 4 ° C ou 1 h no RT, respectivamente) ou de acordo com um protocolo previamente otimizado.
Nota: no protocolo atual, anticorpos contra histonas acetilados H4K12 (Figura 6 e Figura 7) e H3K27 (Figura 8) foram utilizados.
Resultados
Para ilustrar a progressão do protocolo de purificação de histona e composição de todas as frações analisadas, avaliamos histona diferentes extratos de células humanas microglial BV2. Para demonstrar a quantificação das histonas H3 e H4 PTMs (ou seja, acetilação), usamos lysates do tecido cerebral.
BV2 células foram banhadas em 5 x 106 células por prato em pratos de cultura de tecido-Tratado de 10cm e permitiu a crescer a confluência de 48 h. células foram então reunidas, e histonas foram lançadas a partir da cromatina por uma incubação em solução tampão contendo 0,4 M ácido sulfúrico, 1 mM KCl, 1 mM MgCl2, 50 mM Tris-HCl (pH 8.0) e 1 x inibidor da protease. O tempo de extração, entre 15 min e 24 h, não afetou a composição global dos extratos de histona bruto conforme determinado pelo Coomassie brilhante azul coloração (Figura 2). Próximo, brutas histonas foram passadas através das colunas de histona equilibrado e a passagem foi analisado. Alta eficiência de ligação de coluna é determinada pela ausência de proteína histona na passagem quando analisados pela coloração azul de Coomassie brilhante. Determinamos a eficiência da ligação de coluna para ser 100% como haviam sem proteínas histonas detectáveis presentes no analisados de passagem (Figura 3). Todas as membranas com histonas acopladas então foram lavadas três vezes com tampão de lavagem para eliminar as impurezas restantes, deixando proteínas histonas única vinculadas a sílica gel. Determinamos que, para a extração de histona todas as vezes (ou seja, 15 min, 2 h e 24 h), a primeira lavagem de membrana era o mais importante remover contaminações HMG4L2 as colunas, enquanto as segunda e terceiros lavagens não influenciou a pureza da amostra. Assim, dependendo do tipo de amostra, as duas últimas lavagens podem ser omitidas. Após a primeira eluição da proteína histona da coluna (usando o tampão de eluição contendo 1mM NaCl e EDTA), histonas foram precipitadas durante a noite com ácido perclórico de 4% peletizadas, lavadas e analisadas para o enriquecimento das histonas purificadas H3 e H4. Observamos que 24 h de extração tempo aumenta a quantidade de histonas H3 e H4 na fração purificada em comparação com 15 min e 2h de tempo de extração (Figura 5A). A segunda eluição da coluna não resultou em alta qualidade ou elevado-quantidade histonas (Figura 5B).
Em seguida, nós costumávamos homogenates do tecido de cérebro para quantificar histona H3 e H4 PTMs, nomeadamente de acetilação. Tipo-selvagem (C57BL6/J) camundongos machos foram administrados um amplamente agindo inibidor HDAC (tributyrin) na dose de 5 g/kg por via oral durante 3 tecido d. todo-cérebro foi coletado no dia 4 e histonas brutas foram extraídas de acordo com o protocolo descrito. Usando um unpaired t-teste, determinamos que tributyrin aumenta a acetilação de histonas no extrato bruto (t(6) = 6.184, P = 0,0004); no entanto, as impurezas são detectadas no extrato (bandas de histona não estão claramente definidas). Assim, o anticorpo H4K12ac não tem uma alta especificidade (Figura 6). Para ainda mais avaliar a aplicabilidade do protocolo apresentado para seções menores do tecido, recolhemos o córtex pré-frontal tripla transgénicos a doença de Alzheimer (3 x Tg-AD) ratos tratadocom diariamente com 10 mg/kg M344, uma classe I e inibidor IIb HDAC, para quatro meses. Precipitação e purificação de histona foi realizada de acordo com o protocolo descrito neste documento. Usando o purificado histona H3 e H4 fração, determinamos que M344 aumenta a acetilação de H4K12 2.4-fold (t(6) = 13.03, P < 0,0001), com uma alta especificidade do anticorpo H4K12ac (Figura 7). Da mesma forma, observamos um aumento na acetilação da histona H3 em BV2 células em resposta a outro inibidor HDAC, nomeadamente o HDAC3 inibidor seletivo, RGFP-966. 10 µM da RGFP-966 causas um aumento de aproximadamente dupla de acetilação na histona H3K27 após 24 h de tratamento. Estudante é unpaired t-teste foi utilizado para comparar células de controle contra o Tratado.
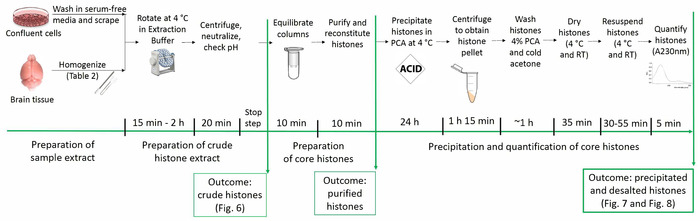
Figura 1: linha do tempo do protocolo de purificação de histona. Todos os passos para análises de histona são mostrados abaixo, juntamente com o tempo estimado necessário para cada etapa. Figuras representando o resultado das etapas específicas e apresentado dentro do manuscrito são referidas em parênteses. Clique aqui para ver uma versão maior desta figura.
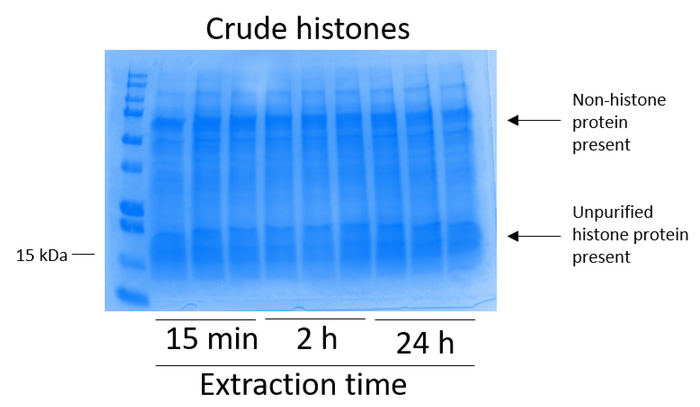
Figura 2: representante gel manchado de azul de Coomassie brilhante demonstrando histonas brutas extraídas de células BV2. BV2 células foram cultivadas por 48 h antes do início do protocolo de extração de histona. Histonas brutas foram extraídas por 15 min, 2 h e 24 h, com três repetições para cada ponto de tempo (este também é o caso na Figura 3, Figura 4e Figura 5). Ambos HMG4L2 e histona proteínas estão presentes no extrato bruto de histona. Clique aqui para ver uma versão maior desta figura.
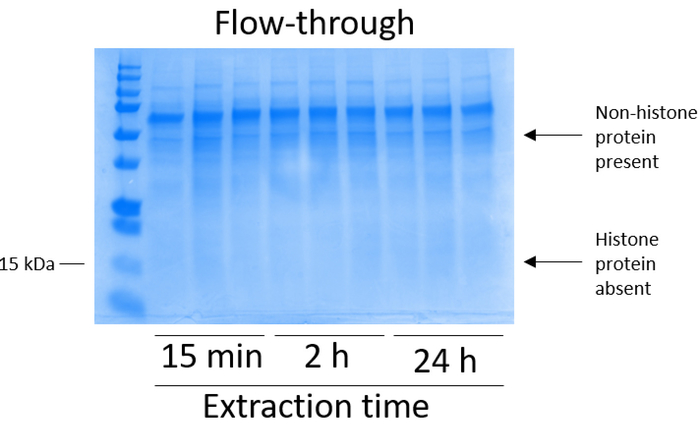
Figura 3: representante gel manchado de azul de Coomassie brilhante, demonstrando a passagem seguinte do histone purificação da coluna a alguns passos das células BV2. Na sequência de histona bruta passando através da coluna de ligação de histona, apenas as proteínas HMG4L2 estão presentes no escoamento. As proteínas histonas são ausentes nesta fração. Clique aqui para ver uma versão maior desta figura.
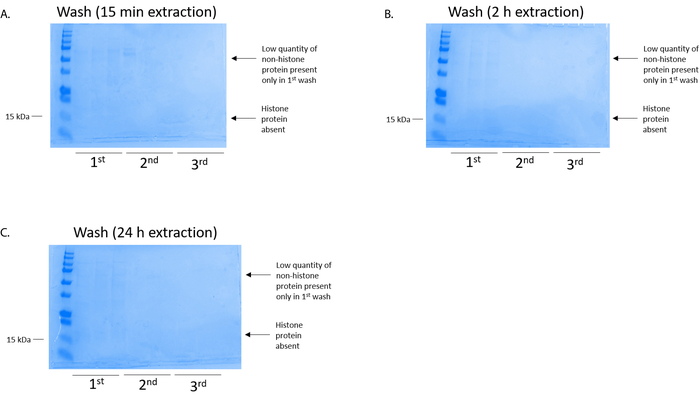
Figura 4: representante gel manchado de azul de Coomassie brilhante, demonstrando uma lavagem de coluna após uma etapa de purificação de histona de células BV2. Independentemente dos tempos de extração de histona, que foram (A) 15 min, (B), 2 h, ou (C), 24 h, baixas quantidades de proteínas HMG4L2 só estavam presentes na coluna primeira lavagem histonebinding. Proteínas de histona estavam ausentes em todas as lavagens. Clique aqui para ver uma versão maior desta figura.
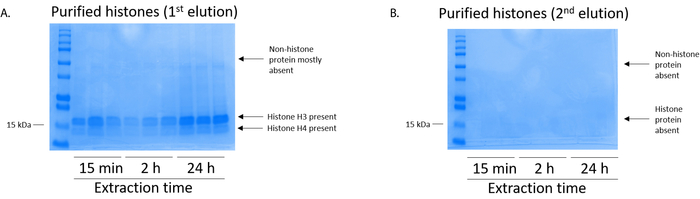
Figura 5: representante gel manchado de azul de Coomassie brilhante demonstrando elutions após uma etapa de purificação de histona de células BV2. (A) alta qualidade purificada e postas histona H3 e H4 foram detectados após a primeira eluição da coluna de purificação de histona. Coluna (B) a segunda eluição da purificação da histona não deu uma alta qualidade ou quantidade das histonas H3 ou H4. Clique aqui para ver uma versão maior desta figura.
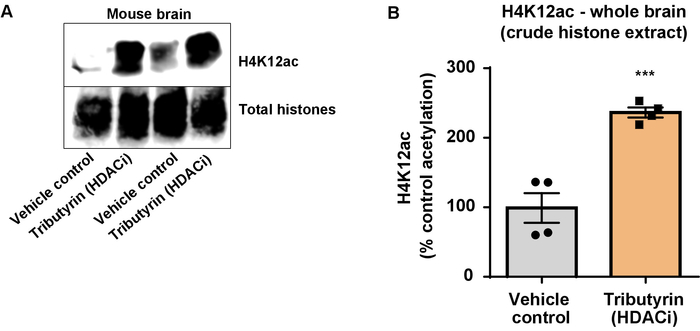
Figura 6: O inibidor, tributyrin, atuando amplamente HDAC aumenta a acetilação de H4K12 em todo o cérebro de ratos do selvagem-tipo. (A) este painel mostra um representante ocidental borrão, representando um aumento de acetilação de H4K12 na histona bruto extrair coletados do cérebro inteiro do selvagem-tipo ratos em resposta ao amplamente interino HDAC inibidor, tributyrin. (B), este painel mostra a quantificação do aumento na H4K12 de acetilação em vivo. Unpaired t-teste foi utilizado para comparar os grupos (t(6) = 6.076, P = 0,0005). As barras representam a média ± erro padrão da média (SEM). N = 8. P < 0,0001. Clique aqui para ver uma versão maior desta figura.
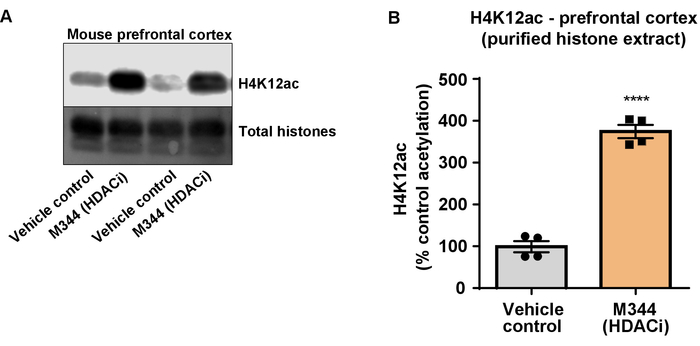
Figura 7: A classe que eu e o inibidor IIb HDAC, M344, aumenta a acetilação de H4K12 no córtex pré-frontal de tripla transgénicos a doença de Alzheimer (3 x Tg-AD) ratos. (A) este painel mostra um representante western blot representando um aumento de acetilação de H4K12 na purificada e extrato de histona demolhado coletados do córtex pré-frontal de 3 x ratos Tg-AD em resposta à inibição das HDACs por M344. (B) este painel mostra a quantificação do aumento de acetilação de H4K12 em resposta a M344 administrado na dose diária de 10 mg/kg por quatro meses. Unpaired t-teste foi utilizado para comparar os grupos (t(6) = 13,30, P < 0,0001). As barras representam a média ± o SEM. N = 8. P < 0.00001. Clique aqui para ver uma versão maior desta figura.
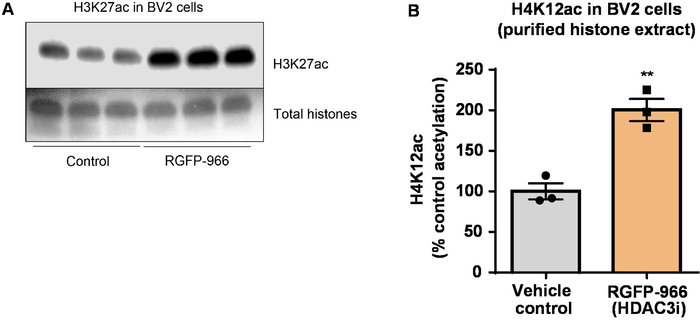
Figura 8: O inibidor seletivo da HDAC3, 966-RGFP, aumenta a acetilação de H3K27 em células de microglial BV2. (A), este painel mostra um representante western blot, representando um aumento de H3K27 acetilação no extrato purificado e demolhado histona coletado de BV2 células em resposta à inibição da HDAC3 por RGFP-966. (B) RGFP-966 provoca um aumento de aproximadamente dupla da acetilação da histona H3 e lisina (K) 27 após 24 h de tratamento. Unpaired t-teste foi utilizado para comparar o controle contra tratados células (t(4) = 5.981, P = 0,002). As barras representam a média ± o SEM. N = 6. P < 0,01. Clique aqui para ver uma versão maior desta figura.
| Tecido representativo (um hemisfério) * | Peso médio de tecido (mg) | Solução tampão (mL) | Número de traços |
| Cerebelo de rato | 40 | 1 | 40 |
| Córtex frontal do mouse | 30 | 0.3 | 20 |
| Hipocampo de rato | 27 | 0.3 | 18 |
| Córtex de rato entorhinal | 19 | 0.3 | 17 |
| * Todos os experimentos foram realizados em ratos machos adultos. | |||
| Idade média: 16 meses. Peso médio: 30 gramas. | |||
Tabela 1: Condição otimizada para homogeneização do tecido cerebral.
Discussão
No trabalho atual, temos demonstrado um método otimizado para purificar as proteínas histonas de núcleo e quantificar histona H3 e H4 PTMs (por exemplo, acetilação). O protocolo apresentado é otimizada para um fluxo de trabalho abrangente que incorpora procedimentos sobre células e preparação do tecido de cérebro, eluição de purificação de histona e precipitação de histona detalhadas, bruta e quantificação, que são seguidos por eletroforese de histona e quantificação de PTM histona robusto. A grande quantidade de detalhes fornecidos aqui permite uma geração replicável de dados de alta qualidade, apesar da necessidade de longas manipulações das amostras de histona.
Muitos protocolos publicados atualmente requerem o uso de HPLC para isolar frações puras de histonas H3 e H419. Apesar de HPLC é uma técnica poderosa, sua complexidade e baixa produtividade dissuadir a maioria dos biólogos moleculares e nonexperts do seu uso frequente. Com efeito, HPLC não está disponível para muitos laboratórios e pessoal altamente qualificado é necessário para operar o instrumento. HPLC muitas vezes é demorado, caro e potencialmente perigosa. Apresentado aqui é uma estratégia de baixo custo, médio-taxa de transferência para alcançar resultados de qualidade semelhante que ignora HPLC. A estratégia relatada também é mais prático e adequado para uso em qualquer laboratório que utiliza uma abordagem de coluna de rotação simples que não requer habilidades de operação do instrumento especializado. Além disso, o tetrâmero de histona H3/H4 é extraído como um single, puro e a fração abundante, permitindo uma quantificação confiável de PTMs preservados em cada uma das proteínas.
PTMs são extremamente sensíveis a mudanças no estresse oxidativo e alterações no pH20,21. Assim, em contraste com os métodos anteriormente publicados18, relatamos uma estratégia eficiente de lavagem das células em media serum-free para garantir uma mínima perturbação metabólica das células e para evitar a interferência da PTMs nativos com componentes do soro. O protocolo atual não só ignora o isolamento núcleos tradicionais, mas também fornece tempos ideais para lise celular e o procedimento de homogeneização de tecidos exata que permite a preservação do envelope nuclear, evitando a agregação nuclear. Embora o tempo de extração pode ser manipulado com base no número de células, o tipo de célula usada, o tamanho do tecido, etc., Lise estendida não é desejável, pois pode levar à Lise dos núcleos e liberação de DNA, dificultando a amostra manipular. Importante, vários pontos de verificação no âmbito do protocolo existem para a validação da purificação de histona bem-sucedida (por exemplo, as etapas 2.7 e 3.2.3). Esta estratégia também facilita a resolução de problemas em todo o processo moroso.
Outra característica importante e única do protocolo apresentado é sua total compatibilidade com ferramentas de análise ocidental do Borrão a jusante e os outros se assim o desejar. Proteínas histonas são detectadas em ~ 15 kDa13,22,23 e, similarmente a outras proteínas de pequeno peso molecular, têm sido provadas desafiadoras para detectar por técnicas padrão immunoblotting. O uso de um sistema de transferência de alto desempenho e alta produtividade em combinação com géis de proteína de ótima resolução permite a manutenção da proteína nativa confirmação (na ausência de SDS) e atividade na ausência de SDS e transferência de alta eficiência as proteínas de baixo peso molecular do histone, garantindo uma quantificação de PTM histona confiável.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores expressam sua gratidão ao programa de pesquisa do departamento de Florida de saúde Ed e Ethel Moore Alzheimer (bolsas 6AZ08 e 7AZ26), o NIH-tinham (concessão 5R01AA023781-03) e a American Heart Association (concessão 17PRE33660831).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | ThermoFiser Scientific | 05-408-129 | or equivalent from other sources |
| Sterile water | Gibco | 15-230-204 | or equivalent from other sources |
| 70% perchloric acid | Sigma Aldrich | 311421 | or equivalent from other sources |
| 100% acetone | Sigma Aldrich | 270725 | or equivalent from other sources |
| pH-indicator strips, non-bleeding | Milliipore Sigma | 1095310001 | |
| 4x SDS sample buffer | BIO-RAD | 161-0747 | |
| Benchtop rotor | Cole-Parmer | UX-04397-34 | or equivalent from other sources |
| 1.5 mL tube rack | ThermoFiser Scientific | 05-541 | or equivalent from other sources |
| Histone purification mini kit | Active Motif | 40026 | spin columns included in the kit |
| Protease Inhibitor Cocktail | ThermoFiser Scientific | 78430 | or equivalent from other sources |
| Nanodrop instrument | ThermoFiser Scientific | ND-2000 | |
| Tissue culture dishes | VWR | 10062-880 | required for histone extraction from cultured cells |
| Tissue culute media | varies based on cell line used | varies based on cell line used | required for histone extraction from cultured cells |
| Low-serum media | ThermoFiser Scientific | 51985091 | required for histone extraction from cultured cells |
| Plastic cell scraper | Falcon | 353086 | required for histone extraction from cultured cells |
| SDS-PAGE gradient gel | BIO-RAD | 456-9035 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Staining Solution | BIO-RAD | 1610436 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Destaining Solution | BIO-RAD | 1610438 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BIO-RAD | 1704156 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Transfer System | RIO-RAD | 1704150 | required for histone extraction from cultured cells |
| Ponceau S stain | CellSignalling | 59803S | required for histone extraction from cultured cells |
| Dounce homogenizer (size/cap sc 7mL) with a small size clearance | Kimble Chase | 885302-0007 | required for histone extraction from tissues |
| 100% bleach | Clorox | 68973 | required for histone extraction from tissues |
| H4K12ac antibody | Active Motif | 39166 | required for PTMs quantification via WB |
| H3K27ac antibody | Active Motif | 39134 | required for PTMs quantification via WB |
Referências
- Holliday, R. Is there an Epigenetic Component in Long-term Memory?. Journal of Theoretical Biology. 200, 339-341 (1999).
- DeWoskin, V. A., Million, R. P. The epigenetics pipeline. Nature Reviews Drug Discovery. 12, 661-662 (2013).
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO Reports. 3, 224-229 (2002).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389, 349-352 (1997).
- Sartor, G. C., Powell, S. K., Brothers, S. P., Wahlestedt, C. Epigenetic Readers of Lysine Acetylation Regulate Cocaine-Induced Plasticity. The Journal of Neuroscience. 35, 15062-15072 (2015).
- Komatsu, N., et al. SAHA, a HDAC inhibitor, has profound anti-growth activity against non-small cell lung cancer cells. Oncology Reports. 15, 187-191 (2006).
- Bahari-Javan, S., Sananbenesi, F., Fischer, A. Histone-acetylation: a link between Alzheimer's disease and post-traumatic stress disorder. Frontiers in Neuroscience. 8, 160 (2014).
- Roh, T. -. Y., Cuddapah, S., Zhao, K. Active chromatin domains are defined by acetylation islands revealed by genome-wide mapping. Genes & Development. 19, 542-552 (2005).
- Mutskov, V., Felsenfeld, G. Silencing of transgene transcription precedes methylation of promoter DNA and histone H3 lysine 9. The EMBO Journal. 23, 138-149 (2004).
- Howe, L., Brown, C. E., Lechner, T., Workman, J. L. Histone acetyltransferase complexes and their link to transcription. Critical Reviews in Eukaryotic Gene Expression. 9, 231-243 (1999).
- Jenuwein, T., Allis, C. D. Translating the histone code. Science. 293, 1074-1080 (2001).
- Bowman, G. D., Poirier, M. G. Post-Translational Modifications of Histones That Influence Nucleosome Dynamics. Chemical Reviews. 115, 2274-2295 (2015).
- Volmar, C. -. H., Wahlestedt, C. Histone deacetylases (HDACs) and brain function. Neuroepigenetics. 1, 20-27 (2015).
- Plagg, B., Ehrlich, D., Kniewallner, K. M., Marksteiner, J., Humpel, C. Increased Acetylation of Histone H4 at Lysine 12 (H4K12) in Monocytes of Transgenic Alzheimer's Mice and in Human Patients. Current Alzheimer Research. 12, 752-760 (2015).
- Bhaskara, S., et al. Hdac3 is essential for the maintenance of chromatin structure and genome stability. Cancer Cell. 18, 436-447 (2010).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone Deacetylase Inhibitors in Clinical Studies as Templates for New Anticancer Agents. Molecules. 20, 3898-3941 (2015).
- Ramakrishnan, S., et al. HDAC 1 and 6 modulate cell invasion and migration in clear cell renal cell carcinoma. BMC Cancer. 16, 617 (2016).
- Wapenaar, H., Dekker, F. J. Histone acetyltransferases: challenges in targeting bi-substrate enzymes. Clinical Epigenetics. 8, 59 (2016).
- Klinker, H., Haas, C., Harrer, N., Becker, P. B., Mueller-Planitz, F. Rapid Purification of Recombinant Histones. PLoS ONE. 9, e104029 (2014).
- Chen, K., et al. Neurodegenerative Disease Proteinopathies Are Connected to Distinct Histone Post-translational Modification Landscapes. ACS Chemical Neuroscience. 9, 838-848 (2018).
- Simithy, J., Sidoli, S., Garcia, B. A. Integrating Proteomics and Targeted Metabolomics to Understand Global Changes in Histone Modifications. Proteomics. , (2018).
- Volmar, C. -. H., et al. An Epigenetic Approach for the Modulation of Amyloid Precursor Protein (APP) Processing and Improvement of Memory in Alzheimer's Disease. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. 40, S470 (2015).
- Volmar, C. -. H., et al. M344 promotes nonamyloidogenic amyloid precursor protein processing while normalizing Alzheimer’s disease genes and improving memory. Proceedings of the National Academy of Sciences. 114 (43), E9135-E9144 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados