需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种快速的疾病抑制初步评估的板块竞争分析法
摘要
介绍了一种平板竞争试验的协议, 以确定特定堆肥是否可能含有抑制纹枯病菌生长的细菌和真菌。
摘要
其目的是开发和优化一个简单, 负担得起和有效的生物测定, 以检测特定堆肥对土传真菌纹枯病菌的疾病抑制能力。R. 病菌是全球范围内各种植物宿主的病原体。真菌在土壤中存活为腐生植物, 在简单的水琼脂培养基上迅速生长。钢板法是一种快速的方法来比较堆肥的能力, 以减缓病菌的生长。该检测还与其他土传真菌病原体的抑制有很好的相关性, 如链孢早期摧残、枯萎病菌、霉菌根腐病和腐霉根腐病等土壤中腐生生物。
引言
纹枯代表了真菌的一个广泛的复杂, 其中Thanatephorus 螨(弗兰克) 反主动 (无性型 =纹枯病菌库恩) 是导致根腐病和阻尼1。纹枯病菌是一种积极的病原体和腐生植物, 可以作为菌核在恶劣环境条件下存活1。因此, 它有一个全球性的分布, 并可能导致广泛的工厂主机的疾病, 包括茄科, 豆科, 菊科, 和十字花科造成严重的经济损失。
堆肥有能力为某些植物病原体提供2的生物防治剂。然而, 并非所有的堆肥都一样, 也不影响所有病原体同样3。木质碳的木质素比干草或稻草碳基堆肥的纤维素比例高。R. 病菌更喜欢在稻草中找到的容易获得的碳。相比之下, 生物控制真菌, 如木霉菌, 更有效时, 碳是不太容易得到。有益真菌和细菌进入堆肥可以通过竞争、对抗或调节植物生长3来抑制植物疾病。所建议的检测方法主要检测抗生素、ecoenzymes 或螯合剂的产生对病原体有害的拮抗作用。
植物生物鉴定是确定堆肥有利于或阻止植物生长4的黄金标准。然而, 植物生物鉴定是耗时的 (几周到几个月) 完成这可能是长于预期的, 需要更多的劳动力, 以提取植物根系, 以量化的严重程度的根系统。相对稳健, 但更快 (天) 的检测将是质量控制计划的理想选择。本文的目的是对堆肥的抑制电位进行比较快速、准确的试验。该方法阿尔法诺等。5除两种例外外, 堆肥提取物被稀释, 水琼脂用于代替马铃薯葡萄糖琼脂 (PDA)。R. 病菌在简单的水琼脂培养基上生长迅速, 而 PDA 促进细菌和其他真菌的生长, 污染了文化6。
此板块测定是一种抑制指标, 适用于土壤中存活的一系列植物病原体, 如腐生生物病菌7、链孢摧残、枯萎病、疫霉根腐、腐霉根腐病。板块竞争检测是有用的筛选一系列堆肥产品的包含微生物群落作为土壤病原体的生物控制剂。该检测是商业堆肥产品中最一致的疾病抑制指标之一6,8。产品在配方、成熟度和生产过程中的差异被选择。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 提前准备
- 主真菌培养 (试验有机体)
- 从美国类型文化收集, 微生物学收集9, 由其 teleomorph Thanatephorus 螨(弗兰克) (ATCC 10154) 或妙4031。
- 或者: 收集由作者完成的本地隔离。红萝卜苗 (萝卜) 作为诱饵厂工作良好;收集土壤从已知有阻尼关闭或根腐烂的历史记录由R. 病菌造成。播种种子在土壤和孤立从根病变时幼苗是3到4周大。
- 从土壤中取出幼苗, 用自来水冲洗。在叶子和根部之间的下胚轴区域寻找棕色组织 (图 1)。
- 使用单刃刀片切割1厘米的下胚轴或有褐色颜色的根。使用火焰灭菌钳在10% 个家用漂白剂溶液中浸泡1分钟, 然后在无菌水中进行十年代冲洗。
注: 无菌培养皿的顶部和底部是此步骤的有用容器。 - 使用火焰灭菌钳将植物碎片转移到纸巾的内侧, 然后用水琼脂 (15 g 1 L) 在培养皿的表面上进行拍干。
- 将培养皿放入带盖子的塑料容器内, 在室温下孵育 (约20摄氏度)。用10% 漂白剂或75% 乙醇擦拭容器内部, 在放入盘子前让它风干。
- 将分离物长期储存在玉米粉琼脂的最小培养基上 (17 g 在 1 L) 偏 (5 摄氏度)。

图 1: 疾病症状.含病菌的土壤会导致斑点发芽和建立 (左)。萝卜幼苗的症状发生在下胚轴的褐色病变 (右)。请点击这里查看这个数字的更大版本.
- 使用马铃薯葡萄糖琼脂板 (39 g 在 1 L) 用于接种此板试验。
- 在马铃薯葡萄糖琼脂上建立纹枯文化的女儿文化在化验前一或两天, 以确保它在检测前已在培养板上建立好。通过将R. 病菌的小块 (直径10毫米) 从主文化转移到马铃薯葡萄糖琼脂的新鲜盘子的中心, 开始女儿文化 (图 2)。
注意: 在层流罩中工作或使用10% 漂白剂或75% 乙醇擦拭实验室工作台, 以最小化污染风险。
- 在马铃薯葡萄糖琼脂上建立纹枯文化的女儿文化在化验前一或两天, 以确保它在检测前已在培养板上建立好。通过将R. 病菌的小块 (直径10毫米) 从主文化转移到马铃薯葡萄糖琼脂的新鲜盘子的中心, 开始女儿文化 (图 2)。
- 高压灭菌器 25 ml 试管, 含10毫升等份蒸馏水 (2 x 样品数量)。
2. 样品的准备测试
- 在25毫升试管中添加两个独立的 0.5 g 样品, 每个堆肥测试样品到10毫升的蒸压水中。一夜之间摇动试管。
- 使用唯一样本编号对测试管进行标注, 将对的每个成员作为 A (参考) 或 B (示例)。
- 24小时后, 在两个 125 mLconical 烧瓶中加入 1.5 g 纯琼脂至90毫升蒸馏水。
- 热压罐两个圆锥烧瓶与琼脂, 和每对20分钟的样品与一个缓慢的排气设置。
- 热压罐后, 将琼脂的锥形烧瓶放入45摄氏度的水浴中, 直至达到平衡 (约30分钟)。切勿将样品泥浆放入水浴中, 直至冷却至45摄氏度。
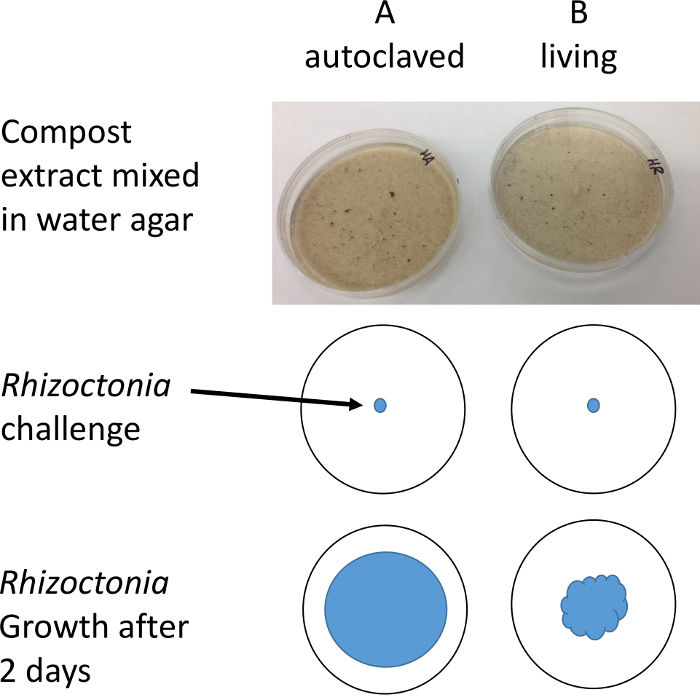
图 2: 协议说明.病菌的插头放在含有堆肥水萃取物的培养皿上。菌丝生长的直径在1-2 天后通过立体声显微镜来测量, 以提高分辨率和对比度。请点击这里查看这个数字的更大版本.
- 将样品 (蒸压) 堆肥浆倒入琼脂烧瓶的熔融琼脂中。漩涡将堆肥分散到琼脂中。
- 将 b 样样品 (活样品) 倒入 b 琼脂烧瓶的熔融琼脂中。漩涡将堆肥分散到琼脂中。
- 将每个烧瓶的混合物倒入五个直径为100毫米的塑料培养皿中。
- 让盘子凉一夜, 使琼脂变硬。
3. 添加纹枯挑战
- 使用无菌技术, 将相同尺寸的病菌件转移到每对样品琼脂板 (3 至 5 mm corkborer 工作良好, 以建立同等大小的件)。从殖民地的外边缘把殖民地的一部分, 以确保菌丝正在积极增长。
注意: 在层流罩中工作或使用10% 漂白剂或70% 乙醇擦拭实验室工作台。 - 将盘子在室温下孵育1-2 天, 直到菌落的生长量达到大约一半到板块边缘为止。
4. 测量R. 病菌增长
- 使用带透射照明的立体声显微镜, 测量每片板上菌丝的半径至最接近的 1 mm。
注意: 倾斜或暗场照明会使您更容易看到和测量透明菌丝。此时, 如果堆肥是抑制的, 那么在 B 板块的堆肥片段周围将会可见抑制作用区。 - 记录每个板块三个位置的半径, 并计算三的平均值作为代表性度量值。
- 从盘子中减去 B 板的平均值。如果 b < a 然后有微生物在 b 板块是抑制对病菌病原体。
- 将平均半径除以挑战天数, 将相对抑制的单位表示为速率, mm 菌丝每天。
Access restricted. Please log in or start a trial to view this content.
结果
成品堆肥应该是稳定和成熟的, 两个术语, 经常互换使用, 所以它可以安全包装和运输, 并没有造成不良影响, 在其最终使用4。稳定性是一种抗分解性, 通常使用微生物活性指标来确定。微生物呼吸的一般措施可以测量堆肥的稳定性, 但不一定能抑制侵袭性病原体和腐生植物如R. 病菌7的疾病。本研究着眼于成熟度, 推断?...
Access restricted. Please log in or start a trial to view this content.
讨论
我们从以前的研究中知道, 某些堆肥是有效的抑制病菌和抑制作用是由于微生物生活在堆肥, 而不是非生物性质的堆肥6,8。使用高压灭菌作为一种手段, "杀死" 微生物群已被批评, 因为它影响碳化学的媒体10。我们通过 Whatman 1 号纸将高压灭菌与真空过滤进行了比较。既不过滤也不蒸压的治疗显示病菌生长的最大抑制
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
佛蒙特州农业实验站竞争孵化计划 VT-HO1609 资助了这项研究。林恩在佛蒙特大学6的硕士论文中使用了这个方法。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| autoclavable narrow-neck glass conical flask | Fisher Scientific | 10-040D | 125-mL |
| autoclavable glass testtubes | Fisher Scientific | 14-925J | 25-mL |
| dehydrated granulated agar | Fisher Scientific | DF0145-17-0 | 500 g quantity |
| heat resistant gloves | Fisher Scientific | MEMGG1314WL | several brands available |
| Parafilm (strips of 2-3 cm wide) | Fisher Scientific | PM992 13-374-16 | 5 or 10 cm widths work |
| disposable polystyrene petri dishes | Fisher Scientific | R80116 | comes in sleeves of 20/ea or cases of 500 |
| dehydrated potato dextrose agar | Fisher Scientific | DF0013-15-8 | comes in quantities of 100, 500 and 2000 grams |
| benchtop reciprocal shaker | Thomas Scientific | 1227Y31 | other models will work |
| water bath | ThermoScientific | S37363 | 5L general purpose |
| clear ruler, flat, at least 10 cm | Any | use metric rule | |
| ATCC culture | American Type Culture Collection | ATCC 10154 | teleomorph Thanatephorus cucumeris (Frank) (ATCC 10154) or MYA 4031; |
| lab tape | Fisher Scientific | 15935 | autoclavable and removable, 1" wide preferred |
| water resistant marker | office or scientific supply | Sharpie fine tip | write sample number on tape |
参考文献
- Gonzalez Garcia, G., Onco, M. A. P., Susan, V. R. Review. Biology and systematics of the form genus Rhizoctonia. Spanish Journal of Agricultural Research. 4 (1), 55-79 (2006).
- Bonanomi, G., Antignani, V., Pane, C., Scala, E. Suppression of soilborne fungal diseases with organic amendments. Journal of Plant Pathology. 89, 311-324 (2007).
- Noble, R. Risks and benefits of soil amendment with composts in relation to plant pathogens. Australasian Plant Pathology. 40, 157-167 (2011).
- Wichuk, K. M., McCartney, D. Compost stability and maturity evaluation - a literature review. Canadian Journal of Civil Engineering. 37, 1505-1523 (2010).
- Alfano, G., Lustrato, G., Lima, G., Vitullo, D., Ranalli, G. Characterization of composted olive mill wastes to predict potential plant disease suppressiveness. Biological Control. 3, 199-207 (2011).
- Fang, L. Biological indicators of compost-mediated disease suppression against the soilborne plant pathogen Rhizoctonia solani. , University of Vermont. M.S. Thesis (2015).
- Bonanomi, G., Antignani, V., Capodilupo, M., Scala, F. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases. Soil Biology and Biochemistry. 42, 136-144 (2010).
- Neher, D. A., Fang, L., Weicht, T. R. Ecoenzymes as indicators of compost to suppress Rhizoctonia solani. Compost Science and Utilization. 25 (4), 251-261 (2017).
- American Type Culture Collection. ATCC® Mycology Culture Guide. , Available from: https://www.atcc.org/~/media/PDFs/Culture%20Guides/Mycology_Guide.ashx (2018).
- Berns, A. E., Phillip, H., Narres, H. -D., Burauel, P., Vereecken, H., Tappe, W. Effect of gamma-sterilization and autoclaving on soil organic matter structure as studied by solid state NMR, UV and fluorescence spectroscopy. European Journal of Soil Science. 59, (2008).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。