Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un análisis de la competencia la placa como una evaluación preliminar rápida de supresión de la enfermedad
En este artículo
Resumen
Presentado es un protocolo para un análisis de la competencia de placa determinar si un compuesto específico es probable que contenga bacterias y hongos que inhiben el crecimiento de Rhizoctonia solani.
Resumen
El objetivo era desarrollar y optimizar una prueba simple, asequible y eficaz para detectar la capacidad supresora de la enfermedad de un compost específico contra hongos de suelo Rhizoctonia solani. R. solani es un patógeno de una amplia gama de anfitriones de la planta en todo el mundo. El hongo sobrevive en los suelos como un saprofito y crece rápidamente en medios de agar agua simple. El ensayo de placa es un método rápido para comparar compuestos por su capacidad para frenar el crecimiento de r. solani. El ensayo también se correlaciona bien con la supresión de otros hongos patógenos de suelo que sobreviven como saprófitos en suelos como tizones tempranos Alternaria, marchitamiento por Fusarium, podredumbre de las raíces Phytophthora y Pythium putrefacción de la raíz.
Introducción
Rhizoctonia representa un amplio complejo de hongos, de que Thanatephorus cucumeris (Frank) Donk (anamorfo = Rhizoctonia solani Kühn) es el patógeno causante de la pudrición de la raíz y damping-off1. Rhizoctonia solani es un patógeno agresivo y un saprófito que puede sobrevivir como esclerocios bajo condiciones ambientales adversas1. Como resultado, se tiene una distribución global y puede causar enfermedad en amplia gama de anfitriones de la planta incluyendo Solanaceae, Fabaceae, Asteraceae y Brassicaceae que resulta en graves pérdidas económicas.
Compuesto tiene la capacidad para abrigar a agentes de biocontrol para ciertos patógenos de planta2. Sin embargo, el compost no todos es igual ni afectan todos los patógenos del mismo modo3. Carbón con base de madera tiene lignina mayor proporción de celulosa de heno o paja de carbono compuestos. R. solani prefiere carbono disponible en paja. En contraste, control biológico de hongos, como Trichoderma spp., son más eficaces cuando el carbono es menos fácilmente disponible. Beneficiosos hongos y bacterias en compost pueden suprimir enfermedades de planta a través de la competencia, antagonismo o regulador de crecimiento de planta3. El ensayo propuesto principalmente detecta antagonismo creado por la producción de antibióticos, ecoenzymes o quelantes que son perjudiciales para el patógeno.
Pruebas biológicas de la planta son un estándar de oro para determinar si compostas favorecerán o impedir el crecimiento de planta4. Sin embargo, pruebas biológicas de la planta son desperdiciadoras de tiempo (semanas o meses) para completar el que puede ser más largo que desea y requiere más trabajo para extraer las plantas con raíces para cuantificar la gravedad de los sistemas de la raíz. Comparable robusto, pero más rápido los análisis (días) sería ideales para programas de control de calidad. El objetivo de este trabajo es demostrar una prueba relativamente rápida y exacta para predecir potencial represivo del compost. El método fue modelado después de Alfano et al. se diluyeron 5 con dos excepciones, extractos de compost y agua agar fue utilizado en lugar de papa dextrosa agar (PDA). R. solani crece rápidamente en medios de agar agua simple mientras que PDA promovió el crecimiento de bacterias y otros hongos que contamina la cultura6.
Este análisis de la placa sirve como un indicador de supresión que se aplica a una variedad de patógenos de plantas que sobreviven en el suelo como saprófitos como r. solani7, tizones tempranos Alternaria, marchitamiento por Fusarium, podredumbre de las raíces Phytophthora y Pythium putrefacción de la raíz. El análisis de la competencia de placa es útil para detectar una gama de productos de abono para que las comunidades de microbios que sirven como agentes de control biológico de patógenos del suelo. El ensayo fue uno de los indicadores más consistentes de la supresión de la enfermedad en compost comercial productos6,8. Los productos fueron elegidos por su variación en la receta, la madurez y el proceso de producción.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. preparar de antemano
- Maestro cultura fungicida (organismo de prueba)
- Orden de la American Type Culture Collection, colección de Microbiología9, por su teleomorfo Thanatephorus cucumeris (Frank) (ATCC 10154) o MYA 4031.
- Como alternativa: Recoger aislamientos locales como hecho por los autores. Las plántulas de rábano rojo (Raphanus sativus) funcionan bien como una planta de cebo; recoger suelo de un lugar conocido para tener una historia de la podredumbre damping-off o raíz causada por r. solani. Sembrar semillas en el suelo y aislar de las lesiones de la raíz cuando las plantas de semillero son 3 a 4 semanas de edad.
- Retire las plantas de semillero de suelo y enjuague con agua corriente. Buscar tejido marrón en la región de hipocótilo entre las hojas y la raíz (figura 1).
- Utilice una cuchilla de filo única para cortar segmentos de 1 cm del hipocotilo o de raíz que tienen un color marrón. Utilizar pinzas esterilizadas a la llama para los segmentos en solución al 10% de cloro por 1 min, seguido de un enjuague de s 10 en agua estéril de la inmersión.
Nota: La parte superior e inferior de una placa Petri estéril son útiles contenedores para este paso. - Pinzas de uso esterilizado a la llama a la planta de transferencia las piezas en el interior de una toalla de papel para secar dando golpecitos y luego colocar en la superficie de una placa de Petri con agar agua (15 g en 1 L).
- Coloque el plato Petri dentro de un recipiente de plástico con tapa e incubar a temperatura ambiente (aproximadamente 20 ° C). Limpie el interior del contenedor con 10% de lejía o 75% de etanol y se deja secar al aire antes de introducir el plato.
- Mantener los aislamientos en el almacenamiento a largo plazo en un medio mínimo de harina de maíz agar sesgos (17 g en 1 L) (a 5 ° C).

Figura 1: síntomas de la enfermedad. Suelo que contiene a r. solani produce germinación desigual y establecimiento (izquierda). Síntomas en plántulas de rábano como lesiones color marrón en el hipocotilo (derecha). Haga clic aquí para ver una versión más grande de esta figura.
- Usar placas de agar de dextrosa de papa (39 g en 1 L) de inóculo para este análisis de la placa.
- Establecer una cultura de la hija de la cultura de Rhizoctonia en papa dextrosa agar, uno o dos días antes del ensayo asegurarlo bien establecido en la placa de cultivo antes de la prueba. Inicio la cultura hija transfiriendo un pedazo pequeño (10 mm de diámetro) de r. solani de la cultura principal en el centro de una placa fresca de agar patata-glucosa (figura 2).
Nota: Trabajar en campana de flujo laminar o limpiar un banco de laboratorio con 10% de lejía o 75% etanol para minimizar el riesgo de contaminación.
- Establecer una cultura de la hija de la cultura de Rhizoctonia en papa dextrosa agar, uno o dos días antes del ensayo asegurarlo bien establecido en la placa de cultivo antes de la prueba. Inicio la cultura hija transfiriendo un pedazo pequeño (10 mm de diámetro) de r. solani de la cultura principal en el centro de una placa fresca de agar patata-glucosa (figura 2).
- Autoclave tubos de ensayo de 25 mL con alícuotas de 10 mL de agua destilada (2 x número de muestras).
2. preparación de muestras para prueba de
- Añadir dos muestras independientes de 0.5 g de cada muestra de compost y 10 mL de agua esterilizada en tubos de ensayo de 25 mL. Agite los tubos de ensayo durante la noche.
- Etiquetar los tubos de ensayo con los números de muestra única y cada miembro de la pareja como una (referencia) o B (muestra).
- Después de 24 h, añadir 1,5 g de agar llano a 90 mL de agua destilada en matraces de dos 125 mLconical.
- Autoclave de ambos matraces cónicos con agar y una muestra de cada par por 20 min con un ajuste de escape lento.
- Después del autoclave, lugar los matraces cónicos con agar en un baño de agua de 45 ° C hasta que alcancen el equilibrio (30 minutos). No ponga cualquier mezclas de muestra en el baño de agua hasta que se ha enfriado a 45 ° C.
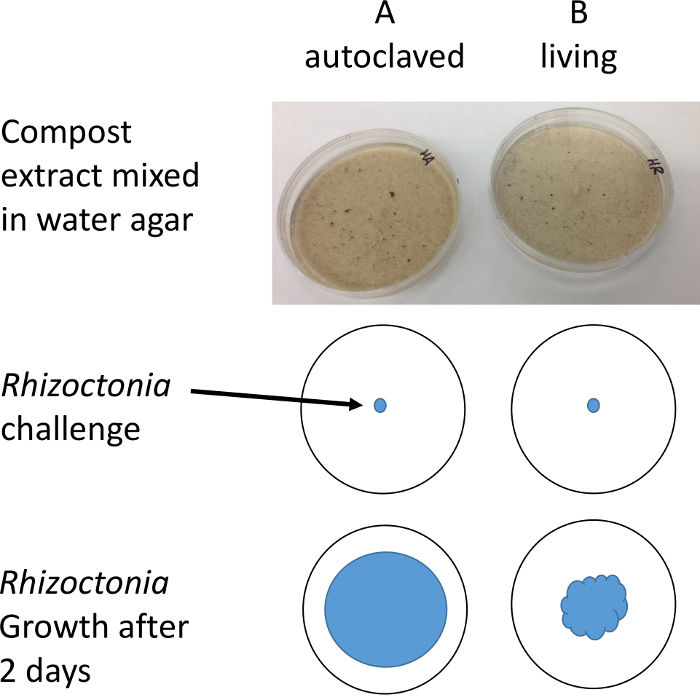
Figura 2: ejemplo de protocolo de. Tapones de r. solani se colocan en placas de Petri que contiene extracto acuoso de compost. El diámetro de crecimiento micelial se mide después de 1-2 días con la ayuda de un microscopio estéreo para mejorar la resolución y contraste. Haga clic aquí para ver una versión más grande de esta figura.
- Vierta la mezcla de compost (referencia esterilizado) A muestra en el agar fundido del matraz A agar. Agitar para dispersar el compuesto en el agar.
- Vierta la mezcla de compost B muestra (muestra de la vida) en el agar fundido del matraz B agar. Agitar para dispersar el compuesto en el agar.
- Vierta la mezcla de cada frasco en cinco platos de Petri plásticas que son de 100 mm de diámetro.
- Que la noche fría de las placas para que el agar se endurece.
3. Añadir el reto de Rhizoctonia
- Utilizando una técnica aséptica, transferir pedazos de igual tamaño de r. solani para cada par de placas de agar de muestra (3 a 5 mm corkborer funciona bien para establecer en piezas iguales). Tomar pedazos de la Colonia del margen exterior de la Colonia para asegurar el micelio está creciendo activamente.
Nota: Trabajar en campana de flujo laminar o limpiar un banco de laboratorio con 10% de lejía o 70% de etanol. - 1-2 días hasta que el crecimiento de la Colonia llega a medio camino hasta el borde de las placas A incubar las placas a temperatura ambiente.
4. medir el crecimiento de r. solani
- Medir el radio del micelio en cada plato a la cerca 1 mm con una regla transparente plana usando un microscopio estéreo con iluminación transmitida.
Nota: Iluminación de campo oscuro u oblicua hará más fácil de ver y medir las hifas transparentes. En este punto, las zonas de inhibición será visibles alrededor de fragmentos de compost en la placa B Si el compost es represivo. - Grabar el radio en tres lugares por placa y calcular una media de los tres para servir como una medida representativa.
- Restar la media de las placas de B de las placas de A. Si B < entonces allí son microbios en los platos de B que son supresivos al patógeno r. solani .
- Divida el radio promedio por el número de días de desafío para expresar unidades de supresión relativa como una tasa, micelio de mm por día.
Access restricted. Please log in or start a trial to view this content.
Resultados
Composta debe ser estable y madura, dos términos que a menudo se usan indistintamente, así que puede ser con seguridad envasado y transportado y no causa efectos adversos en su uso final4. La estabilidad es una resistencia a la descomposición y normalmente se determina mediante índices de actividad microbiana. Las medidas generales de respiración microbiana pueden medir estabilidad del compost pero no necesariamente enfermedad supresión de un patóge...
Access restricted. Please log in or start a trial to view this content.
Discusión
Sabemos por investigaciones anteriores, de que ciertos compuestos son eficaces en la supresión de r. solani y que los efectos supresivos son debido a los microbios que viven en el compost, no las características abióticas de compost6,8. El uso de autoclave como un medio para 'matar' microbiota ha sido criticado porque afecta la química del carbono de los medios de comunicación10. Comparamos el uso de autoclave al vacío filtr...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El Vermont agrícola estación experimental competitivo Portilla programa VT-HO1609 financió la investigación. Lynn Fang utiliza el método como parte de su tesis M.S. Universidad de Vermont6.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| autoclavable narrow-neck glass conical flask | Fisher Scientific | 10-040D | 125-mL |
| autoclavable glass testtubes | Fisher Scientific | 14-925J | 25-mL |
| dehydrated granulated agar | Fisher Scientific | DF0145-17-0 | 500 g quantity |
| heat resistant gloves | Fisher Scientific | MEMGG1314WL | several brands available |
| Parafilm (strips of 2-3 cm wide) | Fisher Scientific | PM992 13-374-16 | 5 or 10 cm widths work |
| disposable polystyrene petri dishes | Fisher Scientific | R80116 | comes in sleeves of 20/ea or cases of 500 |
| dehydrated potato dextrose agar | Fisher Scientific | DF0013-15-8 | comes in quantities of 100, 500 and 2000 grams |
| benchtop reciprocal shaker | Thomas Scientific | 1227Y31 | other models will work |
| water bath | ThermoScientific | S37363 | 5L general purpose |
| clear ruler, flat, at least 10 cm | Any | use metric rule | |
| ATCC culture | American Type Culture Collection | ATCC 10154 | teleomorph Thanatephorus cucumeris (Frank) (ATCC 10154) or MYA 4031; |
| lab tape | Fisher Scientific | 15935 | autoclavable and removable, 1" wide preferred |
| water resistant marker | office or scientific supply | Sharpie fine tip | write sample number on tape |
Referencias
- Gonzalez Garcia, G., Onco, M. A. P., Susan, V. R. Review. Biology and systematics of the form genus Rhizoctonia. Spanish Journal of Agricultural Research. 4 (1), 55-79 (2006).
- Bonanomi, G., Antignani, V., Pane, C., Scala, E. Suppression of soilborne fungal diseases with organic amendments. Journal of Plant Pathology. 89, 311-324 (2007).
- Noble, R. Risks and benefits of soil amendment with composts in relation to plant pathogens. Australasian Plant Pathology. 40, 157-167 (2011).
- Wichuk, K. M., McCartney, D. Compost stability and maturity evaluation - a literature review. Canadian Journal of Civil Engineering. 37, 1505-1523 (2010).
- Alfano, G., Lustrato, G., Lima, G., Vitullo, D., Ranalli, G. Characterization of composted olive mill wastes to predict potential plant disease suppressiveness. Biological Control. 3, 199-207 (2011).
- Fang, L. Biological indicators of compost-mediated disease suppression against the soilborne plant pathogen Rhizoctonia solani. , University of Vermont. M.S. Thesis (2015).
- Bonanomi, G., Antignani, V., Capodilupo, M., Scala, F. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases. Soil Biology and Biochemistry. 42, 136-144 (2010).
- Neher, D. A., Fang, L., Weicht, T. R. Ecoenzymes as indicators of compost to suppress Rhizoctonia solani. Compost Science and Utilization. 25 (4), 251-261 (2017).
- American Type Culture Collection. ATCC® Mycology Culture Guide. , Available from: https://www.atcc.org/~/media/PDFs/Culture%20Guides/Mycology_Guide.ashx (2018).
- Berns, A. E., Phillip, H., Narres, H. -D., Burauel, P., Vereecken, H., Tappe, W. Effect of gamma-sterilization and autoclaving on soil organic matter structure as studied by solid state NMR, UV and fluorescence spectroscopy. European Journal of Soil Science. 59, (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados