É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio de competição de placa como uma rápida avaliação preliminar de supressão da doença
Neste Artigo
Resumo
Apresentado é um protocolo para um ensaio de competição de placa identificar se um adubo específico é susceptível de conter bactérias e fungos que inibem o crescimento de Rhizoctonia solani.
Resumo
O objetivo era desenvolver e otimizar um bioensaio de simples, acessível e eficaz para detectar a capacidade supressora de doença de um composto específico contra soilborne fungo Rhizoctonia solani. R. solani é um patógeno de uma vasta gama de hospedeiros de planta em todo o mundo. O fungo sobrevive no solo como uma Saprófita e cresce rapidamente em meios de ágar água simples. O ensaio de placa é um método rápido para comparar compostos por sua capacidade de retardar o crescimento de r. solani. O ensaio também se correlaciona bem com a supressão de outros patógenos fúngicos soilborne que sobrevivem como saprófitas em solos como início definha Alternaria, murcha de Fusarium, podridão radicular de Phytophthora e Pythium podridão de raiz.
Introdução
Rhizoctonia representa um amplo complexo de fungos, dos qual Thanatephorus cucumeris (Frank) Donk (anamorfo = Rhizoctonia solani Kühn) é o agente patogênico causando podridão de raiz e umedecimento-fora1. Rhizoctonia solani é um patógeno agressivo e uma Saprófita que pode sobreviver como esclerócios sob condições ambientais adversas1. Como resultado, tem uma distribuição global e podem causar doenças em ampla gama de hospedeiros de planta incluindo Solanaceae, Fabaceae, Asteraceae e Brassicaceae, resultando em sérios prejuízos econômicos.
O adubo tem a capacidade de abrigar agentes de biocontrole para determinados agentes patogénicos de planta2. No entanto, nem todos os compostos são iguais, nem eles afetam todos os agentes patogénicos da mesma forma3. Carbono à base de madeira tem lignina mais elevada rácios de celulose de compostos à base de feno ou palha-carbono. R. solani prefere carbono prontamente disponível encontrado em palha. Em contraste, o controle biológico de fungos, como Trichoderma spp., são mais eficazes quando o carbono é menos prontamente disponível. Benéficos fungos e bactérias em adubo podem suprimir a doença de planta através de competição, antagonismo ou regulador de crescimento de planta3. O ensaio proposto primeiramente detecta antagonismo criado pela produção de antibióticos, ecoenzymes ou quelantes que são prejudiciais ao patógeno.
Bioensaios de planta são um padrão-ouro para determinar se o terriço favorece ou impedir o crescimento de planta4. No entanto, a planta bioensaios são demoradas (semanas a meses) para concluir que pode ser mais do que o desejado e exige mais trabalho para extrair plantas com raízes para quantificar a severidade de sistemas da raiz. Comparativamente robusto, mas, mais rápido os ensaios (dias) seria ideais para programas de controle de qualidade. O objetivo deste trabalho é demonstrar um teste relativamente rápido e exato para prever potencial supressivo de adubo. O método foi padronizado após Alfano et al 5 com duas exceções, adubo extratos foram diluídos e ágar água foi usada no lugar de ágar de batata dextrose (PDA). R. solani cresce rapidamente em meios de ágar simples água Considerando que PDA promoveu o crescimento de bactérias e outros fungos que contaminou a cultura6.
Este ensaio de placa serve como um indicador de supressão que se aplica a uma gama de patógenos vegetais que sobrevivem no solo como saprófitas, incluindo r. solani7início definha Alternaria, murcha de Fusarium, podridão radicular de Phytophthora e Pythium podridão de raiz. O ensaio de competição de placa é útil para a tela uma gama de produtos de adubo para que contém comunidades de micróbios que servem como agentes de controle biológico de patógenos de solo. O ensaio foi um dos indicadores mais consistentes de supressão da doença em adubo comercial produtos6,8. Produtos foram escolhidos para sua variação na receita, maturidade e processo de produção.
Protocolo
1. preparar com antecedência
- Cultura de fungosa mestre (organismo de teste)
- Encomendar o American Type Culture Collection, coleção de microbiologia9, pelo seu teleomorfo Thanatephorus cucumeris (Frank) (ATCC 10154) ou MYA 4031.
- Como alternativa: Colete locais isolados como feito pelos autores. Mudas de vermelho rabanete (Raphanus sativus) funcionam bem como uma planta de isca; colete o solo de um local conhecido por ter um histórico de umedecimento-fora ou raiz podridão causada por r. solani. Plantar sementes no solo e isolar-se de lesões de raiz quando mudas são 3 a 4 semanas de idade.
- Retire as mudas do solo e enxágue com água da torneira. Olhe para o tecido marrom na região hypocotyl entre as folhas e a raiz (Figura 1).
- Use uma única lâmina afiada para cortar segmentos de 1 cm do hypocotyl ou raiz que têm uma cor marrom. Use chama-esterilizados fórceps para mergulhar os segmentos em solução de 10% de alvejante doméstico por 1 min, seguido de um enxágue s 10 em água estéril.
Nota: A parte superior e inferior de uma placa de Petri estéril são recipientes úteis para esta etapa. - Uso chama-esterilizados fórceps para transferir a planta pedaços para dentro de uma toalha de papel para pat seco e em seguida coloque sobre a superfície de uma placa de Petri com ágar água (15 g em 1 L).
- Coloque o prato de Petri dentro de um recipiente plástico com tampa e incubar à temperatura ambiente (cerca de 20 ° C). Limpe o interior do recipiente com 10% de lixívia ou 75% de etanol e deixe secar antes de colocar o prato.
- Manter os isolados em armazenamento a longo prazo em uma mídia mínima do ágar farinha de milho inclinações (17 g em 1 L) (a 5 ° C).

Figura 1: sintomas da doença. Solo, contendo o r. solani resulta em germinação irregular e estabelecimento (à esquerda). Os sintomas em mudas de rabanete ocorrerem como lesões marrons do hypocotyl (à direita). Clique aqui para ver uma versão maior desta figura.
- Use placas de ágar batata dextrose (39 g em 1 L) de inóculo para este ensaio de placa.
- Estabelecer uma cultura de filha de Rhizoctonia cultura em ágar dextrose batata, um ou dois dias antes do ensaio garantir está bem estabelecido na placa de cultura, antes do ensaio. Começa a cultura filha transferindo um pequeno pedaço (10 mm de diâmetro) de r. solani de cultura mestre para o centro de um prato fresco de ágar de batata dextrose (Figura 2).
Nota: Trabalhar em uma capa de fluxo laminar ou limpar uma bancada de laboratório com 10% de lixívia ou 75% etanol para minimizar o risco de contaminação.
- Estabelecer uma cultura de filha de Rhizoctonia cultura em ágar dextrose batata, um ou dois dias antes do ensaio garantir está bem estabelecido na placa de cultura, antes do ensaio. Começa a cultura filha transferindo um pequeno pedaço (10 mm de diâmetro) de r. solani de cultura mestre para o centro de um prato fresco de ágar de batata dextrose (Figura 2).
- Autoclave tubos de ensaio de 25 mL com alíquotas de 10 mL de água destilada (2 x número de amostras).
2. preparação de amostras para teste
- Adicione duas amostras independentes de 0,5 g de cada amostra de adubo para 10 mL de água esterilizada em tubos de ensaio de 25 mL. Agite os tubos de ensaio durante a noite.
- Etiquete os tubos de ensaio com números da amostra original e cada membro do par como uma (referência) ou B (amostra).
- Após 24 h, adicione 1,5 g de ágar-ágar simples para 90 mL de água destilada em frascos de dois 125 mLconical.
- Autoclave ambos os Matrases com agar e a uma amostra de cada par por 20 min com uma configuração de escape lento.
- Depois da autoclave, coloca os frascos cónicos com ágar em um banho de água de 45 ° C até atingirem o equilíbrio (cerca de 30 min). Não coloque qualquer slurries de amostra em banho-maria até ter arrefecido a 45 ° C.
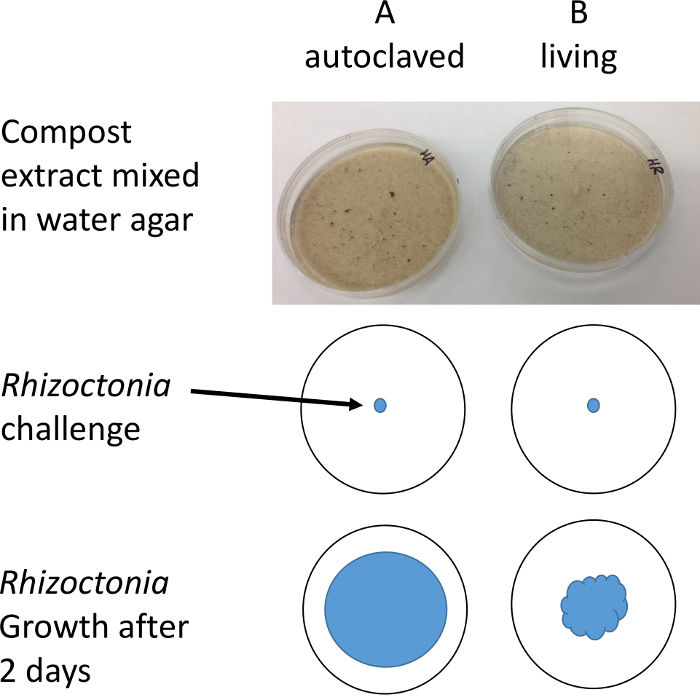
Figura 2: ilustração do protocolo. Plugues de r. solani são colocados em placas de Petri contendo extrato de água de adubo. O diâmetro do crescimento micelial é medido após 1-2 dias com o auxílio de um microscópio estéreo para melhorar a resolução e contraste. Clique aqui para ver uma versão maior desta figura.
- Despeje o chorume de adubo A amostra (referência autoclavados) o ágar fundido do balão A agar. Agitar o frasco para dispersar o adubo sobre o agar.
- Despeje o ágar fundido do frasco B ágar, o chorume de adubo B amostra (amostra). Agitar o frasco para dispersar o adubo sobre o agar.
- Despeje a mistura de cada balão em cinco pratos de Petri plástico que são de 100 mm de diâmetro.
- Deixe a noite legal de placas para que o ágar endurece.
3. Adicione o desafio de Rhizoctonia
- Utilizando técnica asséptica, transferir pedaços de tamanho igual de r. solani para cada par de placas de ágar de amostra (3 a 5 mm corkborer funciona bem para estabelecer pedaços de tamanhos iguais). Pegue pedaços da colônia da margem externa da colônia para segurar o micélio está crescendo ativamente.
Nota: Trabalhar em uma capa de fluxo laminar ou limpar uma bancada de laboratório com 10% de lixívia ou 70% de etanol. - Incube as placas em temperatura ambiente por 1-2 dias até que o crescimento da colônia atinge cerca de meio caminho até a borda das placas A.
4. medida de r. solani crescimento
- Medir o raio do micélio em cada placa para o mais próximo 1 mm com uma régua plana claro usando um microscópio estéreo com iluminação transmitida.
Nota: Iluminação de campo escuro ou oblíqua será mais fácil de ver e medir as hifas transparentes. Neste ponto, zonas de inibição será visíveis ao redor fragmentos de adubo na placa B se o adubo é supressivo. - Gravar o raio em três lugares por placa e calcular uma média dos três para servir como uma medida representativa.
- Subtrai a média das placas das placas A B. Se B < A então existem micróbios nas placas de B que são supressivos ao patógeno r. solani .
- Divida o raio médio pelo número de dias de desafio para expressar unidades de supressão relativa como uma taxa, micélio mm por dia.
Resultados
Adubo terminado deve ser estável e maduro, dois termos que frequentemente são utilizados indistintamente, portanto pode com segurança ser embalado e transportado e não causa efeitos adversos durante a sua utilização final4. Estabilidade é uma resistência à decomposição e geralmente é determinada usando índices de atividade microbiana. Medidas gerais da respiração microbiana podem medir a estabilidade de adubo, mas não necessariamente doenç...
Discussão
Sabemos por pesquisas anteriores, que certos compostos são eficazes na supressão de r. solani e que os efeitos supressivos são devido os micróbios que vivem no adubo, não as propriedades abióticos de adubo6,8. O uso de autoclave como um meio para 'matar' a microbiota tem sido criticado porque afeta a química do carbono da mídia10. Comparou-se o uso de autoclave a vácuo filtração através de papel Whatman n º 1. Tratame...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
O Vermont agrícola Experiment Station competitiva Hatch programa VT-HO1609 financiou a pesquisa. Lynn Fang usou o método como parte de sua tese de M.S. na Universidade de Vermont6.
Materiais
| Name | Company | Catalog Number | Comments |
| autoclavable narrow-neck glass conical flask | Fisher Scientific | 10-040D | 125-mL |
| autoclavable glass testtubes | Fisher Scientific | 14-925J | 25-mL |
| dehydrated granulated agar | Fisher Scientific | DF0145-17-0 | 500 g quantity |
| heat resistant gloves | Fisher Scientific | MEMGG1314WL | several brands available |
| Parafilm (strips of 2-3 cm wide) | Fisher Scientific | PM992 13-374-16 | 5 or 10 cm widths work |
| disposable polystyrene petri dishes | Fisher Scientific | R80116 | comes in sleeves of 20/ea or cases of 500 |
| dehydrated potato dextrose agar | Fisher Scientific | DF0013-15-8 | comes in quantities of 100, 500 and 2000 grams |
| benchtop reciprocal shaker | Thomas Scientific | 1227Y31 | other models will work |
| water bath | ThermoScientific | S37363 | 5L general purpose |
| clear ruler, flat, at least 10 cm | Any | use metric rule | |
| ATCC culture | American Type Culture Collection | ATCC 10154 | teleomorph Thanatephorus cucumeris (Frank) (ATCC 10154) or MYA 4031; |
| lab tape | Fisher Scientific | 15935 | autoclavable and removable, 1" wide preferred |
| water resistant marker | office or scientific supply | Sharpie fine tip | write sample number on tape |
Referências
- Gonzalez Garcia, G., Onco, M. A. P., Susan, V. R. Review. Biology and systematics of the form genus Rhizoctonia. Spanish Journal of Agricultural Research. 4 (1), 55-79 (2006).
- Bonanomi, G., Antignani, V., Pane, C., Scala, E. Suppression of soilborne fungal diseases with organic amendments. Journal of Plant Pathology. 89, 311-324 (2007).
- Noble, R. Risks and benefits of soil amendment with composts in relation to plant pathogens. Australasian Plant Pathology. 40, 157-167 (2011).
- Wichuk, K. M., McCartney, D. Compost stability and maturity evaluation - a literature review. Canadian Journal of Civil Engineering. 37, 1505-1523 (2010).
- Alfano, G., Lustrato, G., Lima, G., Vitullo, D., Ranalli, G. Characterization of composted olive mill wastes to predict potential plant disease suppressiveness. Biological Control. 3, 199-207 (2011).
- Fang, L. . Biological indicators of compost-mediated disease suppression against the soilborne plant pathogen Rhizoctonia solani. , (2015).
- Bonanomi, G., Antignani, V., Capodilupo, M., Scala, F. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases. Soil Biology and Biochemistry. 42, 136-144 (2010).
- Neher, D. A., Fang, L., Weicht, T. R. Ecoenzymes as indicators of compost to suppress Rhizoctonia solani. Compost Science and Utilization. 25 (4), 251-261 (2017).
- . ATCC® Mycology Culture Guide Available from: https://www.atcc.org/~/media/PDFs/Culture%20Guides/Mycology_Guide.ashx (2018)
- Berns, A. E., Phillip, H., Narres, H. -. D., Burauel, P., Vereecken, H., Tappe, W. Effect of gamma-sterilization and autoclaving on soil organic matter structure as studied by solid state NMR, UV and fluorescence spectroscopy. European Journal of Soil Science. 59, (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados