Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Assay конкуренции плита как быстрой предварительной оценки заболевания подавления
В этой статье
Резюме
Представлено — это протокол для конкуренции assay пластины для идентификации ли конкретные компост может содержать бактерии и грибки, которые подавляют рост Солани ризоктониоза.
Аннотация
Целью было разработать и оптимизировать простой, доступной и эффективной биопроб для обнаружения болезни подавляющих способности конкретной компоста против soilborne гриб ризоктониоза Солани. R. Солани является патогеном широкого круга растения узлов во всем мире. Гриб сохраняется в почве как сапрофитные и растет быстрыми темпами на простой воды агар СМИ. Assay плита является быстрый метод для сравнения компостов для их способность замедлить рост R. Солани. Assay также хорошо коррелирует с подавления других soilborne грибковых патогенов, которые выживают как развернёт в почвах Alternaria ранних губит, фузариозному увяданию, фитофторозом корневым гнилям и Pythium корневой гнили.
Введение
Ризоктониоза представляет собой широкий комплекс грибов, из которых Thanatephorus cucumeris (Франк) Донк (анаморфа = ризоктониоза Солани Кюна) является патогена, вызывая корневым гнилям и затухания от1. Ризоктониоза Солани является агрессивным возбудителя и сапрофитные, которые могут выжить как склероции при неблагоприятных условий окружающей среды1. В результате он имеет глобальное распространение и может вызвать заболевания на широкий спектр узлов растений, включая пасленовых, бобовые, сложноцветных и капустные, что привело к серьезным экономическим потерям.
Компост имеет способность питать биоконтроля агентов для определенных патогенов растений2. Однако, не все компостов так ни они влияют на все патогенов аналогично3. На основе древесины углерода имеет выше лигнина целлюлозы коэффициенты, чем сена или соломы углерода на основе компостов. R. Солани предпочитает легко доступны углерода в солому. В отличие от биологического контроля грибов, таких как Trichoderma spp., являются более эффективными, когда углерода менее доступными. Полезных грибов и бактерий в компост может подавлять болезни растений через конкурс, антагонизм или регулирование роста растений3. Главным образом предлагаемого анализа обнаруживает антагонизм, созданные производства антибиотиков, ecoenzymes или энтеросорбенты, которые наносят ущерб возбудителя.
Bioassays растений являются золотым стандартом для определения компостов пользу или сдерживать рост растений4. Однако, завод bioassays являются длительным (недель до месяцев) для завершения, который может быть больше, чем желаемого и требует больше труда для извлечения растения с корнями для количественного определения тяжести корневых систем. Соответствующе надежные, но быстрее (дней) анализов будет идеально подходит для контроля качества программ. Целью этой статьи является продемонстрировать относительно быстрый и точный тест, чтобы предсказать подавляющих потенциал компоста. Метод был рисунком после Альфано и др. 5 с двумя исключениями, экстракты компост разводили и агар воды был использован вместо картофеля декстроза агар (PDA). R. Солани растет быстрыми темпами на простой воды агар СМИ, тогда как КПК способствовало росту бактерий и других грибков, которые загрязнены культуры6.
Этот assay пластина служит индикатором подавления, которое применяется к ряду патогенов растений, которые выживают в почве как развернёт, включая р. Солани7, Alternaria ранних губит, фузариозному увяданию, фитофторозом корневым гнилям и Pythium корневой гнили. Assay конкуренции плита является полезным для экран ряд продуктов компоста для содержащих сообществ микробов, которые служат в качестве биоконтролирующих агентов почвенными патогеннами. Assay был одним из наиболее последовательных показателей заболевания подавления в коммерческих компост продукты6,8. Продукты были выбраны для их изменения в рецепт, зрелости и производственного процесса.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовьте заранее
- Мастер грибковые культуры (тест организма)
- Заказ от американского типа культуры коллекции, коллекции микробиологии9, teleomorph Thanatephorus cucumeris (Франк) (ATCC 10154) или Мья 4031.
- В качестве альтернативы: Соберите местные изолятов, как авторы. Саженцы красный редис (редька sativus) хорошо работать как приманка растений; Соберите почвы от местоположения, знаны, что имеют историю затухания выключен или корневой гнили, вызванные р. Солани. Сеять семена в почву и изолировать от корня поражений, когда сеянцы 3 до 4 недель.
- Удаление саженцев из почвы и промыть водопроводной воды. Ищите коричневый ткани в регионе гипокотиля между листья и корень (рис. 1).
- Использование единого обрезная лезвие сократить 1 см сегменты гипокотиля или корня, которые имеют коричневый цвет. Используйте стерилизованное пламени щипцы окунуть сегментов в 10% растворе бытовой отбеливатель за 1 мин, следуют 10 s промыть в стерильной воде.
Примечание: Верхней и нижней части стерильного Петри являются полезным контейнеры для этого шага. - Использование стерилизованные пламени щипцы для передачи завода частей внутри бумажное полотенце, чтобы погладить сухой, а затем поместить на поверхности Петри с водой агар (15 g в 1 Л).
- Место Петри внутри пластиковый контейнер с крышкой и инкубировать при комнатной температуре (примерно 20 ° C). Протрите внутри контейнера с 10% отбеливатель или 75% этанола и дайте ему высохнуть на воздухе перед вставкой блюдо.
- Держите изолятов в длительного хранения на минимальной СМИ кукурузная агар скошенном (17 g в 1 Л) (при 5 ° C).

Рисунок 1: симптомы болезни. Почвы, содержащие R. Солани приводит пятнистый всхожесть и создание (слева). Симптомы на проростки редиса происходят как коричневый поражения на гипокотиля (справа). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Использование картофеля декстроза агар пластины (39 g в 1 Л) для посевным материалом для этой пластины assay.
- Сформировать культуру дочь ризоктониоза культуры на картофеля декстроза агар, один или два дня до assay, чтобы застраховать его хорошо устанавливается на пластину культуры перед assay. Запустите дочь культуры путем передачи небольшой кусок (диаметр 10 мм) р. Солани от мастер культуры центр свежие плиты картофеля декстроза агар (рис. 2).
Примечание: Работа в Ламинарный шкаф или протрите вниз на лабораторном столе с 10% отбеливатель или 75% этанола, чтобы свести к минимуму риск загрязнения.
- Сформировать культуру дочь ризоктониоза культуры на картофеля декстроза агар, один или два дня до assay, чтобы застраховать его хорошо устанавливается на пластину культуры перед assay. Запустите дочь культуры путем передачи небольшой кусок (диаметр 10 мм) р. Солани от мастер культуры центр свежие плиты картофеля декстроза агар (рис. 2).
- Автоклав 25 мл пробирки с 10 мл аликвоты дистиллированной воды (2 x число выборок).
2. Подготовка образцов для испытаний
- Добавьте два независимых 0,5 g образцы каждого испытательного образца компоста в 10 мл воды газобетона в 25 мл пробирок. Встряхните пробирки на ночь.
- Ярлык пробирки с уникальным образцом и каждый член пары как (ссылку) или B (образец).
- После 24 часов добавьте 1,5 г простой агар 90 мл дистиллированной воды в двух 125 mLconical колбы.
- Автоклав оба Конические колбы с агар и A выборки каждой пары 20 мин с параметром медленно выхлопных газов.
- После автоклава место Конические колбы с агар в ванну водой 45 ° C, до тех пор, пока они достигают равновесия (около 30 мин). Не ставьте любой образец суспензий в водяной бане до тех пор, пока он остынет до 45 ° C.
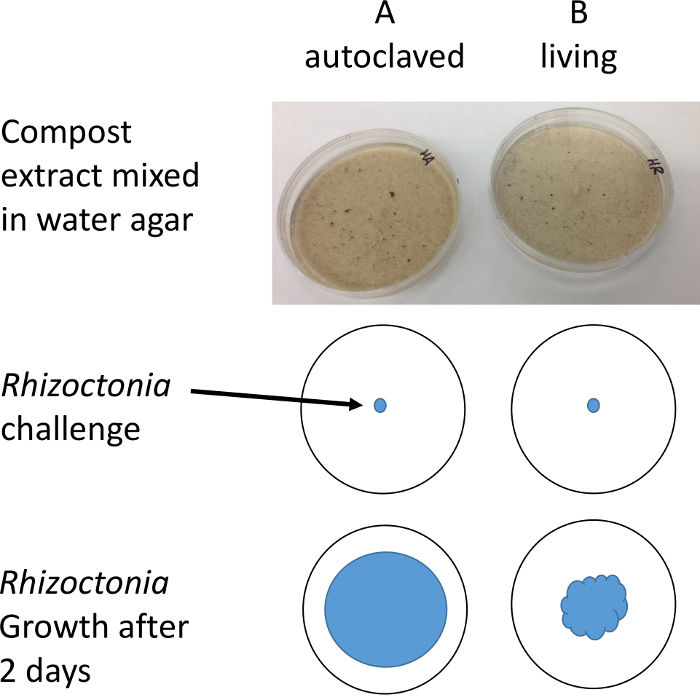
Рисунок 2: Иллюстрация протокола. Вилки R. Солани размещаются на Петри, содержащие компост водный экстракт. Диаметр мицелиальных роста измеряется после 1-2 дней с помощью стерео Микроскоп, чтобы улучшить разрешение и контраст. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Залейте навозной жижи компоста (газобетона справочник) образца A в расплавленный агар агар колбу A. Вихрем разойтись компоста в агар.
- Наливайте в расплавленный агар агар колба B навозной жижи компоста B образец (образец жизни). Вихрем разойтись компоста в агар.
- Вылейте смесь каждого колбу в пяти пластиковых чашек Петри 100 мм в диаметре.
- Пусть прохладно ночь пластины, так агар затвердевает.
3. Добавьте вызов ризоктониоза
- С помощью асептической техники, передачи одинакового размера куски R. Солани к каждой паре плиты агара образца (3-5 мм corkborer работает хорошо для установления равного размера кусков). Возьмите кусочки колонии от внешнего края колонии, чтобы застраховать активно развивается мицелий.
Примечание: Работа в Ламинарный шкаф или протрите вниз на лабораторном столе с 10% отбеливатель или 70% этанола. - Инкубируйте пластины при комнатной температуре 1-2 дня до тех пор, пока рост колонии достигает около половины пути к краю A плит.
4. Измерьте R. Солани роста
- Измерьте радиус мицелий в каждой пластины с точностью до 1 мм с четкой плоский правителя, с помощью стерео микроскоп с передаваемой освещения.
Примечание: Косые или темные области освещения сделают его легче увидеть и измерить прозрачный гифы. На данный момент зон ингибирования будут видны вокруг фрагменты компоста в пластину B Если компост подавляющее. - Запись радиус в трех местах на пластину и вычислить среднее из трех в качестве представителя меру.
- Вычтите среднее B плит из A пластины. Если B < затем есть микробы в B пластины, которые подавляющих R. Солани возбудителя.
- Средний радиус разделите на количество дней вызов выразить единиц относительной подавления как ставка, мицелий мм в день.
Access restricted. Please log in or start a trial to view this content.
Результаты
Законченный компост должен быть стабильным и зрелые, двух терминов, которые часто используются как взаимозаменяемые, поэтому он может безопасно упакованы и доставлены, а не причиной неблагоприятных эффектов во время ее конечного использования4. Стабил...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Из предыдущих исследований, мы знаем, что некоторые компостов являются эффективными на подавление R. Солани и что подавляющее воздействие благодаря микробов, живущих в компост, не абиотических свойства компоста6,8. Использование автоклавирования ка?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Вермонт сельскохозяйственной опытной станции конкурентных Люк программы VT-HO1609 финансирование исследований. Линн Fang используется метод как часть защитила диссертацию магистра в университете штата Вермонт6.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| autoclavable narrow-neck glass conical flask | Fisher Scientific | 10-040D | 125-mL |
| autoclavable glass testtubes | Fisher Scientific | 14-925J | 25-mL |
| dehydrated granulated agar | Fisher Scientific | DF0145-17-0 | 500 g quantity |
| heat resistant gloves | Fisher Scientific | MEMGG1314WL | several brands available |
| Parafilm (strips of 2-3 cm wide) | Fisher Scientific | PM992 13-374-16 | 5 or 10 cm widths work |
| disposable polystyrene petri dishes | Fisher Scientific | R80116 | comes in sleeves of 20/ea or cases of 500 |
| dehydrated potato dextrose agar | Fisher Scientific | DF0013-15-8 | comes in quantities of 100, 500 and 2000 grams |
| benchtop reciprocal shaker | Thomas Scientific | 1227Y31 | other models will work |
| water bath | ThermoScientific | S37363 | 5L general purpose |
| clear ruler, flat, at least 10 cm | Any | use metric rule | |
| ATCC culture | American Type Culture Collection | ATCC 10154 | teleomorph Thanatephorus cucumeris (Frank) (ATCC 10154) or MYA 4031; |
| lab tape | Fisher Scientific | 15935 | autoclavable and removable, 1" wide preferred |
| water resistant marker | office or scientific supply | Sharpie fine tip | write sample number on tape |
Ссылки
- Gonzalez Garcia, G., Onco, M. A. P., Susan, V. R. Review. Biology and systematics of the form genus Rhizoctonia. Spanish Journal of Agricultural Research. 4 (1), 55-79 (2006).
- Bonanomi, G., Antignani, V., Pane, C., Scala, E. Suppression of soilborne fungal diseases with organic amendments. Journal of Plant Pathology. 89, 311-324 (2007).
- Noble, R. Risks and benefits of soil amendment with composts in relation to plant pathogens. Australasian Plant Pathology. 40, 157-167 (2011).
- Wichuk, K. M., McCartney, D. Compost stability and maturity evaluation - a literature review. Canadian Journal of Civil Engineering. 37, 1505-1523 (2010).
- Alfano, G., Lustrato, G., Lima, G., Vitullo, D., Ranalli, G. Characterization of composted olive mill wastes to predict potential plant disease suppressiveness. Biological Control. 3, 199-207 (2011).
- Fang, L. Biological indicators of compost-mediated disease suppression against the soilborne plant pathogen Rhizoctonia solani. , University of Vermont. M.S. Thesis (2015).
- Bonanomi, G., Antignani, V., Capodilupo, M., Scala, F. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases. Soil Biology and Biochemistry. 42, 136-144 (2010).
- Neher, D. A., Fang, L., Weicht, T. R. Ecoenzymes as indicators of compost to suppress Rhizoctonia solani. Compost Science and Utilization. 25 (4), 251-261 (2017).
- American Type Culture Collection. ATCC® Mycology Culture Guide. , Available from: https://www.atcc.org/~/media/PDFs/Culture%20Guides/Mycology_Guide.ashx (2018).
- Berns, A. E., Phillip, H., Narres, H. -D., Burauel, P., Vereecken, H., Tappe, W. Effect of gamma-sterilization and autoclaving on soil organic matter structure as studied by solid state NMR, UV and fluorescence spectroscopy. European Journal of Soil Science. 59, (2008).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены