Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un test de concurrence plaque comme une rapide évaluation préliminaire de la Suppression de la maladie
Dans cet article
Résumé
Présenté est un protocole pour un test de concurrence de plaque déterminer si un compost spécifique est susceptible de contenir des bactéries et des champignons qui inhibent la croissance de Rhizoctonia solani.
Résumé
L’objectif était de développer et optimiser un bioessai de simple, abordable et efficace pour détecter les capacité suppressive de maladie d’un compost spécifique contre le champignon terricole Rhizoctonia solani. R. solani est un pathogène d’une large gamme de plantes-hôtes dans le monde entier. Le champignon survit dans le sol comme un saprophyte et pousse rapidement sur milieu gélosé eau simple. L’essai de plaque est une méthode rapide pour comparer les composts pour leur capacité à ralentir la croissance de r. solani. L’essai corrèle aussi bien avec la suppression d’autres pathogènes fongiques terricole qui survivent en tant que saprophytes dans les sols comme les premiers fléaux Alternaria, fusariose, pourridié phytophthoréen, Pythium et pourriture des racines.
Introduction
Rhizoctonia représente un vaste complexe de champignons, de laquelle Donk Thanatephorus cucumeris (Frank) (anamorphe Rhizoctonia solani Kühn de =) est l’agent pathogène causant la pourriture des racines et la fonte des semis1. Rhizoctonia solani est un pathogène agressif et un saprophyte qui peut survivre comme sclérotes sous des conditions environnementales défavorables1. En conséquence, il a une répartition mondiale et peut provoquer des maladies sur la large gamme de plantes hôtes, y compris les Solanaceae, Fabaceae, Asteraceae et Brassicaceae entraînant des pertes économiques sérieuses.
Compost a la capacité d’abriter des agents de lutte biologique pour certains agents pathogènes de plantes2. Cependant, pas tous les terreaux ne se ressemblent ni ils affectent tous les agents pathogènes de la même façon3. Carbone à base de bois a lignine supérieure aux ratios de cellulose que le foin ou la paille-carbone basé composts. R. solani préfère carbone facilement accessible dans la paille. En revanche, la lutte biologique champignons, tels que les espèces de Trichoderma , sont plus efficaces lorsque le carbone est moins facile d’obtenir. Champignons bénéfiques et les bactéries en compost peuvent supprimer des maladies des plantes par le biais de concours, antagonisme ou régulation de la croissance végétale3. Le test proposé détecte principalement antagonisme créée par la production d’antibiotiques, les ecoenzymes ou les chélateurs qui nuisent à l’agent pathogène.
Plantes biologiques sont un étalon-or pour déterminer si les composts favorisent ou dissuader de croissance végétale4. Cependant, plantes biologiques sont beaucoup de temps (semaines ou mois) pour terminer qui peut être plus longtemps que vous le souhaitez et exige plus de travail pour extraire les plantes avec des racines de quantifier la sévérité des systèmes racinaires. Relativement robuste, mais plus rapide des essais (jours) serait idéales pour les programmes de contrôle de la qualité. L’objectif de cet article est de démontrer un test relativement rapide et précis pour prédire le potentiel suppressive de compost. La méthode a été modelée après Alfano et al. 5 à deux exceptions près, des extraits de compost ont été dilués et gélose aqueuse a été utilisé à la place de la gélose dextrosée à la pomme de terre (PDA). R. solani pousse rapidement sur milieu gélosé simple d’eau tandis que le PDA a favorisé la croissance des bactéries et autres champignons qui a contaminé la culture6.
Cet essai de plaque sert d’indicateur de suppression qui s’applique à un éventail d’agents pathogènes des plantes qui survivent dans le sol comme saprophytes y compris r. solani7, les premiers fléaux Alternaria, fusariose, pourridié phytophthoréen et Pythium pourridié. Le test de concurrence de plaque est utile pour dépister une gamme de produits de compost pour endiguer les communautés de microbes qui servent d’agents de lutte biologique des agents pathogènes du sol. Le test a été un des indicateurs plus constants de la suppression de la maladie dans le compost commercial produits6,8. Produits ont été choisis pour leur variation dans la recette, maturité et processus de production.
Protocole
1. Préparez à l’avance
- Master culture fongique (organisme d’essai)
- Commander auprès de l’American Type Culture Collection, Collection de microbiologie9, par sa téléomorphe Thanatephorus cucumeris (Frank) (ATCC 10154) ou MYA 4031.
- Alternative : Recueillir des souches locales comme fait par les auteurs. Semis de radis rouge (Raphanus sativus) fonctionnent bien comme plante appât ; récupérer la terre d’un endroit connu pour avoir une histoire de pourriture de racine ou de fonte des semis causée par r. solani. Semer les graines dans le sol et isoler des lésions des racines lorsque les semis sont âgés de 3 à 4 semaines.
- Enlever les semis du sol et rincer à l’eau du robinet. Vous cherchez un tissu brun dans la région de l’hypocotyle entre les feuilles et la racine (Figure 1).
- Utiliser une simple lame de rasoir tranchant pour couper les segments de 1 cm de l’hypocotyle ou les racines qui ont une couleur brune. Utiliser forceps stérilisé à la flamme pour tremper les segments en solution à 10 % d’eau de Javel pendant 1 min, suivi d’un rinçage de 10 s dans de l’eau stérile.
Remarque : Le haut et le bas d’une boîte de Petri stérile sont des conteneurs utiles pour cette étape. - Pinces à usage stérilisé à la flamme pour transférer l’usine de pièces à l’intérieur d’une serviette en papier pour pat sécher et puis placer sur la surface d’une boîte de Pétri avec eau gélosée (15 g dans 1 L).
- Placez la boîte de Pétri à l’intérieur d’un récipient en plastique avec un couvercle et laisser incuber à température ambiante (environ 20 ° C). Essuyer l’intérieur du récipient avec l’eau de Javel ou 75 % 10 % d’éthanol et laissez-le sécher à l’air avant d’insérer le plat.
- Garder les isolats dans le stockage à long terme sur un milieu minimal de semoule de maïs gélose inclinée (17 g dans 1 L) (à 5 ° C).

Figure 1 : symptômes de la maladie. Sols contenant r. solani se traduit par la germination inégale et mise en place (à gauche). Sur des semis de radis, les symptômes apparaissent comme des lésions brunes à l’hypocotyle (à droite). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Utilisez des plaques de gélose de dextrose (39 g dans 1 L) de pommes de terre pour l’inoculum pour cet essai de plaque.
- Établir une culture de la fille de Rhizoctonia culture sur gélose dextrosée à la pomme de terre un ou deux jours avant le dosage, afin d’assurer, il est bien établi sur la plaque de culture avant le dosage. Démarrer la culture de la fille en transférant un petit morceau (10 mm de diamètre) de r. solani de la culture de maître au centre d’une nouvelle plaque de gélose dextrosée à la pomme de terre (Figure 2).
NOTE : Travailler sous une hotte à flux laminaire ou essuyer un banc de laboratoire avec 10 % d’éthanol 75 % ou de l’eau de Javel pour minimiser les risques de contamination.
- Établir une culture de la fille de Rhizoctonia culture sur gélose dextrosée à la pomme de terre un ou deux jours avant le dosage, afin d’assurer, il est bien établi sur la plaque de culture avant le dosage. Démarrer la culture de la fille en transférant un petit morceau (10 mm de diamètre) de r. solani de la culture de maître au centre d’une nouvelle plaque de gélose dextrosée à la pomme de terre (Figure 2).
- Autoclave 25 mL tubes à essai avec 10 mL d’eau distillée (2 × nombre d’échantillons).
2. préparation des échantillons pour essai
- Ajouter deux échantillons indépendants 0,5 g de chaque échantillon de compost pour 10 mL d’eau stérilisé dans des éprouvettes de 25 mL. Secouer les tubes à essai du jour au lendemain.
- Étiqueter les tubes à essai avec numéros d’échantillon unique et chaque membre de la paire comme (référence) ou B (échantillon).
- Après 24 h, ajouter 1,5 g de gélose ordinaire à 90 mL d’eau distillée dans des flacons de deux 125 mLconical.
- Autoclave les deux fioles coniques avec agar et l’échantillon A de chaque paire pendant 20 min avec un réglage d’échappement lent.
- Après l’autoclave, placer les fioles coniques avec agar dans un bain d’eau de 45 ° C jusqu'à l’équilibre (environ 30 min). Ne pas mettre n’importe quel coulis de l’échantillon dans un bain-marie jusqu'à ce qu’il ait refroidi à 45 ° C.
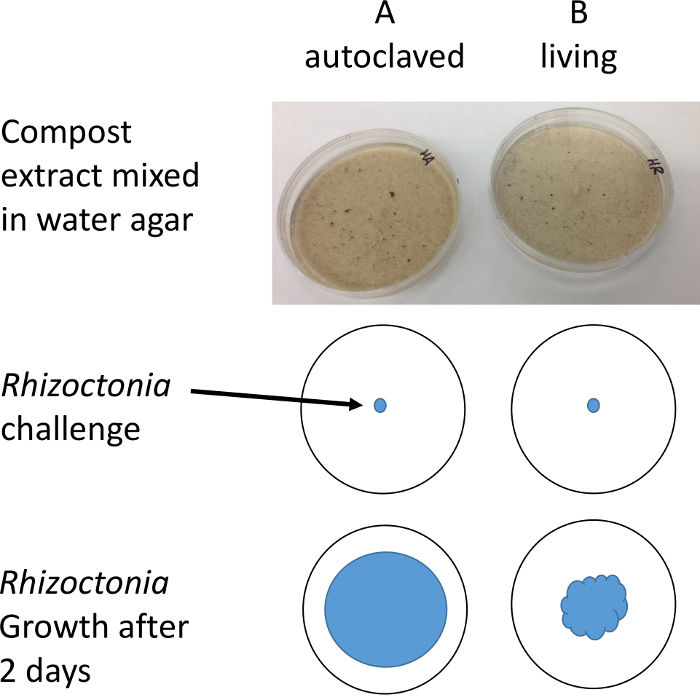
Figure 2 : Illustration du protocole. Bouchons de r. solani sont placés sur des plats de Pétri contenant de compost extrait à l’eau. Le diamètre de la croissance mycélienne est mesuré après 1-2 jours à l’aide d’un microscope stéréo pour améliorer la résolution et le contraste. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Versez le purin de compost A sample (référence autoclavé) dans l’agar fondu de la fiole d’agar A. Agiter pour disperser le compost dans la gélose.
- Versez le purin de compost B sample (échantillon de vie) dans l’agar fondu du flacon B agar. Agiter pour disperser le compost dans la gélose.
- Versez le mélange de chaque fiole dans cinq plats de Pétri en plastique qui sont de 100 mm de diamètre.
- Laisser la nuit fraîche de plaques donc l’agar se durcit.
3. ajouter le défi Rhizoctonia
- À l’aide d’une technique aseptique, transférer des morceaux de taille égale de r. solani sur chaque paire de plaques de gélose échantillon (3 à 5 mm corkborer fonctionne bien pour créer des morceaux de taille égale). Prenez les morceaux de la colonie du bord extérieur de la colonie pour assurer le mycélium est en croissance active.
NOTE : Travailler sous une hotte à flux laminaire ou essuyer un banc de laboratoire avec 10 % d’éthanol eau de Javel ou de 70 %. - Incuber les plaques à température ambiante pendant 1 à 2 jours jusqu'à ce que la croissance de la colonie atteint à mi-chemin vers le bord des plaques A.
4. mesurer la croissance de r. solani
- Mesurer le rayon du mycélium dans chaque assiette 1 mm près avec une règle claire plate à l’aide d’un microscope stéréo avec éclairage transmis.
NOTE : Illumination Oblique ou foncé champ rendra plus facile à voir et mesurer les hyphes transparents. À ce stade, les zones d’inhibition sera visibles autour de fragments de compost dans la plaque B si le compost est suppressif. - Enregistrer le rayon à trois endroits par plaque et calculer une moyenne de trois pour servir une mesure représentative.
- Soustraire la moyenne des plaques des plaques A B. Si B < A puis il y a des microbes dans les plaques de B qui sont suppressives au pathogène r. solani .
- Le rayon moyen de diviser par le nombre de jours de défi pour exprimer les unités de suppression relative sous forme de taux, mycélium de mm par jour.
Résultats
Compost fini doit être stable et mature, deux termes qui sont souvent utilisés indifféremment, donc peut être emballé et transporté en toute sécurité et pas entraîner des effets négatifs au cours de son utilisation finale4. La stabilité est une résistance à la décomposition et est habituellement déterminée à l’aide d’indices de l’activité microbienne. Mesures générales de respiration microbienne peuvent mesurer de stabilité compo...
Discussion
Nous savons par les recherches antérieures, que certains composts sont efficaces pour réprimer r. solani et que les effets suppresseurs sont due à des microbes vivant dans le compost, pas les propriétés abiotiques de compost6,8. L’utilisation de l’autoclave afin de « tuer » microbiote a été critiquée parce qu’elle affecte la chimie du carbone des médias10. Nous avons comparé l’utilisation de l’autoclave pou...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
La recherche financée par le Vermont Agricultural Experiment Station concurrentiel Hatch programme VT-HO1609. Lynn Fang a utilisé la méthode dans le cadre de sa thèse de M.S. à l’Université du Vermont,6.
matériels
| Name | Company | Catalog Number | Comments |
| autoclavable narrow-neck glass conical flask | Fisher Scientific | 10-040D | 125-mL |
| autoclavable glass testtubes | Fisher Scientific | 14-925J | 25-mL |
| dehydrated granulated agar | Fisher Scientific | DF0145-17-0 | 500 g quantity |
| heat resistant gloves | Fisher Scientific | MEMGG1314WL | several brands available |
| Parafilm (strips of 2-3 cm wide) | Fisher Scientific | PM992 13-374-16 | 5 or 10 cm widths work |
| disposable polystyrene petri dishes | Fisher Scientific | R80116 | comes in sleeves of 20/ea or cases of 500 |
| dehydrated potato dextrose agar | Fisher Scientific | DF0013-15-8 | comes in quantities of 100, 500 and 2000 grams |
| benchtop reciprocal shaker | Thomas Scientific | 1227Y31 | other models will work |
| water bath | ThermoScientific | S37363 | 5L general purpose |
| clear ruler, flat, at least 10 cm | Any | use metric rule | |
| ATCC culture | American Type Culture Collection | ATCC 10154 | teleomorph Thanatephorus cucumeris (Frank) (ATCC 10154) or MYA 4031; |
| lab tape | Fisher Scientific | 15935 | autoclavable and removable, 1" wide preferred |
| water resistant marker | office or scientific supply | Sharpie fine tip | write sample number on tape |
Références
- Gonzalez Garcia, G., Onco, M. A. P., Susan, V. R. Review. Biology and systematics of the form genus Rhizoctonia. Spanish Journal of Agricultural Research. 4 (1), 55-79 (2006).
- Bonanomi, G., Antignani, V., Pane, C., Scala, E. Suppression of soilborne fungal diseases with organic amendments. Journal of Plant Pathology. 89, 311-324 (2007).
- Noble, R. Risks and benefits of soil amendment with composts in relation to plant pathogens. Australasian Plant Pathology. 40, 157-167 (2011).
- Wichuk, K. M., McCartney, D. Compost stability and maturity evaluation - a literature review. Canadian Journal of Civil Engineering. 37, 1505-1523 (2010).
- Alfano, G., Lustrato, G., Lima, G., Vitullo, D., Ranalli, G. Characterization of composted olive mill wastes to predict potential plant disease suppressiveness. Biological Control. 3, 199-207 (2011).
- Fang, L. . Biological indicators of compost-mediated disease suppression against the soilborne plant pathogen Rhizoctonia solani. , (2015).
- Bonanomi, G., Antignani, V., Capodilupo, M., Scala, F. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases. Soil Biology and Biochemistry. 42, 136-144 (2010).
- Neher, D. A., Fang, L., Weicht, T. R. Ecoenzymes as indicators of compost to suppress Rhizoctonia solani. Compost Science and Utilization. 25 (4), 251-261 (2017).
- . ATCC® Mycology Culture Guide Available from: https://www.atcc.org/~/media/PDFs/Culture%20Guides/Mycology_Guide.ashx (2018)
- Berns, A. E., Phillip, H., Narres, H. -. D., Burauel, P., Vereecken, H., Tappe, W. Effect of gamma-sterilization and autoclaving on soil organic matter structure as studied by solid state NMR, UV and fluorescence spectroscopy. European Journal of Soil Science. 59, (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon