需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
胸腺标本分离和鸡刺激器官的形成
摘要
本文提供了一种从鹌鹑和鸡胚胎中分离出可结合形成体外嵌合器官的纯胚胎组织的方法。
摘要
分离胚胎组织的能力是建立鸡嵌合体系统的一个重要步骤, 而这又为揭示发育生物学的关键过程提供了无可争辩的贡献。
本文介绍了一种通过显微手术和酶消化从鹌鹑和鸡中分离胚胎组织的优化方法, 同时保持其生物学特性。隔离后, 这两个物种的组织在48小时的体外组织型分析中联系在一起. 鹌鹑和鸡组织可以通过不同的核特征和分子标记来区分, 从而研究细胞间的交叉对话。组织的异种关联。因此, 这种方法是研究具有高度动态空间修饰的发育过程中复杂组织相互作用的有用工具, 例如在咽部形态发生和前肢形成过程中发生的过程内皮衍生器官。本实验方法首次用于研究胸腺形成早期上皮-间充质的相互作用。本文分别从鹌鹑和鸡胚胎中分离出内皮源性的远景胸腺原体和中胚层源性间质。
相关组织产生器官的能力可以通过将它们移植到鸡胚胎的绒毛膜 (cam) 来进一步测试。cam 提供营养, 并允许气体交换到被解释的组织。在奥沃发育10天后, 用常规形态学方法对采集的外植体中的嵌合器官进行分析。这一过程还允许研究器官形成过程中组织特有的贡献, 从其最初的发育 (体外发育) 到器官发生的最后阶段 (在奥沃发育中)。
最后, 改进后的分离方法还提供了三维保存的胚胎组织, 也可用于组织特异性基因表达模式的高分辨率地形分析。
引言
20世纪70年代初, le douarin 开发了一个优雅的鹌尾鸡嵌合体系统, 为了解细胞迁移和细胞相互作用在发育过程中的作用开辟了新的途径 1,2。该模型是在两个物种之间的细胞交换不会明显干扰胚胎发育的前提下设计的, 后来在用于研究包括神经和造血在内的许多发育过程时得到了证实系统1。以后者为例, 首次利用鸡嵌合体系统3观察到了造血祖细胞对胸腺上皮雏形进行殖民的循环波.为此, 胸腺的预期区域, 即第三和第四咽袋 () 的内胚层, 在15至 30-sy像中阶段从鹌鹑 (q) 胚胎中进行了机械和酶分离 [胚胎日 (e) 1.5-e2.5]。这些阶段对应于鸡汉堡包和 hamilton4 (hh)-阶段12-17。隔离程序从使用胰蛋白酶开始, 将内皮从附着的中生酶中分离。分离的内皮在 e3-e3.5 (hh 级 20-21) 被移植到宿主鸡 (c) 胚胎的体细胞区域。这种异源间质被认为是胸腺上皮发育的 "允许", 也有助于器官的形成 3.随后, 鸡寄主血液传播祖细胞的连续波浸润到鹌鹑供体胸腺上皮对应体,有助于宿主胚胎3的胸腺形成。
最近, 这种方法的改进版本也被证明是重要的研究上皮-间充质相互作用的早期阶段胸腺 5.在这方面, 参与嵌合胚胎3中异位胸腺形成的组织从供体胚胎和宿主胚胎中分离, 并在体内相关。采用改进的方案分离了鹌鹑 (e2.5-e3) 和鸡生长激素中胚层 (e2.5-e3)。简单地说, 胚胎组织通过显微手术分离, 并进行体外胰腺素消化。并根据组织类型和发育阶段优化了酶消化条件、培养温度和培养时间 (表 1)。
其次, 分离的组织在一个组织型的体外系统中联系 48小时, 如先前报道的 5,6。组织的体外关联模仿胚胎中的局部细胞相互作用, 克服了体内操作的一些限制。该系统对于研究复杂形态发生事件中的细胞相互作用特别有用, 例如咽部设备的开发。
可以使用 cam 方法 (以前详细的5,7, 8)进一步探讨每个组织在胸腺组织发生中的作用, 以及异种协会产生胸腺的能力。简单地将培养的组织嫁接到 ce8 胚胎的 cam 中, 并允许在体内发育10天。然后, 通过对采集的外植体进行形态学分析, 评价胸腺的形成。与经典的鹌鹑研究3一样, 鹌鹑胸腺上皮被来自鸡胚胎的造血祖细胞 (hpc) 殖民, 后来被证明有助于器官发育9,10.hpc 通过高度血管化的 cam 5、7、8从胚胎迁移到异位嵌合胸腺。鹌鹑源性胸腺上皮可以通过免疫组织化学使用物种特异性抗体 (即 qcpn-mab 鹌鹑环核) 进行鉴定, 克服了对组织特异性分子标记的需求。
这种实验方法, 正如在以前的出版物8中报告的两步方法, 允许调节信号通路通过定期给药剂在体外和奥沃发展。此外, 外植体可以在实验过程的任何时间点收获 8.
最后, 这里详细的隔离协议允许保存胚胎组织的自然特性和三维结构, 特别是用于详细说明胚胎领土的原位基因表达模式, 否则无法进入常规方法。此外, 转录组分析方法, 包括 rna-seq 或微阵列, 也可以应用于孤立的组织, 而不需要遗传标记, 同时提供组织特异性高通量 "组学" 分析。
研究方案
所有这些实验都遵循了 lisboa medicina de medicina académico 中心的动物护理和伦理准则。
1. 施肥鹌鹑和鸡蛋孵育
- 将日本鹌鹑的受精卵放入38°c 的加湿孵化器中3天。将鸡蛋 (鸡蛋钝器端) 面朝上在气室中孵育。
注: 加湿环境是通过在孵化器底部放置一个水容器来实现的。 - 将鸡受精卵 (gallus gallus) 在38°c 加湿孵化器中孵育2.5天。将鸡蛋孵育在水平位置, 并使用一块木炭标记上侧, 以确定胚胎位置。
注: 在建立此实验时, 请从40个鹌鹑蛋和60个鸡蛋开始。
2. 含有胸腺雏形预期域的鹌鹑内皮的分离
注: 在无菌条件下, 使用水平层流罩和灭菌仪器和材料进行鸡蛋操作。
- 取出含有胸腺原状的推定区域的胚胎区域, 即包含第3和第4拱门的咽弓区域, 如7,8所述。
- 用60毫升的冷磷酸盐缓冲盐水 (pbs) 填充一个大的硼硅酸盐玻璃碗 (100 毫米 x50 毫米; 100 厘米 3)。
- 在弯曲剪刀的帮助下, 在已经孵育了3天的鹌鹑蛋的壳上敲击并切割一个圆形的洞。使鸡蛋另一侧的洞变钝, 用冷 pbs 将蛋黄 (与胚胎) 转移到碗中。
- 用弯曲的剪刀将卵黄外的卵细胞膜切割成外胚血管, 将胚胎从蛋黄中取出。
- 在薄钳子的帮助下, 将胚胎转移到一个小碗 (60 毫米 x30 毫米; 15 厘米3), 里面装满了10毫升的冷 pbs。
- 使用脱脂剂, 将胚胎移动到一个100毫米的 petri 培养皿中, 中间有一个黑色的基座 (见材料表), 里面装有10毫升的冷 pbs, 并将其置于立体显微镜下。
- 如前面所述, 对 "par" 进行剖析.
- 使用2毫升无菌巴斯德移液器, 将 "par" 和转移到一个充满冷 pbs 的玻璃盘子四分之三。
- 用胰蛋白酶酶消化, 分离含有胸腺原变 (pp) 推定区域的内皮。
- 在铲子和薄钳子的帮助下, 将 "par" 转移到一个充满冷胰蛋白酶的玻璃盘子四分之三 (8 mg/ml; 1: 3 稀释 25 mgml 与冷 pbs)。
- 在冰上孵化 1小时, 进行酶消化。
注: 酶消化的时间取决于发育阶段 (表 1)。 - 将玻璃盘置于立体显微镜 (40x-60x 放大倍率) 下, 将内胚层与 par 隔离。
注: 在此过程中, 所有表面和溶液保持低温。如果需要很长时间来解剖组织 (& gt;15 分钟), 则改用新的冷胰腺溶液。作为照明源, 考虑到有限的热负荷, 请使用集成在立体显微镜或光纤中的 led 灯。 - 要将内皮从周围组织中分离出来, 请在引脚支架中使用两个不锈钢微手术刀。
注: 使用直径在0.1 毫米至0.2 毫米之间的微手术刀和下巴开口直径为0毫米至1毫米的镍销支架。- 首先取出附着在咽部内侧表面的神经管和中胚层。
- 随着背侧向上, 小心分离并取出咽部拱门之间的中间膜, 露出咽袋。在 "" par "的两侧执行此过程。
- 取出前袋周围的心脏管和间质。
- 随着腹侧向上, 切割第2和第3咽弓的外胚层,并小心地取出贴在袋上的中膜。在 "" "的另一侧重复此过程。在这个阶段, 甲状腺的雏形应该是可见的。
- 用两个微手术刀去除附着在咽部内胚层上的任何剩余间充质细胞。
- 在第2和第3 pp之间进行横向切割, 将含有第3和第4袋的咽部内胚层与具有甲状腺磨擦和 2的内皮前部分离咽袋。
- 在铲子和薄钳的帮助下, 将分离的 pp 内皮转移到一个玻璃盘子四分之三, 里面装满了100% 的冷胎牛血清 (fbs)。
- 在体外试验的准备过程中, 将玻璃盘与隔离的组织放在冰上。或者, 分离的组织可以三维保存和原位分析基因表达。
3. 鸡肌肌膜中胚层的分离
注: 在无菌条件下使用水平层流罩和灭菌仪器和材料进行鸡蛋操作。
- 去除含有长达 19-24 (s19-24) 水平的含有体细胞的胚胎区域。
- 孵育2.5天后, 将鸡蛋从孵化器中取出。
- 用弯曲的剪刀, 在壳上打开一个小孔。插入针头, 用10毫升注射器吸入2毫升白蛋白, 以降低鸡蛋内的白蛋白体积, 防止胚胎受损 (位于壳的标记区域以下)。丢弃吸气白蛋白。
- 使用弯曲的剪刀在外壳的标记区域切割一个圆形孔 (最多三分之二的顶部表面积)。
- 将玻璃体膜从外部切割到胚胎外血管, 同时用薄薄的钳子固定胚胎。
- 在立体显微镜下, 将胚胎放置在一个100毫米的培养皿中, 中间有一个含有10毫升冷 pbs 的黑色基座。
注: 从这一点开始, 使用立体显微镜进行显微手术的渐进放大。 - 使用四个薄薄的昆虫别针将胚胎固定在盘子底部。将针脚放置在胚胎外区域形成正方形。
- 在体细胞19和24之间进行两次切割, 横向到胚胎轴, 并跨越所有胚胎区域, 使用 wecker 眼睛剪刀。
- 通过切割边缘胚胎边缘, 释放胚胎部分, ss19-24。
- 使用2毫升无菌巴斯德移液器, 将19-24 组织和转移到一个充满冷 pbs 的玻璃盘子四分之三。
- 用胰蛋白酶 (8 mg/ml; 1: 3 稀释 25 mgml, 冷 pbs) 从体状胸膜区 (ss19-24) 中分离侧向中胚层。
- 在铲子和薄钳的帮助下, 将19-24 个组织转移到一个玻璃盘子四分之三, 里面充满了冷胰腺素溶液。
- 在冰上孵化 30分钟, 进行酶消化。
- 在立体显微镜下, 使用支架中的两个微手术刀将中胚层与周围组织分离。
注: 在此过程中, 所有表面和溶液保持低温。如果需要很长时间来解剖组织 (gt;10 分钟), 则改用新的冷胰腺溶液。作为照明源, 考虑到有限的热负荷, 请使用集成在立体显微镜或光纤中的 led 灯。 - 在中胚层隔离过程中, 首先取出表面的外胚层, 然后小心脱离位于腹侧的花型胸膜组织。
- 通过在与神经管平行的运动中切割, 释放肌肠的右侧中胚层。
- 重复胚胎左侧的中胚层分离。
注: 在此过程中, 使微手术刀移动缓慢。暴露在外细胞外的基质蛋白粘附在防止液体运动的组织和仪器上。 - 在铲子和薄钳的帮助下, 隔离的中胚层转移到一个玻璃盘子四分之三充满冷 fbs。
- 在体外试验的准备过程中, 将玻璃盘与隔离的组织放在冰上。
4. 我的工作是什么?体外组织型分析: 鹌鹑-pp 内皮和鸡体细胞中胚层异种协会
- 用 rpmi-1640 培养基制备培养基, 辅以10% 的 fbs 和 1% pens-strep3,5。
- 在35毫米培养皿中放置一个金属网格, 培养培养基为5毫升。
注: 去除多余的液体, 使介质表面与网格顶部对位。 - 在薄钳的帮助下, 将滤膜浸入培养基中, 然后将其放置在栅格顶部, 使其与空气接触。
注: 四分之一的膜面积 (直径13毫米) 足以进行组织结合。 - 在立体显微镜下, 将膜过滤器顶部的隔离组织结合起来。首先通过在移植勺子 (或铲子) 和薄钳的帮助下轻轻滑动, 将 pp 内皮 (步骤 2) 从玻璃盘中转移出来。对隔离的中胚层重复此过程 (步骤 3)。
注: 在微手术刀的帮助下, 混合组织, 以最大限度地提高其联系。 - 将相关组织小心地放置在37°c 加湿孵化器中, 在48小时内将 5% co2 置于加湿孵化器中, 培养的组织可以移植到绒毛膜 (cam) 上.
注: 在 cam 中, 异位器官的形成以前是详细的8。
结果
该协议详细介绍了一种分离鸟类胚胎组织的方法, 用于几种细胞和发育生物学技术方法。该方法以前用于研究胸腺形成早期的上皮-间充质相互作用5。这里, 新的结果显示在图 1和图 2中, 使用类似的方法。
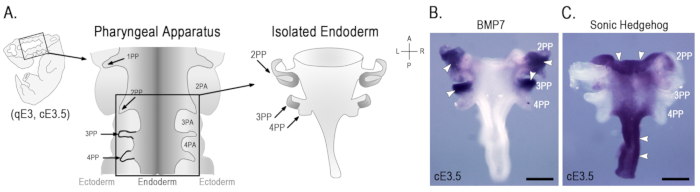 ...
...
讨论
本文详细介绍的胚胎组织分离程序从以前的技术进行了改进, 在不同的生物环境中产生了鸡嵌状胚胎 3,5,6。
这种方法适用于分离纯胚胎组织, 而不需要基因操作或使用组织特异性标记, 这些标记往往是未定的, 限制了转基因动物模型的使用。它可用于研究上皮-间充质相互作用在发展过程中, 与分离纯组织的?...
披露声明
作者没有什么可透露的。
致谢
提交人感谢 isabel alcobia 对手稿的批判性阅读, 感谢对 mário henriques 进行录像的阅读, 并感谢来自 desenvolvimento、medicina de lisboa 组织学处的 vitor proa,里斯本大学, 技术支持。我们特别感谢来自视听单位、里斯本医学研究委员会、里斯本大学的 Faculdade 和 hugo silva 对制作这段视频的杰出承诺。我们感谢 leica 微系统善意地提供配备了视频系统的立体镜和 interaves-sociedade agro-pecuária, s. a 为鹌鹑受精卵做出贡献。这项工作得到了 lisboa 大学 medicina de faculdade de lisboa 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Chicken fertilized eggs (Gallus gallus) | Pintobar, Portugal | Poultry farm | |
| Quail fertilized eggs (Coturnix coturnix) | Interaves, Portugal | Bird farm | |
| 15 mL PP centrifuge tubes | Corning | 430052 | |
| 50 mL PP centrifuge tubes | Corning | 430290 | |
| 60 x 20 mm pyrex dishes | Duran group | 21 755 41 | |
| 100 x 20 mm pyrex dishes | Duran group | 21 755 48 | |
| Metal grid | Goodfellows | fine meshed stainless steel grid | |
| Membrane filter | Millipore | DTTP01300 | 0.6 mm Isopore membrane filter |
| Petri dish, 35 x 10 mm | Sigma-Aldrich | P5112 | |
| 60 x 30 mm pyrex bowls (Small size) | from supermarket | ||
| 100 x 50 mm pyrex bowls (Large size) | from supermarket | ||
| Transfer pipettes | Samco Scientific, Thermo Fisher Scientific | 2041S | 2 mL plastic pipet |
| Glass pasteur pipette | Normax | 5426015 | |
| Clear plastic tape | from supermarket | ||
| Cytokeratin (pan; acidic and basic, type I and II cytokeratins), clone Lu-5 | BMA Biomedicals | T-1302 | |
| Fetal Bovine Serum | Invitrogen, Thermo Fisher Scientific | Standart FBS | |
| Pancreatin | Sigma-Aldrich | P-3292 | Prepare a 25 mg/mL solution according to manufacturer's instructions; centrifuge and filter prior to aliquote and store at -20ºC. Aliquots can be kept frozen for several years. |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin-Streptomycin | Invitrogen, Thermo Fisher Scientific | 15140-122 | |
| Phosphate-Buffered Saline (PBS) | GIBCO, Thermo Fisher Scientific | 10010023 | |
| QCPN antibody | Developmental Studies Hybridoma Bank | QCPN | |
| RPMI 1640 Medium, GlutaMAX Supplement | GIBCO, Thermo Fisher Scientific | 61870010 | |
| Bluesil RTV141A/B Silicone Elastomer 1.1Kg Kit | ELKEM/Silmid | RH141001KG | To prepare the back base for petri dish |
| Dumont #5 Forceps | Fine Science Tools | 11251-30 | Thin forceps |
| Extra fine Bonn scissors, curved | Fine Science Tools | 14085-08 | Curved scissors |
| Insect pins | Fine Science Tools | 26001-30 | 0.3 mm Stainless steel pin |
| Micro spatula | Fine Science Tools | 10087-12 | Transplantation spoon |
| Minutien Pins | Fine Science Tools | 26002-20 | 0.2 mm Stainless steel microscalpel |
| Minutien Pins | Fine Science Tools | 26002-10 | 0.1 mm Stainless steel microscalpel |
| Moria Nickel Plated Pin Holder | Fine Science Tools | 26016-12 | Nickel plated pin holder |
| Moria Perforated Spoon | Fine Science Tools | 10370-17 | Skimmer |
| Wecker Eye Scissor | Fine Science Tools | 15010-11 | |
| Camera | Leica Microsystems | MC170 HD | |
| Microscope | Leica Microsystems | DM2500 | |
| NanoZoomer S360 Digital slide scanner | Hamamatsu Photonics | C13220-01 | |
| Stereoscope | Leica Microsystems | Leica M80 |
参考文献
- Le Douarin, N. The Nogent Institute--50 years of embryology. The International Journal of Developmental Biology. 49 (2-3), 85-103 (2005).
- Le Douarin, N. M., Teillet, M. A. The migration of neural crest cells to the wall of the digestive tract in avian embryo. Journal of Embryology and Experimental Morphology. 30 (1), 31-48 (1973).
- Le Douarin, N. M., Jotereau, F. V. Tracing of cells of the avian thymus through embryonic life in interspecific chimeras. Journal of Experimental Medicine. 142 (1), 17-40 (1975).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Developmental Dynamics. 195 (4), 231-272 (1992).
- Neves, H., Dupin, E., Parreira, L., Le Douarin, N. M. Modulation of Bmp4 signalling in the epithelial-mesenchymal interactions that take place in early thymus and parathyroid development in avian embryos. Developmental Biology. 361 (2), 208-219 (2012).
- Takahashi, Y., Bontoux, M., Le Douarin, N. M. Epithelio--mesenchymal interactions are critical for Quox 7 expression and membrane bone differentiation in the neural crest derived mandibular mesenchyme. Embo Journal. 10 (9), 2387-2393 (1991).
- Figueiredo, M., et al. Notch and Hedgehog in the thymus/parathyroid common primordium: Crosstalk in organ formation. Developmental Biology. 418 (2), 268-282 (2016).
- Figueiredo, M., Neves, H. Two-step Approach to Explore Early-and Late-stages of Organ Formation in the Avian Model: The Thymus and Parathyroid Glands Organogenesis Paradigm Video Link. Journal of Visualuzed Experiments. , (2018).
- Nehls, M., et al. Two genetically separable steps in the differentiation of thymic epithelium. Science (New York, N.Y.). 272 (5263), 886-889 (1996).
- Morahan, G., et al. The nu gene acts cell-autonomously and is required for differentiation of thymic epithelial progenitors. Proceedings of the National Academy of Sciences of the United States of America. 93 (12), 5742-5746 (1996).
- Jerome, L. A., Papaioannou, V. E. DiGeorge syndrome phenotype in mice mutant for the T-box gene, Tbx1. Nature Genetics. 27 (3), 286-291 (2001).
- Nie, X., Brown, C. B., Wang, Q., Jiao, K. Inactivation of Bmp4 from the Tbx1 expression domain causes abnormal pharyngeal arch artery and cardiac outflow tract remodeling. Cells Tissues Organs. 193 (6), 393-403 (2011).
- Zou, D., et al. Patterning of the third pharyngeal pouch into thymus/parathyroid by Six and Eya1. Developmental Biology. 293 (2), 499-513 (2006).
- Davey, M. G., Tickle, C. The chicken as a model for embryonic development. Cytogenetic and Genome Research. 117 (1-4), 231-239 (2007).
- Nowak-sliwinska, P., Segura, T., Iruela-arispe, M. L., Angeles, L. The chicken chorioallantoic membrane model in biology, medicine and bioengineering. Angiogenesis. 17 (4), 779-804 (2014).
- Uematsu, E., et al. Use of in ovo chorioallantoic membrane engraftment to culture testes from neonatal mice. Comparative Medicine. 64 (4), 264-269 (2014).
- Martyn, I., Kanno, T. Y., Ruzo, A., Siggia, E. D., Brivanlou, A. H. Self-organization of a human organizer by combined Wnt and Nodal signaling. Nature. 558 (7708), 132-135 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。