Method Article
P2X7 受体实时活细胞流式细胞仪检测成人神经祖细胞中的钙影响、毛孔形成和吞噬作用
* 这些作者具有相同的贡献
摘要
提供单细胞灵敏度, 实时流式细胞仪是唯一适合量化多模态受体功能的活培养物。利用成体神经祖细胞, 通过钙指示剂检测钙流入、溴化乙酯吸收的跨膜孔形成和荧光乳胶珠的吞噬作用来评估 P2X7 受体功能。
摘要
活细胞流式细胞术越来越多地用于细胞生物学家, 以量化活细胞培养中的生物过程。该协议描述了一种实时细胞流式细胞术的方法, 用于实时分析 P2X7 受体激活的多重功能。使用安装在流式细胞仪上的时间模块, 可以在给定的时间段内评估和绘制活细胞功能, 以探索钙流入、跨膜孔隙形成和吞噬的动力学。这种简单的方法是有利的, 因为 P2X7 受体的所有三个规范功能都可以用一台机器来评估, 随着时间的推移绘制的收集到的数据提供了整个活细胞群体的信息, 而不是经常的单细胞记录使用技术上具有挑战性的膜片钳方法获得。钙流入实验使用钙指示剂, 而 P2X7 孔隙形成检测依靠溴化乙酯被允许通过在高激动剂浓度下形成的跨膜孔。黄绿 (YG) 乳胶珠被用来测量吞噬性。应用特异性激动剂和拮抗剂研究 P2X7 受体活性的影响。单独地, 这些方法可以被修改, 以提供任何数量的钙通道和嘌中华人民共和国和清除剂受体的定量数据。总之, 他们强调了如何使用实时活细胞流式细胞术是一种快速, 具有成本效益, 可重复性, 和可量化的方法来研究 P2X7 受体功能。
引言
嘌中华人民共和国信号转导的研究是广泛和多方面的, 涉及细胞生理学, 生物化学和药理学。Purnetp 信号参与了无数的细胞和分子过程, 从癌症和细胞周期调控到细胞通讯和干细胞生物学;因此, 往往存在一种潜在的调节嘌上的信号转导治疗的好处。在嘌上能受体中, P2X7 受体由于具有多种炎症疾病的治疗靶点潜力, 近年来受到了广泛关注.多年来, 研究受体的方法已经进化并进行了调整, 以促进这项研究 2,3,4,5。本文介绍了一种活细胞流式细胞仪法, 研究 P2X7 受体在成人神经祖细胞中的多重功能, 这些细胞分光法来源于心室下区 (SVZ) 和海马齿状回。
P2X7 受体最初被描述为 P2Z 受体, 或 "细胞死亡" 受体, 因为它的激活与高浓度的三磷酸腺苷 (ATP) 导致形成一个大的跨膜孔渗透分子高达 900 da 6.这导致细胞骨架重组, 跨膜毛孔形成, 并有可能, 细胞凋亡和/或坏死7。传统上, p2x7 的这一功能是通过吸收大分子量染料 (如 yo-pro-1 或溴化乙酯) 来量化的, 当它与 dna 3,8插入时会发光。板材读取器方法是快速的, 并且允许向上缩放, 一般不允许观察动力学。这里描述的方法是基于的吸收, 并允许随着时间的推移观察荧光的增加, 提供了更多的关于孔隙形成速度的信息深度。此后, p2x7 受体被证明有助于一些非免疫功能, 根据接触时间和激动剂浓度9, 10,有不同的反应。通过较低浓度的 ATP 短暂激活导致阳离子流入, 用于神经递质和信号转导 11。使用流式细胞仪测量钙的流入克服了与繁琐且技术上具有挑战性的方法相关的问题, 特别是补丁夹紧以测量内向电流, 这些电流为整个地区的电位变化提供了宝贵的细节细胞膜, 但不允许进行种群分析2。P2x7 受体的第三个功能发生在没有 atp 的情况下, p2x7 受体已被证明有助于免疫系统和神经系统的吞噬9,12,13。显微镜技术的进步使细胞骨架的反应在吸收过程中得以可视化, 尽管定量和种群分析仍然可能带来挑战。
这里详细介绍的活细胞流式细胞仪方法可以实时调查 P2X7 受体的所有三个主要功能。在流式细胞仪上包含时间模块装置, 可在悬浮液中控制温度并持续搅拌细胞。在一秒钟内, 可以提供农化剂和拮抗剂刺激, 几乎不间断地测量细胞反应。这提供了一种快速而简单的方法, 可重复量化功能, 同时避免使用多个检测系统。需要注意的是, 该协议可以很容易地适应任何细胞类型, 并可用于检查其他受体亚型, 因为包括特定的激动剂或抑制剂, 这取决于它们的特性。
研究方案
动物是根据《澳大利亚为科学目的护理和使用动物业务守则》进行治疗的, 并获得格里菲斯大学动物伦理委员会的批准。
1. 成人 SVZ 和海马神经祖细胞的神经球培养
请注意:这里介绍的解剖协议是基于沃克和凯姆佩恩的工作, 在其他地方可以找到从成年小鼠身上解剖神经祖细胞的详细协议.巴布和他的同事15对文化条件进行了修改。使用8–12周的成年雌性 c57bl6 小鼠。
- 在生物安全柜中, 制备培养基 (神经基部培养基), 辅以神经干细胞增殖补充剂、2 m 谷氨酰胺、20 ngml 表皮生长因子 (EGF)、10 ngml 基本成纤维细胞生长因子 (bFGF) 和2μgml肝 素。
- 吸入二氧化碳使两只小鼠安乐死。或者, 根据机构指南麻醉小鼠, 并立即通过宫颈脱位对其实施安乐死。用70% 的乙醇喷洒头部并将其斩首。将每个头部转移到含有汉克平衡盐溶液 (HBSS) 的无菌管中, 用1x 青霉素/链霉素溶液 (P/s)。
- 在解剖显微镜下, 在层流罩中进行解剖。
- 使用钳子和解剖剪刀, 取出组织和骨头, 露出大脑, 并将其转移到含有 HBSS 的无菌培养皿中。
- 将脑侧向上放置, 并使用手术刀刀片, 使一个完整的日冕切口穿过视神经痉挛。用钳子保持大脑稳定, 并使用一个快速, 干净, 向下的运动。避免锯切, 以尽量减少细胞死亡, 并帮助维持组织结构。
请注意:如果不能安全地固定, 大脑可能会在切割过程中向前倾斜, 从而损害从 SVZ 获得的祖细胞的数量。 - 将 SVZ 与大脑的左半部分隔离开来。
- 找到两个心室, 由隔膜隔开, 在它们上面形成一座白桥。
- 使用钳子切除两个心室的隔膜, 并隔离前侧脑室的外侧壁。通过在上面、下面、两侧和前面用精细的解剖剪刀剪掉来做到这一点。将只剩下一个小杯状的形状。
- 准备一个干净的培养皿盖, 中间有几滴 HBSS, 然后将 SVZ 转移到液体中。不要让组织干燥或接触干燥的表面。站在一边, 同时解剖海马。
- 将海马体与大脑的尾端部分隔离开来。
- 在半球之间做一个中线切割, 以切断黄体。使用侧脑室作为指南, 轻轻展开皮层, 以暴露海马体。一旦皮层被展开, 海马体可以被看作是一个密集的, 白色的, 弯曲的结构。
- 使用精细的解剖剪刀或钳子将海马体与邻近组织隔离开来。
- 用钳子去除多余的白质、血管和覆盖海马的任何膜状组织。
- 准备一个干净的培养皿盖, 准备几滴 HBSS, 并将海马体转移到液体中。对另一个半球重复此操作。
- 一旦两只小鼠的海马体和 SVZ 被分离并转移到各自的培养皿盖, 用手术刀刀片机械地将组织切碎。将组织在一个培养皿盖中切碎约 1分钟, 每10秒旋转一次, 直到组织看起来光滑, 只剩下细片。取一个干净的手术刀刀片, 并重复为另一道菜, 切碎的组织1分钟。
- 使用1毫升移液器, 将每个培养皿盖中的所有组织转移到含有 0.25%-乙醇-乙二胺四乙酸 (EDTA) 的1毫升的分开管中。使用一个管的 SVZ 和一个管的海马。
- 首先将大约一半的胰蛋白酶 edta 移注到盘子中的组织, 以最大限度地减少气泡, 并防止该组织在转移到管道时与干燥的移液器尖端接触。用色氨酸 edta 的其余部分冲洗盘子和手术刀刀片, 以收集尽可能多的组织, 并将其添加到试管中。
- 用胰蛋白酶在37°c 的水浴中培养组织 30分钟, 每10分钟搅拌一次管, 以正确分离组织。
- 使用火抛光玻璃巴斯德移液器对组织进行切割, 以创建单个细胞悬浮液。注意不要过度, 因为这会导致过度的细胞裂解。这是最佳组织离解的关键步骤。
- 在拔管过程中观察管内物, 并在大多数组织团块已被切除的最早迹象停止。当细胞进入单细胞悬浮液时, 胰蛋白酶溶液会变得略阴化, 尽管一些团块可能会保留。
请注意:作为一个迹象, 通过悬架向上和向下10x–15x 是足够的。 - 加入培养基, 以中和胰蛋白酶, 并在 300 x g 旋转3分钟. 用 HBSS 再清洗 2x, 并通过70μm 细胞过滤器将培养基取出任何组织团块。
- 将培养基中的所有细胞转移到 T75 细胞培养瓶中。
请注意:在海马培养中, 在7-10天和15-20天后, 在通道零 (P0) SVZ 培养中应该形成球体。在这段时间内, 避免清洗或喂养细胞, 以最大限度地增加培养中神经祖细胞的数量。如果需要更多的祖细胞, 或者为了减少 P0 的孵化时间, 就有可能增加牺牲的老鼠数量。 - 使用5% 的 CO2 将培养保持在 37°c, 并在最初的 P0 培养阶段之后, 根据需要使用生物安全柜和标准组织培养实践, 每7-10天通过一次.
请注意:P0 海马培养应产生足够的球体进入 T25 瓶;SVZ 文化将产生更多的球体, 并可以被传入 T75。如果 P0 海马球体粘附在一起, 则使用200μl 移液器轻轻提起球体。 - 当球体直径达到150至200μm 时通过球体。将球体和介质收集在15毫升管中, 使球体在重力作用下沉淀约 5分钟, 或者在低速 (100 x g) 下旋转2分钟。
- 根据球体的大小, 取出培养基, 用离解试剂分离细胞7-10分钟。
请注意:所使用的离解试剂会对培养的结果产生重大影响, 因此请参阅材料表了解具体情况。 - 在细胞溶液中加入5毫升的 HBSS, 并以 300 x g的离心机清洗细胞, 取出上清液, 在培养基中重新悬浮细胞, 并在 t25 细胞培养瓶或等效培养基中的5毫升培养基中将细胞种子在约 150, 000 毫升。将培养物保持在37°c 和 5% CO2。
- 在进入任何下游协议9之前, 通过识别干细胞标记 (如 Sox2 和 ASCL1) 的表达来确认神经祖细胞状态。
请注意:这可以通过研究人员的首选方法 (例如, 通过显微镜、流式细胞仪或西方印迹进行免疫化学, 或使用定量聚合酶链反应 (qPCR)) 来实现。
2. 流式细胞仪分析单细胞悬浮液的制备
-
准备所需的媒体。其中包括以下内容。
- 制备含有 145 mm 氯化钠、5 mm koh、10 mm Hepes、5 mm d-葡萄糖、0.1% 牛血清白蛋白 (bsa) 和 0.1 mm Ccl 2 的 na +培养基。这种介质也以无钙的形式使用, 省略 0.1 Mm Ccl2 。
- 制备含有 145 mM KCl、5 mM koh、10 mM hepes、5 mM d-葡萄糖和 0.1% BSA 的k+介质。
请注意:这些媒体得到了广泛的优化, 并在以前的出版物4、5 中详细说明。 - 通过称量约20毫升的 100 Mm 库存的 ATP 粉末来准备库存 ATP 。将粉末溶解在17毫升的 KCl 缓冲液中 (145 mM KCl, 5 ML KOH 和 10mm HEPES, pH 7.5) 和缓慢, 在搅拌时, 在溶液中加入2毫升的 18% (w/v) 四甲基氢氧化铵 (TMA), 使 pH 值达到6.8–7.0。
- 将最终音量调整为20毫升。不要超过 ph 值7.0。将库存存放在-80°c;请注意, ATP 等价物至少稳定6个月。
请注意:无水 ATP 的自由分子量为 551.14 g/mol, 这不包括水和二钠分子的分子量, 这些分子的分子量可能因批次而异, 在计算中应加以考虑。TMA 是有毒的, 处理时必须小心。阅读安全数据表, 并准备在烟雾柜中的股票。 - 在超纯 H2o 中溶解 BzATP, 为最终库存浓度为 10Mm, 制备库存 BzATP 。
- 创建步骤1.16 和1.16 中所述的单细胞悬浮液。使用血细胞计或自动细胞计数器计数细胞。为正在进行的实验 (如下所述) 将所需培养基 (例如 na+培养基、培养基) 中的细胞重新利用, 同时将细胞放在冰上。
- 对于每个实验, 确保有足够的样品来包括前向和侧向散射的控制, 以及电压和补偿设置的校准。请注意, 作为一个迹象, 在 T75 烧瓶中生长的球体通常每个烧瓶产生约 8 x10 6个细胞。
-
使用控制样本设置流式细胞仪设置。
- 使用向前和侧面散射, 有选择地启动活细胞。
注: 正向散射提供有关基于光衍射的细胞大小的信息, 而侧面散射提供内部复杂度或粒度的度量。具有小向前和侧面散射的流动事件可被视为死细胞。 - 根据制造商的说明调整流式细胞仪的电压和增益。运行试验样本, 以确保以最大的荧光强度捕获数据。单一渠道收购不需要任何补偿。
- 使用向前和侧面散射, 有选择地启动活细胞。
3. 活细胞流式细胞仪测定钙的影响
- 在制备单细胞悬浮液后, 将细胞重新悬浮在1毫升的无钙Na +介质中, 并根据制造商的协议 (参见材料表) 将其装载到2ng/ml 中, 并使用10μl 的材料表含量为5%。在37°c 下将细胞培养30分钟。
- 加入3-5 毫升的无钙钠 +培养基, 轻轻离心 (200 x克, 4分钟), 清洗细胞。取出上清液, 在无钙na +培养基中重新悬浮细胞, 第二次清洗。
- 将细胞在1毫升的无钙na +培养基中重新移植, 放在冰上, 并使其去酯化30分钟。
- 加入3-5 毫升的 K + 培养基和离心 (200 xg, 4分钟), 清洗1x 以上 ;然后, 将 k+培养基中的细胞重新悬浮, 并以每粒细胞研管 1 x 10 6 细胞的浓度将其插入荧光辅助细胞分选 (facs) 管中。
请注意:每个样本的流式细胞仪管的数量将取决于包括在内的治疗和重复次数。 - 将流式细胞仪管放在冰上, 直到细胞准备好进行分析。不要将细胞长时间放在冰上, 而是尽快开始检测。
- 对于某些样品, 在分析前, 用 P2X7 受体特异性抑制剂 AZ10606120 (10–15分钟 1μm) 或 A438079 (10Μm 30分钟) 或 A438079 (10μm) 预培养细胞。
- 在运行第一个样品前几分钟, 加入 CaCl2 (在流式细胞仪管中的最终浓度为 1 mm), 并将管放入37°c 的水浴中进行回收。
- 将一个干净的小磁力搅拌器放入流式细胞仪管中, 并将管放置在连接到循环37°c 水浴的时间模块中, 以控制样品温度。选择较低的搅拌速度, 以确保样品的运动, 而不会引入涡流效应。将水套管适配器放在样品平台上, 并关闭流式细胞仪的杠杆臂。
- 启动样品采集, 以每秒约 1, 000个事件运行样品3分钟。
- 在40秒标记处, 快速取出管并添加 P2X7 激动剂, 可以是 1 mM ATP 或 300μm BzATP, 然后更换管继续采集。
- 在记录第一个样品时, 用 CaCl2制备第二个样品, 并将其放置在 37°c, 以便细胞在分析前有足够的时间进行热身。一旦第一个样本完成, 通过运行水样本来清洁进气口, 然后第二个样本的采集可以按照步骤3.8 和3.9 中所述开始。始终清洁样品之间的摄入量。
4. 活细胞流式细胞仪测量孔的形成
- 创建步骤1.16 和1.16 中所述的单细胞悬浮液。节省几毫升的旧培养基, 使用它以每 1 x 10 6个细胞的浓度重新悬浮细胞, 每一个流式细胞仪管 100μl, 并将其放在冰上, 直到准备好。
- 在进行检测之前, 加入 900μl的 k +介质, 最终体积为1毫升, 并将管放置在37°c 的水浴中10分钟即可恢复。
- 如果适用, 用预处理对细胞进行预培养, 包括 P2X7 特异性抑制剂 AZ10606120 (10–15分钟为 1μm) 或 A438079 (10μm 为 30分钟)。
- 在进行检测之前, 在流式细胞仪管中加入25μm 溴化物;然后, 加入磁力搅拌器, 按照步骤3.7 将其放置在流式细胞仪机器上, 并开始采集。
请注意:溴化乙酯是有毒的, 在处理时必须小心。适当地处理使用过的流式细胞仪管。 - 为了诱导细胞膜中毛孔的形成, 在采集开始后加入 1 mM ATP 或 100μm BzATP 40秒。
- 以每秒约 1, 000个事件运行样品, 时间为6分钟。
- 在第一个样本运行时, 从冰中取出第二个样本, 放在37°c 的水浴中, 以便细胞在分析前有足够的时间恢复。一旦第一个样品完成采集, 通过运行水样清洗进气口;然后, 第二个样本可以放置在机器上, 开始记录如步骤3.8 和3.9 中所述。
5. 活细胞流式细胞仪检测吞噬细胞增多症
- 创建步骤1.16 和1.16 中所述的单细胞悬浮液。将经过条件的培养基中的细胞重新注入流式细胞联管, 浓度为每100μl 每 FACS 管至少 1 x 10 6 个细胞。用 Na + 培养基将细胞稀释到 1 x10 6细胞的最终浓度 (例如, 加入 900Μl的 na +培养基), 并将细胞放在冰上, 直到进行分析。
- 使用1μm 的 YG 乳胶珠 (微球) 作为吞噬靶点进行实时吞噬检测。
请注意:其他颜色也可以被取代, 但不同大小的珠子被发现是吞噬4的不足够的目标。 - 在运行第一个样本之前, 将细胞转移到37°c 的水浴中, 孵育约 7-10分钟, 使细胞恢复。
-
添加任何需要预先孵育到各自试管的处理方法, 包括15分钟的 1 MM ATP、40分钟的300μm 氧化 ATP (Osatp)、20分钟的20Μm 细胞杯蛋白 D 和20分钟的4% 甲醛 (PFA)。
- 5% 的人血清不需要预孵化。如果大约在同一时间添加治疗方法, 则可以按相反的顺序运行样本, 而其他样本则继续孵育。例如, 先运行对照和血清, 然后运行 atp 处理的样本, 然后是细胞囊素 D 和 PFA, 最后是 osatp。
- 按照步骤3.8 和3.9 中的说明, 将样品与磁力搅拌器一起放置在细胞仪上, 然后启动样品采集。
- 在采集开始后15-20秒从机器上取出样品管, 并加入5μl 未稀释的 YG 珠。返回样品化管并继续采集。以大约 1, 000个事件运行样品7至8分钟。
- 在第一个样本运行时, 从冰中取出第二个样本, 放在 3 7°C 的水浴中, 让细胞在分析前有足够的时间恢复。一旦第一个样本完成, 通过运行水样本来清洁进气口, 然后按照步骤3.8 和3.9 中的说明开始获取第二个样本。
6. 数据分析
- 将数据导出到电子表格。数据分析将取决于实验问题。
请注意:请注意, 不同的运行可能具有不同的基线强度, 因此在添加任何激动剂之前 (约 40秒) 在指定时间 (约 40秒) 运行检测非常重要, 并通过计算荧光 (荧光) 的变化来使数据正常化。在任何给定的时间点 [F] 除以时间点零点 [F0] 或 F/f0) 的荧光。 - 要量化有关 P2X7 函数的速率或动力学, 请计算每10秒时间段16在曲线下产生的面积或梯形之和。
- 为了确定处理的效果, 在最后10-20秒的记录中平均荧光强度, 并对处理进行比较。通过t检验或方差分析来确定其意义。
结果
神经祖细胞培养
使用这种方法得到的神经祖体球体培养应该是相位明亮的, 并且具有平滑的圆边缘 (图 1a, b)。在健康的培养中, 可以在边缘观察到小的微峰 (图 1c)。在后期通道, 或如果喂养不足, 球体可以形成一个空心杯形状 (图 1D) 或大的长方形形状 (图 1D, 用箭头表示)。这些培养物不应用于流式细胞仪或任何其他下游应用, 因为这些特征可能表明差异化。为了确认神经祖者的状态, 细胞被镀到玻璃覆盖物上, 涂覆了多-l-鸟氨酸和层压蛋白, 用于免疫细胞化学 (图 1F,在较高的融合度,图 1F)。对 GFAP、nestin、Sox2、vimentin、ASCL1、BLBP、Progenitor 和 DCX 的细胞进行染色, 以确定细胞为2型祖细胞 (海马) 或 C 型祖细胞 (SVZ)9。细胞应该有一个明确定义的细胞核和扩展的过程。
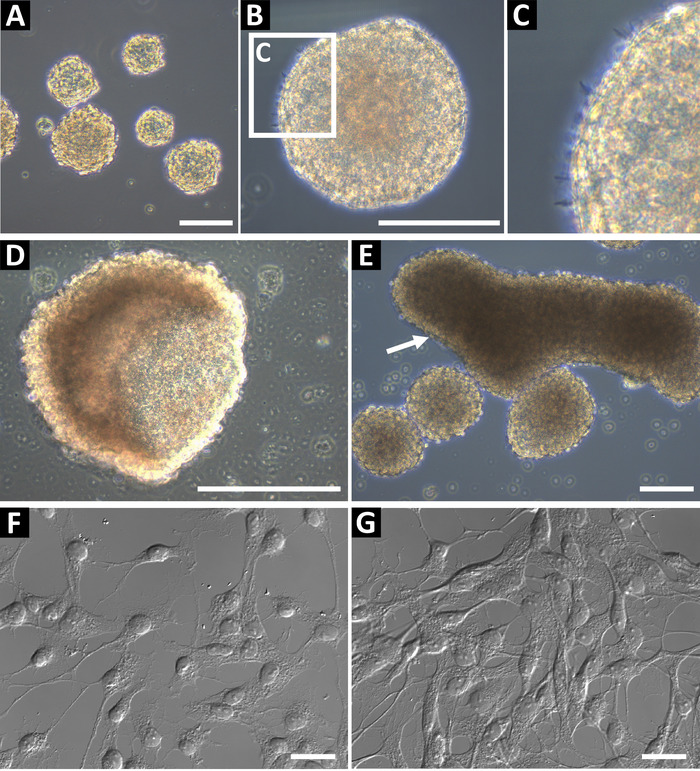
图 1: 代表性海马神经祖细胞培养.(A) 海马神经祖细胞从成年小鼠身上分离, 作为神经球体培养, 直到直径约100至150微米。(B) 神经球应该有一个光滑的外围, (c) 和小微尖峰可以观察到在他们的表面。当球体在文化中太长的时候, 它们可以形成 (d) 杯或 (e) 长方形的形状。这些文化不应用于实验。为了确认细胞的神经祖细胞状态, 将其作为多-l-鸟氨酸 (巴解组织) 和用于免疫化学的层压镀膜玻璃盖板上的单细胞悬浮液。细胞应该有一个小的 soma 和分枝过程, (f) 在低融合和 (g) 准备免疫化学。刻度条 = 100μm. 请点击这里查看此图的较大版本.
活细胞流式细胞仪的钙流入
该协议允许实时分析 P2X7 受体作为钙通道的功能。受体功能的动力学, 以及不同激动剂和拮抗剂的影响, 也可以评估。随着时间的推移, 海马和 SVZ 神经祖细胞中的钙流入通常相似 (分别为图 2a和图 2A)。正如红色箭头所示, 在40秒标记处添加了 Agonists 者 (ATP 或 BzATP)。在短暂的时间内, 将管道从记录点中取出, 以添加激动剂, 从而使数据点为零。这将允许识别添加激动剂的时间。BzATP 迅速激活 P2X7 受体, 打开离子通道并允许钙流入, 与 Fluo-8 和荧光结合。ATP 的应用通常会导致更逐渐的钙流入。与 BzATP 相比, 它与 P2X7 的亲和力较低, 也会导致 g-蛋白偶联受体激活, 这是一种缓慢的信号通路, 从内质网释放钙。纳入 P2X7 拮抗剂 A438079 和 AZ10606120 (未显示数据) 减少了因激动剂应用而产生的钙的流入。
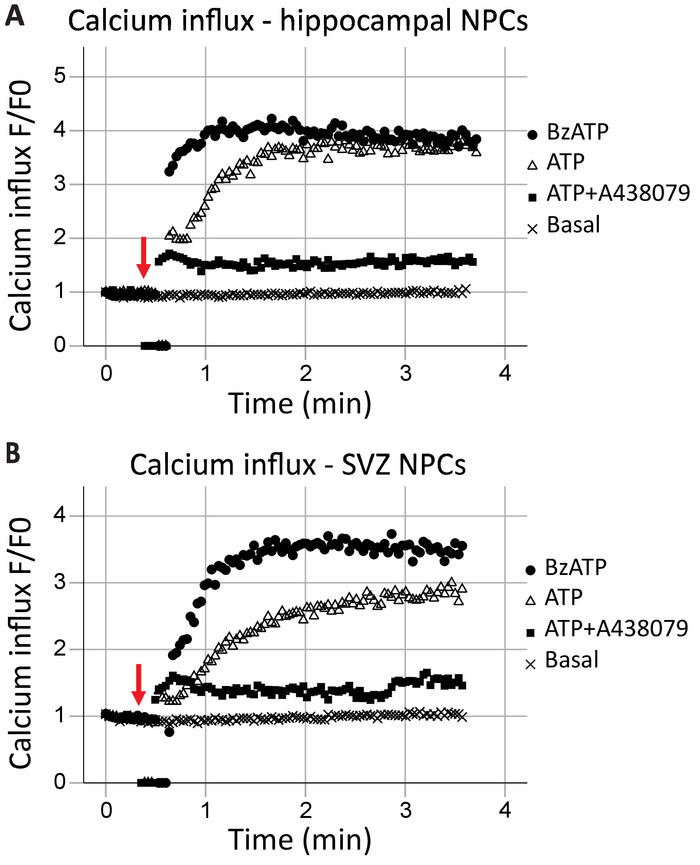
图 2: 海马和 SVZ 神经祖细胞中的活细胞钙流入.P2X7 受体钙通道功能在 (a) 海马和 (b) svz 衍生的祖细胞中表现为氟-8 荧光的变化。一般 P2X 激动剂 ATP 和 P2X7 激动剂 BzATP 的应用导致 P2X7 离子通道的打开, 允许钙流入。P2X7 特异性抑制剂 A438079 或 AZ10606120 (未显示数据) 阻止了流入。F = 荧光;F0 = 零点零点的荧光。请点击这里查看此图的较大版本.
活细胞流式细胞术在孔隙形成中的研究
跨膜孔的形成是 P2X7 受体的典型特征, 导致高分子交换, 并可导致细胞死亡。乙二酯+是一种从健康细胞中排除的大分子 (314 da);它的吸收和随后与 DNA 的插层导致荧光的排放, 并可用于评估 P2X7 受体形成跨膜毛孔的能力。在 40秒 (箭头表示) 应用激动剂 ATP (1 mM ATP) 和 BzATP (100Μm) 后, 时间分辨流式细胞仪实时捕获进入细胞的溴化乙酯 (图 3 a)。P2X7 特异性抑制剂 AZ10606120 削弱了这一效果。溴化乙酯吸收试验显示了一种功能性 P2X7 受体c -末端 17, 是全长 p2x7 受体表达的良好证据。ATP 浓度响应检测说明了激动剂浓度对 P2X7 孔隙形成的影响, 利用随着时间的推移, 溴化乙酯荧光的变化 (图 3B)。Ag奉行药量浓度曲线与受体特异性抑制剂结合使用者剂量浓度曲线为受体活化提供了有力的证据。
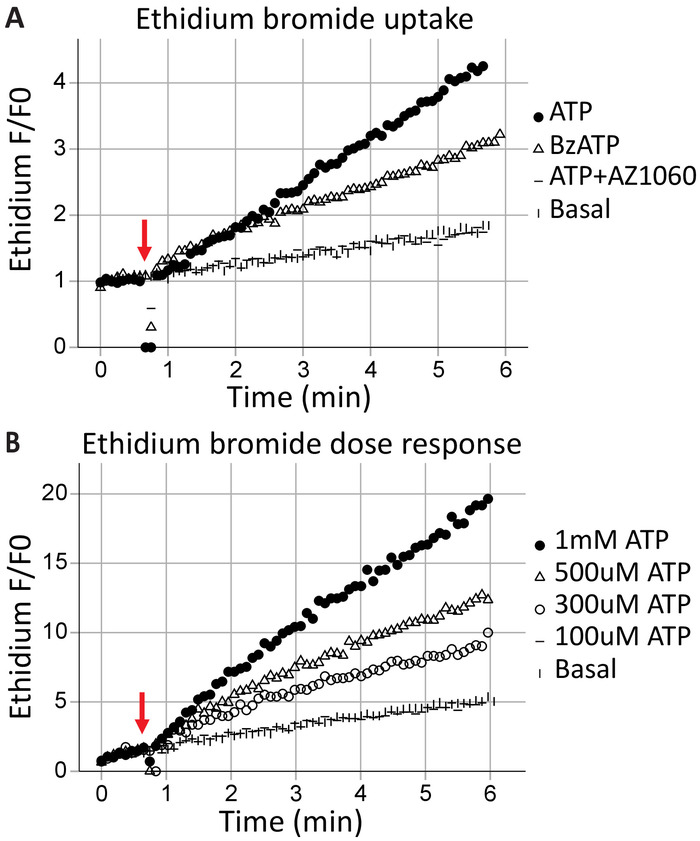
图3:P2X7 跨膜孔形成测量的乙二酸吸收.在采集开始前添加溴化乙酯, 用于测量 P2X7 跨膜毛孔的形成。高浓度的 ATP 和 BzATP 导致 (a) p2x7 受体孢子形成, 允许溴化乙酯进入细胞。P2X7 抑制剂 AZ10606120 减轻了这一现象, 并为功能性 P2X7 受体提供了证据。(B) atp 浓度响应检测表明, 在500μm 和 1 mm 处形成了显著的孔隙, 但在浓度较低的情况下不存在。请点击这里查看此图的较大版本.
活细胞流式细胞术吞噬
本小组先前已经证明, 细胞外 atp 通过从细胞骨架中分离 p2x7 c-末端, 特别是非肌肉肌球蛋白 iia 18,19,抑制p2x7 介导的吞噬。该方法在这些发现的基础上, 显示 P2X7 受体参与参与吞噬的海马和 SVZ 神经祖细胞的实时 (图 4, 海马吞噬的一个例子)。建立了 1μm YG 乳胶珠的不受约束吞噬 (控制) 水平作为阳性对照。ATP 抑制 YG 珠吞噬的程度与非特异性抑制剂相同, 即 PFA 固定和肌动蛋白聚合抑制剂细胞杯 d, 5% 的血清废除了所有先天吞噬20。
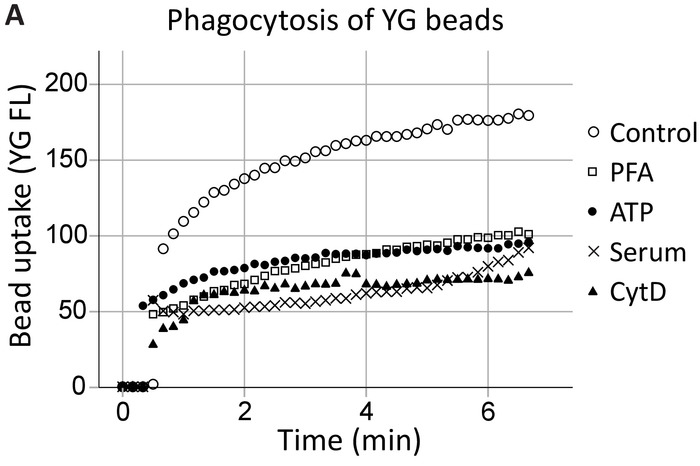
图 4: YG 珠吸收通过 P2X7 受体显示神经祖细胞的吞噬能力.利用活细胞流式细胞仪实时观察到神经祖细胞对 YG 珠的吸收。最初建立了吞噬的控制水平, 如果细胞数量允许, 在运行结束时再次确认。P2X7 受体的参与表现为 ATP 存在时吞噬作用的抑制, 因为这将 c-末端从膜细胞骨架中分离出来, 从而防止 P2X7 介导的细胞骨架重组。ATP 阻断吞噬吞噬的应用与使用非特异性吞噬抑制剂相同的程度, 包括对甲醛 (PFA) 和细胞杯蛋白 D (CytD)。请点击这里查看此图的较大版本.
讨论
本文提出了一种详细的方案, 分析 P2X7 受体在神经祖细胞培养中的功能, 这些受体在成人神经源位的培养中的作用。成人神经祖细胞的潜在应用范围从研究到治疗目的, 因此培养方法必须是稳健和可重复的。此协议有许多关键方面可能会影响终结点区域性的质量。一旦从头骨上取出, 不应允许大脑干燥, 应尽快进行解剖。特别是海马体, 额外注意切除任何血管或膜组织将导致优越的祖细胞产量。分离和三化过程会严重影响在培养中获得的球体数量;在胰蛋白酶 edta 培养过程中搅拌组织将产生更均匀的溶液。强烈建议在 P1000 塑料移液器尖端使用火抛光玻璃牧场移液器, 以减少细胞死亡并改善由此产生的培养。避免过度排尿。尽管采取了这些预防措施, 该程序可以在 P0 培养中产生大量的碎片, 并避免失去祖细胞, 清洗或喂养培养, 应避免, 直到球体形成。
在 P0 下, 海马和 SVZ 培养之间的一些差异将是显而易见的。海马培养产生的球体较少, 这些球体一般都坚持。使用移液器尖端轻轻地提起球体的初始通道。在随后的通道中没有观察到附体。不同品牌的组织培养瓶可能会导致球体, 特别是海马球体, 在菜的底部粘附和生长为菌落。这并没有改变本议定书的任何下游结果, 但应该加以监测, 并应尽可能保持一致性。
以前用于测量 P2X7 受体功能的方法, 如贴片夹紧记录钙的涌入, 既耗时又费力, 可能只提供单个细胞的信息。该协议提出了一种快速、可重复的方法, 可以用一台机器分析 P2X7 受体的所有三大功能。时间分辨活细胞流式细胞仪可进行全群分析, 并为研究人员提供有关钙流入、孔隙形成和吞噬功能的动力学信息。除此之外, 流式细胞术还可以很容易地用作评估标记表达模式和基于细胞大小或蛋白质表达水平的群体分析的方法。
在进行这些实验时, 可以观察到重复次数之间最大钙流入、吸收或吞噬率的差异。为了尽量减少这种情况, 球体大小、培养条件和喂养条件必须一致, 因为细胞的健康将对所取得的结果产生重大影响。冰上的时间也会影响数据, 所以要确保一切都提前准备好, 这样冰上的时间就会最小。确保钙指示剂染料加载时间一致。另一个可能导致最大钙记录大不一致的因素是 ATP 批次之间的差异。ATP 库存的制备至关重要, 应避免在相同的实验中使用不同的批次。还建议比较新旧批次, 以确保 ATP 的一致性。P2X7 拮抗剂的有效性也可能是细胞线和批次相关的, 因此可能需要优化孵育时间和浓度。
值得注意的是, 钙流出是最基本和最复杂的细胞功能之一, 可以通过许多受体介导。Atp 诱导的钙流入, 作为 P2X7 通道/毛孔功能的经典测量, 可能无法准确反映 P2X7 受体的真实功能, 因为 ATP 还可能激活 P2Y 受体释放细胞内钙。在这种情况下, 钡可能是一个更好的阳离子使用, 而不是钙, 因为它的流入是单向16。为了区分钙流入中 P2Y 受体的贡献, 在这种情况下, 可以将 1 mM EDTA 或乙二醇-双 (β-氨基乙醚)-n、N '、N '--四乙酸 (EGTA) 添加到 K+培养基中, 而不是 CaCl2 。测定。
该协议也可以很容易地适应其他细胞类型, 并可用于研究参与吞噬的替代离子通道受体或受体的功能。这种方法也可以适用于没有时间模块的流式细胞仪。例如, 在常规流式细胞仪分析之前7-8分钟添加 YG 珠子时, 可进行吞噬检测。将细胞保持在 37°c, 并持续旋转。这不会提供实时信息, 但在平均最终荧光的差异仍将告知研究人员有关 P2X7 受体的功能。
对 p2x7 受体作为药物靶标21、22甚至作为药物输送路线的兴趣正在迅速增长, 因此, 研究这种神秘受体的方法必须不断调整和改进。促进这些研究。该协议概述了可用于探索 P2X7 在成人神经祖细胞中的功能的方法, 并希望在神经源位中对 P2X7 受体有更深入的了解, 这可能会导致中风治疗的进步和其他缺血性损伤。
披露声明
作者没有什么可透露的。
致谢
作者要感谢玛丽亚·卡斯曼和新黄对这项研究的贡献。这项工作得到了丽贝卡·库珀医学研究基金会向 m. w.、t. c. l. 和澳大利亚国家卫生和医学研究委员会 (NHMRC) 和 Baxter 慈善基金会 (澳大利亚悉尼)。B. g. 得到了澳大利亚研究理事会未来研究金 (FT120100581)、NHMRC 项目赠款 (1048082、1048082和 11200995) 以及维多利亚州政府向 Florey 研究所提供的业务基础设施支助赠款的支持。M. l. 得到了国际视网膜研究基金会 (美国) 查尔斯·D·凯尔曼博士奖 (2010年) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| A438079 | Tocris | 2972/10 | |
| ATP | Sigma-Aldrich | A2383 | |
| AZ10606120 | Tocris | 3323/10 | |
| bzATP | Sigma-Aldrich | B6396 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| FACSCalibur | Becton Dickinson | ||
| Fluo-8AM | AAT-Bioquest | 21080 | Fluo-4AM and Fura-Red AM have also been used successfully |
| Fluoresbrite YG Microspheres | Polysciences Inc | 17154-10 | 1.00 µm, yellow-green |
| Glutamine | ThermoFisher Scientific | 25030081 | 200 mM |
| HBSS | ThermoFisher Scientific | 14170112 | |
| Heparin | Sigma-Aldrich | H3149 | |
| NeuroCult Basal Medium | Stemcell Technologies | 5700 | Mouse and rat |
| NeuroCult Proliferation Supplement | Stemcell Technologies | 5701 | Mouse and rat |
| Oxidized ATP | Sigma-Aldrich | A6779 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | pluronic acid |
| Recombinant Murine EGF | Peprotech | 315-09 | |
| Recombinant Murine FGF-basic | Peprotech | 450-33 | |
| Tetramethylammonium Hydroxide | Sigma-Aldrich | T7505 | |
| Time Zero Module | Cytek Biosciences | ||
| Tissue culture flasks | BD Falcon (Corning) | 353108 (T25), 353136 (T75) | Blue vented screw cap |
| TrypLE Express | Gibco | 12604013 | |
| Trypsin-EDTA (0.25%) | ThermoFisher Scientific | 25200056 | with phenol red |
| UltraPure Ethidium Bromide | ThermoFisher Scientific | 15585011 | 10 mg/mL |
参考文献
- Sperlagh, B., Illes, P. P2X7 receptor: an emerging target in central nervous system diseases. Trends in Pharmacological Sciences. 35 (10), 537-547 (2014).
- Liang, X., et al. Quantifying Ca2+ current and permeability in ATP-gated P2X7 receptors. Journal of Biological Chemistry. 290 (12), 7930-7942 (2015).
- Rat, P., Olivier, E., Tanter, C., Wakx, A., Dutot, M. A fast and reproducible cell- and 96-well plate-based method for the evaluation of P2X7 receptor activation using YO-PRO-1 fluorescent dye. Journal of Biological Methods. 4 (1), 64(2017).
- Gu, B. J., et al. A quantitative method for measuring innate phagocytosis by human monocytes using real-time flow cytometry. Journal of Quantitative Cell Science: Cytometry Part A. 85 (4), 313-321 (2014).
- Jursik, C., et al. A quantitative method for routine measurement of cell surface P2X7 receptor function in leucocyte subsets by two-colour time-resolved flow cytometry. Journal of Immunological Methods. 325 (1-2), 67-77 (2007).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272 (5262), 735-738 (1996).
- Delarasse, C., et al. Neural progenitor cell death is induced by extracellular ATP via ligation of P2X7 receptor. Journal of Neurochemistry. 109 (3), 846-857 (2009).
- North, R. A. Molecular physiology of P2X receptors. Physiological Reviews. 82 (4), 1013-1067 (2002).
- Leeson, H. C., et al. P2X7 Receptors Regulate Phagocytosis and Proliferation in Adult Hippocampal and SVZ Neural Progenitor Cells: Implications for Inflammation in Neurogenesis. Stem Cells. , (2018).
- Glaser, T., et al. Modulation of mouse embryonic stem cell proliferation and neural differentiation by the P2X7 receptor. PLoS One. 9 (5), e96281(2014).
- Papp, L., Vizi, E. S., Sperlagh, B. Lack of ATP-evoked GABA and glutamate release in the hippocampus of P2X7 receptor-/- mice. Neuroreport. 15 (15), 2387-2391 (2004).
- Wiley, J. S., Gu, B. J. A new role for the P2X7 receptor: a scavenger receptor for bacteria and apoptotic cells in the absence of serum and extracellular ATP. Purinergic Signalling. 8 (3), 579-586 (2012).
- Lovelace, M. D., et al. P2X7 receptors mediate innate phagocytosis by human neural precursor cells and neuroblasts. Stem Cells. 33 (2), 526-541 (2015).
- Walker, T. L., Kempermann, G. One mouse, two cultures: isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of Visualized Experiments. (84), e51225(2014).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Frontiers in Neuroscience. 5, 89(2011).
- Gu, B. J., Wiley, J. S. Broad applications of mulit-colour time-resolved flow cytometry. Flow Cytometry - Recent Perspectives. , (2012).
- Cheewatrakoolpong, B., Gilchrest, H., Anthes, J. C., Greenfeder, S. Identification and characterization of splice variants of the human P2X7 ATP channel. Biochemical and Biophysical Research Communications. 332 (1), 17-27 (2005).
- Gu, B. J., Saunders, B. M., Jursik, C., Wiley, J. S. The P2X7-nonmuscle myosin membrane complex regulates phagocytosis of nonopsonized particles and bacteria by a pathway attenuated by extracellular ATP. Blood. 115 (8), 1621-1631 (2010).
- Gu, B. J., Rathsam, C., Stokes, L., McGeachie, A. B., Wiley, J. S. Extracellular ATP dissociates nonmuscle myosin from P2X(7) complex: this dissociation regulates P2X(7) pore formation. American Journal of Physiology-Cell Physiology. 297 (2), C430-C439 (2009).
- Gu, B. J., et al. P2X7 receptor-mediated scavenger activity of mononuclear phagocytes toward non-opsonized particles and apoptotic cells is inhibited by serum glycoproteins but remains active in cerebrospinal fluid. Journal of Biological Chemistry. 287 (21), 17318-17330 (2012).
- Bhattacharya, A. Recent Advances in CNS P2X7 Physiology and Pharmacology: Focus on Neuropsychiatric Disorders. Frontiers in Pharmacology. 9 (30), (2018).
- Burnstock, G., Knight, G. E. The potential of P2X7 receptors as a therapeutic target, including inflammation and tumour progression. Purinergic Signalling. 14 (1), 1-18 (2018).
- Alves, L. A., et al. Pore forming channels as a drug delivery system for photodynamic therapy in cancer associated with nanoscintillators. Oncotarget. 9 (38), 25342-25354 (2018).
- Pacheco, P. A., et al. P2X7 receptor as a novel drug delivery system to increase the entrance of hydrophilic drugs into cells during photodynamic therapy. Journal of Bioenergetics and Biomembranes. 48 (4), 397-411 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。