Method Article
In tempo reale Live-cella flusso Cytometry per indagare l'afflusso del calcio, la formazione del poro e fagocitosi dai recettori P2X7 in cellule progenitrici neurali adulto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Fornire sensibilità unicellulare, citometria a flusso in tempo reale è in grado di quantificare le funzioni del ricevitore multimodale di culture vivono. Utilizzando cellule progenitrici neurali adulte, la funzione del recettore P2X7 è stata valutata tramite afflusso del calcio rilevato dal colorante indicatore di calcio, la formazione dei pori transmembrana dall'assorbimento di bromuro di etidio e fagocitosi utilizzando granuli di lattice fluorescente.
Abstract
Citometria a flusso di cellule vive sempre più viene utilizzato fra i biologhi delle cellule per quantificare i processi biologici in un vivente coltura cellulare. Questo protocollo descrive un metodo per cui vivere-cella flusso cytometry è esteso al momento per analizzare le molteplici funzioni dell'attivazione del recettore P2X7 in tempo reale. Utilizzando un modulo di tempo installato su un citometro a flusso, cellule vive funzionalità possono essere valutati e tracciati nel corso di un determinato periodo di tempo per esplorare la cinetica dell'afflusso del calcio, la formazione dei pori transmembrana e fagocitosi. Questo semplice metodo è vantaggioso, come tutte le tre funzioni canoniche del recettore P2X7 possono essere valutate utilizzando una sola macchina, e i dati raccolti tracciati nel tempo forniscono informazioni sull'intera popolazione di cellule vive anziché cella singola registrazioni spesso ottenuti utilizzando metodi di patch-clamp tecnicamente impegnativo. Esperimenti di afflusso del calcio usare un colorante indicatore di calcio, mentre P2X7 poro formazione analisi contano il bromuro di etidio essendo autorizzato a passare attraverso del transmembrane del poro formati su concentrazioni elevate dell'agonista. Granuli di lattice di colore giallo-verde (YG) sono utilizzati per misurare la fagocitosi. Antagonisti e gli agonisti specifici vengono applicati per studiare gli effetti dell'attività del recettore P2X7. Individualmente, questi metodi possono essere modificati per fornire dati quantitativi su qualsiasi numero di canali del calcio e dei recettori purinergici e scavenger. Presi insieme, essi sottolineano come l'uso di citometria a flusso di cellule vive in tempo reale è un metodo rapido, conveniente, riproducibile e quantificabile per studiare la funzione del recettore P2X7.
Introduzione
Lo studio delle segnalazione purinergic è vasta e multiforme, che coinvolgono farmacologia, biochimica e fisiologia cellulare. Segnalazione purinergic è coinvolto in un numero infinito di processi cellulari e molecolari, da cancro e regolazione del ciclo cellulare per comunicazioni cellula-cellula e biologia delle cellule staminali; come tale, esiste spesso un potenziale di modulare purinergic segnalazione per un beneficio terapeutico. Dei recettori purinergici, recettore P2X7 ha ricevuto l'attenzione significativa negli ultimi anni dovuto il relativo potenziale come obiettivo terapeutico per numerose condizioni infiammatorie1. Metodi per studiare il recettore hanno evoluto ed è stati adattati nel corso degli anni per facilitare questa ricerca2,3,4,5. Qui, descriviamo un metodo di citometria a flusso di cellule vive per studiare le funzioni multiple dei recettori P2X7 in cellule progenitrici neurali adulte derivate dalla zona subventricolare (SVZ) e giro dentato dell'ippocampo.
Il recettore P2X7 in primo luogo è stato descritto come il recettore P2Z, o il recettore 'morte cellulare', come la sua attivazione con alte concentrazioni di adenosina trifosfato (ATP) risultati nella formazione di un grande poro transmembrana permeabile alle molecole fino a 900 Da6. Questo porta ad un riarrangiamento del citoscheletro, formazione dei pori transmembrana e, potenzialmente, apoptosi e/o necrosi7. Tradizionalmente, questa funzione di P2X7 è quantificata mediante l'assorbimento di coloranti di grande peso molecolare come YO-PRO-1 o etidio bromuro, che reagiscono in quando intercalate con DNA3,8. Metodi di lettore di piastra, che sono rapidi e consentono per upscaling, generalmente non consentono l'osservazione della cinetica. Il metodo qui descritto si basa sull'assorbimento di etidio e consente l'aumento di fluorescenza devono essere rispettate nel corso del tempo, fornendo una maggiore profondità di informazioni per quanto riguarda la velocità di formazione del poro. Dei recettori P2X7 da allora sono stati indicati per facilitare un numero di funzioni non immune, con risposte distinte a seconda dell'esposizione tempo e agonista concentrazione9,10. Breve attivazione dalle concentrazioni più basse di ATP provoca catione afflusso ai fini del neurotrasmettitore e segnale di trasduzione11. Mediante citometria a flusso per misurare l'afflusso del calcio supera i problemi associati ai metodi ingombranti e tecnicamente impegnativi — in particolare, patch di bloccaggio per misurare correnti interne che forniscono preziosi dettagli per quanto riguarda il cambiamento di potenziale attraverso una membrana cellulare, ma non consente per popolazione analisi2. La terza funzione dei recettori P2X7 si verifica in assenza di ATP, dove i recettori P2X7 sono stati dimostrati per facilitare la fagocitosi in sia il sistema immunitario e il sistema nervoso9,12,13. Gli avanzamenti nelle tecniche di microscopia hanno permesso la visualizzazione dei riarrangiamenti citoscheletrici durante il processo di assorbimento, anche se analisi quantificazione e popolazione può ancora presentare una sfida.
Il metodo di citometria a flusso di cellule vive dettagliato qui consente per l'indagine su tutte le tre funzioni principali dei recettori P2X7 in tempo reale. L'inserimento di un dispositivo di modulo tempo sul citofluorimetro permette il controllo di temperatura e agitazione continua delle cellule in sospensione. Agonista e antagonista stimoli possono essere consegnati entro un secondo, consentendo la misurazione di ininterrotta nei pressi della risposta cellulare. Questo presenta un metodo rapido e semplice per quantificare riproducibile funzione, evitando l'utilizzo di più sistemi di dosaggio. È importante notare che questo protocollo può essere facilmente adattato per soddisfare qualsiasi tipo di cellula e potrebbe essere usato per esaminare altri sottotipi di recettori in considerazione l'inclusione di agonisti specifici o inibitori, a seconda delle loro proprietà.
Protocollo
Animali sono stati trattati in conformità con il codice di pratica australiana per la cura e l'uso di animali per scopi scientifici e approvati per l'uso dal comitato di etica animale di Griffith University.
1. Neurosphere cultura di cellule progenitrici neurali SVZ adulta e ippocampo
Nota: Il protocollo di dissezione qui presentato si basa sul lavoro di Walker e Kempermann e un protocollo dettagliato per la dissezione delle cellule progenitrici neurali da topi adulti è disponibile altrove14. Condizioni di coltura sono state modificate da Babu e colleghi15. Sono stati utilizzati topi C57BL/6 femminili adulti 8 – 12 settimane di età.
- In una cappa di sicurezza biologica, preparare il terreno di coltura (neurale medio basale) completato con supplemento di proliferazione delle cellule staminali neurali, glutamina 2mm, 20 ng/mL fattore crescita epidermico (EGF), fattore di crescita di 10 ng/mL base del fibroblasto (bFGF) e 2 µ g/mL eparina.
- Eutanasia due topi da inalazione di CO2 . In alternativa, anestetizzare i topi secondo le linee guida istituzionali e immediatamente li eutanasia di dislocazione cervicale. Spruzzare le loro teste con etanolo al 70% e decapitare loro. Trasferire ogni testa in una provetta sterile contenente soluzione salina bilanciata di Hank (HBSS) con soluzione 1x penicillina/streptomicina (P/S).
- Eseguire dissezioni in cappa a flusso laminare sotto un microscopio di dissezione.
- Utilizzando le forbici pinze e dissezione, rimuovere tessuti e ossa per esporre il cervello e trasferirlo in un piatto sterile contenente HBSS con P/S.
- Posizionare il lato ventrale del cervello fino e utilizzare un bisturi per effettuare un'incisione della corona completa attraverso il chiasma ottico. Tenete fermo il cervello con il forcipe e utilizzare uno swift, pulito, movimento verso il basso. Evitare il taglio per ridurre al minimo la morte delle cellule e per aiutare a mantenere la struttura del tessuto.
Nota: Se non tiene saldamente, il cervello può inclinare in avanti durante il taglio, compromettere il numero di cellule progenitrici ottenute dalla SVZ. - Isolare il SVZ dalla metà rostrale del cervello.
- Individuare entrambi i ventricoli, separati da setto, con il corpo calloso formando un ponte bianco sopra di loro.
- Utilizzare pinze per rimuovere il setto che separa i due ventricoli e isolare le pareti laterali dei ventricoli laterali anteriori. Questo scopo, tagliando via sopra, sotto, ai lati e nella parte anteriore con le forbici dissezione bene. Ci rimane solo una piccola tazza-come forma.
- Preparare un coperchio piatto pulito di Petri con poche gocce di HBSS nel mezzo e trasferire la SVZ al liquido. Non lasciare il tessuto a secco o di toccare una superficie asciutta. Stare al lato mentre ippocampi di dissezione.
- Isolare gli ippocampi dalla metà caudale del cervello.
- Tagli una linea mediana tra gli emisferi di recidere il corpo calloso. Utilizzare i ventricoli laterali come guida e aprire delicatamente la corteccia per esporre l'ippocampo. Una volta srotolata la corteccia, l'ippocampo può essere visto come una struttura densa, bianca, curva.
- Utilizzare pinze o forbici per dissezione bene per isolare l'ippocampo dai tessuti vicini.
- Con una pinza, rimuovere l'eccesso della materia bianca, vasi sanguigni e qualsiasi tessuto membranoso che copre l'ippocampo.
- Preparare un coperchio piatto Petri pulito preparato con poche gocce di HBSS e trasferire l'ippocampo al liquido. Ripetere per l'altro emisfero.
- Una volta che l'ippocampo e la SVZ da due topi sono stati isolati e trasferito al loro rispettivo di Petri coperchi, dadi meccanicamente il tessuto usando un bisturi. Tagliare il tessuto in una capsula di Petri coperchio per circa 1 min, rotazione ogni 10 s fino a quando il tessuto appare liscio e solo raffinati pezzi rimangono. Prendere un bisturi pulito e ripetere per l'altro piatto, tagliare il tessuto per 1 min.
- Utilizzando una pipetta da 1 mL, trasferire tutto il tessuto da ogni coperchio piastra di Petri per separare le provette contenenti 1 mL di acido di 0,25% tripsina-etilendiamminotetraacetico (EDTA). Utilizzare un tubo per il SVZ e un tubo per l'ippocampo.
- Fare questo primo pipettaggio circa la metà di tripsina-EDTA al tessuto nel piatto per ridurre al minimo le bolle d'aria e per evitare che il tessuto venga a contatto con la punta della pipetta asciutto come è trasferito al tubo. Risciacquare il piatto e la lama del bisturi con il resto della tripsina-EDTA per raccogliere quanto più tessuto possibile e aggiungerlo al tubo.
- Incubare il tessuto con la tripsina in bagnomaria a 37 ° C per 30 minuti, agitando il tubo ogni 10 min per dissociare correttamente il tessuto.
- Triturare il tessuto usando un vetro lucidati a fuoco pipetta Pasteur per creare una sospensione unicellulare. Fare attenzione a non overtriturate ciò causerebbe la lisi cellulare eccessiva. Questo è un passo fondamentale per dissociazione ottimale dei tessuti.
- Osservare il contenuto del tubo durante il processo di triturazione e interrompere al più presto segni che la maggior parte dei grumi di tessuto è stati rimossi. La soluzione di tripsina dovrebbe diventare leggermente nuvolosa quando le cellule sono andati in sospensione unicellulare, anche se alcuni grumi possono rimanere.
Nota: Come indicazione, passando la sospensione su e giù per 10 x x-15 è adeguata. - Terreno di coltura di aggiungere fino a 5 mL per neutralizzare la tripsina e girare a 300 x g per 3 min lavaggio un ulteriore 2x con HBSS e pass mezzo attraverso un colino di cella 70 µm per rimuovere qualsiasi tessuto ciuffi.
- Trasferire tutte le celle in 15 mL di terreno in un pallone di cultura cellulare T75.
Nota: Sfere dovrebbero formare nel passaggio zero (P0) cultura SVZ dopo 7-10 giorni e dopo 15 – 20 giorni nella cultura hippocampal. Astenersi da lavare o nutrire le cellule durante questo tempo di massimizzare il numero di cellule progenitrici neurali nella cultura. Se più progenitori sono necessari, o per diminuire il tempo di incubazione di P0, è possibile aumentare il numero di topi sacrificati. - Mantenere le colture a 37 ° C con 5% CO2 e, dopo la fase iniziale della cultura P0, passaggio ogni 7 – 10 giorni se necessario usando un pratiche di coltura del tessuto mobile e standard di sicurezza biologica.
Nota: La cultura di hippocampal P0 deve generare abbastanza sfere per passaggio in un matraccio da T25; la cultura SVZ genererà molte altre sfere e possa essere attraversata in un T75. Se le sfere hippocampal P0 hanno aderito, è possibile utilizzare una pipetta 200 µ l per sollevare delicatamente la sfera. - Passaggio le sfere quando raggiungono 150-200 µm di diametro. Raccogliere le sfere e le medie in una provetta da 15 mL e consentire le sfere per depositarsi per gravità per circa 5 min. in alternativa, far girare a bassa velocità (100 x g) per 2 min.
- Rimuovere il mezzo e dissociare le cellule con il reagente di dissociazione per 7 – 10 min, a seconda della dimensione delle sfere.
Nota: Il reagente di dissociazione utilizzato avrà effetti significativi sul risultato della cultura, così si prega fare riferimento alla Tabella materiali per informazioni specifiche. - Lavare le cellule aggiungendo 5 mL di HBSS per la soluzione di cella e centrifugare a 300 x g per 3 min. eliminare il surnatante, risospendere le cellule in terreno di coltura e di semi a circa 150.000 cellule in 5 mL di terreno in un matraccio di cultura cellulare T25 o equivalente. Mantenere le colture a 37 ° C e 5% CO2.
- Verificare lo stato di cellule progenitrici neurali identificando l'espressione di marcatori di cellule staminali come Sox2 e ASCL1 prima di procedere a qualsiasi protocollo a valle9.
Nota: Questo può essere fatto dal metodo preferito del ricercatore (ad es., immunochimica di microscopia, citometria a flusso o macchia occidentale, o usando reazione a catena della polimerasi quantitativa (qPCR)).
2. preparazione di una sospensione di singola cellula per l'analisi di citometria a flusso
-
Preparare il supporto richiesto. Questi sono i seguenti.
- Preparare mezzo Na+ che contiene 145 mM NaCl, 5 mM KOH, 10 mM HEPES, 5mm D-glucosio, 0,1% albumina di siero bovino (BSA) e 0,1 mM CaCl2. Questo mezzo è utilizzato anche in una forma senza calcio, con 0,1 mM CaCl2 omesso.
- Preparare mezzo K+ che contiene 145 mM KCl, 5mm KOH, 10 mM HEPES, 5mm D-glucosio e 0.1% BSA.
Nota: Questi mezzi sono stati ampiamente ottimizzati e sono dettagliati in precedenti pubblicazioni4,5. - Preparare Stock ATP pesando abbastanza polvere di ATP per circa 20 mL di uno stock di 100 mM. Sciogliere la polvere in 17 mL di tampone di KCl (145 mM KCl, 5mm KOH e 10 mM HEPES, pH 7.5) e lentamente, continuando a mescolare, aggiungere 2 mL di idrossido di tetrametilammonio 18% (p/v) (TMA) alla soluzione per portare il pH a 6,8-7,0.
- Regolare il volume finale di 20 mL. Non oltrepassare il pH passato 7.0. Conservare lo stock a-80 ° C; Si noti che le aliquote di ATP sono stabili per almeno 6 mesi.
Nota: Il peso molecolare libero dell'ATP anidro è 551.14 g/mol, e questo non include il peso molecolare delle molecole d'acqua e disodico, che possono variare da lotto a lotto e dovrebbero essere presi in considerazione per i calcoli. TMA è tossico, e deve prestare attenzione quando si maneggia. Leggere i dati di sicurezza foglio e preparano le scorte in un cabinet di fumi. - Preparare il brodo BzATP sciogliendo il BzATP in ultrapura H2O per una concentrazione finale di stock di 10 mM.
- Creare una sospensione unicellulare come descritto nei passaggi 1.16 e 1.17. Contare le celle utilizzando un emocitometro o contatore di cellule automatico. Risospendere le cellule nel medio richiesto (ad es., Na+ medio, terreno di coltura) per l'esperimento in corso (come descritto di seguito) e mettere le celle sul ghiaccio nel frattempo.
- Per ogni esperimento, assicurarsi che ci sia abbastanza campione per includere controlli per dispersione avanti e laterali, nonché per la calibrazione delle impostazioni di tensione e compensazione. Si noti che, come un'indicazione, che sfere coltivate in un matraccio da T75 in genere resa circa 8 x 106 cellule per boccetta.
-
Impostare il flusso cytometer impostazioni utilizzando campioni di controllo.
- Utilizzare avanti e laterali a dispersione per cancello selettivamente le cellule viventi.
Nota: Forward scatter fornisce informazioni relative alle dimensioni delle cellule basato sulla diffrazione della luce, mentre la dispersione laterale fornisce una misura della complessità interna o granularità. Eventi di flusso con piccole avanti e dispersione laterale possono essere considerati come le cellule morte. - Regolare la tensione e guadagno del citofluorimetro secondo le istruzioni del produttore. Eseguire un campione di prova per garantire l'acquisizione dei dati presso l'intensità di fluorescenza massima. Nessun compenso è richiesto per le acquisizioni di singolo canale.
- Utilizzare avanti e laterali a dispersione per cancello selettivamente le cellule viventi.
3. afflusso del calcio di misurazione di flusso Live-cella citometria a
- In seguito la preparazione di una sospensione unicellulare, risospendere le cellule in 1 mL di medium di Na+ senza calcio e caricarli con 2 ng/mL di colorante indicatore del calcio secondo il protocollo del produttore (fare riferimento alla Tabella materiali) con 10 µ l 5% di acido pluronic. Incubare le cellule per 30 min a 37 ° C.
- Lavare le cellule aggiungendo 3 – 5 mL di medium di Na+ senza calcio e centrifugazione delicatamente (200 x g per 4 min). Rimuovere il supernatante e risospendere le cellule in medium Na+ con calcio-senza, lavare una seconda volta.
- Risospendere le cellule in 1 mL di medium di Na+ senza calcio, metterli sul ghiaccio e consentire loro di-esterificare per 30 min.
- Lavare 1 x altro aggiungendo 3 – 5 mL di terreno di K+ e centrifugazione (200 x g per 4 min); quindi, risospendere le cellule in K+ medie e aliquota loro in fluorescenza assistita cella ordinamento (FACS) tubi ad una concentrazione di 1 x 106 cellule per 500 µ l per provetta FACS.
Nota: Il numero di provette di FACS per campione dipenderà il numero di trattamenti e ripete che sono inclusi. - Posizionare i tubi di FACS su ghiaccio fino a quando le cellule sono pronte essere analizzati. Non lasciare le cellule sul ghiaccio per un periodo prolungato, ma iniziare l'analisi appena possibile.
- Per alcuni campioni, preincubate le cellule con recettore P2X7 inibitore AZ10606120 (1 µM per 10 – 15 min) o A438079 (10 µM per 30 min) a 37 ° C prima dell'analisi.
- Pochi minuti prima dell'esecuzione dell'esempio di primo, aggiungere CaCl2 (a una concentrazione finale di 1 mM nel tubo di FACS) e collocare la provetta nel bagnomaria a 37 ° C per recuperare.
- Drop un pulito, piccolo agitatore magnetico nel tubo di FACS e posizione il tubo nel modulo tempo collegata ad un bagno di acqua di 37 ° C circolanti per controllare la temperatura del campione. Selezionare una bassa velocità di agitazione per assicurare il movimento del campione senza introdurre un effetto vortice. Posizionare l'adattatore del tubo camicia d'acqua sulla piattaforma del campione e chiudere il braccio di leva della macchina FACS.
- Avvia acquisizione di esempio ed eseguire l'esempio per 3 min a circa 1.000 eventi al secondo.
- Presso il marchio s 40, rimuovere il tubo rapidamente e aggiungere l'agonista P2X7, ATP di 1 mM o 300 µM BzATP e sostituire il tubo per continuare l'acquisizione.
- Mentre sta registrando il primo campione, preparare il campione secondo con CaCl2 e posizionarlo a 37 ° C per consentire tempo sufficiente per le celle per riscaldarsi prima dell'analisi. Una volta che ha terminato il primo campione, pulire l'assunzione tramite l'esecuzione di un campione di acqua, e quindi l'acquisizione del secondo campione può iniziare come descritto ai punti 3.8 e 3.9. Pulire sempre l'assunzione tra i campioni.
4. formazione dei pori da citometria a flusso di cellule vive di misurazione
- Creare una sospensione unicellulare come descritto nei passaggi 1.16 e 1.17. Salvare pochi millilitri del vecchio mezzo, utilizzarlo per risospendere le cellule ad una concentrazione di 1 x 106 cellule per 100 µ l per provetta FACS e posizionarlo sul ghiaccio fino al momento.
- Prima di eseguire il test, è necessario aggiungere 900 µ l di terreno di K+ per un volume finale di 1 mL e posizionare le provette in bagnomaria a 37 ° C per 10 min recuperare.
- Se applicabile, preincubate le cellule con trattamenti, tra cui gli inibitori specifici P2X7 AZ10606120 (1 µM per 10 – 15 min) o A438079 (10 µM per 30 min).
- Immediatamente prima di eseguire il test, aggiungere il bromuro di etidio 25 µM per il tubo di FACS; quindi, aggiungere l'agitatore magnetico, posizionarlo sulla macchina FACS secondo passo 3.7 e iniziare l'acquisizione.
Nota: Il bromuro di etidio è tossico, e deve prestare attenzione nel maneggiarlo. Smaltire in modo appropriato tubi usati FACS. - Per indurre la formazione di pori nella membrana cellulare, aggiungere 1 mM ATP o 100 µM BzATP 40 s dopo l'inizio dell'acquisizione.
- Eseguire gli esempi a circa 1.000 eventi al secondo per 6 min.
- Mentre è in esecuzione il primo campione, prendere il secondo campione dal ghiaccio e metterlo nel bagno d'acqua di 37 ° C per consentire tempo sufficiente per le cellule di recuperare prima dell'analisi. Una volta che il primo campione ha finito con l'acquisizione, pulire l'assunzione tramite l'esecuzione di un campione di acqua; poi, nel secondo esempio può essere collocato sulla macchina per iniziare la registrazione come descritto ai punti 3.8 e 3.9.
5. misurazione della fagocitosi da citometria a flusso di cellule vive
- Creare una sospensione unicellulare come descritto nei passaggi 1.16 e 1.17. Risospendere le cellule in medium condizionato e aliquota in FACS tubi ad una concentrazione di almeno 1 x 106 cellule per 100 µ l per provetta FACS. Diluire le cellule ad una concentrazione finale di 1 x 106 cellule/mL con il mezzo di Na+ (ad esempio, aggiungere 900 µ l di terreno di Na+ ) e inserire le celle su ghiaccio fino a quando l'analisi viene eseguita.
- Utilizzare 1 µm di granuli di lattice YG (microsfere) come obiettivi fagocitici per i test di fagocitosi in tempo reale.
Nota: Altri colori possono anche essere sostituiti, ma perle di diverse dimensioni sono stati trovati per essere obiettivi inadeguati di fagocitosi4. - Prima di eseguire il primo campione, trasferire le cellule a bagnomaria a 37 ° C ed incubare per circa 7-10 min consentire alle cellule di recuperare.
-
Aggiungere eventuali trattamenti che richiedono la preincubazione ai loro rispettivi tubi, tra cui 1 mM ATP per 15 min, 300 µM ossidato ATP (oxATP) per 40 min, 20 µM Citocalasina D per 20 min e paraformaldeide al 4% (PFA) per 20 min.
- Nessun preincubazione è richiesta per il 5% di siero umano. Se i trattamenti vengono aggiunti all'incirca alla stessa ora, i campioni possono essere eseguiti in ordine inverso mentre gli altri continuano a incubare. Ad esempio, eseguire i controlli e siero in primo luogo, quindi il campione ATP-trattato, seguito da Citocalasina D e PFA e oxATP Ultima.
- Mettere il campione sul citometro con agitatore magnetico come descritto ai punti 3.8 e 3.9 e, quindi, Avvia acquisizione del campione.
- Rimuovere la provetta dalla macchina 15 – 20 s dopo l'inizio dell'acquisizione e aggiungere 5 µ l di perline YG non diluiti. Tornare nella provetta di FACS e continuare l'acquisizione. Eseguire gli esempi per 7 – 8 min a circa 1.000 eventi/s.
- Mentre è in esecuzione il primo campione, prendere il secondo campione dal ghiaccio e metterlo in un bagnomaria a 37 ° C per consentire tempo sufficiente per le cellule di recuperare prima dell'analisi. Una volta che è finito il primo campione, pulire l'assunzione eseguendo un campione d'acqua e, quindi, iniziare acquisizione sul secondo campione come descritto ai punti 3.8 e 3.9.
6. analisi dei dati
- Esportare i dati in un foglio di calcolo. L'analisi dei dati dipenderà la questione sperimentale.
Nota: Essere consapevoli del fatto che su piste diverse possono avere intensità diversa della linea di base, quindi è importante eseguire il test di prova per un tempo designato all'inizio (circa 40 s) prima di aggiungere qualsiasi agonisti e per normalizzare i dati calcolando la variazione di fluorescenza (la fluorescenza in un determinato punto di tempo [F] diviso per la fluorescenza a tempo punto zero [F0] o F/F0). - Per quantificare il tasso o la cinetica della funzione P2X7 in questione, calcolare l'area sotto la curva o la somma dei trapezi creato sotto la curva per ogni periodo di tempo s 1016.
- Per determinare gli effetti dei trattamenti, in media l'intensità di fluorescenza sopra la s finale 10 – 20 della registrazione e confrontare i trattamenti. Determinare il significato di t-test o analisi della varianza.
Risultati
Colture di cellule progenitrici neurali
Progenitrici neurali sfera culture derivate utilizzando questo metodo dovrebbero essere la fase luminosa e hanno un bordo tondo liscio (Figura 1AB). In culture sane, piccolo microspikes può osservare sui bordi (Figura 1). A fine passaggi, o se non adeguatamente nutriti, sfere possono formare una tazza vuota forma (Figura 1) o grandi forme allungate (Figura 1E, indicato dalla freccia). Queste culture non devono essere usate per citometria a flusso o qualsiasi altre applicazioni a valle, come queste caratteristiche può essere indicativo di differenziazione. Per confermare lo stato di progenitrici neurali, le cellule erano cromate sulle lamelle di vetro rivestite con poli-L-ornitina e laminin per immunocitochimica (Figura 1F e, al più alto confluency, Figura 1). Le cellule sono state macchiate per GFAP, nestina, Sox2, vimentina, ASCL1, BLBP, Prox1 e DCX per identificare le cellule come cellule progenitrici di tipo 2 (ippocampo) o di tipo C progenitrici cellule (SVZ)9. Le cellule dovrebbero avere un nucleo ben definito e processi estesi.
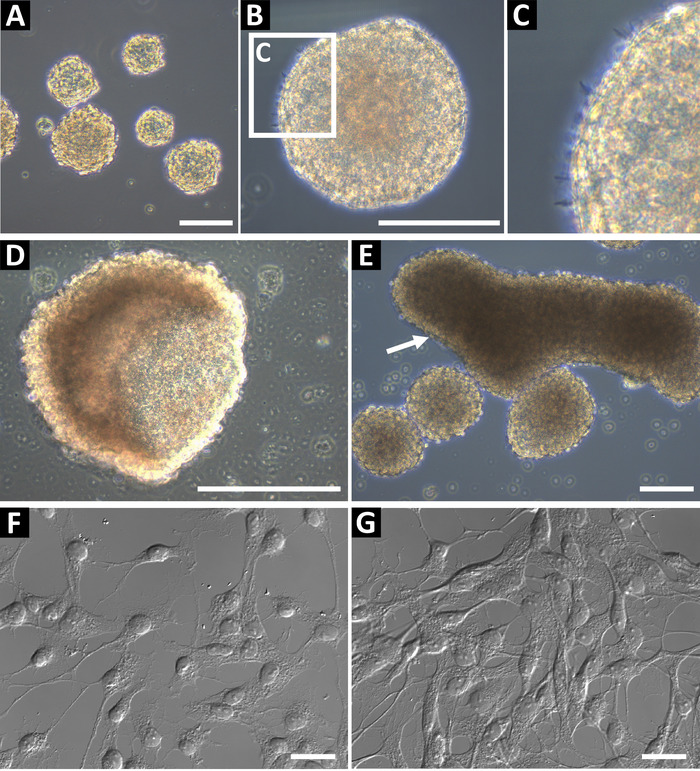
Figura 1: coltura delle cellule progenitrici neurali hippocampal rappresentante. Cellule progenitrici neurali Hippocampal (A) sono isolate da topi adulti e coltivate come neurosfere fino a circa 100-150 µm di diametro. Neurosfere (B) dovrebbe avere una periferia liscia, (C) e microspikes piccolo può essere osservata sulla loro superficie. Quando le sfere sono troppo a lungo nella coltura, possono formare Coppa (D) o (E) forme allungate. Queste culture non devono essere utilizzate per gli esperimenti. Per confermare lo stato di progenitrici neurali delle cellule, semi come una sospensione unicellulare sui poli-L-ornitina (PLO) e lamelle di vetro rivestite con laminina per immunochimica. Le cellule dovrebbero avere un piccolo soma e processi di ramificazioni, (F) al confluency di basso e (G) pronto per immunochimica. Scala bar = 100 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Afflusso del calcio da citometria a flusso di cellule vive
Questo protocollo consente l'analisi della funzione del recettore P2X7 come un canale di calcio in tempo reale. La cinetica della funzione del ricevitore, come pure gli effetti di differenti agonisti ed antagonisti, possono anche essere valutati. Quando tracciati nel corso del tempo, afflusso del calcio nella hippocampal e cellule progenitrici neurali SVZ era generalmente simile (Figura 2A e 2B figura, rispettivamente). Agonisti (ATP o BzATP) sono stati aggiunti al mark s 40, come indicato dalla freccia rossa. Per un breve istante, il tubo viene rimosso dal punto di registrazione per aggiungere l'agonista, con conseguente punti di dati pari a zero. Ciò consentirà l'identificazione del tempo quando è stato aggiunto l'agonista. BzATP rapidamente attiva dei recettori P2X7, aprendo il canale ionico e consentendo l'afflusso del calcio, che si lega a Fluo-8 e reagisce in. Applicazione di ATP provoca generalmente un afflusso del calcio più graduale. Esso ha una minore affinità per P2X7 rispetto ai BzATP e comporterà anche l'attivazione dei recettori accoppiati a proteine G, una via di segnalazione più lento che rilascia calcio dal reticolo endoplasmatico. L'inclusione degli antagonisti P2X7 A438079 e AZ10606120 (dati non mostrati) ridotto l'afflusso di calcio in risposta all'agonista applicazione.
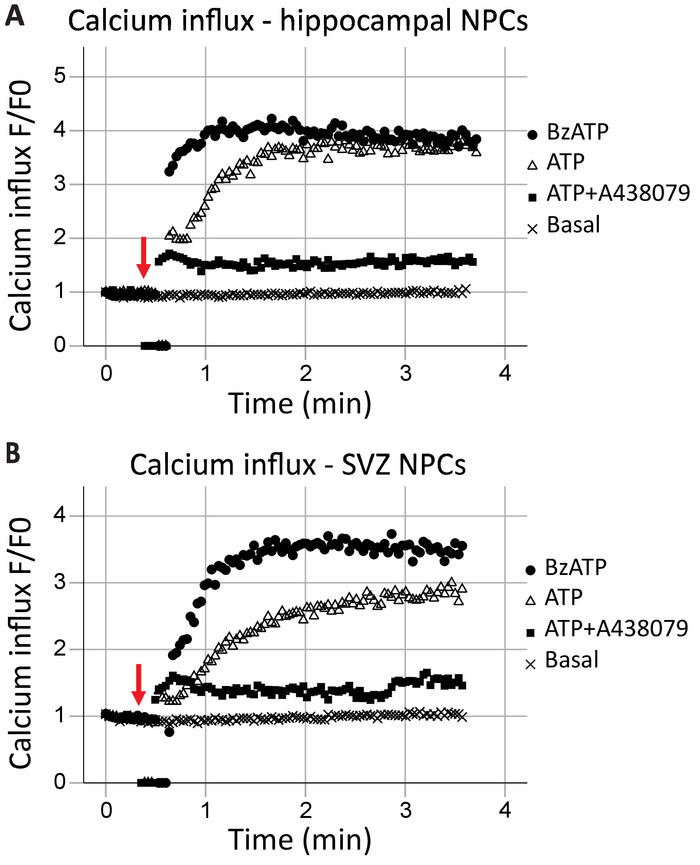
Figura 2: afflusso del calcio Live-cellulare in cellule progenitrici neurali da ippocampo e SVZ. Funzione di canale del calcio del recettore P2X7 è stata dimostrata in (A) hippocampal e (B) le cellule progenitrici SVZ-derivati dai cambiamenti in fluorescenza Fluo-8. Applicazione dell'agonista P2X generale ATP e il risultato di BzATP agonista P2X7 P2X7 canali ionici apertura, permettendo l'afflusso del calcio. L'afflusso è stato bloccato con gli inibitori specifici P2X7 A438079 o AZ10606120 (dati non mostrati). F = fluorescenza; F0 = fluorescenza al punto di tempo zero. Clicca qui per visualizzare una versione più grande di questa figura.
Formazione dei pori da citometria a flusso di cellule vive
Formazione dei pori transmembrana è una caratteristica canonica dei recettori P2X7, risultati in cambio della macromolecola e può portare alla morte cellulare. Etidio+ è una grande molecola (Da 314) esclusa dalle cellule sane; sua l'assorbimento e la successiva intercalazione con DNA provochi emissioni di fluorescente e può essere utilizzato per valutare la capacità dei recettori P2X7 per formare pori transmembrana. Dopo l'applicazione del agonisti ATP (1 mM ATP) e BzATP (100 μM) presso il 40 s (indicato dalla freccia), tempo-risolta flusso cytometry acquisisce il bromuro di etidio le cellule sta entrando in tempo reale (Figura 3A). Questo effetto è stato attenuato dall'inibitore P2X7 specifiche AZ10606120. L'analisi di assorbimento del bromuro di etidio dimostra un recettore P2X7 funzionale C-terminus17 ed è buona prova per l'espressione dei recettori P2X7 full-length. Analisi di concentrazione-risposta ATP illustrano gli effetti della concentrazione di agonista su P2X7 poro formazione, utilizzo di change in fluorescenza di bromuro di etidio nel tempo (Figura 3B). Curve di concentrazione dose di agonista insieme con gli inibitori del recettore specifico forniscono la prova ben fondata per l'attivazione del recettore.
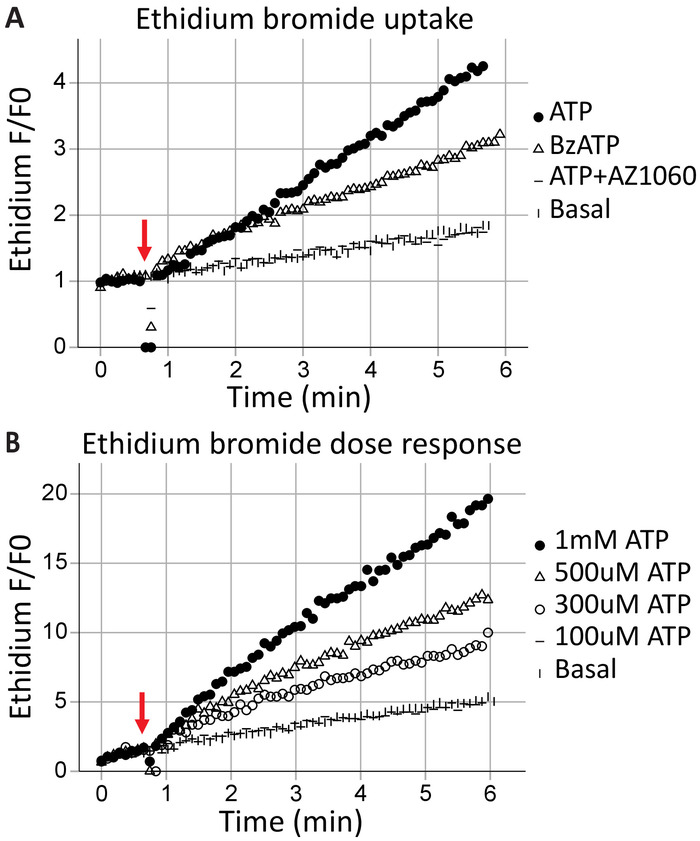
Figura 3: la formazione dei pori transmembrana P2X7 misurata dall'assorbimento etidio. L'aggiunta di momenti di bromuro di etidio prima dell'inizio dell'acquisizione è utilizzato per misurare la formazione di pori transmembrana P2X7. Alte concentrazioni di ATP e BzATP risultato del recettore P2X7 (A) poro formazione, permettendo il bromuro di etidio per entrare nella cellula. L'inibitore di P2X7 AZ10606120 attenua questo fenomeno e fornisce la prova funzionale dei recettori P2X7. (B) ATP concentrazione-risposta analisi hanno dimostrato significativi poro formazione a 500 μM e 1 mM, ma non alle concentrazioni più basse. Clicca qui per visualizzare una versione più grande di questa figura.
Fagocitosi di citometria a flusso di cellule vive
Il nostro gruppo ha precedentemente dimostrato che l'ATP extracellulare inibisce fagocitosi mediata P2X7 dissociando P2X7 C-terminale dal citoscheletro, in particolare, non muscolare miosina IIA18,19. Questo metodo si espande su questi risultati di dimostrare il coinvolgimento di recettori P2X7 nella fagocitosi ippocampali e cellule progenitrici neurali SVZ in tempo reale (Figura 4, un esempio di hippocampal fagocitosi). Come controllo positivo sono stati stabiliti livelli disinibito fagocitosi (controllo) di granuli di lattice YG di 1 µm. ATP ha inibito la fagocitosi dei branelli YG nella stessa misura come gli inibitori non specifici, vale a dire la fissazione di PFA e l'actina polimerizzazione inibitore Citocalasina D, mentre il 5% di siero ha abolito tutte le innata fagocitosi20.
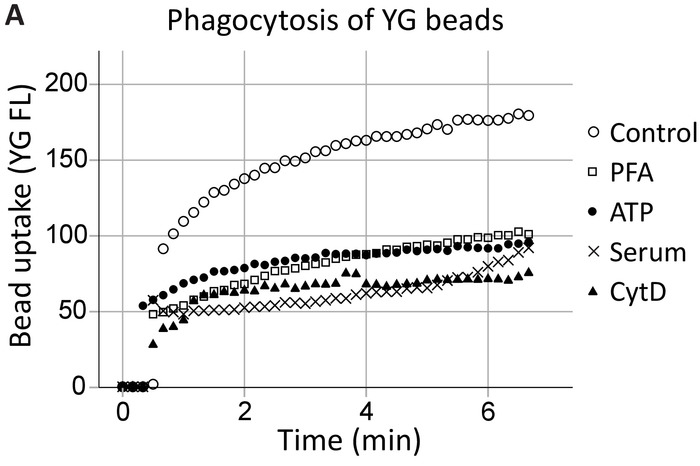
Figura 4: l'assorbimento di perlina YG dimostrando la capacità fagocitica dei progenitori neurali attraverso recettori P2X7. L'assorbimento di perlina YG di cellule progenitrici neurali è osservabile utilizzando cellule vive flusso cytometry in tempo reale. Livelli di controllo della fagocitosi sono stabiliti inizialmente e se il numero delle cellule permette, riconfermati alla fine della corsa. Coinvolgimento dei recettori P2X7 è indicato tramite l'inibizione della fagocitosi in presenza di ATP, come questo si dissocia il C-terminale da citoscheletro della membrana, impedendo riarrangiamenti citoscheletrici P2X7-mediata. L'applicazione di ATP bloccata fagocitosi nella stessa misura come l'uso di inibitori non specifici della fagocitosi, tra cui paraformaldeide (PFA) e Citocalasina D (CytD). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questa carta presenta un protocollo dettagliato per l'analisi della funzione del recettore P2X7 in colture di cellule progenitrici neurali derivate da adulte nicchie neurogene. Le applicazioni potenziali per adulto progenitrici neurali cellule spaziano dalla ricerca a fini terapeutici, e quindi il metodo della cultura deve essere robusto e riproducibile. Ci sono una serie di aspetti chiave di questo protocollo che possono influire sulla qualità della cultura dell'endpoint. Una volta rimosso dal cranio, il cervello non dovrebbe essere consentito ad asciugare e la dissezione deve essere eseguita più rapidamente possibile. Specialmente con l'ippocampo, cura supplementare per rimuovere eventuali vasi sanguigni o tessuto membranoso si tradurrà in rendimenti delle cellule progenitrici superior. Il processo di dissociazione e triturazione possa avere un impatto fortemente il numero di sfere ottenute in una cultura; il tessuto di agitazione durante l'incubazione con tripsina-EDTA si tradurrà in una soluzione più omogenea. L'uso di un vetro lucidati a fuoco pascolo pipetta sopra un P1000 puntale in plastica è altamente raccomandato per ridurre la morte delle cellule e migliorare la cultura risultante. Evitare overtriturating. Nonostante queste precauzioni, la procedura può creare un sacco di detriti nella cultura P0, e per evitare la perdita di cellule progenitrici, lavare o nutrire la cultura dovrebbe essere evitato fino a sfere sono formati.
Un numero di differenze tra l'ippocampo e culture SVZ sarà evidente in P0. Hippocampal culture producono un minor numero di sfere, e questi generalmente aderire. Utilizzare una pipetta per sollevare delicatamente le sfere per il passaggio iniziale. Sfere di aderenti non sono stati osservati nei passaggi successivi. Diverse marche di boccette di coltura del tessuto possono causare le sfere, sfere particolarmente hippocampal, di aderire e crescere come colonie sul fondo del piatto. Questo non è stato trovato per alterare alcun risultato a valle per questo protocollo, ma deve essere monitorato, e ove possibile, dovrebbe essere mantenuta la coerenza.
Precedenti metodi utilizzati per misurare la funzione del recettore P2X7, quali patch di bloccaggio per registrare l'afflusso del calcio, sono che richiede tempo e laborioso e possono fornire informazioni solo su una singola cella. Questo protocollo presenta un metodo rapido e riproducibile per analizzare tutte le tre funzioni principali dei recettori P2X7 utilizzando una sola macchina. Citometria a flusso di cellule vive risolta nel tempo consente analisi di tutta la popolazione e fornisce il ricercatore con informazioni riguardanti la cinetica di afflusso del calcio, formazione dei pori, e/o funzione fagocitica. Oltre a questo, citometria a flusso può essere facilmente utilizzato come un metodo per valutare i modelli di espressione del marcatore e analisi della popolazione sulla base dei livelli di espressione di dimensione o proteina cellulare.
Quando questi esperimenti, possono essere osservate differenze in afflusso del calcio massima, assorbimento di etidio o tariffe di fagocitosi tra le ripetizioni. Per minimizzare questa, la dimensione della sfera, condizioni di coltura e regime d'alimentazione deve essere coerente come la salute delle cellule avrà un impatto significativo sui risultati ottenuti. Il tempo sul ghiaccio può anche influenzare i dati, così garantire tutto è preparato prima del tempo in modo che il tempo sul ghiaccio è minimo. Assicurarsi che il colorante indicatore di calcio tempo di caricamento sia coerenza. Un altro fattore che può portare a grandi incoerenze nelle registrazioni calcio massima è la variazione tra i lotti di ATP. La preparazione delle scorte di ATP è cruciale, e dovrebbe essere evitato l'uso di lotti diversi per gli stessi esperimenti. Si consiglia inoltre di confronto tra vecchi e nuovi lotti per garantire che l'ATP è coerenza. L'efficacia degli antagonisti P2X7 può anche essere dipendente di linea cellulare e batch, ottimizzazione dei tempi di incubazione e concentrazioni potrebbe essere necessaria.
Vale la pena notare che calcio afflusso/deflusso è uno della più fondamentale e più complesse funzioni cellulari e può essere mediato da recettori di molti. L'afflusso di calcio indotta da ATP, come una misura classica per la funzione di canale/poro P2X7, potrebbero non riflettere accuratamente la vera funzione dei recettori P2X7, come trifosfato di adenosina può anche attivare recettori P2Y a rilascio di calcio intracellulare. In questo caso, il bario può essere un catione meglio utilizzare invece di calcio come suo afflusso è unidirezionale16. Per differenziare il contributo da recettori P2Y in afflusso del calcio, condizioni dove 1 mM EDTA o glicole etilenico-bis(β-aminoethyl ether)-N, N, N′, N′-tetraacetico acido (EGTA) è aggiunto al medium K+ invece di CaCl2 potrebbero essere usate in questo test.
Questo protocollo può anche essere facilmente adattato per soddisfare altri tipi delle cellule e può essere utile per analizzare la funzionalità dei recettori canale alternativo dello ione o recettori che partecipano alla fagocitosi. Questo metodo può anche essere adattato ad una macchina di citometria a flusso senza un modulo in fase. Ad esempio, essere eseguiti saggi di fagocitosi dove perline YG vengono aggiunti 7 – 8 min prima l'analisi di citometria a flusso convenzionale. Mantenere le cellule a 37 ° C e agitare continuamente li. Ciò non fornirà informazioni in tempo reale, ma le differenze nella media finale di fluorescenza ancora informerà il ricercatore per quanto riguarda la funzionalità dei recettori P2X7.
Interesse dei recettori P2X7 come un farmaco target21,22 o anche come una consegna di droga itinerario23,24 sta crescendo rapidamente, e quindi metodi per lo studio di questo recettore enigmatico devono essere continuamente adattato e migliorato per facilitare questi studi. Questo protocollo descrive le metodologie che possono essere utilizzate per esplorare la funzione P2X7 in cellule progenitrici neurali adulto, e si spera che conseguire una maggiore comprensione dei recettori P2X7 nelle nicchie neurogene può condurre a progressi nel trattamento del colpo e altre lesioni ischemiche.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori vorrei ringraziare Maria Kasherman e Xin Huang per il loro contributo a questa ricerca. Questo lavoro è stato supportato da sovvenzioni da Rebecca L. Cooper Medical Research Foundation a M.W., T.C.L. e M.L. e a T.C.L. il National Health and Medical Research Consiglio (NHMRC) dell'Australia (571100 e 1048082) e la Fondazione di beneficenza di Baxter ( Sydney, Australia). B.G. era sostenuto dalla compagnia del futuro di Australian Research Council (ARC) (FT120100581), sovvenzioni di progetti NHMRC (1048082, 1061419 e 1120095) e operativa infrastruttura supporto Grant del governo vittoriano all'Istituto di Florey. M.L. è stato sostenuto da un Charles D. Kelman, M.D. Postdoctoral Award (2010) da internazionale retinica Research Foundation (USA).
Materiali
| Name | Company | Catalog Number | Comments |
| A438079 | Tocris | 2972/10 | |
| ATP | Sigma-Aldrich | A2383 | |
| AZ10606120 | Tocris | 3323/10 | |
| bzATP | Sigma-Aldrich | B6396 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| FACSCalibur | Becton Dickinson | ||
| Fluo-8AM | AAT-Bioquest | 21080 | Fluo-4AM and Fura-Red AM have also been used successfully |
| Fluoresbrite YG Microspheres | Polysciences Inc | 17154-10 | 1.00 µm, yellow-green |
| Glutamine | ThermoFisher Scientific | 25030081 | 200 mM |
| HBSS | ThermoFisher Scientific | 14170112 | |
| Heparin | Sigma-Aldrich | H3149 | |
| NeuroCult Basal Medium | Stemcell Technologies | 5700 | Mouse and rat |
| NeuroCult Proliferation Supplement | Stemcell Technologies | 5701 | Mouse and rat |
| Oxidized ATP | Sigma-Aldrich | A6779 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | pluronic acid |
| Recombinant Murine EGF | Peprotech | 315-09 | |
| Recombinant Murine FGF-basic | Peprotech | 450-33 | |
| Tetramethylammonium Hydroxide | Sigma-Aldrich | T7505 | |
| Time Zero Module | Cytek Biosciences | ||
| Tissue culture flasks | BD Falcon (Corning) | 353108 (T25), 353136 (T75) | Blue vented screw cap |
| TrypLE Express | Gibco | 12604013 | |
| Trypsin-EDTA (0.25%) | ThermoFisher Scientific | 25200056 | with phenol red |
| UltraPure Ethidium Bromide | ThermoFisher Scientific | 15585011 | 10 mg/mL |
Riferimenti
- Sperlagh, B., Illes, P. P2X7 receptor: an emerging target in central nervous system diseases. Trends in Pharmacological Sciences. 35 (10), 537-547 (2014).
- Liang, X., et al. Quantifying Ca2+ current and permeability in ATP-gated P2X7 receptors. Journal of Biological Chemistry. 290 (12), 7930-7942 (2015).
- Rat, P., Olivier, E., Tanter, C., Wakx, A., Dutot, M. A fast and reproducible cell- and 96-well plate-based method for the evaluation of P2X7 receptor activation using YO-PRO-1 fluorescent dye. Journal of Biological Methods. 4 (1), 64(2017).
- Gu, B. J., et al. A quantitative method for measuring innate phagocytosis by human monocytes using real-time flow cytometry. Journal of Quantitative Cell Science: Cytometry Part A. 85 (4), 313-321 (2014).
- Jursik, C., et al. A quantitative method for routine measurement of cell surface P2X7 receptor function in leucocyte subsets by two-colour time-resolved flow cytometry. Journal of Immunological Methods. 325 (1-2), 67-77 (2007).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272 (5262), 735-738 (1996).
- Delarasse, C., et al. Neural progenitor cell death is induced by extracellular ATP via ligation of P2X7 receptor. Journal of Neurochemistry. 109 (3), 846-857 (2009).
- North, R. A. Molecular physiology of P2X receptors. Physiological Reviews. 82 (4), 1013-1067 (2002).
- Leeson, H. C., et al. P2X7 Receptors Regulate Phagocytosis and Proliferation in Adult Hippocampal and SVZ Neural Progenitor Cells: Implications for Inflammation in Neurogenesis. Stem Cells. , (2018).
- Glaser, T., et al. Modulation of mouse embryonic stem cell proliferation and neural differentiation by the P2X7 receptor. PLoS One. 9 (5), e96281(2014).
- Papp, L., Vizi, E. S., Sperlagh, B. Lack of ATP-evoked GABA and glutamate release in the hippocampus of P2X7 receptor-/- mice. Neuroreport. 15 (15), 2387-2391 (2004).
- Wiley, J. S., Gu, B. J. A new role for the P2X7 receptor: a scavenger receptor for bacteria and apoptotic cells in the absence of serum and extracellular ATP. Purinergic Signalling. 8 (3), 579-586 (2012).
- Lovelace, M. D., et al. P2X7 receptors mediate innate phagocytosis by human neural precursor cells and neuroblasts. Stem Cells. 33 (2), 526-541 (2015).
- Walker, T. L., Kempermann, G. One mouse, two cultures: isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of Visualized Experiments. (84), e51225(2014).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Frontiers in Neuroscience. 5, 89(2011).
- Gu, B. J., Wiley, J. S. Broad applications of mulit-colour time-resolved flow cytometry. Flow Cytometry - Recent Perspectives. , (2012).
- Cheewatrakoolpong, B., Gilchrest, H., Anthes, J. C., Greenfeder, S. Identification and characterization of splice variants of the human P2X7 ATP channel. Biochemical and Biophysical Research Communications. 332 (1), 17-27 (2005).
- Gu, B. J., Saunders, B. M., Jursik, C., Wiley, J. S. The P2X7-nonmuscle myosin membrane complex regulates phagocytosis of nonopsonized particles and bacteria by a pathway attenuated by extracellular ATP. Blood. 115 (8), 1621-1631 (2010).
- Gu, B. J., Rathsam, C., Stokes, L., McGeachie, A. B., Wiley, J. S. Extracellular ATP dissociates nonmuscle myosin from P2X(7) complex: this dissociation regulates P2X(7) pore formation. American Journal of Physiology-Cell Physiology. 297 (2), C430-C439 (2009).
- Gu, B. J., et al. P2X7 receptor-mediated scavenger activity of mononuclear phagocytes toward non-opsonized particles and apoptotic cells is inhibited by serum glycoproteins but remains active in cerebrospinal fluid. Journal of Biological Chemistry. 287 (21), 17318-17330 (2012).
- Bhattacharya, A. Recent Advances in CNS P2X7 Physiology and Pharmacology: Focus on Neuropsychiatric Disorders. Frontiers in Pharmacology. 9 (30), (2018).
- Burnstock, G., Knight, G. E. The potential of P2X7 receptors as a therapeutic target, including inflammation and tumour progression. Purinergic Signalling. 14 (1), 1-18 (2018).
- Alves, L. A., et al. Pore forming channels as a drug delivery system for photodynamic therapy in cancer associated with nanoscintillators. Oncotarget. 9 (38), 25342-25354 (2018).
- Pacheco, P. A., et al. P2X7 receptor as a novel drug delivery system to increase the entrance of hydrophilic drugs into cells during photodynamic therapy. Journal of Bioenergetics and Biomembranes. 48 (4), 397-411 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon