Method Article
В реальном времени живой клетки проточной цитометрии расследовать приток кальция, порообразования и фагоцитоз, P2X7 рецепторы в клетках взрослых нейронных прародителя
* Эти авторы внесли равный вклад
В этой статье
Резюме
Предоставление одноклеточных чувствительность, реального времени проточной цитометрии однозначно подходит для количественного определения смешанных рецепторных функций живых культур. С использованием клеток взрослых нейронных прародителю, функция рецептора P2X7 оценивалось через приток кальция, обнаруженных кальция индикатор краситель, трансмембранного порообразования поглощения бромид ethidium, и фагоцитоз, с использованием флуоресцентных латексные шарики.
Аннотация
Для количественной оценки биологических процессов в живых клеток проточной цитометрии все шире используется среди клеточных биологов клеточные культуры. Этот протокол описывает метод whereby клеток проточной цитометрии продлевается после анализа многочисленных функций активации рецептора P2X7 в режиме реального времени. С помощью модуля времени, установленных на проточный цитометр, жить клеточной функциональность можно оценивать и заговор за определенный период времени для изучения кинетики приток кальция, трансмембранного порообразования и фагоцитоз. Этот простой метод является выгодным, поскольку все три канонические функции рецептора P2X7 могут быть оценены с использованием одной машины, и собранные данные на печать со временем предоставляет информацию о совокупности клеток, а не одноклеточных записи часто полученные с помощью технически сложных методов патч зажим. Эксперименты приток кальция использовать индикатор краска кальция, P2X7 поры формирования assays полагаются на бромид ethidium, разрешается пройти через трансмембранного поры сформированных по концентрации высокой агониста. Желто зеленый (YG) латексные шарики используются для измерения фагоцитоза. Конкретные агонистов и антагонистов применяются для изучения последствий деятельности P2X7 рецепторов. Индивидуально эти методы могут быть изменены представить количественные данные о любое количество кальциевых каналов и рецепторов purinergic и падалью. Взятые вместе, они подчеркивают, как использование в реальном времени живой клетки проточной цитометрии является быстрое, экономически эффективным, воспроизводимые и количественному методом расследовать P2X7 рецептор функции.
Введение
Изучение purinergic сигнализации является широкая и многогранная, с участием клеточной физиологии, биохимии и фармакологии. Purinergic сигнализации участвует в бесконечное количество клеточных и молекулярных процессов, от рака и регуляции клеточного цикла в ячейке коммуникаций и биологии стволовых клеток; Таким образом часто существует потенциал для модуляции purinergic сигнализации для терапевтический эффект. Purinergic рецепторов P2X7 рецептор получила значительное внимание в последние годы из-за ее потенциал как терапевтические мишенью для многочисленных воспалительных процессов1. Методы для изучения рецептор развивалась и была адаптирована с годами для облегчения этого исследования2,3,4,5. Здесь мы описываем метод цитометрии клеток потока для расследования многочисленных функций P2X7 рецепторы в клетках взрослых нейронных прародителю, полученных из субвентрикулярной зоны (SVZ) и зубчатой извилине гиппокампа.
Рецептор к P2X7 был впервые описан как с P2Z рецепторами, или «смерть клетки»-рецептор, как ее активации с высокой концентрацией аденозина трифосфата (АТФ) приводит к образованию большого трансмембранного поры проницаемой для молекул до 900 да6. Это приводит к цитоскелета перегруппировки, трансмембранного порообразования и, потенциально, apoptosis and/or некроз7. Традиционно эта функция P2X7 количественно путем поглощения красители большой молекулярный вес как YO-PRO-1 или ethidium бромид, которые флуоресцировать когда интеркалированного с ДНК3,8. Пластина чтения методы, которые являются быстрое и позволяют для масштабирования, как правило не позволяют для наблюдения за кинетики. Метод, описанный здесь основан на поглощении ethidium и позволяет увеличить флуоресценции соблюдаться со временем, обеспечивая большую глубину информации в отношении скорости порообразования. С тех пор было показано P2X7 рецепторов, облегчить ряд nonimmune функций, с различных ответов в зависимости от воздействия времени и агонист концентрация9,10. Краткое активации по более низкой концентрации ATP результаты в катионной приток для целей трансдукции медиатора и сигнала11. С помощью проточной цитометрии для измерения приток кальция преодолевает проблемы, связанные с громоздким и технически сложные методы — особенно, патч зажима для измерения внутрь токи, которые обеспечивают неоценимую детали относительно изменения в потенциал через клеточной мембраны, но не позволяют проводить анализ населения2. Третья функция P2X7 рецепторов происходит в отсутствие АТФ, где было продемонстрировано облегчения фагоцитоза в иммунной системы и нервной системы9,12,13P2X7 рецепторов. Усовершенствования в методы микроскопии позволили визуализации цитоскелета перестановок во время процесса поглощения, хотя анализ количественной оценки и населения могут по-прежнему представляют собой проблему.
Метод потока клеток цитометрии подробно здесь позволяет для расследования всех трех основных функций P2X7 рецепторов в режиме реального времени. Включение модуля устройства время на проточный цитометр позволяет контроля температуры и постоянно помешивая клеток в суспензии. Агонистов и антагонистов стимулы могут быть доставлены в течение секунды, позволяя почти непрерывное измерение клеточного ответа. Это предоставляет быстрый и простой метод для герметизации количественную оценку функции избегая использования нескольких систем анализа. Важно отметить, что этот протокол может быть легко адаптирована для удовлетворения любой тип клеток и могут быть использованы для изучения другие подтипы рецепторов, учитывая включение конкретных агонистов или ингибиторы, в зависимости от их свойств.
протокол
Животные были обращались в соответствии с австралийским кодекса практики для ухода и использование животных для научных целей и одобрены для использования Комитетом по этике животных университет Гриффит.
1. нейросферы культура нейронных прогениторных клеток от взрослых SVZ и гиппокампа
Примечание: Протокол вскрытия, представленные здесь основан на работе Уокер и Kempermann, и подробный протокол для рассечения нейронных прогениторных клеток от взрослых мышей доступен других14. Бабу и коллеги15были изменены условия культуры. Были использованы взрослых самок мышей C57BL/6, в возрасте 8-12 недель.
- В биологической безопасности кабинета Подготовьте питательной среды (нейронных базальной средний) дополнены распространением дополнение нервных стволовых клеток, глютамин 2 мм, 20 нг/мл эпидермального фактора роста (EGF), фактор роста фибробластов основные 10 нг/мл (bFGF) и 2 мкг/мл гепарин.
- Усыпить двух мышей вдыханием CO2 . Кроме того анестезировать мышей согласно институциональных руководящих принципов и немедленно усыпить их путем дислокации шейки матки. Спрей их головы с 70% этанола и обезглавить их. Трансфер каждый руководитель в стерильную пробирку, содержащую Хэнка сбалансированного солевого раствора (HBSS) с раствором пенициллина/стрептомицина 1 x (P/S).
- Выполните вскрытия в Ламинарный шкаф под микроскопом рассечение.
- С помощью щипцов и Рассечение ножницами, удалите ткани и кости подвергать мозга и перенести его на стерильную блюдо, содержащие HBSS с P/S.
- Поместите вентральной стороне мозга вверх и использовать лезвие скальпеля, чтобы сделать полный корональных разрез через зрительных нервов. Стабильна мозга с щипцами и использовать один Свифт, чистой, нисходящего движения. Избегайте пильные для сведения к минимуму гибели клеток и помочь сохранить структуру ткани.
Примечание: Если не надежно удерживается, мозг может наклонить вперед во время резки, ставя под угрозу количество клеток-предшественников, полученные из SVZ. - Изолируйте SVZ ростральной половины мозга.
- Найдите обоих желудочков, разделенных перегородки, с мозолистого, образуя белый мост над ними.
- Используйте щипцы для удаления перегородки, разделяющей два желудочка и изолировать боковые стенки передних боковых желудочков. Сделать это путем убирания выше, ниже, по бокам и на фронте с тонкой Рассечение ножницами. Останется только маленький Кубок образную форму.
- Подготовьте чистую Петри блюдо крышкой с несколькими каплями HBSS в середине и передачи SVZ жидкости. Не позволяйте ткани высохнуть или коснуться сухой поверхности. Стоя на сторону рассекает гиппокампах.
- Изолируйте гиппокампах из хвостовой части мозга.
- Сделайте срединной вырезать между полушариями разорвать мозолистого тела. Использование боковых желудочков, как руководство и аккуратно разворачиваться коры подвергать гиппокампа. После развернутые коры гиппокампа может рассматриваться как плотная, белая, изогнутые структуры.
- Для изоляции гиппокамп из соседних тканей используйте тонкой Рассечение ножницами или щипцами.
- Пинцетом удалите избыток белого вещества, кровеносных сосудов и любой мембранные ткани, охватывающих гиппокампа.
- Подготовьте чистую Петри блюдо крышкой приготовленные несколько капель HBSS и передачи гиппокампа жидкости. Повторите для другого полушария.
- После того, как были изолированы и переданы их соответствующих Петри крышки гиппокампа и SVZ от двух мышей, механически кости тканей, с использованием лезвием скальпеля. Чоп ткани в одной чашке Петри крышкой примерно 1 мин, вращающихся каждые 10 s появится гладкой ткани и только мелкие кусочки остаются. Возьмите чистый скальпель лезвие и повторите для другой блюдо, нарезки ткани за 1 мин.
- С помощью пипетки 1 мл, передачи всех тканей от каждого Петри блюдо крышкой в отдельные Пробирки, содержащие 1 мл 0,25% трипсина Этилендиаминтетрауксусная кислота (ЭДТА). Используйте одну трубку для SVZ и одна трубка для гиппокампа.
- Для этого первый закупорить, около половины из трипсина ЭДТА в ткани в блюдо для сведения к минимуму пузырьки воздуха и предотвращения ткани соприкасающихся кончик сухой пипетки, как он переходит к трубе. Промойте блюдо и лезвие скальпеля с остальной частью трипсина ЭДТА собирать столько ткани как можно и добавить его к трубе.
- Инкубируйте ткани с трипсина в 37 ° C водяной бане 30 мин, агитируя трубку каждые 10 мин для правильно отделить ткани.
- Нарезанных ткани, используя пожар полированные стеклянная пипетка Пастера для создания одной ячейки подвеска. Будьте осторожны, не overtriturate как это приведет к чрезмерной клеток лизис. Это является важным шагом для оптимального ткани диссоциации.
- Наблюдать за содержимое трубки во время процесса Тритурация и останавливаться на ранние признаки того, что большинство тканей сгустки были удалены. Трипсин решение должно стать немного облачно когда клетки пошли в одну ячейку подвеска, хотя некоторые сгустки могут оставаться.
Примечание: Как признак передавая подвески вверх и вниз по 10 x-15 x является адекватным. - Добавить культуры среднего до 5 мл для нейтрализации трипсина и спина на 300 x g для 3 мин мыть еще 2 x с HBSS и перевал среднего через сито ячейки 70 мкм, чтобы удалить любые ткани сгустки.
- Передать все клетки в 15 мл среды T75 колбу культуры клеток.
Примечание: Сферах должны составлять в проход ноль (P0) культуры SVZ после 7-10 дней и 15 – 20 дней в гиппокампе культуре. Воздерживаться от промывки или кормления клетки в это время, чтобы максимизировать количество нейронных прогениторных клеток в культуре. Если требуются более прародителями, или уменьшить время инкубации P0, можно увеличить количество мышей в жертву. - Поддержания культур при 37 ° C с 5% CO2 и, после завершения первоначального этапа культуры P0, проход каждые 7-10 дней, при необходимости, с использованием практики кабинета и стандартные культуры ткани биологической безопасности.
Примечание: P0 гиппокампа культуры должна генерировать достаточно сферах проход в колбе T25; SVZ культура будет генерировать много больше сфер и может быть пассированной в T75. Если присоединились гиппокампа сферах P0, используйте пипетку 200 мкл аккуратно поднять сфере. - Проход сферах, когда они достигают 150-200 мкм в диаметре. Собирать сферы и среднего в 15 мл трубку и позволяют сферах довольствуйтесь примерно 5 минут под действием силы тяжести, альтернативно, спина на низкой скорости (100 x g) 2 мин.
- Удалите носитель и разбить ячейки с диссоциации реагент для 7-10 мин, в зависимости от размера сфер.
Примечание: Диссоциация реагент, который используется будет иметь значительное влияние на результаты культуры, поэтому обратитесь к Таблице материалы для специфики. - Вымыть клетки путем добавления 5 мл HBSS мобильные решения и центрифуги на 300 x g на 3 мин удалить супернатант Ресуспензируйте клетки в культурной среде и семян на приблизительно 150 000 ячеек в 5 мл среды в колбу культуры клеток T25 или эквивалент. Поддержания культур при 37 ° C и 5% CO2.
- Подтвердите нейронных прогениторных клеток статус путем определения выражения маркеры стволовых клеток как Sox2 и ASCL1 прежде чем приступать к любой течению протокол9.
Примечание: Это может быть сделано путем исследователя предпочтительный метод (например, иммунохимии микроскопии, проточной цитометрии или Западная помарка, или с помощью количественных полимеразной цепной реакции (ПЦР)).
2. подготовка одной ячейки подвеска для анализа проточной цитометрии
-
Подготовьте необходимые средства массовой информации. К ним относятся следующие.
- Подготовка среднего Na+ , содержащий 145 мм NaCl, 5 мм Кох, 10 мм HEPES, 5 мм D-глюкоза, 0.1% бычьим сывороточным альбумином (БСА) и 0,1 мм CaCl2. Это средство используется также в форме свободного кальция с 0,1 мм CaCl2 опущены.
- Подготовка среднего K+ , содержащий 145 мм KCl, 5 мм Кох, 10 мм HEPES, 5 мм D-глюкозы и 0.1% BSA.
Примечание: Эти средства массовой информации широко были оптимизированы и подробно описаны в предыдущих публикациях4,5. - Подготовка Запасов АТФ путем взвешивания достаточно СПС порошок для около 20 мл бульона 100 мм. Растворите порошок в 17 мл хлористого калия буфера (145 мм KCl, 5 мм Кох и 10 мм HEPES, pH 7.5) и медленно, помешивая, добавить 2 мл 18% (w/v) Тетраметиламмония гидроксида (TMA) решение довести рН 6,8-7,0.
- Окончательного громкость до 20 мл. Не выброс pH 7.0 в прошлом. Хранить запас при температуре-80 ° C; Обратите внимание, что СПС аликвоты стабильны для по крайней мере 6 месяцев.
Примечание: Бесплатный молекулярной массой безводного АТФ-551.14 г/моль, и это не включать молекулярный вес воды и динатриевая молекул, которые могут меняться от партии к партии и должно приниматься во внимание для расчета. TMA токсичен, и необходимо соблюдать осторожность при обработке. Читайте безопасность данных листа и подготовка запасов в вытяжной шкаф. - Подготовьте фондовая BzATP путем растворения BzATP в сверхчистого H2O для окончательного запасов концентрации 10 мм.
- Создание одной ячейки подвеска, как описано в шагах 1.16 и 1.17. Подсчет количества ячеек с помощью Горяева или счетчик автоматического клеток. Ресуспензируйте клеток в среде требуется (например, средний Na+ , питательной среды) для эксперимента, проводимого (как описано ниже) и в то же время место клетки на льду.
- Для каждого эксперимента убедитесь, что имеется достаточно образцов для включения элементов управления для передней и боковых разброса, а также для калибровки параметров напряжения и компенсации. Обратите внимание, что как признак того, что сферах, выращенных в колбе T75 обычно дают около 8 х 106 клеток за флакон.
-
Настройки потока цитометр с помощью контрольных образцов.
- Использование вперед и боковые разброс выборочно ворота живых клеток.
Примечание: Вперед разброс предоставляет информацию относительно размера ячейки, основанные на дифракцию света, в то время как стороны точечной обеспечивает измерение внутренней сложности или гранулярности. Поток событий с Малый вперед и разброс сторона может рассматриваться как мертвые клетки. - Отрегулировать напряжение и получить из проточный цитометр согласно инструкциям производителя. Запустите образец судебного разбирательства обеспечить сбор данных с интенсивностью максимум флюоресценции. Никакая компенсация не требуется для приобретения одного канала.
- Использование вперед и боковые разброс выборочно ворота живых клеток.
3. Измерение приток кальция потоком цитометрии Live клеток
- После подготовки одной ячейки подвеска, Ресуспензируйте клеток в 1 мл раствора кальция свободной среды Na+ и загрузить их с 2 нг/мл красителя индикатор кальция согласно протоколу производителя (см. Таблицу материалы) с 10 мкл 5% плюрониевого кислоты. Инкубировать клетки для 30 минут при 37 ° C.
- Вымыть клетки путем добавления 3 – 5 мл свободного кальция Na+ среды и центрифугирование мягко (200 x g 4 мин). Удалить супернатант и Ресуспензируйте ячейки свободного кальция средний Na+ , мытье во второй раз.
- Ресуспензируйте клеток в 1 мл раствора кальция свободной среды Na+ , разместить их на льду и позволить им де эстерифицировать за 30 мин.
- Вымыть 1 x больше, добавив 3 – 5 мл K+ среды и центрифугирования (x 200 g 4 мин); затем Ресуспензируйте клетки в K+ средних и аликвота их в флуоресценции вспомогательной ячейки, сортируя (FACS) трубы в концентрации 1 х 106 клеток на 500 мкл в СУИМ трубки.
Примечание: Количество трубок СУИМ на сэмпл будет зависеть количество процедур и повторяет, что входит в стоимость номера. - Место СУИМ трубы на льду, пока клетки готовы анализируемое. Не оставляйте клетки на льду для длительного периода времени, но как можно скорее начать пробу.
- Для некоторых образцов, preincubate клетки с P2X7 рецептор специфические ингибиторы AZ10606120 (1 мкм для 10-15 мин) или A438079 (10 мкм 30 мин) при 37 ° C до анализа.
- За несколько минут до запуска первого образца, добавить CaCl2 (конечная концентрация 1 мм в трубу СУИМ) и трубку в ванну воды 37 ° C для восстановления.
- Падение чистой, малые магнитной мешалкой в СУИМ трубки и положение трубки в модуле время связаны с ванну циркулирующей воды 37 ° C для контроля температуры образца. Выберите низкий перемешивания скорость для обеспечения перемещения образца без введения вихревого эффекта. Поместите адаптер трубки водой куртку на платформу образца и закрыть рычаг машины СУИМ.
- Инициировать выборки приобретение и выполнение примера 3 мин около 1000 событий в секунду.
- В знак 40 s, быстро снять трубку и добавить P2X7 агонист, АТФ 1 мм или 300 мкм BzATP и заменить трубки для продолжения приобретения.
- В то время как первый образец записи, подготовить второй образец с CaCl2 и поместите его в 37 ° C, чтобы обеспечить достаточно времени для клеток для разминки перед анализом. По окончании первого образца очистить потребление, запустив образец воды, и тогда может начаться на приобретение второго образца, как описано в шагах 3.8 и 3.9. Всегда очищайте потребление между выборками.
4. Измерение порообразования подачей Cytometry клеток
- Создание одной ячейки подвеска, как описано в шагах 1.16 и 1.17. Сохранить несколько миллилитров старой среды, использовать его для Ресуспензируйте клетки в концентрации 1 х 106 клеток на 100 мкл в СУИМ трубки и поместите его на льду до готовности.
- Перед запуском assay, мкл 900 K+ среды для заключительного тома 1 мл и трубы в ванну воды 37 ° C за 10 мин до восстановления.
- Если применимо, preincubate клетки с методами лечения, включая P2X7-специфические ингибиторы AZ10606120 (1 мкм для 10-15 мин) или A438079 (10 мкм 30 мин).
- Сразу перед запуском assay, добавьте 25 мкм бромид ethidium СУИМ трубки; Затем добавьте Магнитная мешалка, поместите его на машине СУИМ согласно шаг 3.7 и начать приобретение.
Примечание: Бромид ethidium токсичен, и необходимо соблюдать осторожность при обращении с ней. Надлежащим образом распоряжаться используются трубы СУИМ. - Чтобы вызвать образование поры в мембране клетки, добавьте 1 мм АТФ или 100 мкм BzATP 40 s после начала приобретения.
- Выполнение примеров на около 1000 событий в секунду для 6 мин.
- Во время первого образца, взять второй пример из льда и поместите его в ванну воды 37 ° C дать достаточно времени для клеток для восстановления до анализа. После завершения первого образца с приобретением очистите потребление, запустив образец воды; затем второй выборки могут быть размещены на машину, чтобы начать запись, как описано в шагах 3.8 и 3.9.
5. Измерение фагоцитоза, жить клеточной проточной цитометрии
- Создание одной ячейки подвеска, как описано в шагах 1.16 и 1.17. Ресуспензируйте клетки в кондиционерами среднего и Алиготе, их в СУИМ трубки в концентрации менее 1 x 106 клеток на 100 мкл в СУИМ трубки. Разбавить клетки до конечной концентрации 1 х 106 клеток/мл с Na+ среднего (например, мкл 900 среднего Na+ ) и место клетки на льду, до тех пор, пока выполняется анализ.
- Используйте 1 мкм YG латексные шарики (микросферы) фагоцитарной мишенями для реального времени фагоцитоза анализов.
Примечание: Другие цвета также может быть заменен, но разного размера бусины были признаны неадекватными объектом фагоцитоза4. - Перед запуском первого образца, передача клетки в ванну воды 37 ° C и инкубировать их для примерно 7-10 мин до позволяют клеткам восстанавливаться.
-
Добавьте любые процедуры, требующие preincubation с их соответствующих трубок, включая 1 мм СПС 15 мин, 300 мкм окисляется СПС (oxATP) для 40 мин, 20 мкм cytochalasin D 20 мин и параформальдегида 4% (PFA) для 20 мин.
- Не preincubation является обязательным для 5% сыворотки крови человека. Если процедуры добавляются в приблизительно то же время, образцы можно запустить в обратном порядке, в то время как другие по-прежнему инкубации. Например элементы управления и сыворотки сначала выполните, затем АТФ лечение образца, следуют cytochalasin D и PFA и oxATP последний.
- Поместите образец на цитометр с магнитной мешалкой, как описано в шагах 3.8 и 3.9 и, затем, начать приобретение образца.
- Удалить образец трубки из машины 15 – 20 с после начала приобретения и 5 мкл неразбавленном бусины Ю.Г. Возвращает образец трубки СУИМ и продолжить приобретения. Запуск образцов для 7-8 минут на около 1000 событий/сек.
- Во время первого образца, взять второй пример из льда и поместите его в ванну воды 37 ° C дать достаточно времени для клеток для восстановления до анализа. После завершения первого образца, очистить потребление, запустив образец воды и, затем, начать приобретение на втором образце, как описано в шагах 3.8 и 3.9.
6. анализ данных
- Экспортируйте данные в электронную таблицу. Анализ данных будет зависеть от экспериментальных вопрос.
Примечание: Имейте в виду, что различные трассы могут иметь различные базовые интенсивности, поэтому очень важно для выполнения анализа в течение указанного времени в начале (около 40 s) перед добавлением любого агонисты и нормализовать данные путем расчета изменений в флуоресцировании (флуоресцирования в любой заданный момент времени [F], разделенных флуоресценции в момент времени 0 [F0], или F/F0). - Чтобы измерить скорость или кинетики данной функции P2X7, вычислить площадь под кривой или сумма трапеции, созданные под кривой для каждого 10 s время периода16.
- Чтобы определить эффект лечения, средней интенсивности флуоресценции окончательного 10 – 20 сек запись и сравнить лечения. Определить значение t-теста или дисперсионный анализ.
Результаты
Культуры клеток нейронной прародителя
Нейронные прародитель сферы культуры, полученных с помощью этого метода следует фаза светлые и имеют гладкие круглые края (рис. 1AB). В здоровых культур малые microspikes можно наблюдать на края (рис. 1 c). В конце ходы или если недостаточно кормили, сферах могут образовывать полые Чашечная форма (рис. 1 d) или крупные продолговатые формы (Рисунок 1E, указано стрелкой). Эти культуры не должны использоваться для проточной цитометрии или любые другие нисходящие приложения, как эти функции оно может свидетельствовать о дифференциации. Для подтверждения статуса нейронных прародителю, клетки были покрытием на стекло coverslips покрытием с поли L-орнитин и Ламинин immunocytochemistry (Рисунок 1F и, в более высоких confluency, Рисунок 1 g). Клетки окрашивали для СВМС, Нестин, Sox2, виментин, ASCL1, BLBP, Prox1 и DCX для идентификации клетки клетки-предшественники типа 2 (гиппокамп) или типа C прогениторных клеток (SVZ)9. Клетки должны иметь четко определенные ядро и расширенных процессов.
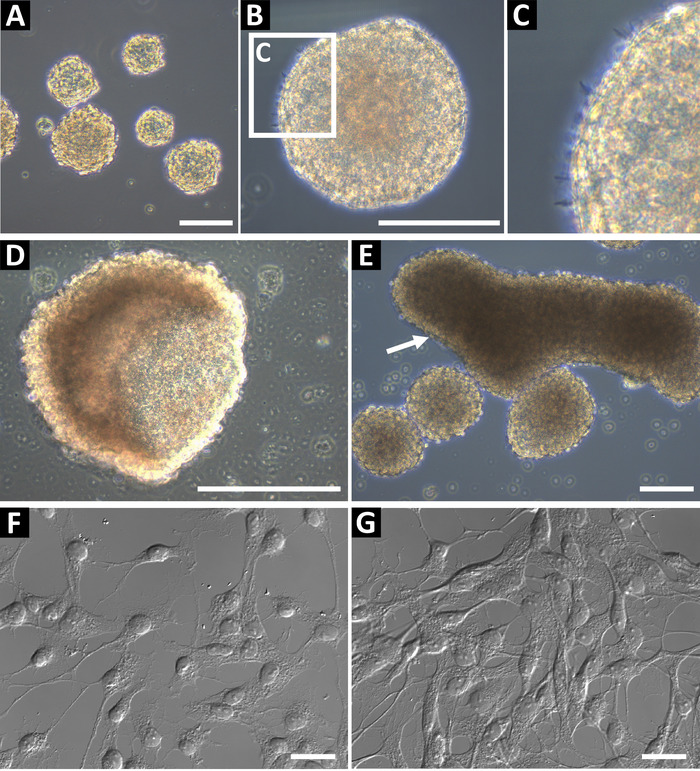
Рисунок 1: представитель гиппокампа нейронных прародитель клеточной культуры. (A) гиппокампа прародитель нейронные клетки изолированы от взрослых мышей и культивировали как neurospheres до примерно 100-150 мкм в диаметре. (B) Neurospheres должен иметь гладкую периферии, (C) и малых microspikes может быть замечен на их поверхности. Когда сферы являются слишком долго в культуре, они могут образовывать Кубок (D) или (E) продолговатой формы. Эти культуры не должны использоваться для экспериментов. Для подтверждения статуса нейронных прогениторных клеток, семя их как одну ячейку подвеска на поли L-орнитин (ООП) и coverslips Ламинин покрытием стекла для Иммунохимия. Клетки должны иметь небольшой сома и ветвящихся процессов, (F) на низких confluency и (G) готовы к иммунохимии. Масштаб баров = 100 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Приток кальция, жить клеточной проточной цитометрии
Этот протокол позволяет для анализа функции рецептора P2X7 как кальциевых каналов в режиме реального времени. Кинетика функции рецепторов, а также последствия различных агонистов и антагонистов, также может быть оценена. Когда печать над время, приток кальция в гиппокампе и нейронных прогениторных клеток SVZ был в целом аналогичные (рисунок 2A и 2B рисунок, соответственно). Агонисты (АТФ или BzATP) были добавлены на метке 40 s, как указано красной стрелкой. На мгновение трубка удаляется из точки записи для добавления агонист, что приводит к точкам данных нулевой. Это позволит для определения времени, когда был добавлен агониста. BzATP быстро активирует P2X7 рецепторы, открытию ионного канала и позволяя приток кальция, который связывает Fluo-8 и флуоресцирует. СПС приложения обычно приводит к более постепенный приток кальция. Он имеет меньше сродством к P2X7 по сравнению с BzATP и также приведет к активации сочетании G-белка рецептора, медленнее сигнальный путь, который выпускает кальций из эндоплазматического ретикулума. Включение P2X7 антагонисты A438079 и AZ10606120 (данные не показаны) сократить приток кальция в ответ на применение агонистов.
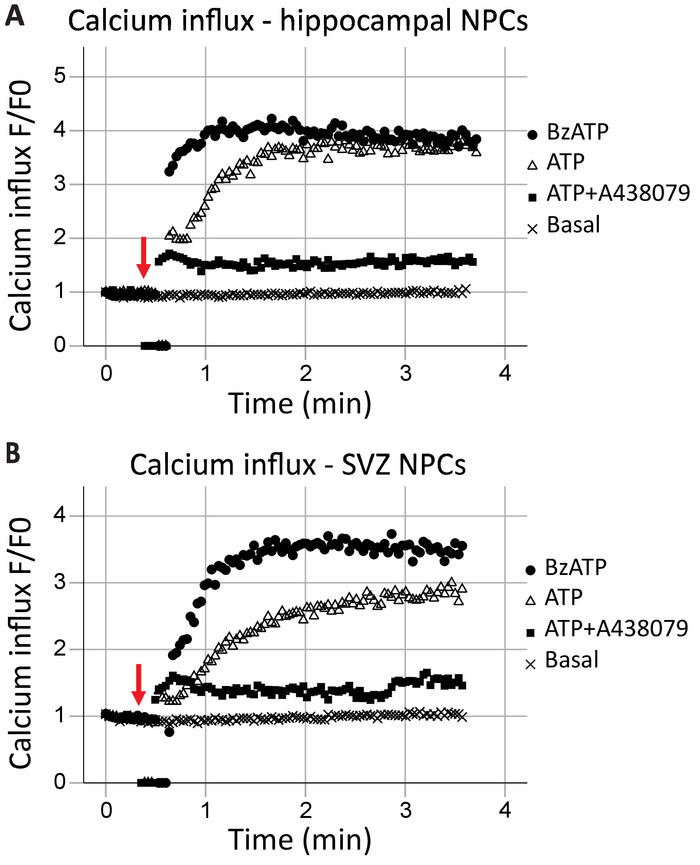
Рисунок 2: приток кальция клеток в нейронных прогениторных клеток гиппокампа и SVZ. P2X7 рецептор кальция канала функция была продемонстрирована в (A) гиппокампа и клеток SVZ-производные прародитель (B) изменения в флуоресцировании Fluo-8. Применение общего P2X агонист АТФ и P2X7 агониста BzATP результат в P2X7 ионные каналы открытие, позволяя приток кальция. Приток был заблокирован с P2X7-специфические ингибиторы A438079 или AZ10606120 (данные не показаны). F = флуоресценции; F0 = флуоресценции в момент времени 0. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Порообразования подачей cytometry клеток
Трансмембранный порообразования является функцией каноническое P2X7 рецепторов, результаты в макромолекулы обмен и может привести к смерти клетки. Ethidium+ является большая молекула (314 Da), исключены из здоровых клеток; его поглощения и последующего Интеркаляция ДНК приводит к Флуоресцентные выбросов и может использоваться для оценки способности P2X7 рецепторов сформировать трансмембранного поры. После применения агонистов АТФ (1 мм АТФ) и BzATP (100 мкм) на 40 s (указано стрелкой), время решена проточной цитометрии захватывает бромид ethidium, введя клетки в режиме реального времени (рис. 3A). Этот эффект был аттенуированных P2X7-специфические ингибиторы AZ10606120. Assay поглощение бромид ethidium демонстрирует функциональные P2X7 рецептор C-конечная17 и хорошо доказательства для полнометражных экспрессии рецепторов P2X7. ATP концентрация реакция анализов иллюстрируют эффекты агонистов концентрации на P2X7 порообразования, используя изменения в флуоресцировании бромид ethidium со временем (рис. 3B). Агонист дозе концентрации кривых вместе с рецепторов специфичные ингибиторы обеспечивают убедительные доказательства для активации рецептора.
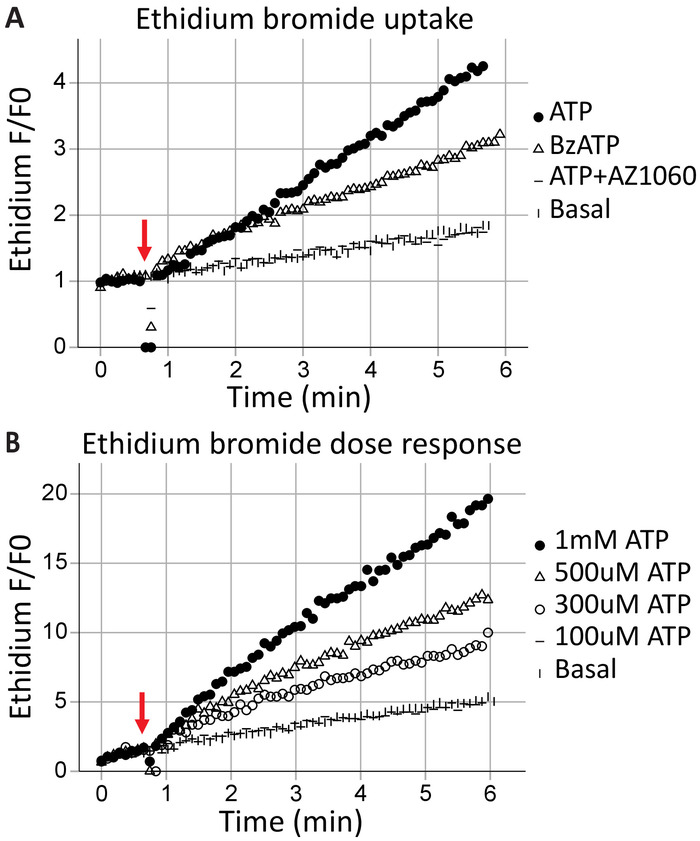
Рисунок 3: P2X7 трансмембранного порообразования измеряется ethidium поглощения. Помимо моментов бромид ethidium до начала приобретения используется для измерения формирования P2X7 трансмембранного поры. Высокие концентрации АТФ и BzATP результат в (A) P2X7 рецептор поры формирования, позволяя бромид ethidium войти в камеру. P2X7 ингибитор AZ10606120 ослабляет это явление и предоставляет доказательства для функциональных P2X7 рецепторов. (B) СПС концентрация реакция анализов продемонстрировала значительные порообразования в 500 мкм и 1 мм, но не при более низких концентрациях. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Фагоцитоз, жить клеточной проточной цитометрии
Наша группа продемонстрировала ранее внеклеточного АТФ тормозит P2X7-опосредованной фагоцитоза путем отделения P2X7 C-конечная от цитоскелета, в частности, nonmuscle миозин IIA18,19. Этот метод расширяет на этих выводах продемонстрировать P2X7 рецептор участие в фагоцитозе гиппокампа и клеток SVZ нейронных прародитель в режиме реального времени (рис. 4, пример гиппокампа фагоцитоза). Раскованный фагоцитоза (управления) уровня 1 мкм YG латексные шарики были созданы как позитивный элемент управления. СПС тормозится фагоцитоза YG бусины в той же степени, как неспецифические ингибиторы, а именно PFA фиксации и cytochalasin ингибитор полимеризации актина D, в то время как 5% сыворотки отменили все врожденные фагоцитоза20.
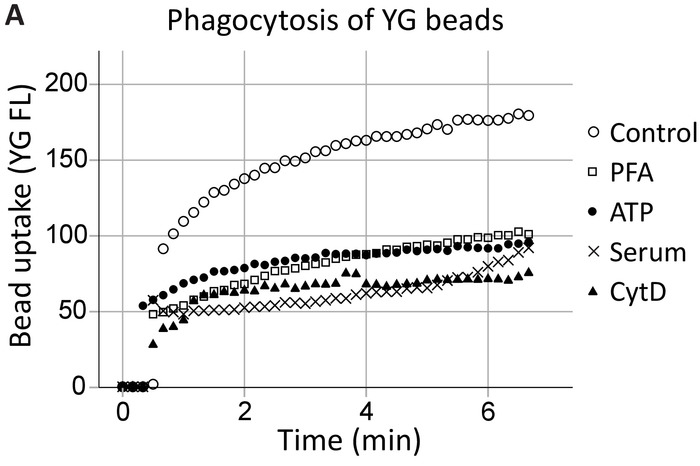
Рисунок 4: YG шарик поглощения, демонстрируя фагоцитарной способности нейронных прародителями через рецепторы P2X7. YG шарик поглощение нейронных прогениторных клеток наблюдается с использованием клеток проточная цитометрия в режиме реального времени. Контролировать уровень фагоцитоза установлены изначально и если количество клеток позволяет, подтвердил в конце выполнения. Участие P2X7 рецепторов обозначается угнетение фагоцитоза в присутствии АТФ, как это диссоциирует C-отель terminus из цитоскелет мембраны, предотвращая P2X7-опосредованной цитоскелета перестановок. Применения СПС заблокирован фагоцитоза в той же степени, как использование ингибиторов неспецифической фагоцитоза, включая параформальдегида (PFA) и cytochalasin D (CytD). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Этот документ представляет подробный протокол для анализа функции рецептора P2X7 в нейронных прародитель клеточных культур, производный от взрослых нейрогенный ниши. Потенциальные приложения для взрослых нейронных прародитель клетки варьируются от научных исследований до терапевтических целях, и таким образом метод культуры должны быть надежной и воспроизводимость. Существует ряд ключевых аспектов настоящего Протокола, которые могут повлиять на качество конечной культуры. После удаления из черепа, мозг не должно быть позволено сухой и вскрытие должно выполняться как можно быстрее. Особенно с гиппокампе осторожность для устранения любых кровеносных сосудов или пленочной ткани приведет к Улучшенный прогениторных клеток урожайности. Процесса диссоциации и Тритурация может сильно повлиять на количество сфер, полученных в культуре; Агитируя ткани во время инкубации с трипсина ЭДТА приведет к более однородный раствор. Использование стекла, огонь полированные пастбище пипетки над P1000, пластиковая Пипетка Совет настоятельно рекомендуется сократить гибель клеток и улучшить результате культуры. Избегайте overtriturating. Несмотря на эти меры предосторожности процедура может создать много мусора в P0 культуре, и чтобы избежать потери клетки-предшественники, промывки или кормления культуры следует избегать до тех пор, пока сформировали сферах.
Целый ряд различий между гиппокампа и SVZ культур будет очевидным в P0. Гиппокампа культур дают меньше сферах, и это обычно придерживаются. Используете наконечник пипетки для осторожно поднимите сфер для первоначального прохода. Адгезивная сферах не наблюдалось в последующих проходах. Различные марки колбы культуры ткани может привести к сфере, особенно гиппокампа сферах, присоединиться и расти как колоний в нижней части блюда. Это не был найден изменять любые течению результаты для этого протокола, но должны контролироваться, и там, где это возможно, следует сохранить соответствие.
Предыдущие методы, используемые для измерения P2X7 рецептор функции, такие как патч зажима для записи приток кальция, длительным и трудоемким и можно передавать информацию только на одну ячейку. Этот протокол предоставляет быстрый и воспроизводимый метод для анализа все три основные функции рецепторов P2X7, с помощью одной машины. Время решена клеток проточной цитометрии позволяет для анализа всего населения и предоставляет информацию о кинетике приток кальция, порообразования и/или фагоцитарную функцию исследователь. В дополнение к этому проточной цитометрии может легко использоваться в качестве метода оценки маркер выражения шаблоны и населения анализ, основанный на уровнях выражения белка или размер ячейки.
При проведении этих экспериментов, могут наблюдаться различия в приток максимальной кальция, ethidium поглощения или фагоцитоза ставки между повторами. Чтобы минимизировать это, размер области, условий культуры и кормления режима должны быть согласованы как здоровье клеток будет иметь значительное влияние на результаты, полученные. Время на льду также может оказывать влияние данных, таким образом обеспечить все готовится заранее, так что время на льду является минимальным. Гарантировать согласованность краситель индикатор кальция, время загрузки. Еще одним фактором, который может привести к большие несоответствия в записи максимальной кальция является разница между партиями СПС. Подготовка запасов АТФ имеет решающее значение, и следует избегать использования различных пакетов для те же эксперименты. Сравнение старых и новых пакетов, чтобы убедиться, что СПС согласуется также рекомендуется. Эффективность P2X7 антагонистов также может быть зависит от линии клетки и партии, поэтому может потребоваться оптимизация инкубации раз и концентрации.
Стоит отметить, что приток кальция/измеряем является одним из наиболее важных и сложных клеточных функций и может быть опосредовано многие рецепторы. АТФ индуцированной кальция приток, как классический измерения для P2X7 канала/поры функции, не может точно отражать истинную функцию P2X7 рецепторов, как АТФ может также активировать P2Y рецепторы выпустить внутриклеточного кальция. В этом случае Барий может быть лучше катиона для использования вместо кальция, как ее приток является однонаправленным16. Чтобы различать вклад от P2Y рецепторов в приток кальция, условия, где средний K+ вместо CaCl2 добавляется 1 мм ЭДТА или этиленгликоля bis(β-aminoethyl ether)-N, N, N′, N′-tetraacetic кислота (EGTA) может использоваться в этом анализа.
Этот протокол также может быть легко адаптирована для удовлетворения других типов клеток и может быть полезным для изучения функциональность альтернативных ионного канала рецепторов или рецепторов, которые участвуют в фагоцитозе. Этот метод также может быть адаптирована к поток цитометрии машину без модуля времени. Например может выполняться фагоцитоза анализов, где YG бусины добавляют 7-8 минут до анализ обычной проточной цитометрии. Держите клетки при 37 ° C и непрерывно вихрем их. Это не будет предоставлять информацию в реальном времени, но по-прежнему различия в средней заключительном флуоресцирования проинформирует исследователь относительно функциональности P2X7 рецепторов.
Интерес к P2X7 рецепторы как препарат целевой21,22 или даже как доставки лекарств маршрута23,24 , быстро растет, и поэтому постоянно должны быть методы для изучения этого загадочного рецептора адаптированы и улучшены для облегчить эти исследования. Этот протокол определяет методологий, которые могут быть использованы для изучения функции P2X7 в клетках взрослых нейронных прародителю, и ожидается, что достижение более глубокого понимания P2X7 рецепторов в нишах, нейрогенные может привести к достижения в лечении инсульта и другие ишемические повреждения.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы поблагодарить Мария Kasherman и Хуан Синь за их вклад в это исследование. Эта работа была поддержана грантов от Ребекка л Купер медицинский исследовательский фонд М.В., T.C.L. и м.л. и T.C.L. из национального здравоохранения и медицинских исследований Совета (NHMRC) Австралии (571100 и 1048082) и (Благотворительный фонд компании «Бакстер» Сидней, Австралия). Б.г. была поддержана Австралийский исследовательский совет (ARC) будущее стипендий (FT120100581), грантов проекта NHMRC (1048082, 1061419 и 1120095) и викторианской правительство оперативной инфраструктуры поддержки Грант института Флори. М.л. была поддержана Чарльз D. Келман, M.D. докторской Award (2010) от международного фонда исследования сетчатки (США).
Материалы
| Name | Company | Catalog Number | Comments |
| A438079 | Tocris | 2972/10 | |
| ATP | Sigma-Aldrich | A2383 | |
| AZ10606120 | Tocris | 3323/10 | |
| bzATP | Sigma-Aldrich | B6396 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| FACSCalibur | Becton Dickinson | ||
| Fluo-8AM | AAT-Bioquest | 21080 | Fluo-4AM and Fura-Red AM have also been used successfully |
| Fluoresbrite YG Microspheres | Polysciences Inc | 17154-10 | 1.00 µm, yellow-green |
| Glutamine | ThermoFisher Scientific | 25030081 | 200 mM |
| HBSS | ThermoFisher Scientific | 14170112 | |
| Heparin | Sigma-Aldrich | H3149 | |
| NeuroCult Basal Medium | Stemcell Technologies | 5700 | Mouse and rat |
| NeuroCult Proliferation Supplement | Stemcell Technologies | 5701 | Mouse and rat |
| Oxidized ATP | Sigma-Aldrich | A6779 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | pluronic acid |
| Recombinant Murine EGF | Peprotech | 315-09 | |
| Recombinant Murine FGF-basic | Peprotech | 450-33 | |
| Tetramethylammonium Hydroxide | Sigma-Aldrich | T7505 | |
| Time Zero Module | Cytek Biosciences | ||
| Tissue culture flasks | BD Falcon (Corning) | 353108 (T25), 353136 (T75) | Blue vented screw cap |
| TrypLE Express | Gibco | 12604013 | |
| Trypsin-EDTA (0.25%) | ThermoFisher Scientific | 25200056 | with phenol red |
| UltraPure Ethidium Bromide | ThermoFisher Scientific | 15585011 | 10 mg/mL |
Ссылки
- Sperlagh, B., Illes, P. P2X7 receptor: an emerging target in central nervous system diseases. Trends in Pharmacological Sciences. 35 (10), 537-547 (2014).
- Liang, X., et al. Quantifying Ca2+ current and permeability in ATP-gated P2X7 receptors. Journal of Biological Chemistry. 290 (12), 7930-7942 (2015).
- Rat, P., Olivier, E., Tanter, C., Wakx, A., Dutot, M. A fast and reproducible cell- and 96-well plate-based method for the evaluation of P2X7 receptor activation using YO-PRO-1 fluorescent dye. Journal of Biological Methods. 4 (1), 64(2017).
- Gu, B. J., et al. A quantitative method for measuring innate phagocytosis by human monocytes using real-time flow cytometry. Journal of Quantitative Cell Science: Cytometry Part A. 85 (4), 313-321 (2014).
- Jursik, C., et al. A quantitative method for routine measurement of cell surface P2X7 receptor function in leucocyte subsets by two-colour time-resolved flow cytometry. Journal of Immunological Methods. 325 (1-2), 67-77 (2007).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272 (5262), 735-738 (1996).
- Delarasse, C., et al. Neural progenitor cell death is induced by extracellular ATP via ligation of P2X7 receptor. Journal of Neurochemistry. 109 (3), 846-857 (2009).
- North, R. A. Molecular physiology of P2X receptors. Physiological Reviews. 82 (4), 1013-1067 (2002).
- Leeson, H. C., et al. P2X7 Receptors Regulate Phagocytosis and Proliferation in Adult Hippocampal and SVZ Neural Progenitor Cells: Implications for Inflammation in Neurogenesis. Stem Cells. , (2018).
- Glaser, T., et al. Modulation of mouse embryonic stem cell proliferation and neural differentiation by the P2X7 receptor. PLoS One. 9 (5), e96281(2014).
- Papp, L., Vizi, E. S., Sperlagh, B. Lack of ATP-evoked GABA and glutamate release in the hippocampus of P2X7 receptor-/- mice. Neuroreport. 15 (15), 2387-2391 (2004).
- Wiley, J. S., Gu, B. J. A new role for the P2X7 receptor: a scavenger receptor for bacteria and apoptotic cells in the absence of serum and extracellular ATP. Purinergic Signalling. 8 (3), 579-586 (2012).
- Lovelace, M. D., et al. P2X7 receptors mediate innate phagocytosis by human neural precursor cells and neuroblasts. Stem Cells. 33 (2), 526-541 (2015).
- Walker, T. L., Kempermann, G. One mouse, two cultures: isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of Visualized Experiments. (84), e51225(2014).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Frontiers in Neuroscience. 5, 89(2011).
- Gu, B. J., Wiley, J. S. Broad applications of mulit-colour time-resolved flow cytometry. Flow Cytometry - Recent Perspectives. , (2012).
- Cheewatrakoolpong, B., Gilchrest, H., Anthes, J. C., Greenfeder, S. Identification and characterization of splice variants of the human P2X7 ATP channel. Biochemical and Biophysical Research Communications. 332 (1), 17-27 (2005).
- Gu, B. J., Saunders, B. M., Jursik, C., Wiley, J. S. The P2X7-nonmuscle myosin membrane complex regulates phagocytosis of nonopsonized particles and bacteria by a pathway attenuated by extracellular ATP. Blood. 115 (8), 1621-1631 (2010).
- Gu, B. J., Rathsam, C., Stokes, L., McGeachie, A. B., Wiley, J. S. Extracellular ATP dissociates nonmuscle myosin from P2X(7) complex: this dissociation regulates P2X(7) pore formation. American Journal of Physiology-Cell Physiology. 297 (2), C430-C439 (2009).
- Gu, B. J., et al. P2X7 receptor-mediated scavenger activity of mononuclear phagocytes toward non-opsonized particles and apoptotic cells is inhibited by serum glycoproteins but remains active in cerebrospinal fluid. Journal of Biological Chemistry. 287 (21), 17318-17330 (2012).
- Bhattacharya, A. Recent Advances in CNS P2X7 Physiology and Pharmacology: Focus on Neuropsychiatric Disorders. Frontiers in Pharmacology. 9 (30), (2018).
- Burnstock, G., Knight, G. E. The potential of P2X7 receptors as a therapeutic target, including inflammation and tumour progression. Purinergic Signalling. 14 (1), 1-18 (2018).
- Alves, L. A., et al. Pore forming channels as a drug delivery system for photodynamic therapy in cancer associated with nanoscintillators. Oncotarget. 9 (38), 25342-25354 (2018).
- Pacheco, P. A., et al. P2X7 receptor as a novel drug delivery system to increase the entrance of hydrophilic drugs into cells during photodynamic therapy. Journal of Bioenergetics and Biomembranes. 48 (4), 397-411 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены