Method Article
Citometria de fluxo de viver-pilha em tempo real para investigar o influxo de cálcio, formação de poros e fagocitose pelos receptores P2X7 em células progenitoras neurais adulto
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Citometria de fluxo em tempo real fornecendo sensibilidade de célula única, é especialmente adequada para quantificar as funções do receptor multimodal de culturas vivas. A função de receptor P2X7 usando células progenitoras neurais adulto, foi avaliada através do influxo de cálcio, detectado pelo corante indicador de cálcio, formação do poro transmembrana pela absorção do brometo de etídio e fagocitose usando grânulos látex fluorescentes.
Resumo
Citometria de fluxo ao vivo-celular é cada vez mais usada entre os biólogos de célula para quantificar os processos biológicos em uma vida cultura de células. Este protocolo descreve um método pelo qual citometria de fluxo ao vivo-célula é estendida em cima para analisar as múltiplas funções da ativação de receptores P2X7 em tempo real. Usando um módulo de tempo instalado em um citômetro de fluxo, viver-pilha funcionalidade pode ser avaliada e plotada ao longo de um determinado período de tempo para explorar a cinética do influxo de cálcio, formação de poro transmembrana e fagocitose. Este método simples é vantajoso, como todas as três funções canônicas do receptor P2X7 podem ser avaliadas usando uma máquina, e os dados plotados ao longo do tempo fornecem informações sobre a população viver-pilha inteira ao invés de gravações de célula única muitas vezes obtidos usando métodos de remendo-braçadeira tecnicamente desafiador. Experimentos de influxo de cálcio usar um corante indicador de cálcio, enquanto ensaios de formação de poros P2X7 contam com brometo de etídio, sendo permitido a passagem da transmembrana pore formados com concentrações elevadas do agonista. Grânulos de látex amarelo-verde (YG) são utilizados para medir a fagocitose. Antagonistas e agonistas específicas são aplicadas para investigar os efeitos da atividade de receptores P2X7. Individualmente, esses métodos podem ser modificados para fornecer dados quantitativos sobre qualquer número de canais de cálcio e receptores purinérgicos e ao tesouro. Tomados em conjunto, eles destacam como o uso da citometria de fluxo em tempo real de viver-pilha é um método rápido, cost-effective, reprodutível e quantificável para investigar a função de receptor P2X7.
Introdução
O estudo da sinalização purinérgicos é amplo e multifacetado, envolvendo farmacologia, bioquímica e fisiologia celular. Purinérgicos sinalização está envolvido em um número infinito de processos celulares e moleculares, de câncer e a regulação do ciclo celular, a comunicação célula-célula e biologia de células-tronco; como tal, muitas vezes existe um potencial para modular purinérgicos, sinalizando para um benefício terapêutico. Dos receptores purinérgicos, receptores P2X7 tem recebido atenção significativa nos últimos anos devido ao seu potencial como um alvo terapêutico para numerosas condições inflamatórias1. Métodos para estudar o receptor tem evoluído e foi adaptados ao longo dos anos para facilitar esta pesquisa2,3,4,5. Aqui, descrevemos um método de citometria de fluxo ao vivo-celular para investigar as múltiplas funções dos receptores P2X7 em células progenitoras neurais adulto derivados a zona subventricular (SVZ) e giro denteado do hipocampo.
O receptor P2X7 foi descrito pela primeira vez como o receptor P2Z, ou o receptor 'morte celular', como sua ativação com altas concentrações de adenosina trifosfato (ATP) resulta na formação de um poro transmembrana grande permeável às moléculas até 900 Da6. Isto leva a rearranjo do citoesqueleto, formação de poro transmembrana e, potencialmente, apoptose e/ou necrose7. Tradicionalmente, esta função de P2X7 é quantificada pela utilização de corantes de grande peso molecular como YO-PRO-1 ou ethidium brometo, que fluorescem quando intercalados com DNA3,8. Métodos de leitor de placa, que são rápidos e permitem "upscaling", geralmente não permitem a observação da cinética. O método descrito aqui é baseado na captação de etídio e permite o aumento de fluorescência para ser observada ao longo do tempo, proporcionando uma maior profundidade de informações no que diz respeito a velocidade de formação de poros. Os receptores P2X7 desde que foram mostrados para facilitar uma série de funções, com respostas distintas, dependendo da exposição tempo e agonista concentração9,10. Breve ativação por concentrações de ATP resulta em influxo de cação para efeitos do neurotransmissor e sinal de transdução11. Usando citometria de fluxo para medir o influxo de cálcio supera os problemas associados aos métodos complicados e tecnicamente desafiadoras — particularmente, remendo de aperto para medir correntes internas que fornecem detalhes inestimáveis a respeito da mudança no potencial do outro lado uma membrana celular, mas não permitem a análise de população2. A terceira função de receptores P2X7 ocorre na ausência de ATP, onde os receptores P2X7 tenham sido demonstrados para facilitar a fagocitose em ambos o sistema imunológico e o sistema nervoso9,12,13. Avanços em técnicas de microscopia permitiram a visualização de rearranjos do citoesqueleto durante o processo de absorção, embora a análise de quantificação e população ainda pode apresentar um desafio.
O método de citometria de fluxo ao vivo-celular detalhado aqui permite a investigação de todos os três principais funções dos receptores P2X7 em tempo real. A inclusão de um dispositivo de módulo de tempo sobre o citômetro de fluxo permite que o controle de temperatura e agitação contínua de células em suspensão. Agonista e antagonista de estímulos podem ser entregues dentro de um segundo, permitindo a medição ininterrupta perto da resposta celular. Isso apresenta um método rápido e simples para quantificar reproducibly função, evitando o uso de vários sistemas de ensaio. É importante notar que este protocolo pode ser facilmente adaptado para atender qualquer tipo de célula e pode ser usado para examinar outros subtipos de receptores, dados a inclusão de agonistas específicas ou inibidores, dependendo de suas propriedades.
Protocolo
Animais foram tratados de acordo com o Australian código de práticas para o cuidado e o uso de animais para fins científicos e aprovados para uso pelo Comité de ética Griffith University.
1. Neurosphere de cultura de células progenitoras neurais da SVZ adulto e hipocampo
Nota: O protocolo de dissecação apresentado aqui é baseado no trabalho de Walker e Kempermann e um protocolo detalhado para a dissecação de células progenitoras neurais de camundongos adultos está disponível em outro lugar14. Condições de cultura foram modificadas de Barbosa e colegas15. Utilizaram-se ratos adultos de C57BL/6 femininos, com idades entre 8 a 12 semanas.
- Em uma câmara de segurança biológica, preparar o meio de cultura (meio basal neural) suplementado com suplemento de proliferação de células-tronco neurais, glutamina 2mm, ng/mL 20 fator de crescimento epidérmico (EGF), fator de crescimento de fibroblastos básico de ng/mL 10 (bFGF) e 2 µ g/mL heparina.
- Eutanásia em dois ratos por inalação de CO2 . Alternativamente, anestesiar os ratos de acordo com as orientações institucionais e imediatamente sacrificá-los por deslocamento cervical. Borrife suas cabeças com 70% de etanol e decapitá-los. Transferi cada cabeça para um tubo estéril contendo solução salina do Hank, equilibrada (HBSS) com solução de penicilina/estreptomicina 1 x (P/S).
- Realize dissecações em uma capa de fluxo laminar sob um microscópio de dissecação.
- Usando a tesoura pinça e dissecação, remover tecidos e ossos para expor o cérebro e transferi-lo para um prato estéril contendo HBSS com P/S.
- Posicione o lado ventral do cérebro acima e use uma lâmina de bisturi para fazer uma incisão coronal completa através do quiasma. Mantenha o cérebro firme com a pinça e usar um rápido, limpo e movimento descendente. Evite serrar para minimizar a morte celular e para ajudar a manter a estrutura do tecido.
Nota: Se não realizada de forma segura, o cérebro pode inclinar para a frente durante o corte, comprometer o número de células progenitoras obtidas da SVZ. - Isole o SVZ da metade rostral do cérebro.
- Localize os dois ventrículos, separados por septo, com o corpo caloso, formando uma ponte branca acima deles.
- Use pinça para remover o septo que separa os dois ventrículos e isolar as paredes laterais dos ventrículos laterais anteriores. Fazer isso, cortando com uma tesoura de dissecação bem acima, abaixo, para os lados e na parte da frente. Continuarão a existir apenas uma pequena Copa-como a forma.
- Preparar uma prato de Petri limpo tampa com algumas gotas de HBSS no meio e transferir o SVZ ao líquido. Não permita que o tecido para secar ou tocar em uma superfície seca. Fique ao lado enquanto dissecando o hipocampo.
- Isole o hipocampo da metade caudal do cérebro.
- Faça uma linha média corte entre os hemisférios para romper o corpo caloso. Uso dos ventrículos laterais como um guia e desdobre delicadamente o córtex para expor o hipocampo. Uma vez que o córtex foi desenrolado, o hipocampo pode ser visto como uma estrutura densa, branca e curvada.
- Use tesoura de dissecação fino ou uma pinça para isolar o hipocampo no tecido vizinho.
- Com a pinça, remova o excesso de substância branca, os vasos sanguíneos e qualquer tecido membranoso cobrindo o hipocampo.
- Preparar uma prato de Petri limpo tampa preparada com algumas gotas de HBSS e transferir o hipocampo para o líquido. Repita para o outro hemisfério.
- Uma vez que o hipocampo e a SVZ de dois ratos foram isoladas e transferido para suas respectivas de Petri tampas, dice mecanicamente o tecido usando uma lâmina de bisturi. Cortar o tecido em uma placa de Petri tampa, por cerca de 1 min, girando a cada 10 s até que o tecido parece suave e somente peças bem permanecem. Pegue uma lâmina de bisturi limpo e repita para o outro prato, cortar o tecido para 1 min.
- Utilizando uma pipeta de 1 mL, transferi todo o tecido de cada tampa da placa de Petri para separar os tubos contendo 1 mL de ácido de 0,25% do trypsin-ácido etilenodiaminotetracético (EDTA). Use um tubo para o SVZ e um tubo para o hipocampo.
- Fazer isso, primeiro pipetagem cerca de metade o tripsina-EDTA no tecido no prato para minimizar as bolhas de ar e para evitar que o tecido entrando em contato com a ponta da pipeta seco como é transferido para o tubo. Lave o prato e a lâmina de bisturi com o resto do tripsina-EDTA para coletar tanto tecido quanto possível e adicioná-lo ao tubo.
- Incube o tecido com a tripsina em banho-maria 37 ° C por 30 min, agitando o tubo a cada 10 min para dissociar corretamente o tecido.
- Triture o tecido usando um pipeta Pasteur de vidro polido fogo para criar uma suspensão de célula única. Tome cuidado para não overtriturate como isto irá causar lise celular excessiva. Este é um passo crítico para a dissociação de tecido ideal.
- Observar o conteúdo do tubo durante o processo de trituração e parar os primeiros sinais de que a maioria dos aglomerados de tecido foram removida. A solução de tripsina deve tornar-se ligeiramente turva quando as células foram para suspensão de célula única, embora alguns grupos podem permanecer.
Nota: Como uma indicação, passando a suspensão acima e para baixo 10 x x-15 é adequada. - Adicionar o meio de cultura até 5 mL para neutralizar a tripsina e girar a 300 x g durante 3 min. lavagem mais 2x com HBSS e passar o meio através de um filtro de célula de 70 µm para remover qualquer tecido agrupa.
- Transferi todas as células em 15 mL de meio para um frasco de cultura celular T75.
Nota: As esferas devem formar na passagem zero (P0) cultura SVZ após 7-10 dias e depois de 15 a 20 dias na cultura hippocampal. Abster-se de lavar ou alimentando as células durante este tempo para maximizar o número de células progenitoras neurais em cultura. Se os progenitores mais são necessários, ou para diminuir o tempo de incubação de P0, é possível aumentar o número de ratos sacrificados. - Manter as culturas a 37 ° C com 5% de CO2 e, após a fase inicial de cultura P0, passagem a cada 7-10 dias, se necessário, usando um práticas de cultura de tecido do armário e padrão de segurança biológica.
Nota: A cultura de hippocampal P0 deve gerar suficiente esferas para passagem para um balão de T25; a cultura SVZ irá gerar muitas esferas mais e pode ser passada em um T75. Se as esferas hippocampal P0 aderiram, use uma pipeta de 200 µ l de Levante suavemente a esfera. - Passagem das esferas quando eles alcançam 150 a 200 µm de diâmetro. Recolher as esferas e médio em um tubo de 15 mL e permitir que as esferas contentar pela gravidade aproximadamente 5 min. em alternativa, gira a uma velocidade baixa (100 x g) por 2 min.
- Remover o meio e dissociar as células com reagente de dissociação para 7-10 min, dependendo do tamanho das esferas.
Nota: O reagente de dissociação usado terá efeitos significativos sobre o resultado da cultura, então por favor, consulte a Tabela de materiais para detalhes. - Lavagem das células pela adição de 5 mL de HBSS para a célula solução e centrifugar x 300 g por 3 min. Retire o sobrenadante, Ressuspender as células em meio de cultura e sementes em aproximadamente 150.000 células em 5 mL do meio em um frasco de cultura celular T25 ou equivalente. Manter as culturas a 37 ° C e 5% de CO2.
- Confirme o estatuto de células progenitoras neurais, identificando a expressão de marcadores de células-tronco como Sox2 e ASCL1 antes de proceder a qualquer protocolo a jusante9.
Nota: Isso pode ser feito pelo método preferido do pesquisador (por exemplo, Imunoquímica por microscopia, citometria de fluxo ou borrão ocidental, ou usando a reação em cadeia da polimerase quantitativa (qPCR)).
2. preparação de uma suspensão de célula única para análise por citometria de fluxo
-
Prepare os meios necessários. Estes incluem o seguinte.
- Prepare meio at+ contendo 145 mM NaCl, KOH de 5 mM, 10 mM HEPES, 5 mM D-glicose, 0,1% albumina de soro bovino (BSA) e 0,1 mM CaCl2. Este meio é usado também em uma forma livre de cálcio, com 0,1 mM CaCl2 omitido.
- Prepare-se K+ médio contendo 145 mM KCl, KOH de 5 mM, 10 mM HEPES, 5 mM D-glicose e 0,1% BSA.
Nota: Estes meios de comunicação foram extensivamente otimizados em estão detalhados no anterior publicações4,5. - Prepare o Estoque de ATP por pesagem pó suficiente ATP para cerca de 20 mL de um estoque de 100 mM. Dissolver o pó em 17 mL de tampão de KCl (145 mM KCl, 5mm KOH e 10 mM HEPES, pH 7,5) e lentamente, mexendo, adicione 2 mL de 18% (p/v) de hidróxido de tetrametilamónio (TMA) para a solução de trazer o pH para 6.8-7.0.
- Ajuste o volume final de 20 mL. Não ultrapassar o pH passado 7.0. Armazenar o estoque a-80 ° C; Observe que as alíquotas de ATP são estáveis pelo menos 6 meses.
Nota: O peso molecular livre de ATP anidro é 551.14 g/mol, e isso não inclui o peso molecular das moléculas de água e dissódico, que pode variar de lote para lote e deve ser tomado em consideração para os cálculos. TMA é tóxico, e tenha cuidado ao manusear. Ler os dados de segurança da folha e preparem as ações em um armário de emanações. - Prepare o estoque BzATP dissolvendo o BzATP em ultrapura H2O para uma concentração final de estoque de 10 mM.
- Crie uma única célula suspensão conforme descrito nas etapas 1.16 e 1.17. Conte as células usando um hemocytometer ou um contador automático de células. Ressuspender as células no meio necessário (por exemplo, médio, at+ , meio de cultura) para o experimento a ser realizado (como descrito abaixo) e coloque as células no gelo, entretanto.
- Para cada experimento, verifique se há suficiente amostra para incluir controles para dispersão para a frente e lateral, bem como para a calibração das configurações de tensão e compensação. Observe, como uma indicação, que esferas crescidas num balão T75 normalmente produzem em torno de 8 x 106 células por balão.
-
Defina o fluxo citômetro configurações usando amostras de controle.
- Uso para a frente e lateral espalham portão seletivamente as células vivas.
Nota: Forward scatter fornece informações sobre tamanho de célula com base na difração de luz, enquanto a dispersão lateral fornece uma medida da complexidade interna ou granularidade. Eventos de fluxo com pequeno frente e dispersão de lado podem ser considerados como células mortas. - Ajustar a tensão e ganhar do citômetro de fluxo de acordo com as instruções do fabricante. Execute uma amostra experimental para garantir a captura de dados na intensidade da fluorescência máxima. Nenhuma compensação é necessária para aquisições de canal único.
- Uso para a frente e lateral espalham portão seletivamente as células vivas.
3. medir o influxo de cálcio por citometria de fluxo de viver-pilha
- Após a preparação de uma suspensão de célula única, Ressuspender as células em 1 mL de meio de at+ de cálcio livre e carregá-los com 2 ng/mL de corante indicador de cálcio de acordo com o protocolo do fabricante (consulte a Tabela de materiais) com 10 µ l de 5% pluronic ácido. Incube as celulas por 30 min a 37 ° C.
- Lavar as células adicionando 3 – 5 mL de meio de at+ de cálcio livre e centrifugação suavemente (200 x g durante 4 min). Remover o sobrenadante e ressuspender as células em meio livre de cálcio at+ , lavar uma segunda vez.
- Ressuspender as células em 1 mL de meio de at+ de cálcio livre, coloque-os em gelo e permitir-lhes de esterificar por 30 min.
- Lavar 1 x mais adicionando 3 – 5 mL de meio de K+ e centrifugação (200 x g durante 4 min); Então, Ressuspender as células em K+ médio e alíquota-los em fluorescência assistida célula classificação (FACS) tubos em uma concentração de 1 x 106 células por µ l 500 pelo tubo de FACS.
Nota: O número de tubos de FACS por amostra dependerá do número de tratamentos e repete que estão incluídos. - Coloque os tubos de FACS no gelo, até que as células estão prontas para ser analisado. Não deixe as células no gelo por um período prolongado, mas começar o ensaio logo que possível.
- Para algumas amostras, preincubate as células com inibidor de específicos do receptor P2X7 AZ10606120 (1 µM por 10-15 min) ou A438079 (10 µM por 30 min) a 37 ° C antes da análise.
- Alguns minutos antes de executar a primeira amostra, adicionar CaCl2 (para uma concentração final de 1 mM no tubo de FACS) e coloque o tubo em banho-maria 37 ° C para recuperar.
- Soltar um limpo, pequeno agitador magnético para o tubo de FACS e a posição do tubo no módulo de tempo ligado a um banho de água circulante 37 ° C para controlar a temperatura da amostra. Selecione uma baixa velocidade de agita para garantir o movimento da amostra sem introduzir um efeito de vórtice. Coloque o adaptador de tubo de revestimento de água para a plataforma de amostra e fechar o braço de alavanca da máquina FACS.
- Iniciar aquisição de amostra e executar a amostra por 3 min em cerca de 1.000 eventos por segundo.
- Na marca de 40 s, rapidamente Retire o tubo e adicionar o agonista P2X7, ATP de 1 mM ou 300 µM BzATP e substituir o tubo para continuar a aquisição.
- Enquanto a primeira amostra está gravando, preparar a segunda amostra com CaCl2 e colocá-lo em 37 ° C para permitir tempo suficiente para que as células para se aquecer antes da análise. Quando tiver terminado a primeira amostra, limpe a ingestão executando uma amostra de água, e então começar a aquisição da segunda amostra conforme descrito nas etapas 3.8 e 3.9. Limpe sempre a ingestão entre amostras.
4. formação de poros por citometria de fluxo ao vivo-célula de medição
- Crie uma única célula suspensão conforme descrito nas etapas 1.16 e 1.17. Salvar alguns mililitros do meio velho, usá-lo para Ressuspender as células em uma concentração de 1 x 106 células por µ l 100 pelo tubo de FACS e colocá-lo no gelo, até que esteja pronto.
- Antes de executar o ensaio, adicionar 900 µ l de meio K+ para um volume final de 1 mL e coloque os tubos em banho-maria 37 ° C durante 10 minutos para se recuperar.
- Se for o caso, preincubate as células com tratamentos, incluindo os inibidores específicos P2X7 AZ10606120 (1 µM por 10-15 min) ou A438079 (10 µM por 30 min).
- Imediatamente antes de executar o ensaio, adicionar brometo de etídio 25 µM para o tubo de FACS; em seguida, adicionar o agitador magnético, colocá-lo na máquina de acordo com a etapa 3.7 FACS e começar a aquisição.
Nota: Brometo de etídio é tóxico, e deve ter cuidado ao manuseá-lo. Descarte adequadamente utilizados tubos de FACS. - Para induzir a formação de poros na membrana celular, adicione ATP de 1 mM ou 100 µM BzATP 40 s após o início da aquisição.
- Execute os exemplos em cerca de 1.000 eventos por segundo para 6 min.
- Enquanto a primeira amostra é executado, tomar a segunda amostra do gelo e colocá-lo num banho de água a 37 ° C para permitir tempo suficiente para que as células para se recuperar antes da análise. Uma vez a primeira amostra terminou com a aquisição, limpa a ingestão executando uma amostra de água; em seguida, a segunda amostra pode ser colocada na máquina para começar a gravação, conforme descrito nas etapas 3.8 e 3.9.
5. a fagocitose por citometria de fluxo ao vivo-célula de medição
- Crie uma única célula suspensão conforme descrito nas etapas 1.16 e 1.17. Ressuspender as células em meio condicionado e alíquota-los em FACS tubos em uma concentração de pelo menos 1 x 106 células por µ l 100 pelo tubo de FACS. Diluir as células para uma concentração final de 1 x 106 células/mL, com média de at+ (por exemplo, adicionar 900 µ l de meio at+ ) e coloque as células no gelo até que a análise é efectuada.
- Use 1 µm de grânulos de látex YG (microesferas) como alvos fagocíticas para ensaios de fagocitose em tempo real.
Nota: Outras cores também podem ser substituídas, mas diferente tamanhos grânulos foram encontrados para ser alvos inadequados de fagocitose4. - Antes de executar a primeira amostra, transferir as células para banho maria a 37 ° C e incube-os por aproximadamente 7-10 min permitir que as células para se recuperar.
-
Adicione quaisquer tratamentos que requerem pré-incubação para seus respectivos tubos, incluindo 1 mM ATP por 15 min, 300 µM oxidado ATP (oxATP) por 40 min, 20 µM citocalasina D por 20 min e 4% paraformaldeído (PFA) por 20 min.
- Não pré-incubação é necessária para 5% de soro humano. Se os tratamentos são adicionados aproximadamente ao mesmo tempo, as amostras podem ser executadas na ordem inversa, enquanto os outros continuam a incubar. Por exemplo, execute os controles e soro primeiro, então a amostra tratada com ATP, seguida por citocalasina D e PFA e oxATP última.
- Colocar a amostra sobre o citômetro com agitador magnético conforme descrito nas etapas 3.8 e 3.9 e, em seguida, iniciar a aquisição de amostra.
- Retire o tubo de amostra da máquina, 15 – 20 s após o início da aquisição e adicione 5 µ l de grânulos YG não diluídos. Retornar o tubo de amostra FACS e continuar a aquisição. Execute os exemplos de 7 – 8 min a cerca de 1.000 eventos/s.
- Enquanto a primeira amostra é executado, tomar a segunda amostra do gelo e colocá-lo em banho-maria 37 ° C para permitir tempo suficiente para que as células para se recuperar antes da análise. Finalizada a primeira amostra, limpe a ingestão executando uma amostra de água e, em seguida, começar a aquisição na segunda amostra conforme descrito nas etapas 3.8 e 3.9.
6. análise de dados
- Exporte os dados para uma planilha. A análise dos dados dependerá a questão experimental.
Nota: Lembre-se que executa diferentes pode ter intensidades diferentes de base, portanto, é importante executar o ensaio por um tempo designado no início (cerca de 40 s) antes de adicionar qualquer agonistas e para normalizar os dados calculando a mudança na fluorescência (fluorescência em qualquer dado ponto do tempo [F] dividido pela fluorescência no ponto zero do tempo [F0] ou F/F0). - Para quantificar a taxa ou cinética da função P2X7 em questão, calcule a área sob a curva ou a soma dos trapézios criado sob a curva para cada 10 s tempo período16.
- Para determinar os efeitos dos tratamentos, média da intensidade de fluorescência mais o s de 10 – 20 final da gravação e comparar os tratamentos. Determinar o significado por t-teste ou análise de variância.
Resultados
Culturas de células progenitoras neurais
Culturas de esfera progenitoras neurais derivadas usando este método devem ser fase brilhante e tem uma borda redonda Lisa (figura 1AB). Em culturas saudáveis, microspikes pequenas podem ser observadas nas bordas (Figura 1). No finais, passagens, ou se alimentado inadequadamente, esferas podem formar uma forma de taça oco (Figura 1) ou grandes formas oblongas (Figura 1E, indicado pela seta). Essas culturas não devem ser usadas por citometria de fluxo ou quaisquer outras aplicações a jusante, como esses recursos podem ser indicativo de diferenciação. Para confirmar o status de progenitoras neurais, as células foram banhadas em lamelas de vidro revestidas com poli-L-ornitina e laminina por imunocitoquímica (Figura 1F e, na maior confluência, Figura 1). As células foram coradas para GFAP, nestin, Sox2, vimentina, ASCL1, BLBP, Prox1 e DCX para identificar as células como as células progenitoras do tipo 2 (hipocampo) ou tipo C progenitoras células (SVZ)9. As células devem ter um núcleo bem definido e processos estendidos.
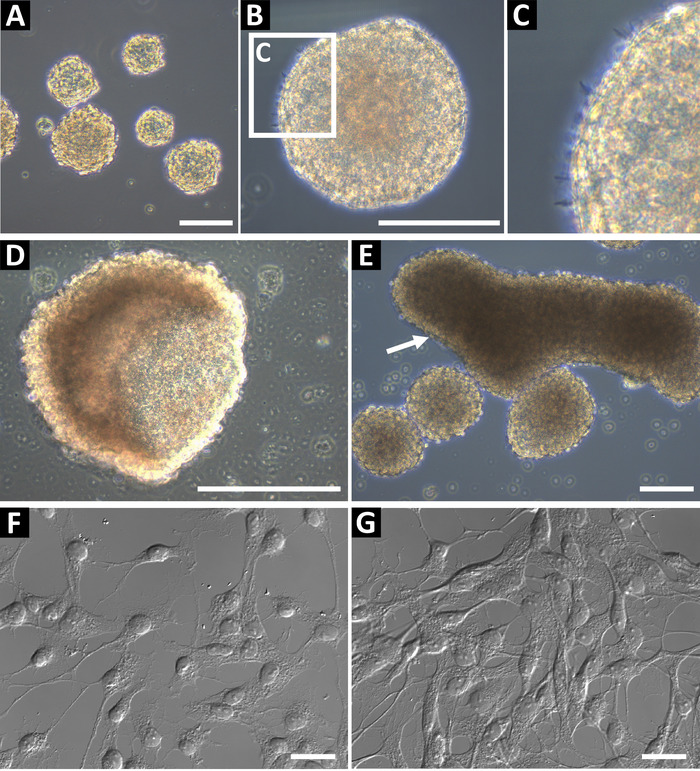
Figura 1: cultura de células progenitoras neurais hippocampal representativa. As células progenitoras neurais Hippocampal do (A) são isoladas de ratos adultos e culta como neurospheres até cerca de 100 a 150 µm de diâmetro. (B) Neurospheres deve ter uma periferia suave, (C) e microspikes pequenas podem ser observadas em sua superfície. Quando as esferas estão muito tempo na cultura, eles podem formar Copa (D) ou (E) formas oblongas. Essas culturas não devem ser usadas para experimentos. Para confirmar o status de progenitoras neurais das células, as sementes-los como uma suspensão de célula única na poli-L-ornitina (PLO) e lamelas de vidro revestido laminina para imunoquímica. As células devem ter processos de ramificação, (F) e uma pequena soma à confluência baixa e (G) pronto para imunoquímica. Barras de escala = 100 µm. clique aqui para ver uma versão maior desta figura.
Influxo de cálcio por citometria de fluxo ao vivo-celular
Este protocolo permite a análise da função do receptor P2X7 como um canal de cálcio em tempo real. A cinética da função do receptor, bem como os efeitos de diferentes agonistas e antagonistas, também podem ser avaliados. Quando plotados ao longo tempo, influxo de cálcio no hipocampo e células progenitoras neurais de SVZ foi geralmente semelhante (Figura 2A e 2B figura, respectivamente). Agonistas (ATP ou BzATP) foram adicionadas na marca de 40 s, como indicado pela seta vermelha. Por um breve momento, o tubo é removido do ponto de gravação para adicionar o agonista, resultando em pontos de dados do zero. Isto permitirá a identificação do tempo quando o agonista foi adicionado. BzATP rapidamente ativa receptores P2X7, abrindo o canal iônico e permitindo o influxo de cálcio, que se liga ao Fluo-8 e fluorescente. Aplicação de ATP geralmente resulta em um influxo de cálcio mais gradual. Tem uma menor afinidade para P2X7 quando comparado com BzATP e também resultará na ativação do receptor G-proteína-acoplado, uma via de sinalização mais lento que libera o cálcio do retículo endoplasmático. A inclusão dos antagonistas P2X7 A438079 e AZ10606120 (dados não mostrados) reduziu o influxo de cálcio em resposta ao pedido do agonista.
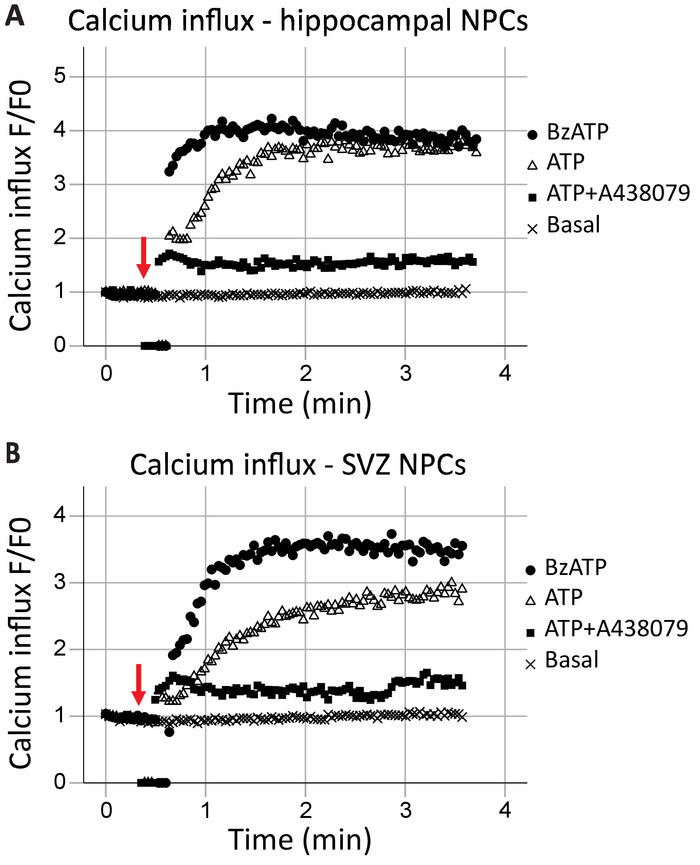
Figura 2: influxo de cálcio celular-ao vivo em células progenitoras neurais do hipocampo e SVZ. Função de canal de cálcio de receptor P2X7 foi demonstrada em (A) hippocampal e (B) derivados SVZ progenitoras por mudanças na fluorescência Fluo-8. Aplicação do agonista P2X geral ATP e o agonista P2X7 BzATP resultam em canais de íon P2X7 abertura, permitindo o influxo de cálcio. O influxo foi bloqueado com os inibidores específicos P2X7 A438079 ou AZ10606120 (dados não mostrados). F = fluorescência; F0 = fluorescência no ponto de tempo zero. Clique aqui para ver uma versão maior desta figura.
Formação de poros por citometria de fluxo ao vivo-celular
Formação de poros transmembrana é uma característica canônica dos receptores P2X7, resultados em troca da macromolécula e pode levar à morte celular. Ethidium+ é uma molécula grande (314 Da) excluída as células saudáveis; sua absorção e subsequente intercalação com DNA resulta em emissões fluorescentes e pode ser usado para avaliar a capacidade dos receptores P2X7 para formar poros transmembranares. Após a aplicação dos agonistas ATP (ATP de 1 mM) e BzATP (100 μM) na linha de 40 s (indicado pela seta), tempo-resolvido citometria de fluxo capta o brometo de etídio entrando as células em tempo real (Figura 3A). Este efeito foi atenuado pelo inibidor específico P2X7 AZ10606120. O ensaio de absorção de brometo de etídio demonstra um funcional receptor P2X7 C-terminal17 e é boa evidência para a expressão de receptores P2X7 completo. Ensaios de concentração-resposta do ATP ilustram os efeitos da concentração de agonista na formação de poros P2X7, usando a mudança na fluorescência de brometo de etídio ao longo do tempo (Figura 3B). As curvas de concentração de dose de agonista juntamente com inibidores de receptores específicos fornecem fortes evidências para a ativação do receptor.
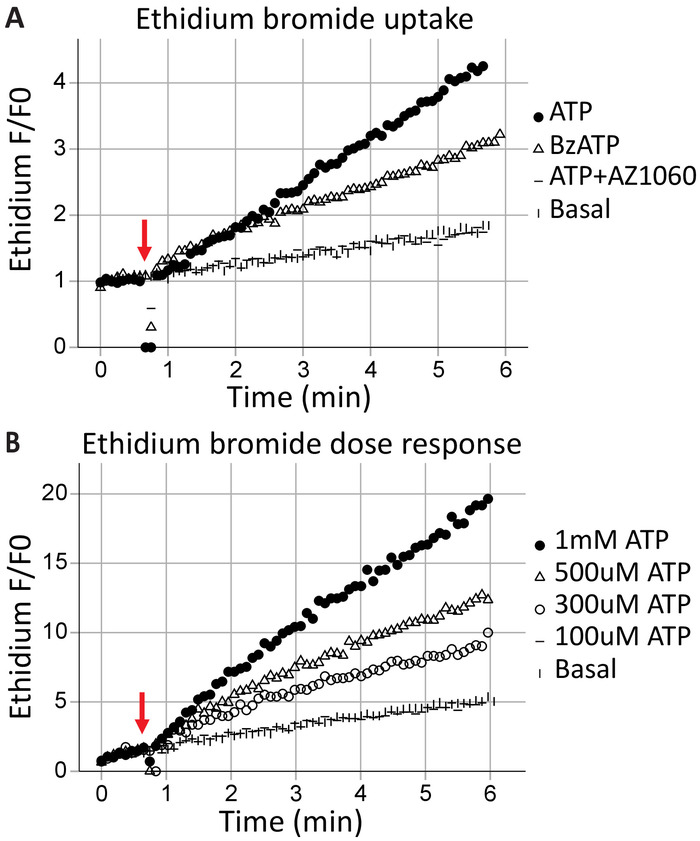
Figura 3: formação de poro transmembrana P2X7 medido pela absorção ethidium. A adição de momentos de brometo de etídio antes do início da aquisição é usada para medir a formação de poros transmembranares P2X7. Altas concentrações de ATP e BzATP resultado no receptor P2X7 (A) pore formação, permitindo que o brometo de ethidium entrar na célula. O inibidor de P2X7 AZ10606120 atenua este fenômeno e fornece evidências para os receptores P2X7 funcionais. Ensaios de concentração-resposta (B), ATP demonstraram a formação de poros significativa em 500 μM e 1 mM, mas não em concentrações inferiores. Clique aqui para ver uma versão maior desta figura.
Fagocitose por citometria de fluxo ao vivo-celular
Nosso grupo tem demonstrado anteriormente que o ATP extracelular inibe a fagocitose mediada por P2X7 por dissociando P2X7 C-terminal do citoesqueleto, especificamente, nonmuscle miosina IIA18,19. Esse método expande sobre estes resultados para demonstrar o envolvimento de receptores P2X7 na fagocitose pelo hipocampo e em tempo real (Figura 4, um exemplo de fagocitose hippocampal) células progenitoras neurais SVZ. Níveis de fagocitose desinibida (controle) de grânulos de látex 1 µm YG estabeleceram-se como controlo positivo. ATP inibiu a fagocitose de grânulos YG na mesma medida que os inibidores inespecíficos, ou seja, fixação de PFA e a citocalasina de inibidor de polimerização de actina D, enquanto 5% de soro aboliu todas inata de fagocitose20.
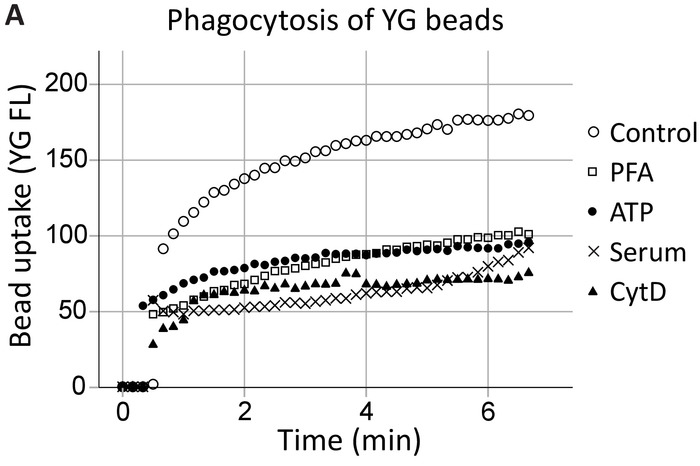
Figura 4: captação de grânulo YG demonstrando a capacidade fagocitária dos progenitores neurais via receptores P2X7. Captação de grânulo YG por células progenitoras neurais é observável usando live-célula de fluxo cytometry em tempo real. Níveis de controle de fagocitose são estabelecidos inicialmente e se o número de células permite, reconfirmados no final da corrida. Envolvimento dos receptores P2X7 é indicado pela inibição da fagocitose na presença de ATP, como isto se dissocia do C-terminal do citoesqueleto da membrana, impedindo mediada por P2X7 rearranjos do citoesqueleto. O aplicativo de ATP bloqueado fagocitose a mesma medida que o uso de inibidores inespecíficos da fagocitose, incluindo paraformaldeído (PFA) e citocalasina D (CytD). Clique aqui para ver uma versão maior desta figura.
Discussão
Este trabalho apresenta um protocolo detalhado para a análise da função do receptor P2X7 em culturas de células progenitoras neurais derivadas de nichos neurogênicos adultos. As aplicações potenciais para adultas progenitoras neurais células variam de pesquisa para fins terapêuticos, e então o método da cultura deve ser robusto e reprodutível. Há uma série de aspectos-chave para este protocolo que podem afetar a qualidade da cultura de ponto de extremidade. Uma vez retirados do crânio, o cérebro não devem secar e a dissecação deve ser realizada mais rapidamente possível. Particularmente com o hipocampo, cuidado extra para remover quaisquer vasos sanguíneos ou tecido membranoso irá resultar em rendimentos de células progenitoras superior. O processo de dissociação e trituração fortemente pode afetar o número de esferas obtidos numa cultura; agitar o tecido durante a incubação com tripsina-EDTA irá resultar em uma solução mais homogênea. O uso de um vidro polido fogo pastagem pipeta sobre um P1000 ponta da pipeta plástico é altamente recomendável para reduzir a morte celular e melhorar a cultura resultante. Evite overtriturating. Apesar destas precauções, o procedimento pode criar um monte de escombros na cultura P0, e evitar perder células progenitoras, lavagem ou alimentando a cultura deve ser evitado até que as esferas se formaram.
Um número de diferenças entre o hipocampo e culturas SVZ será óbvias em P0. Culturas hippocampal rendem menos esferas, e estas geralmente aderem. Use uma ponta de pipeta para levantar delicadamente fora das esferas para a passagem inicial. Esferas de aderentes não foram observadas em passagens subsequentes. Diferentes tipos de frascos de cultura de tecidos podem causar as esferas, particularmente hippocampal esferas, para aderir e crescer como colônias no fundo do prato. Isto não foi encontrado para alterar quaisquer resultados a jusante para este protocolo, mas deve ser monitorado, e consistência deve ser mantida sempre que possível.
Métodos anteriores, usados para medir a função de receptor P2X7, tais como remendo aperto para gravar o influxo de cálcio, são demorado e trabalhoso e só podem fornecer informações sobre uma única célula. Este protocolo apresenta um método rápido e reprodutível para analisar todas as três principais funções dos receptores P2X7 usando uma máquina. Citometria de fluxo determinado tempo de viver-pilha permite a análise de toda a população e fornece o pesquisador com informações sobre a cinética do influxo de cálcio, formação de poros, e/ou função fagocitária. Além disso, citometria de fluxo pode ser facilmente usada como um método para avaliar os padrões de expressão do marcador e análise de população com base nos níveis de expressão de tamanho ou proteína de célula.
Quando estas experiências, diferenças no influxo de cálcio máxima, captação de etídio ou taxas de fagocitose podem ser observadas entre repetições. Para minimizar isto, o tamanho da esfera, as condições de cultura e regime de alimentação devem ser consistente como a saúde das células terá um impacto significativo sobre os resultados obtidos. O tempo no gelo também pode influenciar os dados, então certifique-se de tudo é preparado antecipadamente para que o tempo no gelo é mínimo. Certifique-se de que a tintura do indicador de cálcio tempo de carregamento é consistente. Outro fator que pode levar a grandes inconsistências nas gravações máxima de cálcio é a variação entre lotes de ATP. Preparação de estoques de ATP é crucial e deve ser evitado o uso de lotes diferentes para as mesmas experiências. Comparação de antigos e novos lotes para garantir que o ATP é consistente também é recomendado. A eficácia dos antagonistas P2X7 pode também ser célula-linha - e lote-dependente, para que otimização de tempos de incubação e concentrações pode ser exigida.
É interessante notar o influxo de cálcio/efluxo é uma das mais complexas e fundamentais funções celulares e pode ser mediado por receptores de muitos. O influxo de cálcio ATP-induzido, como uma medida clássica para a função de canal/poros P2X7, pode não refletir com precisão a verdadeira função dos receptores P2X7, como o ATP pode também ativar receptores P2Y para liberar cálcio intracelular. Neste caso, o bário pode ser um cátion melhor para usar em vez de cálcio como seu influxo é unidirecional16. Para diferenciar a participação dos receptores P2Y no influxo de cálcio, condições onde 1 mM EDTA ou glicol de etileno-bis(β-aminoethyl ether)-N, N, n', n'-tetraacetic ácido (EGTA) é adicionado ao meio de K+ , em vez de CaCl2 podem ser utilizadas no presente do ensaio.
Este protocolo também pode ser facilmente adaptado para se adequar a outros tipos de células e pode ser útil para investigar a funcionalidade dos receptores de canal de íon alternativo ou receptores que participam da fagocitose. Esse método também pode ser adaptado a uma máquina de citometria de fluxo sem um módulo de tempo. Como exemplo, fagocitose ensaios podem ser realizados onde grânulos YG são adicionados 7 – 8 min antes da análise por citometria de fluxo convencional. Manter as células a 37 ° C e continuamente redemoinho-los. Isto não irá fornecer informações em tempo real, mas as diferenças na média final fluorescência informará ainda o pesquisador sobre a funcionalidade dos receptores P2X7.
Interesse em receptores P2X7 como uma droga-alvo21,22 , ou mesmo como uma entrega de drogas rota23,24 está crescendo rapidamente, e assim métodos para estudar esta enigmática do receptor devem ser continuamente adaptado e melhorado para facilita a estes estudos. Este protocolo descreve metodologias que podem ser usadas para explorar a função P2X7 em células progenitoras neurais adulto, e espera-se que alcançar uma maior compreensão dos receptores P2X7 nos nichos neurogênicos pode levar a avanços no tratamento do acidente vascular cerebral e outras lesões isquêmicas.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores gostaria de agradecer a Maria Kasherman e Xin Huang por suas contribuições para esta pesquisa. Este trabalho foi apoiado por concessões da Rebecca L. Cooper Medical Research Foundation, M.L., M.W. e T.C.L. e T.C.L. da saúde nacional e Conselho de pesquisa médica (NHMRC) da Austrália (571100 e 1048082) e a Fundação de caridade Baxter ( Sydney, Austrália). B.G. foi apoiado pela sociedade do futuro Australian Research Council (ARC) (FT120100581), bolsas de projeto NHMRC (1048082, 1061419 e 1120095) e operacional infra-estrutura concessão do governo vitoriano de apoio ao Instituto Florey. M.L. foi apoiado por um prêmio de pós-doutorado Charles D. Kelman, M.D. (2010) do internacional Retinal Research Foundation (EUA).
Materiais
| Name | Company | Catalog Number | Comments |
| A438079 | Tocris | 2972/10 | |
| ATP | Sigma-Aldrich | A2383 | |
| AZ10606120 | Tocris | 3323/10 | |
| bzATP | Sigma-Aldrich | B6396 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| FACSCalibur | Becton Dickinson | ||
| Fluo-8AM | AAT-Bioquest | 21080 | Fluo-4AM and Fura-Red AM have also been used successfully |
| Fluoresbrite YG Microspheres | Polysciences Inc | 17154-10 | 1.00 µm, yellow-green |
| Glutamine | ThermoFisher Scientific | 25030081 | 200 mM |
| HBSS | ThermoFisher Scientific | 14170112 | |
| Heparin | Sigma-Aldrich | H3149 | |
| NeuroCult Basal Medium | Stemcell Technologies | 5700 | Mouse and rat |
| NeuroCult Proliferation Supplement | Stemcell Technologies | 5701 | Mouse and rat |
| Oxidized ATP | Sigma-Aldrich | A6779 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | pluronic acid |
| Recombinant Murine EGF | Peprotech | 315-09 | |
| Recombinant Murine FGF-basic | Peprotech | 450-33 | |
| Tetramethylammonium Hydroxide | Sigma-Aldrich | T7505 | |
| Time Zero Module | Cytek Biosciences | ||
| Tissue culture flasks | BD Falcon (Corning) | 353108 (T25), 353136 (T75) | Blue vented screw cap |
| TrypLE Express | Gibco | 12604013 | |
| Trypsin-EDTA (0.25%) | ThermoFisher Scientific | 25200056 | with phenol red |
| UltraPure Ethidium Bromide | ThermoFisher Scientific | 15585011 | 10 mg/mL |
Referências
- Sperlagh, B., Illes, P. P2X7 receptor: an emerging target in central nervous system diseases. Trends in Pharmacological Sciences. 35 (10), 537-547 (2014).
- Liang, X., et al. Quantifying Ca2+ current and permeability in ATP-gated P2X7 receptors. Journal of Biological Chemistry. 290 (12), 7930-7942 (2015).
- Rat, P., Olivier, E., Tanter, C., Wakx, A., Dutot, M. A fast and reproducible cell- and 96-well plate-based method for the evaluation of P2X7 receptor activation using YO-PRO-1 fluorescent dye. Journal of Biological Methods. 4 (1), 64 (2017).
- Gu, B. J., et al. A quantitative method for measuring innate phagocytosis by human monocytes using real-time flow cytometry. Journal of Quantitative Cell Science: Cytometry Part A. 85 (4), 313-321 (2014).
- Jursik, C., et al. A quantitative method for routine measurement of cell surface P2X7 receptor function in leucocyte subsets by two-colour time-resolved flow cytometry. Journal of Immunological Methods. 325 (1-2), 67-77 (2007).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272 (5262), 735-738 (1996).
- Delarasse, C., et al. Neural progenitor cell death is induced by extracellular ATP via ligation of P2X7 receptor. Journal of Neurochemistry. 109 (3), 846-857 (2009).
- North, R. A. Molecular physiology of P2X receptors. Physiological Reviews. 82 (4), 1013-1067 (2002).
- Leeson, H. C., et al. P2X7 Receptors Regulate Phagocytosis and Proliferation in Adult Hippocampal and SVZ Neural Progenitor Cells: Implications for Inflammation in Neurogenesis. Stem Cells. , (2018).
- Glaser, T., et al. Modulation of mouse embryonic stem cell proliferation and neural differentiation by the P2X7 receptor. PLoS One. 9 (5), e96281 (2014).
- Papp, L., Vizi, E. S., Sperlagh, B. Lack of ATP-evoked GABA and glutamate release in the hippocampus of P2X7 receptor-/- mice. Neuroreport. 15 (15), 2387-2391 (2004).
- Wiley, J. S., Gu, B. J. A new role for the P2X7 receptor: a scavenger receptor for bacteria and apoptotic cells in the absence of serum and extracellular ATP. Purinergic Signalling. 8 (3), 579-586 (2012).
- Lovelace, M. D., et al. P2X7 receptors mediate innate phagocytosis by human neural precursor cells and neuroblasts. Stem Cells. 33 (2), 526-541 (2015).
- Walker, T. L., Kempermann, G. One mouse, two cultures: isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of Visualized Experiments. (84), e51225 (2014).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Frontiers in Neuroscience. 5, 89 (2011).
- Gu, B. J., Wiley, J. S. Broad applications of mulit-colour time-resolved flow cytometry. Flow Cytometry - Recent Perspectives. , (2012).
- Cheewatrakoolpong, B., Gilchrest, H., Anthes, J. C., Greenfeder, S. Identification and characterization of splice variants of the human P2X7 ATP channel. Biochemical and Biophysical Research Communications. 332 (1), 17-27 (2005).
- Gu, B. J., Saunders, B. M., Jursik, C., Wiley, J. S. The P2X7-nonmuscle myosin membrane complex regulates phagocytosis of nonopsonized particles and bacteria by a pathway attenuated by extracellular ATP. Blood. 115 (8), 1621-1631 (2010).
- Gu, B. J., Rathsam, C., Stokes, L., McGeachie, A. B., Wiley, J. S. Extracellular ATP dissociates nonmuscle myosin from P2X(7) complex: this dissociation regulates P2X(7) pore formation. American Journal of Physiology-Cell Physiology. 297 (2), C430-C439 (2009).
- Gu, B. J., et al. P2X7 receptor-mediated scavenger activity of mononuclear phagocytes toward non-opsonized particles and apoptotic cells is inhibited by serum glycoproteins but remains active in cerebrospinal fluid. Journal of Biological Chemistry. 287 (21), 17318-17330 (2012).
- Bhattacharya, A. Recent Advances in CNS P2X7 Physiology and Pharmacology: Focus on Neuropsychiatric Disorders. Frontiers in Pharmacology. 9 (30), (2018).
- Burnstock, G., Knight, G. E. The potential of P2X7 receptors as a therapeutic target, including inflammation and tumour progression. Purinergic Signalling. 14 (1), 1-18 (2018).
- Alves, L. A., et al. Pore forming channels as a drug delivery system for photodynamic therapy in cancer associated with nanoscintillators. Oncotarget. 9 (38), 25342-25354 (2018).
- Pacheco, P. A., et al. P2X7 receptor as a novel drug delivery system to increase the entrance of hydrophilic drugs into cells during photodynamic therapy. Journal of Bioenergetics and Biomembranes. 48 (4), 397-411 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados