Method Article
大人の神経前駆細胞における P2X7 受容体を貪食、細孔の形成、カルシウム流入を調査するためのリアルタイム生細胞フローサイトメトリー
* これらの著者は同等に貢献しました
要約
単一細胞の感度を提供する、リアルタイムのフローサイトメトリー、生活文化のマルチ モーダル受容体機能を定量化する一意に適しています。大人の神経前駆細胞を使用して、P2X7 受容体機能カルシウム インジケーター染料、エチジウム ブロマイド吸収と蛍光のラテックス ビーズを用いた貪食による膜貫通孔形成によって検出されたカルシウム流入によって評価されました。
要約
細胞生物学者の間で生活の生物学的プロセスを定量化する生細胞のフローサイトメトリーをますます使用細胞培養。このプロトコルでは、という生細胞のフローサイトメトリーを拡張リアルタイムで P2X7 受容体活性化の複数の機能の分析方法について説明します。流れの cytometer にインストール時間モジュールを使用すると、生細胞機能が評価され、カルシウム流入、膜貫通細孔形成と貪食能の動態を探索する指定された期間にわたってプロットします。この単純な方法が有利な P2X7 受容体のすべての 3 つの標準的な機能を評価するには、1 台のマシンと印刷時間をかけて収集したデータはしばしば単一セルの録音よりもむしろ全体の生きている細胞集団に情報を提供パッチ ・ クランプの技術的に挑戦的なメソッドを使用して取得。カルシウム流入実験カルシウム インジケーター染料を使用して、P2X7 細孔形成アッセイは、エチジウム ブロマイド、膜の通過を許可されているに依存しています毛穴アゴニスト高濃度時に形成されました。イエロー グリーン (YG) ラテックス ビーズは、貪食能を測定するために利用されています。特定アゴニストおよびアンタゴニストは、P2X7 受容体活性の効果に適用されます。個別に、カルシウム チャネルとプリンとスカベン ジャー受容体の数に量的なデータを提供するこれらのメソッドを変更できます。一緒に取られて、彼らはどのようにリアルタイム生細胞のフローサイトメトリーの使用は P2X7 受容体機能を調査する急速なコスト効果の高い、再現、および定量的な方法を強調します。
概要
プリンがシグナル伝達の研究は広範かつ多面的な細胞生理学、生化学、薬理学を含みます。がんと細胞周期制御細胞細胞コミュニケーションおよび幹細胞生物学、細胞および分子プロセスの数が無限でプリンがシグナル伝達が関与しています。などがしばしばプリン治療効果のシグナル伝達を調節する可能性が存在します。プリン受容体の P2X7 受容体は、多くの炎症性条件1の治療上のターゲットとして近年その潜在性のため大きな注目を受けています。受容体を研究する手法の進歩や長年にわたりこの研究2,3,4,5を容易に合わせられました。ここでは、成人の神経前駆細胞由来 (SVZ) 脳室下帯と海馬歯状回における P2X7 受容体の複数の機能を調査する生細胞流れフローサイトメトリー法について述べる.
P2X7 受容体最初 P2Z 受容体または最大 900 ダ6分子を通す大きな貫通孔の形成により、アデノシン三リン酸 (ATP) の高濃度とその活性化としての「細胞死」の受容体として記述されていた。これは、ため、骨格転位は、貫通孔の形成、および、潜在的に、アポトーシスや壊死7。伝統的に、P2X7 のこの機能は DNA3、8を挟むときに蛍光を発するヨ-プロ-1 またはエチジウム ブロマイドなど大きい分子量染料の通風管によって定量化されます。通常急速なとアップスケー リングを可能にする、プレート リーダー メソッドは動態観察のため許可しません。ここで説明したメソッドの ethidium によって吸収に基づいており深みポア形成の速度についての情報を提供すること、時間をかけて観察する蛍光が増加。P2X7 受容体は、非免疫機能、露出時間とアゴニスト濃度9,10に応じて異なる応答の数を容易にするので示されています。ATP の濃度による簡単な活性化は、神経伝達物質および信号の伝達のための11の目的のため陽イオンの流入で結果します。面倒な技術的に挑戦的なメソッドに関連付けられている問題を克服するカルシウム流入を計るためフローサイトメトリーを使用して-特に、パッチク ランプ法ポテンシャルの変化に関して貴重な詳細を提供する内向きの電流を測定するには細胞膜人口分析2のことはありません。P2X7 受容体の第三の機能は ATP、P2X7 受容体が免疫系と神経系9,12,13の貪食を促進する実証されているがないときに発生します。顕微鏡検査の技術の進歩は、定量化と人口分析することができますまだ課題が吸収過程では、細胞骨格の再編成の可視化を許可しています。
ここで詳細な生細胞流れフローサイトメトリー法はリアルタイムにおける P2X7 受容体のすべての 3 つの主要な機能の調査のためことができます。流れの cytometer で時間モジュール デバイスを含めることにより、温度制御と細胞懸濁液の連続攪拌できます。アゴニストとアンタゴニストの刺激は、細胞応答の近い連続測定を許可する、1 秒以内に配信できます。これは、再現性をもって複数のアッセイ システムの使用を回避しながら機能を定量化する迅速かつ簡単な方法を示します。このプロトコルは任意のセル型に合わせて簡単に適応することがあり、特定のアゴニストまたはそのプロパティによって、阻害剤の封入を与えられた他の受容体サブタイプが確認される可能性がありますに注意してくださいすることが重要です。
プロトコル
動物は科学的な目的のためのケアと動物の使用のためオーストラリアのコード練習に従って処理され、用グリフィス大学動物倫理委員会の承認します。
1. Neurosphere アダルト SVZ と海馬由来の神経前駆細胞の文化
注:ここで示した解剖のプロトコルはウォーカーと Kempermann、仕事に基づいており、成体マウス由来の神経前駆細胞の解剖のための詳しいプロトコルは利用可能な別の場所14。培養条件は、バブー、同僚の15から変更されています。大人女性 c57bl/6 マウスは 8-12 週間の熟成に使用されました。
- 生物学的安全キャビネットでは神経幹細胞増殖サプリメント、2 mM グルタミン 20 ng/mL 上皮成長因子 (EGF)、10 ng/mL 塩基性繊維芽細胞成長因子 (bFGF)、2 μ G/ml 添加培養液中 (神経基礎培地) を準備します。ヘパリン。
- CO2吸入による 2 つのマウスを安楽死させます。また、制度のガイドラインに従ってマウスを麻酔し、頚部転位によってそれらをすぐに安楽死させます。頭を 70% エタノール スプレーし、それらの首をはねます。1 x ペニシリン/ストレプトマイシン液 (P/S) とハンクの平衡塩溶液 (HBSS) を含んでいる生殖不能の管にそれぞれの頭を転送します。
- 解剖顕微鏡の下で層流フードの解剖を実行します。
- 鉗子と郭清のはさみを使用すると、組織と脳を公開する骨削除し、P/S と HBSS を含む滅菌皿にそれを転送
- 脳の腹側を置き、視交叉で完全な冠状切開をするメスのブレードを使用します。生検鉗子で脳を安定した保持して 1 つスウィフト、きれいで、下方への運動。こ盤細胞死を最小限に抑えるために、組織構造を維持するためには避けてください。
注:脳が前方に傾けて安全に保持していない場合、カット中に下帯から得られる前駆細胞の数を損なうこと。 - 脳の吻側半分の下帯を分離します。
- その上に白い橋を形成する脳梁の隔壁で区切られた、両方の心室を探します。
- 鉗子を使用して 2 つの心室を分ける中隔を削除し、前方側脳室の側壁を分離します。これを行うには、上、下、両側に、フロントを細かい解剖はさみでカットします。小さいカップのような形だけが残っています。
- 中 HBSS を数滴ときれいなペトリ皿蓋を準備し、下帯を液体に転送します。組織を乾燥または乾燥した表面に触れることができないようにします。なったを解剖しながら、側に立ってください。
- 分離脳の尾側半分からなった。
- 脳梁を切断する半球間カット正中線を作る。ガイドとして側脳室を使用し、優しく皮質、海馬を公開するを展開します。大脳皮質は、圧延されているが、海馬は密な白い、湾曲した構造として見ることができます。
- 細かい解剖はさみや鉗子を使用して、周辺の組織から海馬を分離します。
- 鉗子、余分な白質、血管および海馬を覆う、膜質の組織を削除します。
- HBSS を数滴を使用したきれいなペトリ皿蓋を準備し、海馬を液体に転送します。他の半球に繰り返します。
- 海馬と 2 つのマウスから SVZ が分離されて、彼らそれぞれのシャーレの蓋に転送、一度サイコロ メス刃を使用して組織の機械的に。約 1 分の 1 つのシャーレの蓋に組織をみじん切り、回転ごとの 10 s まで組織が滑らかに見えると細かい部分のみ残っています。きれいなメスの刃を取るし、他の料理は、1 分のティッシュをダイシングを繰り返します。
- 1 mL ピペットを使用して、0.25% トリプシン エチレンジアミン四酢酸 (EDTA) の 1 mL を含むチューブを分離する各シャーレの蓋からすべての組織を転送します。下帯と海馬の 1 つの管の 1 つの管を使用します。
- これを行うには、最初のピペッティング気泡を最小限に抑えるため、チューブに転送しながら乾燥ピペット チップ接触組織を防ぐために皿にティッシュにトリプシン-EDTA の約半分。料理と可能な限りとして多くの組織を収集し、チューブを追加するトリプシン-EDTA の残りの部分とメスの刃をすすいでください。
- 30 分、正常組織を分離するチューブの 10 分毎を攪拌の 37 ° C の水浴のトリプシンと組織を孵化させなさい。
- 火磨かれたガラス パスツール ピペットを使用して単一細胞懸濁液を作成する組織をカップ刻んだ。これにより過度のセル換散を引き起こすので overtriturate に注意してください。これは、最適な組織の解離過程の重要なステップです。
- 製粉プロセス中にチューブ内を観察し、組織塊の大部分が削除されていることの最も早い印で停止します。トリプシン溶液になります少し曇りのセルは単一細胞懸濁液になっているときいくつかの塊が残ることがあります。
注:指示として 10 x-15 x 上下懸濁液を渡すことで十分です。 - 追加培養培地 5 mL、トリプシンを中和し、さらに 3 分洗浄 300 x gでスピンまで HBSS とパス 2 x 70 μ m 細胞が任意の組織を除去するストレーナーの中の塊します。
- コート t75 フラスコ細胞培養用フラスコ中の 15 mL のすべてのセルに転送します。
注:球がゼロ (P0) 通路に形作るべきである海馬文化の 15-20 日後 7-10 日後 SVZ 文化。洗浄または文化の神経前駆細胞の数を最大化するこの時間の間に、細胞を餌を控えます。場合はより多く前駆細胞が必要、または P0 インキュベーション時間を減らすには、それは犠牲にしたマウスの数を増やすことが可能。 - 生物学的安全キャビネット、標準的な組織文化のプラクティスを使用して、必要に応じて、7-10 日おきの通路、5% CO2と、P0 の文化の初期段階、次の 37 ° C で文化を維持します。
注:P0 海馬文化は T25 フラスコ; 通路に十分な球を生成する必要があります。SVZ 文化は、多くのより多くの球が生成され、T75 に継代することができます。P0 海馬球が付いて、フワリと球を 200 μ L ピペットを使用します。 - 直径 150 に 200 μ m に達すると球を通路します。15 mL チューブに球中小を収集し、また約 5 分の重力によって解決する、2 分間低速 (100 x g) で回転する球を許可します。
- メディアを削除し、球のサイズに応じて、7-10 分間解離試薬で細胞を分離します。
注:使用される解離試薬の文化の結果に重大な影響があるので詳細については材料の表を参照してください。 - 洗って HBSS の 5 mL を追加携帯ソリューション 300 x gで 3 分間遠心し、細胞上澄みを除去、培養液中の細胞を再懸濁します、T25 細胞培養用フラスコまたはそれと同等の媒体の 5 mL で約 150,000 細胞種します。37 ° C、5% CO2で文化を維持します。
- 任意の下位プロトコル9に進む前に Sox2 や ASCL1 などの幹細胞マーカーの発現を識別することによって神経前駆細胞の状態を確認します。
注:これは研究者の好まれる方法 (例えば、免疫顕微鏡、cytometry 流れまたはウェスタンブロット、かの量的なポリメラーゼの連鎖反応 (qPCR) を使用して、) によって行うことができます。
2. フローサイトメトリーによる解析のための単一細胞懸濁液の準備
-
必要なメディアを準備します。これらには以下の通りです。
- 145 mM の NaCl、島 5 mM、10 mM HEPES、5 mM D-グルコース、0.1% ウシ血清アルブミン (BSA)、0.1 mM CaCl2を含むNa+媒体の準備します。この媒体は、また 0.1 mm CaCl2を省略すると、カルシウムの形で使用されます。
- 145 mM KCl、島 5 mM、10 mM HEPES、5 mM D-グルコースおよび 0.1 %bsa を含むK+媒体の準備します。
注:これらのメディアは広範囲を最適化した、以前の出版物4,5。 - 20 ml 約 100 mM の在庫の十分な ATP 粉末を秤量することにより在庫 ATPを準備します。KCl バッファー (145 mM KCl、5 mM 島と 10 mM HEPES、pH 7.5) 17 mL に粉体を溶解し、ゆっくりとを攪拌しながら 18% (w/v) 水酸化テトラメチル アンモニウム (TMA) 2 mL を 6.8 から 7.0 に pH をもたらすソリューションに追加します。
- 20 mL に最終的な音量を調整します。過去の 7.0 pH をオーバー シュートしません。-80 ° c; 車両を格納します。ATP 因数が少なくとも 6 ヶ月間安定している注意してください。
注:無水 ATP の無料の分子量は 551.14 g/mol とこれはバッチごとに異なる場合がありますし、計算に考慮する必要があります水とナトリウムの分子の分子量を含まれません。TMA は毒性が強いとを処理するときに注意が必要があります。安全性データ シートで、ヒューム キャビネットの株を準備をお読みください。 - 超純水 H2O 10 mM の最終的な株式の集中のために BzATP を溶解することにより在庫 BzATPを準備します。
- 1.16 と 1.17 の手順で説明するように、単一細胞懸濁液を作成します。検定またはセルの自動カウンターを使用してセルをカウントします。(後述) として実施されている実験の必要な媒体 (例えば、Na+中、培養培地) に細胞を再懸濁します、一方で氷の上のセルを配置します。
- 各実験では、電圧と報酬の設定のキャリブレーションのためだけでなく、前方および側面の散布のためのコントロールを含めるに十分なサンプルがあるを確認します。指示としては、フラスコあたり約 8 x 10 の6セルを T75 フラスコで通常栽培の球に発生注意してください。
-
流れの cytometer 使用して設定コントロールのサンプル。
- 生きている細胞を選択的にゲートに前方および側面の散布図を使用します。
注: 前方散乱は側方散乱は、内部の複雑さや粒度のメジャーを提供しながら、光の回折に基づいてセルのサイズに関する情報を提供します。スモール フォワードと側方散乱フロー イベントは、死んだ細胞として考慮されるかもしれない。 - 製造元の指示に従って流れの cytometer 利得し、電圧を調整します。最大蛍光強度でデータの取得を確保するための試用版のサンプルを実行します。単一チャンネル買収に必要な補償はありません。
- 生きている細胞を選択的にゲートに前方および側面の散布図を使用します。
3. 住セル流れ Cytometry によるカルシウム流入を測定
- 単一細胞懸濁液の準備、カルシウム Na+の中の 1 mL の細胞を再懸濁します、製造元のプロトコルに従ってカルシウム インジケーター色素の 2 ng/mL でそれらをロード (材料の表を参照) を 10 μ L5% プルロニック酸。37 ° C で 30 分間細胞をインキュベートします。
- カルシウム培ナ+の 3-5 mL を追加し、軽く遠心分離によって細胞を洗浄 (4 分の 200 x g )。上澄みを除去し、カルシウム無料 Na+の中、2 回目の洗濯で細胞を再懸濁します。
- カルシウム Na+の中の 1 mL の細胞を再懸濁します、氷の上に置いて、30 分間脱エステル化することができます。
- K+媒体の 3-5 mL を追加し、(200 x g 4 分); を遠心分離で 1 倍を洗うその後、再懸濁します K+中・分注のセルそれら蛍光アシスト セル (FACS) を並べ替え FACS チューブあたり 500 μ L あたり 1 x 10 の6セルの濃度でチューブに。
注:FACS チューブ サンプルあたりの数は、治療の数によって異なりますが含まれます繰り返されます。 - セルは分析する準備が整うまで、FACS チューブを氷の場所します。長時間氷の上細胞を残していないが、アッセイをできるだけ早く開始します。
- いくつかのサンプル preincubate P2X7 受容体阻害剤 AZ10606120 の細胞 (10-15 分の 1 μ M) または A438079 (30 分の 10 μ M) 分析の前に 37 ° C で。
- 最初のサンプルを実行する前に、数分は CaCl2 (FACS チューブ 1 mM の最終濃度) を追加し、回復する 37 ° C の水浴にチューブを置きます。
- きれいなドロップ、FACS チューブと位置に小さなマグネチックスターラー time モジュールのチューブ サンプル温度のコントロールに循環 37 ° C の水浴にリンクします。渦の効果を導入することがなく、サンプルの動きを確保するための低攪拌速度を選択します。サンプル プラットフォーム上にウォーター ジャケット管アダプターを配置し、FACS マシンのレバー腕を閉じます。
- サンプルの収集を開始し、1 秒あたり約 1000 のイベントで 3 分のサンプルを実行します。
- 40 s マークは、すぐにチューブを削除し、P2X7 アゴニストを追加 1 mM ATP または 300 μ M のいずれか BzATP と買収を続行するチューブを交換します。
- 最初のサンプルを記録すると、間 CaCl2 2 番目のサンプルを準備し、細胞分析の前にウォーム アップするのに十分な時間を許可する 37 ° C にそれを置きます。最初のサンプルが終わったら、水のサンプルを実行して、摂取量をきれいにし 3.8、3.9 の手順の説明に従って、2 番目のサンプルの集録が始めることができます。サンプル間の摂取量が常に清潔します。
4. 生細胞のフローサイトメトリーによる細孔形成の測定
- 1.16 と 1.17 の手順で説明するように、単一細胞懸濁液を作成します。古いメディアの数ミリリットルを保存、FACS チューブあたり 100 μ L あたり 1 x 10 の6セルの濃度で細胞を再懸濁しますに使用準備が整うまで氷の上に置きます。
- 分析を実行する前に 1 mL の最終巻 K+媒体の 900 μ L を追加し、回復に 10 分間、37 ° C の水浴中チューブを置きます。
- 該当する場合は、preincubate を含む P2X7 固有阻害剤 AZ10606120 の治療と細胞 (10-15 分の 1 μ M) または A438079 (30 分の 10 μ M)。
- 分析を実行する直前に FACS 管; 臭化エチジウム 25 μ M を追加します。その後、磁性攪拌器を追加 3.7 のステップにしたがって FACS マシン上に配置し、買収を開始します。
注:臭化エチジウムは毒性が強いとそれを処理するときに注意が必要があります。FACS 管を適切に破棄します。 - 細胞膜の気孔の形成を誘導して、集録の開始後 1 mM ATP または 100 μ M BzATP 40 s を追加します。
- 6 分の 1 秒あたり約 1000 のイベントでサンプルを実行します。
- 最初のサンプルを実行すると中の氷から 2 番目のサンプルを取るし、細胞分析の前に回復するのに十分な時間を許可する 37 ° C の水浴中に配置。水サンプルを実行して、最初のサンプルが買収して終わったら、きれいに摂取次に、2 番目のサンプルは、3.8、3.9 の手順で説明されているように、録音を開始するコンピューターに配置できます。
5. 生細胞のフローサイトメトリーによる貪食能の測定
- 1.16 と 1.17 の手順で説明するように、単一細胞懸濁液を作成します。馴化培地と因数 FACS チューブあたり 100 μ L につき少なくとも 1 x 10 の6セルの濃度でチューブ FACS に細胞を再懸濁します。1 x 106セル/mL の培地 Na+での最終濃度に細胞を希釈 (900 μ L の Na+媒体の追加など)、分析が実行されるまで、氷の上のセルを配置。
- リアルタイム食作用の試金のための貪食ターゲットとして YG ラテックス ビーズ (微粒子) の 1 μ m を使用します。
注:他の色にも置き換えられるが、異なるサイズのビーズが貪食4の不適切な目標をことがわかった。 - 最初のサンプルを実行する前に 37 ° C の水浴にセルを転送し、細胞が修復できるように約 7-10 分のためにそれらをインキュベートします。
-
300 μ M は、40 分、20 分、20 分の 4% パラホルムアルデヒド (PFA) の 20 μ M サイトカラシン D の ATP (oxATP) を酸化、15 分間 1 mM ATP を含む彼らのそれぞれのチューブに週間を必要とするすべての処理を追加します。
- 週間は 5% 人血の必要ありません。ほぼ同じ時期の治療を追加すると、他が孵化し続ける一方で、サンプルが逆の順序で実行できます。たとえば、サンプルを実行コントロールおよび血清最初、し ATP 治療、サイトカラシン D と PFA、oxATP を最後に続きます。
- 3.8、3.9 の手順で説明するよう、磁気攪拌の cytometer でサンプルを配置し、次に、サンプルの収集を開始します。
- して集録の開始後 15-20 s をマシンからサンプル チューブを削除し、原液の YG ビーズの 5 μ L を追加します。リターン サンプル FACS チューブと買収を続けます。約 1,000 イベント/秒で 7-8 分のサンプルを実行します。
- 最初のサンプルを実行すると中の氷から 2 番目のサンプルを取るし、分析の前に回復するために細胞の十分な時間を許可する 37 ° C の水浴中に配置。最初のサンプルが完了すると、水のサンプルを実行することによって摂取をきれいにし、3.8、3.9 の手順の説明に従って、2 番目のサンプルの集録を開始します。
6. データの分析
- スプレッドシートにデータをエクスポートします。データ解析は実験的質問によって異なります。
注:異なる実行が異なる基準強度あるかもしれません開始時に指定された時間のための試金を実行する上で重要なことに注意してください (約 40 秒) 蛍光性 (蛍光の変化を計算することによって、データを正規化し、アゴニストを追加する前にいずれかの時点で時間 [F] [F0] 時点 0 で蛍光または F/F0 で割った値)。 - レートまたは P2X7 関数問題の論を定量化するには、曲線または各 10 秒時間周期16のカーブの下で作成された台形の合計の下の領域を計算します。
- 治療の効果を判断するには、記録の最終の 10-20 s 以上平均蛍光強度と治療法を比較します。Tによって意義を決定-テストや分散分析。
結果
神経前駆細胞培養
このメソッドを使用して派生した神経前駆球文化相明るいと滑らかなラウンド エッジ (図 1 a, B)。健康的な文化の端 (図 1) に小さな microspikes を観察できます。後半の通路で中空カップの形状 (図 1) または大型の横長な形状 (図 1E、矢印によって示されます)、球を形作ることができる場合、不十分な供給、または。これらのカルチャは使用しないでくださいフローサイトメトリーや他のダウン ストリーム アプリケーションでは、これらの機能としてがあります分化を示す。ポリ L-オルニチンと免疫細胞化学のラミニン コート ガラス coverslips にメッキされた細胞神経前駆状態を確認する (図 1 fと、高密度、図 1)。ネスチン、Sox2、ビメンチン、ASCL1、BLBP、Prox1、およびタイプ 2 の前駆細胞 (海馬) または C 型前駆細胞 (SVZ)9としてセルを識別するために DCX GFAP 染色による細胞。明確に定義された核および拡張のプロセスの細胞が必要です。
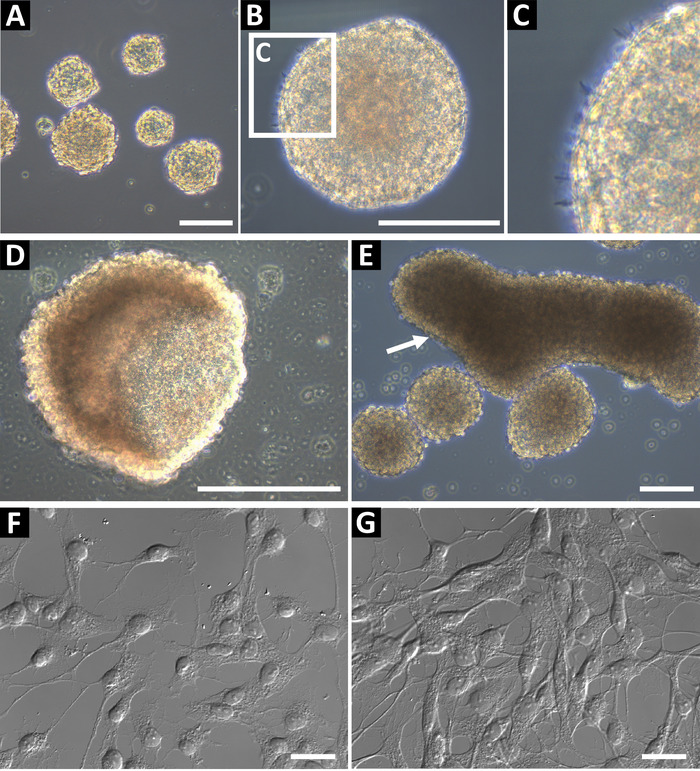
図 1: 代表的な海馬の神経前駆細胞培養。(A) 海馬の神経前駆細胞は、大人のマウスから隔離され、直径約 100 に 150 μ m まで培養神経幹細胞として。(B) 神経幹細胞は、滑らかな周辺、(C) を持つ必要があり、小さな microspikes 場合があります彼らの表面で観察されました。球が長すぎる文化で、彼らは、(D) カップまたは (E) の横長な形状を形成できます。これらの文化は、実験のため使用しないでください。細胞の神経前駆細胞の状態を確認するには、ポリ L-オルニチン (PLO) および免疫のラミニン コートガラス coverslips に単一細胞懸濁液としてそれらを播きます。細胞では、低密度 (G) 検体の準備で小さい相馬分岐プロセス、(F) をしてください。スケール バー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
生細胞のフローサイトメトリーによるカルシウム流入
このプロトコルは、P2X7 受容体機能の解析、リアルタイムでカルシウム チャンネルとして受容体機能の速度だけでなく、異なる作動薬と拮抗薬の効果も評価することができます。プロットすると時間と、海馬におけるカルシウム流入し SVZ 神経前駆細胞一般に類似していた (図 2 aおよび図 2 b、それぞれ)。アゴニスト (ATP または BzATP) は、赤い矢印で示した、40 s マークに追加されました。一瞬、チューブは、アゴニスト、結果ゼロのデータ ポイントを追加する記録ポイントから削除されます。これはアゴニストが追加された時刻の識別になります。BzATP は、イオン チャネルを開き、蛍光 8 に結合し、蛍光を発するカルシウム流入を許可する急速に P2X7 受容体をアクティブにします。ATP アプリケーションは一般的より漸進的なカルシウム流入の結果します。P2X7 BzATP と比較した場合に低い親和性があり、G タンパク質共役型受容体活性化、小胞体からのカルシウムを解放する遅いシグナル伝達経路にもなります。P2X7 拮抗薬 A438079 と AZ10606120 の包含 (データは示されていない) アゴニスト アプリケーションへの応答におけるカルシウム イオンの流入を減少します。
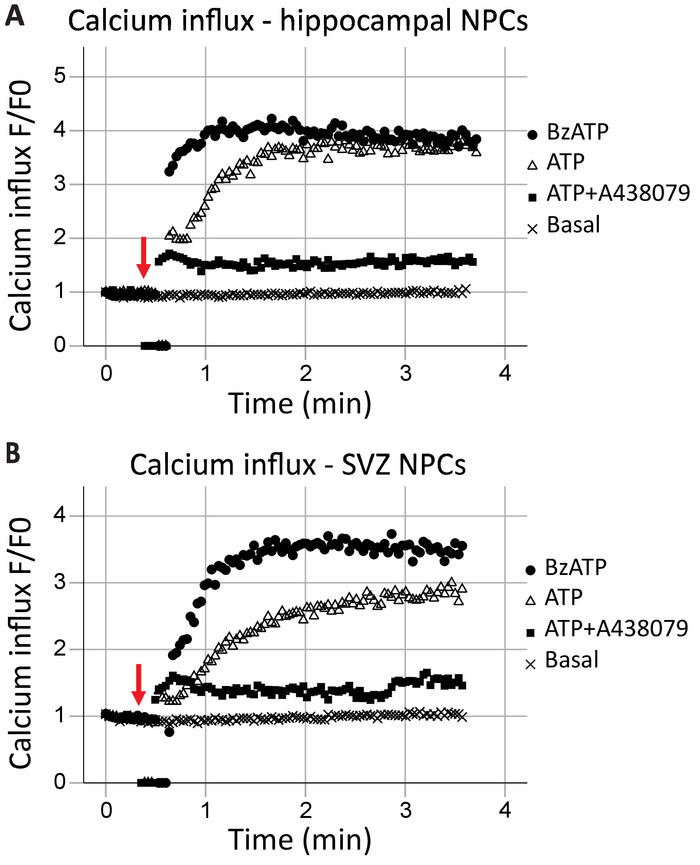
図 2: SVZ と海馬由来の神経前駆細胞の生細胞カルシウム流入。P2X7 受容体カルシウム チャネル機能は、(A) で示した海馬と蛍光 8 蛍光の変化によって (B) SVZ 由来神経前駆細胞。一般的な P2X アゴニスト ATP と P2X7 イオン チャンネルを開く、カルシウム流入を許可する P2X7 アゴニスト BzATP 結果のアプリケーションです。流入 P2X7 固有阻害剤 A438079 または AZ10606120 ブロックされました (データは示されていない)。F = 蛍光;F0 = 0 の時点で蛍光します。この図の拡大版を表示するのにはここをクリックしてください。
生細胞のフローサイトメトリーによる細孔形成
貫通孔形成は P2X7 受容体、高分子交換結果の標準機能であり、細胞死につながることができます。エチジウム+は健康な細胞から除外大きな分子 (314 Da)その吸収とその後 DNA インターカレーション蛍光排出量の結果、P2X7 受容体の膜貫通孔を形成するための能力を評価するために使用することができます。次のアゴニスト ATP (1 mM ATP) と BzATP のアプリケーション (100 μ M)、40 s (矢印によって示されます)、時間分解フローサイトメトリー キャプチャ リアルタイム (図 3 a) で、細胞に侵入するエチジウム ブロマイド。この効果は、P2X7 固有阻害剤 AZ10606120 による減衰だった。エチジウム ブロマイド取り込みアッセイは機能的 P2X7 受容体 C 末端17に示します、フルレングス P2X7 受容体の発現の良い証拠です。ATP 濃度応答アッセイは、時間 (図 3 b) をかけてエチジウム ブロマイド蛍光の変化を用いた、P2X7 気孔形成にアゴニスト濃度の影響を示しています。一緒に特定の受容体阻害薬アゴニスト投与濃度曲線は、受容体活性化のための強力な証拠を提供します。
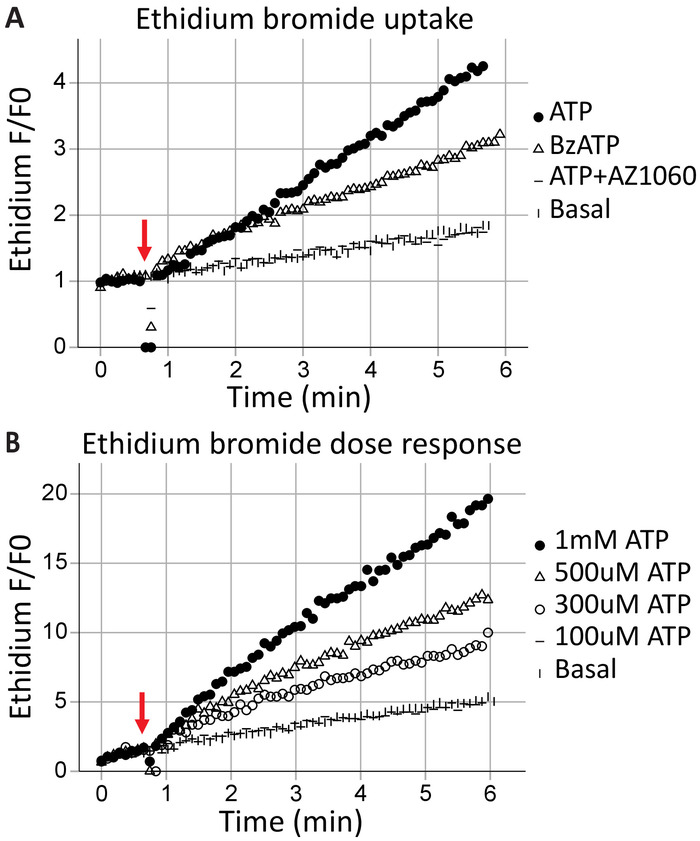
図 3: P2X7 貫通孔形成の ethidium によって通風管によって測定します。エチジウム ブロマイド瞬間集録の開始前に添加、P2X7 貫通孔の形成を測定する使用されます。(A) P2X7 受容体の ATP と BzATP の高濃度は気孔形成、エチジウム ブロマイド セルを入力することができます。P2X7 阻害剤 AZ10606120 はこの現象を減衰機能 P2X7 受容器のための証拠を提供しています。(B) ATP 濃度応答アッセイは、低濃度ではなく 500 μ M と 1 mM で大きな細孔形成を示した。この図の拡大版を表示するのにはここをクリックしてください。
生細胞のフローサイトメトリーによる貪食
私たちのグループは以前細胞外 ATP が骨格から P2X7 C 末端にどう P2X7 を介した貪食能を阻害することを示した具体的には、非ミオシン IIA の18,19。このメソッドは海馬によって貪食における P2X7 受容体の関与を実証するこれらの知見を拡大し、SVZ 神経前駆細胞のリアルタイム (図 4、海馬貪食の例)。1 μ m YG ラテックス ビーズの奔放貪食 (コントロール) レベルをポジティブ コントロールとして設立ATP は、5% 血清廃止すべての生来の貪食20間 PFA 固定とアクチン重合阻害剤サイトカラシン D、すなわち非特異的な阻害剤と同じ程度に YG ビーズの貪食を抑制しました。
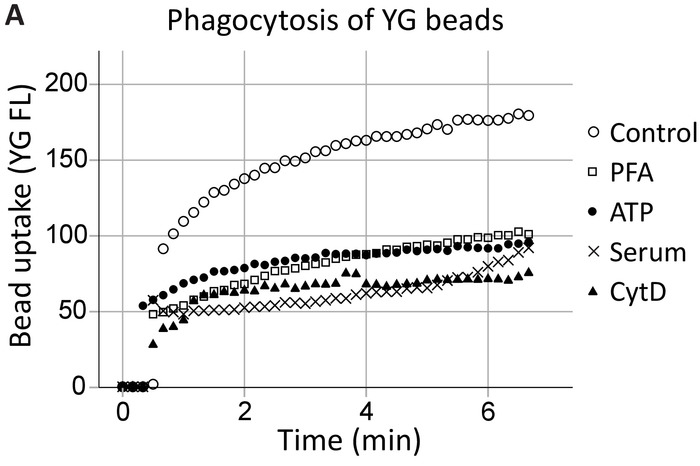
図 4: YG ビーズ取り込み P2X7 受容体を介した神経前駆細胞の貪食能を発揮します。YG ビーズ吸収神経前駆細胞は生きているセルを用いた観測リアルタイムでフローサイトメトリーします。貪食の制御レベルは当初、設立、セルの数が許可されている場合、実行の終わりに再確認します。P2X7 受容体の関与は、この解離 C 末端膜骨格から P2X7 を介した細胞骨格の再編成を防止するよう、ATP 存在下で貪食能の抑制によって示されます。貪食細胞貪食、パラホルムアルデヒド (PFA)、サイトカラシン D (CytD) などの非特異的な阻害剤の使用と同じ程度に、ATP のアプリケーションがブロック。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
大人の神経因性のニッチに由来神経前駆細胞培養における P2X7 受容体機能の解析のための詳しいプロトコルを提案する.大人の神経前駆細胞の潜在的なアプリケーション細胞研究から治療目的の範囲と文化のメソッドは、堅牢かつ再現可能なので。エンドポイント文化の質に影響を与える可能性がありますこのプロトコルの主要な要素の数があります。頭蓋骨から削除されると、脳は乾燥するいけないし、郭清はできるだけ早く実行する必要があります。海馬と特に血管や膜質の組織を削除する余分な注意は優れた前駆細胞の利回りになります。解離と製粉プロセス重く、培養で得られた球の数に影響を与えるトリプシン-EDTA と孵化の間にティッシュを攪拌より均一なソリューションになります。火磨かれたガラスの使用は、細胞死を軽減し生成されたカルチャを向上させる強くお勧めプラスチック ピペット チップ P1000 にピペットを牧草地します。Overtriturating は避けてください。これらの注意にもかかわらず、プロシージャは P0 文化の破片の多くを作成できます、前駆細胞を失うこと、洗濯や文化の餌付けを避けるために球が形成されるまでに避けるべき。
番号違い、海馬、SVZ 文化は P0 で明らかになります。海馬文化収量が少ない球、これらが一般的に従っています。初期の通路の球からそっと持ち上げてピペット チップを使用します。その後通路で付着性球は見られなかった。組織培養のフラスコのさまざまなブランドが、球を引き起こす可能性があります準拠、皿の底の植民地として成長し、特に海馬の球。これはこのプロトコルの下流の結果を変更する見つかりませんでしたが、監視する必要があり、可能な限り一貫性は維持する必要があります。
パッチク カルシウム流入を記録するなど、P2X7 受容体機能を測定するために使用前のメソッドは、時間がかかり、骨の折れる、単一のセルにのみ情報を提供可能性があります。このプロトコルは、P2X7 受容体 1 つのマシンを使用してのすべての 3 つの機能を分析する迅速かつ再現性のある手法を提案します。全体の人口の分析のため時分割住セルイメージ フローサイトメトリーとカルシウム流入、細孔形成および/または貪食能の動態に関する情報を研究者を提供できます。これに加えて、フローサイトメトリーは、マーカー発現パターンとセル サイズやタンパク質発現レベルに基づく母集団解析評価するための方法として簡単に使用できます。
これらの実験を実施する際の繰り返し間隔最大カルシウム流入、エチジウム取り込みや貪食率の違いを観察する可能性があります。これは、球のサイズを最小限に抑える培養条件と供給体制必要があります一貫して細胞の健康は得られた結果に重要な影響を与えます。氷の上にも影響を与えるデータので氷の上には最低限、事前にすべての準備を確認します。カルシウム インジケーターの色素が読み込み時間が一致していることを確認します。最大カルシウム録音の大きな矛盾につながる可能性がありますもう一つの要因は、ATP バッチ間バリエーションです。ATP 株の準備が重要と同じ実験のための異なるバッチの使用は避けるべきであります。ATP が一貫性のあることを確認する古いものと新しいバッチを比較することをもお勧めします。インキュベーション時間と濃度の最適化が必要になる場合がありますので、P2X7 拮抗薬の有効性は細胞ラインとバッチに依存可能性があります。
それはカルシウム流入/流出は最も基本的で複雑な細胞機能の一つ、多くの受容体によって媒介されることができますは注目に値するです。ATP 誘起カルシウム流入 P2X7 チャネル/孔機能の古典的な測定が P2X7 受容体の真の機能を正確に反映しない ATP として可能性がありますもアクティブ P2Y 受容体細胞内のカルシウムを解放します。この場合、バリウムは良い陽の流入は単方向16カルシウムの代わりに使用する可能性があります。このカルシウム流入の P2Y 受容体からの貢献を区別するために代わりに CaCl2 K+中に 1 mM EDTA またはエチレング リコール-bis(β-aminoethyl ether)-N, N, n ′ n ′ 四酢酸 (グリコールエーテルジアミン四酢酸) が追加条件を使用する可能性があります。試金。
このプロトコルは、他の細胞型に合わせて簡単に適応も可能性があり、代替イオン チャンネル受容体または貪食に参加している受容体の機能を調べるために便利することができます。このメソッドは、time モジュールなし流れ cytometry マシンに適応することがあります。例としては、YG ビーズが従来のフローサイトメトリーによる解析の前に 7-8 分を追加、食作用の試金が行われます。37 ° C で細胞を維持し、継続的にそれらを旋回します。これはリアルタイムの情報を提供することはしませんが、平均の最終的な蛍光の違いはまだ P2X7 受容体の機能に関する研究員をお知らせいたします。
興味 P2X7 受容体薬剤標的21,22または24が急速に成長している薬剤投与ルート23,としても、この謎の受容体を研究する手法を継続的にする必要がありますので適応し、する改良これらの研究を促進します。このプロトコルは大人の神経前駆細胞における P2X7 関数を探索するために使用可能性がある方法論を概説し、神経因性のニッチにおける P2X7 受容体のより大きい理解を達成するため、脳卒中治療の進歩につながることを期待していて、その他の虚血性損傷。
開示事項
著者が明らかに何もありません。
謝辞
著者は、この研究への貢献のマリア ・ Kasherman と新黄を感謝したいです。この作品は、国立保健医療研究評議会 (NHMRC) のオーストラリア (571100 と 1048082) とバクスター慈善財団 (から T.C.L.、m. w.、T.C.L.、ミリリットル、レベッカ L. クーパー医療研究財団からの助成金によって支えられました。シドニー、オーストラリア)。B.G. は、オーストラリア研究会議 (ARC) 未来フェローシップ (FT120100581)、NHMRC (1048082、1061419、および 1120095)、プロジェクト助成と Florey 研究所にビクトリア朝の政府の運用インフラストラクチャ サポート助成金によって支持されました。ミリリットルは、ケルマン博士チャールズ d. 博士研究賞 (2010 年) 国際網膜研究財団 (アメリカ) からによって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| A438079 | Tocris | 2972/10 | |
| ATP | Sigma-Aldrich | A2383 | |
| AZ10606120 | Tocris | 3323/10 | |
| bzATP | Sigma-Aldrich | B6396 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| FACSCalibur | Becton Dickinson | ||
| Fluo-8AM | AAT-Bioquest | 21080 | Fluo-4AM and Fura-Red AM have also been used successfully |
| Fluoresbrite YG Microspheres | Polysciences Inc | 17154-10 | 1.00 µm, yellow-green |
| Glutamine | ThermoFisher Scientific | 25030081 | 200 mM |
| HBSS | ThermoFisher Scientific | 14170112 | |
| Heparin | Sigma-Aldrich | H3149 | |
| NeuroCult Basal Medium | Stemcell Technologies | 5700 | Mouse and rat |
| NeuroCult Proliferation Supplement | Stemcell Technologies | 5701 | Mouse and rat |
| Oxidized ATP | Sigma-Aldrich | A6779 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | pluronic acid |
| Recombinant Murine EGF | Peprotech | 315-09 | |
| Recombinant Murine FGF-basic | Peprotech | 450-33 | |
| Tetramethylammonium Hydroxide | Sigma-Aldrich | T7505 | |
| Time Zero Module | Cytek Biosciences | ||
| Tissue culture flasks | BD Falcon (Corning) | 353108 (T25), 353136 (T75) | Blue vented screw cap |
| TrypLE Express | Gibco | 12604013 | |
| Trypsin-EDTA (0.25%) | ThermoFisher Scientific | 25200056 | with phenol red |
| UltraPure Ethidium Bromide | ThermoFisher Scientific | 15585011 | 10 mg/mL |
参考文献
- Sperlagh, B., Illes, P. P2X7 receptor: an emerging target in central nervous system diseases. Trends in Pharmacological Sciences. 35 (10), 537-547 (2014).
- Liang, X., et al. Quantifying Ca2+ current and permeability in ATP-gated P2X7 receptors. Journal of Biological Chemistry. 290 (12), 7930-7942 (2015).
- Rat, P., Olivier, E., Tanter, C., Wakx, A., Dutot, M. A fast and reproducible cell- and 96-well plate-based method for the evaluation of P2X7 receptor activation using YO-PRO-1 fluorescent dye. Journal of Biological Methods. 4 (1), 64(2017).
- Gu, B. J., et al. A quantitative method for measuring innate phagocytosis by human monocytes using real-time flow cytometry. Journal of Quantitative Cell Science: Cytometry Part A. 85 (4), 313-321 (2014).
- Jursik, C., et al. A quantitative method for routine measurement of cell surface P2X7 receptor function in leucocyte subsets by two-colour time-resolved flow cytometry. Journal of Immunological Methods. 325 (1-2), 67-77 (2007).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272 (5262), 735-738 (1996).
- Delarasse, C., et al. Neural progenitor cell death is induced by extracellular ATP via ligation of P2X7 receptor. Journal of Neurochemistry. 109 (3), 846-857 (2009).
- North, R. A. Molecular physiology of P2X receptors. Physiological Reviews. 82 (4), 1013-1067 (2002).
- Leeson, H. C., et al. P2X7 Receptors Regulate Phagocytosis and Proliferation in Adult Hippocampal and SVZ Neural Progenitor Cells: Implications for Inflammation in Neurogenesis. Stem Cells. , (2018).
- Glaser, T., et al. Modulation of mouse embryonic stem cell proliferation and neural differentiation by the P2X7 receptor. PLoS One. 9 (5), e96281(2014).
- Papp, L., Vizi, E. S., Sperlagh, B. Lack of ATP-evoked GABA and glutamate release in the hippocampus of P2X7 receptor-/- mice. Neuroreport. 15 (15), 2387-2391 (2004).
- Wiley, J. S., Gu, B. J. A new role for the P2X7 receptor: a scavenger receptor for bacteria and apoptotic cells in the absence of serum and extracellular ATP. Purinergic Signalling. 8 (3), 579-586 (2012).
- Lovelace, M. D., et al. P2X7 receptors mediate innate phagocytosis by human neural precursor cells and neuroblasts. Stem Cells. 33 (2), 526-541 (2015).
- Walker, T. L., Kempermann, G. One mouse, two cultures: isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of Visualized Experiments. (84), e51225(2014).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Frontiers in Neuroscience. 5, 89(2011).
- Gu, B. J., Wiley, J. S. Broad applications of mulit-colour time-resolved flow cytometry. Flow Cytometry - Recent Perspectives. , (2012).
- Cheewatrakoolpong, B., Gilchrest, H., Anthes, J. C., Greenfeder, S. Identification and characterization of splice variants of the human P2X7 ATP channel. Biochemical and Biophysical Research Communications. 332 (1), 17-27 (2005).
- Gu, B. J., Saunders, B. M., Jursik, C., Wiley, J. S. The P2X7-nonmuscle myosin membrane complex regulates phagocytosis of nonopsonized particles and bacteria by a pathway attenuated by extracellular ATP. Blood. 115 (8), 1621-1631 (2010).
- Gu, B. J., Rathsam, C., Stokes, L., McGeachie, A. B., Wiley, J. S. Extracellular ATP dissociates nonmuscle myosin from P2X(7) complex: this dissociation regulates P2X(7) pore formation. American Journal of Physiology-Cell Physiology. 297 (2), C430-C439 (2009).
- Gu, B. J., et al. P2X7 receptor-mediated scavenger activity of mononuclear phagocytes toward non-opsonized particles and apoptotic cells is inhibited by serum glycoproteins but remains active in cerebrospinal fluid. Journal of Biological Chemistry. 287 (21), 17318-17330 (2012).
- Bhattacharya, A. Recent Advances in CNS P2X7 Physiology and Pharmacology: Focus on Neuropsychiatric Disorders. Frontiers in Pharmacology. 9 (30), (2018).
- Burnstock, G., Knight, G. E. The potential of P2X7 receptors as a therapeutic target, including inflammation and tumour progression. Purinergic Signalling. 14 (1), 1-18 (2018).
- Alves, L. A., et al. Pore forming channels as a drug delivery system for photodynamic therapy in cancer associated with nanoscintillators. Oncotarget. 9 (38), 25342-25354 (2018).
- Pacheco, P. A., et al. P2X7 receptor as a novel drug delivery system to increase the entrance of hydrophilic drugs into cells during photodynamic therapy. Journal of Bioenergetics and Biomembranes. 48 (4), 397-411 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved