Method Article
Cytométrie en cellules vivantes en temps réel d’enquêter sur l’Influx calcique, la Formation de pores et phagocytose par les récepteurs P2X7 dans des cellules progénitrices neurales adultes
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Sensibilité de la cellule unique, cytométrie de flux en temps réel est particulièrement adapté pour quantifier les fonctions du récepteur multimodal de cultures vivantes. À l’aide de cellules progénitrices neurales adultes, la fonction des récepteurs P2X7 a été évaluée par l’influx de calcium détectée par colorant indicateur de calcium, formation des pores transmembranaires par absorption de bromure d’éthidium et de la phagocytose en utilisant des billes de latex fluorescentes.
Résumé
Cytométrie en cellules vivantes est de plus utilisé parmi les biologistes cellulaires pour quantifier les processus biologiques dans une vie culture cellulaire. Ce protocole décrit une méthode par laquelle cytométrie en cellules vivantes est étendu sur d’analyser les fonctions multiples de l’activation des récepteurs P2X7 en temps réel. À l’aide d’un module de temps installé sur un cytomètre en flux, fonctionnalité de cellules vivantes peut être évaluée et tracée sur une période donnée d’étudier la cinétique de l’influx calcique, la formation du pore transmembranaire et phagocytose. Cette méthode simple est avantageuse car tous trois fonctions canoniques du récepteur P2X7 peuvent être évaluées à l’aide d’une machine, et les données tracées au fil du temps fournissent des informations sur la population entière de cellules vivantes plutôt qu’unicellulaires enregistrements souvent obtenue à l’aide de méthodes de patch clamp techniquement difficiles. Expériences d’afflux de calcium utiliser un colorant indicateur de calcium, tandis que les essais de formation pour le pore P2X7 dépendent du bromure d’éthidium étant autorisé à passer par le transmembranaire des pores formés sur les concentrations d’agonistes haute. Billes de latex jaune-vert (YG) sont utilisées pour mesurer la phagocytose. Antagonistes et agonistes spécifiques sont appliquées pour étudier les effets de l’activité des récepteurs P2X7. Individuellement, ces méthodes peuvent être modifiés afin de fournir des données quantitatives sur n’importe quel nombre de canaux calciques et les récepteurs purinergiques et charognard. Pris ensemble, ils mettent en évidence comment l’utilisation de la cytométrie en flux de cellules vivantes en temps réel est une méthode rapide, rentable, reproductible et quantifiable pour étudier la fonction des récepteurs P2X7.
Introduction
L’étude de signalisation purinergique est large et multiforme, impliquant la pharmacologie, biochimie et physiologie cellulaire. Signalisation Purinergique est impliquée dans une infinité de processus cellulaires et moléculaires, de cancer et de la régulation du cycle cellulaire aux communications de cellules et de la biologie des cellules souches ; par conséquent, il existe souvent un potentiel à moduler purinergiques de signalisation pour un bénéfice thérapeutique. Des récepteurs purinergiques, récepteur P2X7 a reçu beaucoup d’attention ces dernières années en raison de son potentiel comme une cible thérapeutique pour nombreuses affections inflammatoires1. Méthodes pour étudier les récepteurs ont évolué et été adaptée au fil des ans pour faciliter cette recherche2,3,4,5. Nous décrivons ici une méthode de cytométrie en flux de cellules vivantes pour enquêter sur les multiples fonctions des récepteurs P2X7 dans les cellules progénitrices neurales adultes provenant de la zone sous-ventriculaire (SVZ) et l’hippocampe gyrus denté.
Le récepteur P2X7 a été décrite comme le récepteur P2Z, ou le récepteur de la « mort de la cellule », comme l’activation de fortes concentrations d’adénosine triphosphate (ATP) conduit à la formation d’un gros pore transmembranaire perméable aux molécules jusqu'à 900 Da6. Cela conduit à la réorganisation du cytosquelette, la formation des pores transmembranaires et, éventuellement, l’apoptose ou nécrose7. Traditionnellement, cette fonction de P2X7 est quantifiée par l’absorption des colorants de masse moléculaire élevée comme le bromure d’éthidium ou de YO-PRO-1, qui réagissent en lorsque intercalées avec ADN3,8. Les méthodes de lecteur de plaque, qui sont rapides et permettant l’upscaling, généralement ne permettent pas pour l’observation de la cinétique. La méthode décrite ici est basée sur l’absorption d’éthidium et permet l’augmentation de fluorescence à observer au fil du temps, offrant une plus grande profondeur de l’information en ce qui concerne la vitesse de formation de pores. Récepteurs P2X7 ont depuis été montrés pour faciliter un certain nombre de fonctions non immunisés, avec des réponses distinctes selon l’exposition temps et agoniste concentration9,10. Brève activation par des concentrations plus faibles de l’ATP se traduit par l’afflux de cation aux fins de neurotransmetteur et signal transduction11. Utilisant l’écoulement cytometry pour mesurer l’influx de calcium permet de surmonter les problèmes associés aux méthodes lourdes et difficiles techniquement — particulièrement, patch de serrage pour mesurer les courants entrants qui fournissent de précieux détails quant à la différence de potentiel à travers une membrane cellulaire mais ne permettent pas pour l’analyse de population2. La troisième fonction de récepteurs P2X7 survient en l’absence de l’ATP, où les récepteurs P2X7 ont été démontrés pour faciliter la phagocytose dans le système immunitaire et le système nerveux9,12,13. Progrès dans les techniques de microscopie ont permis la visualisation des réarrangements du cytosquelette durant le processus de capture, bien que l’analyse de quantification et de la population peut encore présenter un défi.
La méthode de cytométrie de flux des cellules vivantes détaillée ici permet d’enquête sur les trois fonctions principales des récepteurs P2X7 en temps réel. L’inclusion d’un dispositif de module de temps sur le cytomètre en flux permet le contrôle de la température et agitation continuelle des cellules en suspension. Agoniste et antagoniste des stimuli peuvent être livrés en moins d’une seconde, ce qui permet la mesure quasie ininterrompue de la réponse cellulaire. Ceci présente une méthode simple et rapide pour quantifier reproductible fonction tout en évitant l’utilisation de plusieurs systèmes de dosage. Il est important de noter que ce protocole peut-être facilement être adapté pour convenir à tout type de cellule et pourrait servir à examiner les autres sous-types de récepteurs, compte tenus de l’inclusion des agonistes spécifiques ou inhibiteurs, en fonction de leurs propriétés.
Protocole
Les animaux étaient traités conformément au Code de pratique australien pour le soin et l’utilisation des animaux à des fins scientifiques et approuvées par le Comité d’éthique de Griffith University Animal.
1. Neurosphère Culture de cellules progénitrices neurales de la SVZ adulte et de l’hippocampe
Remarque : Le protocole de la dissection présenté ici est basé sur le travail par Walker et Kempermann et un protocole détaillé pour la dissection des cellules progénitrices neurales de souris adultes est disponible ailleurs14. Conditions de culture ont été modifiées de Babu et collègues15. On a utilisé des souris C57BL/6 femelles adultes, âgés de 8 à 12 semaines.
- Dans une armoire de sécurité biologique, préparer le milieu de culture (milieu de base neural) additionné de supplément de prolifération de cellules souches neurales, 2 mM de glutamine, 20 facteur de croissance épidermique (EGF) ng/mL, 10 ng/mL facteur de croissance basique des fibroblastes (bFGF) et 2 µg/mL héparine.
- Euthanasier deux souris par inhalation de CO2 . Sinon, anesthésier les souris selon les lignes directrices et les euthanasier immédiatement par dislocation cervicale. Leurs têtes de pulvérisation avec l’éthanol à 70 % et les décapiter. Transférer chaque chef dans un tube stérile contenant la solution saline équilibrée de Hank (HBSS) avec solution de pénicilline/streptomycine 1 x (P/S).
- Effectuer des dissections sous une hotte à flux laminaire sous un microscope à dissection.
- À l’aide de ciseaux pinces et dissection, enlever le tissu et l’OS pour exposer le cerveau et transférer dans un récipient stérile contenant HBSS avec P/S.
- Positionner la face ventrale du cerveau vers le haut et utiliser une lame de bistouri pour pratiquer une incision coronale complete à travers le chiasma optique. Stabilisez le cerveau avec la pince et utilisez une swift, nettes, mouvement vers le bas. Évitez de sciage pour minimiser la mort cellulaire et pour aider à maintenir la structure du tissu.
Remarque : Si ne pas fermement plaquée, le cerveau peut basculer vers l’avant pendant la coupe, compromettre le nombre de cellules souches provenant de la SVZ. - Isoler la SVZ de la partie rostrale du cerveau.
- Localisez les deux ventricules, séparées par le septum, avec le corps calleux formant un pont blanc au-dessus d’eux.
- Forceps permet de supprimer la cloison séparant les deux ventricules et d’isoler les murs latéraux des ventricules latéraux antérieurs. Cela, en coupant avec des ciseaux de dissection fine au-dessus, au-dessous, sur les côtés et à l’avant. Il restera juste une petite coupe de forme.
- Préparer un couvercle de boîte de pétri propre avec quelques gouttes de HBSS au milieu et transférer la SVZ dans le liquide. Ne laissez pas le tissu se sécher ou toucher une surface sèche. Rester sur le côté tandis que l’hippocampe de dissection.
- Isoler l’hippocampe de la partie caudale du cerveau.
- Faites une ligne médiane coupe entre les hémisphères de rompre le corps calleux. Utiliser les ventricules latéraux comme guide et dépliez délicatement le cortex pour exposer l’hippocampe. Une fois que le cortex a été déroulé, l’hippocampe peut être considérée comme une structure incurvée, blanche et dense.
- Utilisez des ciseaux de dissection fine ou une pince pour isoler l’hippocampe des tissus voisins.
- Avec une pince, retirer les excès de substance blanche, les vaisseaux sanguins et n’importe quel tissu membraneux couvrant l’hippocampe.
- Préparer un couvercle de boîte de pétri propre préparé avec quelques gouttes de HBSS et transférer l’hippocampe dans le liquide. Répétez pour l’autre hémisphère.
- Une fois que l’hippocampe et la SVZ de deux souris ont été isolés et transféré à leurs couvercles respectifs de pétri, mécaniquement dés le tissu à l’aide d’une lame de bistouri. Couper le tissu dans un couvercle de boîte de pétri pendant environ 1 min, tournant toutes les 10 s jusqu'à ce que le tissu semble lisse et seulement de belles pièces restent. Prendre une lame de bistouri propre et répéter pour l’autre plat, découper le tissu pendant 1 min.
- À l’aide d’une pipette 1 mL, transférer tous les tissus de chaque couvercle de boîte de pétri pour séparer les tubes contenant 1 mL d’acide de 0,25 % trypsine-tétraacétique (EDTA). Utiliser un tube pour la SVZ et un tube pour l’hippocampe.
- Cela première pipetage environ la moitié de la trypsine-EDTA au tissu dans le plat pour minimiser les bulles d’air et éviter les tissus venant en contact avec la pipette sec tel qu’il est transféré dans le tube. Rincer le plat et la lame de bistouri avec le reste de la trypsine-EDTA pour recueillir autant que possible le tissu et l’ajouter au tube.
- Incuber le tissu avec la trypsine dans un bain d’eau de 37 ° C pendant 30 min, agiter le tube toutes les 10 min pour bien dissocier le tissu.
- Triturer les tissus utilisant un poli feu pipette Pasteur en verre pour créer une suspension monocellulaire. Prendre soin de ne pas overtriturate car cela provoquerait une lyse cellulaire excessive. Il s’agit d’une étape cruciale pour la dissociation tissulaire optimale.
- Observer le contenu du tube pendant le processus de trituration et arrêtent les premiers signes que la majorité des amas de tissu ont été supprimée. La solution de trypsine devienne légèrement trouble lorsque les cellules sont allés en suspension monocellulaire, bien que quelques touffes peuvent rester.
Remarque : À titre indicatif, en passant de la suspension et descendre de 10 x x-15 est suffisante. - Ajouter le milieu de culture à 5 mL pour neutraliser la trypsine et essorer à 300 g pendant 3 min. lavage supplémentaires 2 x avec HBSS et passer le milieu à travers un tamis de cellule de 70 µm pour éliminer n’importe quel tissu des touffes.
- Transférer toutes les cellules dans 15 mL de milieu dans un flacon de culture cellulaire T75.
Remarque : Sphères doivent former dans le passage à zéro (P0) culture SVZ après 7 à 10 jours et après 15 à 20 jours dans la culture de l’hippocampe. S’abstenir de laver ou de nourrir les cellules pendant cette période pour maximiser le nombre de cellules progénitrices neurales dans la culture. Si plus de progéniteurs sont nécessaires, ou pour diminuer le temps d’incubation de P0, il est possible d’augmenter le nombre de souris sacrifiées. - Culture à 37 ° C, avec 5 % de CO2 et, après la phase initiale de la culture P0, passage tous les 7 – 10 jours si nécessaire, une enceinte de sécurité biologique des pratiques standard et armoire de culture de tissus.
Remarque : La culture hippocampe P0 doit générer suffisamment sphères pour passage dans une fiole de T25 ; la culture SVZ générera des sphères plus nombreuses et peut être repiquée dans un T75. Si les sphères hippocampe P0 ont adhéré, utiliser une pipette de 200 µL pour soulever doucement la sphère. - Le passage des sphères quand elles atteignent 150 à 200 µm de diamètre. Ramassez les sphères et le milieu dans un tube de 15 mL et laisser les sphères s’immobiliser par gravité pendant environ 5 min. par ailleurs, tournent à une vitesse faible (100 x g) pendant 2 min.
- Enlever le milieu et se dissocient les cellules avec le réactif de dissociation pour les 7 à 10 min, selon la taille des sphères.
Remarque : Le réactif de dissociation utilisé aura des répercussions sur l’issue de la culture, donc s’il vous plaît se référer à la Table des matières pour plus de détails. - Laver les cellules en ajoutant 5 mL de HBSS à la solution de la cellule et centrifuger à 300 x g pendant 3 min. retirer le surnageant, remettre en suspension les cellules dans un milieu de culture et des graines à environ 150 000 cellules dans 5 mL de milieu dans un flacon de culture cellulaire T25 ou équivalent. Maintenir les cultures à 37 ° C et 5 % de CO2.
- Confirmer les statut de cellules progénitrices neurales en identifiant l’expression des marqueurs de cellules souches comme Sox2 et ASCL1 avant de passer à n’importe quel protocole en aval9.
Remarque : Cela peut être fait par la méthode de choix du chercheur (p. ex., immunochimie par microscopie, cytométrie en flux ou la tache occidentale, ou en utilisant la PCR quantitative (qPCR)).
2. préparation d’une Suspension de cellules individuelles pour l’analyse par cytométrie en flux
-
Préparer le média requis. Ceux-ci incluent ce qui suit.
- Préparer le milieu Na+ contenant 145 mM NaCl, 5 mM KOH, 10 mM HEPES, 5 mM D-glucose, 0,1 % d’albumine sérique bovine (BSA) et 0,1 mM CaCl2. Ce milieu est également utilisé dans un formulaire sans calcium, avec 0,1 mM CaCl2 omis.
- Préparer le milieu K+ contenant 145 mM KCl, 5 mM KOH, 10 mM HEPES, 5 mM D-glucose et 0,1 % de BSA.
Remarque : Ces milieux ont été grandement améliorés et est détaillées dans les précédentes publications4,5. - Préparer ATP de Stock par pesée assez poudre ATP pour environ 20 mL d’un stock de 100 mM. Dissoudre la poudre dans 17 mL de tampon de KCl (145 mM KCl, 5 mM KOH et 10 mM HEPES, pH 7,5) et lentement, tout en remuant, ajouter 2 mL de 18 % (p/v) d’hydroxyde de tétraméthylammonium (TMA) à la solution pour amener le pH à 6,8 et 7,0.
- Ajuster le volume final à 20 mL. Rater pas le pH passé 7.0. Magasin le stock à-80 ° C ; Notez que les aliquotes d’ATP sont stables pendant au moins 6 mois.
Remarque : Le poids moléculaire libre d’ATP anhydre est 551.14 g/mol, et ceci n’inclut pas le poids moléculaire des molécules de l’eau et de disodium, qui peuvent varier d’un lot à l’autre et doivent être pris en considération pour le calcul. TMA est toxique, et il faut lors de la manipulation. Lire des données d’innocuité feuille et préparent les stocks dans une armoire de fumées. - Préparation stock BzATP en dissolvant le BzATP à ultrapure H2O pour une concentration finale de stock de 10 mM.
- Créer une suspension monocellulaire comme décrit aux points 1.16 et 1.17. Compter les cellules à l’aide d’un compteur de cellule automatique ou un hémocytomètre. Remettre en suspension les cellules dans le milieu requis (p. ex., moyen de Na+ , milieu de culture) pour l’expérimentation en cours (comme décrit ci-dessous) et placer les cellules sur la glace en attendant.
- Pour chaque expérience, ce il y a suffisamment d’échantillon pour inclure des contrôles avant et latéraux en nuages de points, ainsi que pour l’étalonnage des paramètres de tension et d’indemnisation. Notons, à titre indicatif, que sphères cultivés dans un ballon jaugé de T75 généralement produisent environ 8 x 106 cellules par flacon.
-
Réglez le débit cytomètre de paramètres à l’aide d’échantillons de contrôle.
- Utilisation avant et côté dispersent à la porte de façon sélective les cellules vivantes.
NOTE : Forward scatter fournit des informations au sujet de la taille de la cellule basée sur la diffraction de la lumière, tandis que la diffusion latérale fournit une mesure de la complexité interne ou granularité. Événements de flux avec des petits pas en avant et de la diffusion latérale peuvent être considérées comme les cellules mortes. - Ajuster la tension et gain du cytomètre de flux selon les instructions du fabricant. Exécuter un échantillon d’essai pour s’assurer de la saisie des données à l’intensité de la fluorescence maximale. Aucune indemnité n’est requise pour les acquisitions monocanal.
- Utilisation avant et côté dispersent à la porte de façon sélective les cellules vivantes.
3. mesurer l’Influx calcique par flux Live-cellule Cytometry
- Suite à la préparation d’une suspension de cellules individuelles, remettre en suspension les cellules dans 1 mL de milieu Na+ sans calcium et chargez-les 2 ng/mL de calcium indicateur colorant selon le protocole du fabricant (voir la Table des matières) avec 10 µL de 5 % d’acide pluronique. Incuber les cellules pendant 30 min à 37 ° C.
- Laver les cellules en ajoutant 3 – 5 mL de milieu Na+ sans calcium et centrifugation doucement (x 200 g pour 4 min). Retirez le surnageant et remettre en suspension les cellules dans un milieu Na+ sans calcium, laver une seconde fois.
- Remettre en suspension les cellules dans 1 mL de milieu Na+ sans calcium, placez-les sur la glace et laissez-les hors estérifier pendant 30 min.
- Laver 1 fois de plus en ajoutant 3 – 5 mL de milieu K+ et centrifugation (200 x g pendant 4 min ;) puis, resuspendre les cellules K+ moyen et aliquote eux en fluorescence cellulaire assistée triant (FACS) tubes à une concentration de 1 x 106 cellules / µL 500 par tube de FACS.
Remarque : Le nombre de tubes de FACS par échantillon dépendra du nombre de traitements et répète que sont inclus. - Placer les tubes de FACS sur la glace jusqu'à ce que les cellules sont prêtes à être analysées. Ne laissez pas les cellules sur la glace pendant une période prolongée, mais commencer le test dès que possible.
- Pour certains échantillons, príncuber les cellules avec l’inhibiteur spécifique du récepteur P2X7 AZ10606120 (1µm pendant 10-15 min) ou A438079 (10 µM pendant 30 min) à 37 ° C avant l’analyse.
- Quelques minutes avant d’exécuter le premier échantillon, ajouter CaCl2 (à une concentration finale de 1 mM dans le tube de FACS) et placer le tube dans un bain d’eau de 37 ° C à récupérer.
- Déposez un propre, petit agitateur magnétique dans le goulot de FACS et la position du tube dans le module lié à un bain d’eau de 37 ° C circulation pour contrôler la température de l’échantillon. Sélectionnez une vitesse d’agitation faible pour assurer la circulation de l’échantillon sans introduire un effet de vortex. Placer l’adaptateur de tube de chemise d’eau sur la plate-forme de l’échantillon et fermer le bras de levier de la machine de FACS.
- Lancer l’acquisition de l’échantillon et exécuter l’exemple pendant 3 min à environ 1 000 événements par seconde.
- À la marque s 40, sortir le tube rapidement et à ajouter l’agoniste P2X7, ATP de 1 mM ou 300 µM BzATP et remplacer le tube afin de poursuivre l’acquisition.
- Alors que le premier échantillon est l’enregistrement, préparer le second échantillon avec CaCl2 et placez-le à 37 ° C pour permettre un délai suffisant pour les cellules pour se réchauffer avant l’analyse. Lorsque le premier échantillon est terminée, nettoyez l’apport en exécutant un échantillon d’eau, et puis l’acquisition du second échantillon peut commencer comme décrit aux étapes 3.8 et 3.9. Ne jamais nettoyer l’absorption entre les échantillons.
4. Formation de pores par cytométrie en flux en direct-cellule de mesure
- Créer une suspension monocellulaire comme décrit aux points 1.16 et 1.17. Sauver quelques millilitres du milieu ancien, utilisez-le pour remettre en suspension les cellules à une concentration de 1 x 106 cellules / 100 µL par tube de FACS et placez-le sur la glace jusqu’au moment.
- Avant d’exécuter le test, ajouter 900 µL de milieu de K+ pour un volume final de 1 mL et placer les tubes dans un bain d’eau de 37 ° C pendant 10 min récupérer.
- Le cas échéant, príncuber les cellules avec des traitements, y compris les inhibiteurs spécifiques P2X7 AZ10606120 (1µm pendant 10-15 min) ou A438079 (10 µM pendant 30 min).
- Immédiatement avant d’exécuter le test, ajouter le bromure d’éthidium 25 µM dans le tube de FACS ; puis, ajoutez l’agitateur magnétique, placez-le sur la machine de FACS selon étape 3,7 et commencer l’acquisition.
Remarque : Le bromure d’éthidium est toxique, et il faut lors de la manipulation il. Disposer des tubes usagés de FACS convenablement. - Pour induire la formation de pores dans la membrane cellulaire, ajouter 1 mM ATP ou 100 µM BzATP 40 s après le début de l’acquisition.
- Exécuter les exemples à environ 1 000 événements par seconde pendant 6 min.
- Alors que le premier échantillon est en cours d’exécution, prendre le deuxième échantillon de la glace et placez-le dans le bain d’eau de 37 ° C pour permettre un délai suffisant pour les cellules récupérer avant l’analyse. Une fois que le premier échantillon a fini avec l’acquisition, nettoyer l’apport en exécutant un échantillon d’eau ; Ensuite, le second échantillon peut être placé sur la machine pour commencer l’enregistrement comme décrit aux étapes 3.8 et 3.9.
5. phagocytose par cytométrie en flux en direct-cellule de mesure
- Créer une suspension monocellulaire comme décrit aux points 1.16 et 1.17. Remettre en suspension les cellules dans un milieu conditionné et partie aliquote dans FACS tubes à une concentration d’au moins 1 x 106 cellules / 100 µL par tube de FACS. Diluer les cellules à une concentration finale de 1 x 106 cellules/mL en moyenne Na+ (par exemple, ajouter 900 µL de milieu Na+ ) et placer les cellules sur la glace jusqu'à ce que l’analyse est réalisée.
- Utilisez 1 µm de billes de latex YG (microsphères) en tant que cibles phagocytaires pour des analyses en temps réel de la phagocytose.
Remarque : Autres couleurs peuvent également être remplacés, mais différemment tailles perles se sont avérées inadéquates cibles de phagocytose4. - Avant d’exécuter le premier échantillon, transférer les cellules dans un bain-marie à 37 ° C et laisser incuber à eux pendant environ 7-10 min permettre les cellules récupérer.
-
Ajouter tous les traitements nécessitant la préincubation de leurs tubes respectifs, y compris 1 mM ATP pendant 15 min, 300 µM oxydé ATP (oxATP) pendant 40 min, 20 µM cytochalasine D pendant 20 min et 4 % de paraformaldéhyde (PFA) pendant 20 min.
- Aucune préincubation n’est requise pour 5 % de sérum humain. Si les traitements sont ajoutés à peu près en même temps, les échantillons peuvent être exécutés dans l’ordre inverse alors que les autres continuent de couver. Par exemple, exécutez les commandes et le sérum tout d’abord, puis l’échantillon imprégnées par l’ATP, suivie de cytochalasine D et PFA et oxATP dernière.
- Placez l’échantillon sur le cytomètre avec l’agitateur magnétique comme décrit aux étapes 3.8 et 3.9 et lancer ensuite, acquisition de l’échantillon.
- Retirer le tube à essais de la machine de 15 à 20 s après le début de l’acquisition et ajouter 5 µL de perles YG non dilués. Retourner le tube à essais FACS et continuer l’acquisition. Exécuter les exemples pour 7 à 8 min à environ 1 000 événements/s.
- Tandis que le premier échantillon est en cours d’exécution, prendre le deuxième échantillon de la glace et le placer dans un bain d’eau de 37 ° C pour permettre un délai suffisant pour les cellules récupérer avant l’analyse. Une fois que le premier échantillon est terminé, nettoyer l’apport en exécutant un échantillon d’eau et, ensuite, commencer l’acquisition sur le second échantillon comme décrit aux étapes 3.8 et 3.9.
6. analyse de données
- Exporter les données dans une feuille de calcul. L’analyse des données dépendra de la question expérimentale.
Remarque : Sachez que différentes passes peuvent avoir des intensités différentes de base, il est donc important d’exécuter l’essai pour une heure précise au début (environ 40 s) avant l’ajout des agonistes et à normaliser les données en calculant le changement en fluorescence (fluorescence à un donné point dans le temps [F] divisée par la fluorescence au point de temps zéro [F0] ou F/F0). - Afin de quantifier le taux ou la cinétique de la fonction P2X7 en question, calculer l’aire sous la courbe ou la somme des trapèzes créé sous la courbe pour chaque période des temps de s 1016.
- Pour déterminer les effets des traitements, l’intensité de la fluorescence en moyenne au cours de la finale de 10 – 20 s d’enregistrement et comparer les traitements. Déterminer l’importance de la t-test ou analyse de la variance.
Résultats
Cultures de cellules progénitrices neurales
Progénitrices neurales sphère cultures dérivées à l’aide de cette méthode doivent être phase lumineuse et ont un bord arrondi lisse (Figure 1 aB). Dans les cultures saines, petite microspikes peut être observé sur les bords (Figure 1). Au passages de fin, ou si nourris insuffisamment, sphères peuvent former un creux coupe (Figure 1) ou les formes oblongues grands (Figure 1E, indiqué par la flèche). Ces cultures ne doivent pas être utilisés pour la cytométrie en flux ou toute autre application en aval, comme ces caractéristiques, il peut être indicative de la différenciation. Pour confirmer le statut progénitrices neurales, les cellules ont été cultivées sur couvre-objet en verre recouvert de poly-L-ornithine et la laminine pour l’immunocytochimie (Figure 1F et, à la confluence supérieure, Figure 1). Les cellules ont été colorés pour GFAP, nestin, Sox2, vimentine, ASCL1, BLBP, Prox1 et DCX pour identifier les cellules comme les cellules progénitrices (hippocampe) Type 2 ou Type C progénitrices cellules (SVZ)9. Cellules devraient avoir un noyau bien défini et processus étendus.
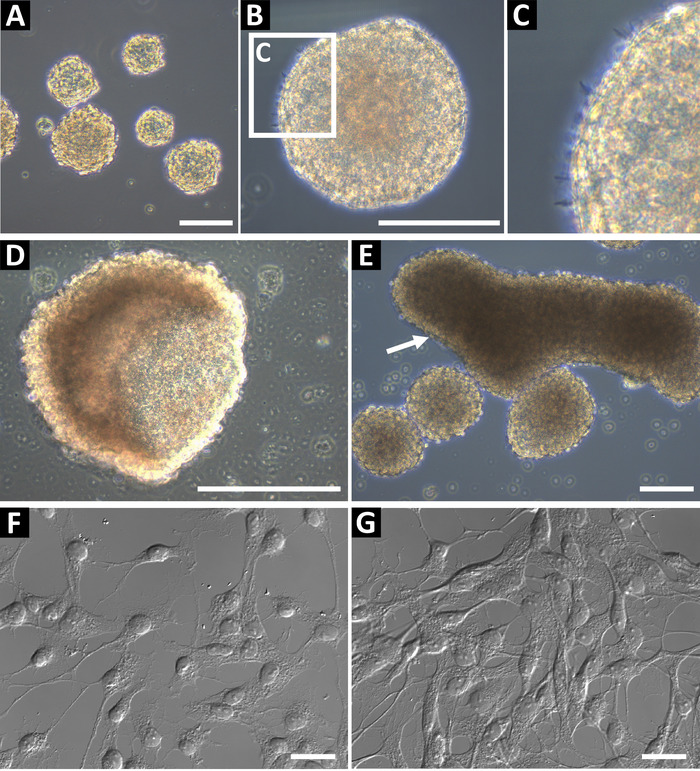
Figure 1 : la culture de cellules progénitrices neurales hippocampe représentatif. (A) les cellules progénitrices neurales hippocampe sont isolés de souris adultes et cultivés sous neurospheres jusqu'à environ 100 à 150 µm de diamètre. (B) Neurospheres devrait avoir une périphérie lisse, (C) et petite microspikes peut être observée sur leur surface. Lorsque les sphères sont trop longs dans la culture, ils peuvent former (D) coupe ou formes oblongues (E). Ces cultures ne doivent pas être utilisés pour des expériences. Pour confirmer le statut progénitrices neurales des cellules, les graines sous forme de suspension monocellulaire sur la poly-L-ornithine (OLP) et lamelles de verre enduit de laminine pour immunochimie. Cellules devraient avoir un petit soma et processus de ramifications, (F) à faible confluence et (G) prêt à l’immunochimie. Barreaux de l’échelle = 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Influx de calcium par cytométrie en cellules vivantes
Ce protocole permet l’analyse de la fonction des récepteurs P2X7 comme un canal calcique en temps réel. La cinétique de la fonction des récepteurs, ainsi que les effets de différents agonistes et antagonistes, peuvent également être évaluées. Lorsque tracées au fil du temps, les influx de calcium dans l’hippocampe et des cellules progénitrices neurales SVZ était généralement semblable (Figure 2 a et 2 b de la Figure, respectivement). Agonistes (ATP ou BzATP) ont été ajoutés à la marque s 40, comme indiqué par la flèche rouge. Pendant un bref moment, le tube est retiré du point d’enregistrement pour ajouter l’agoniste, ce qui entraîne des points de données de zéro. Cela permettra d’identifier le temps lors de l’ajout de l’agoniste. BzATP active rapidement les récepteurs P2X7, ouverture du canal ionique et permettant aux influx de calcium, qui se lie aux Fluo-8 et émet une fluorescence. Demande d’ATP entraîne généralement un influx de calcium plus graduel. Il a une affinité plus faible pour P2X7 comparativement aux BzATP et se traduira également par l’activation des récepteurs couplés aux protéines G, une voie de signalisation plus lente qui libère le calcium du réticulum endoplasmique. L’inclusion de P2X7 antagonistes A438079 et AZ10606120 (données non présentées) réduit l’influx de calcium en réponse à la demande de l’agoniste.
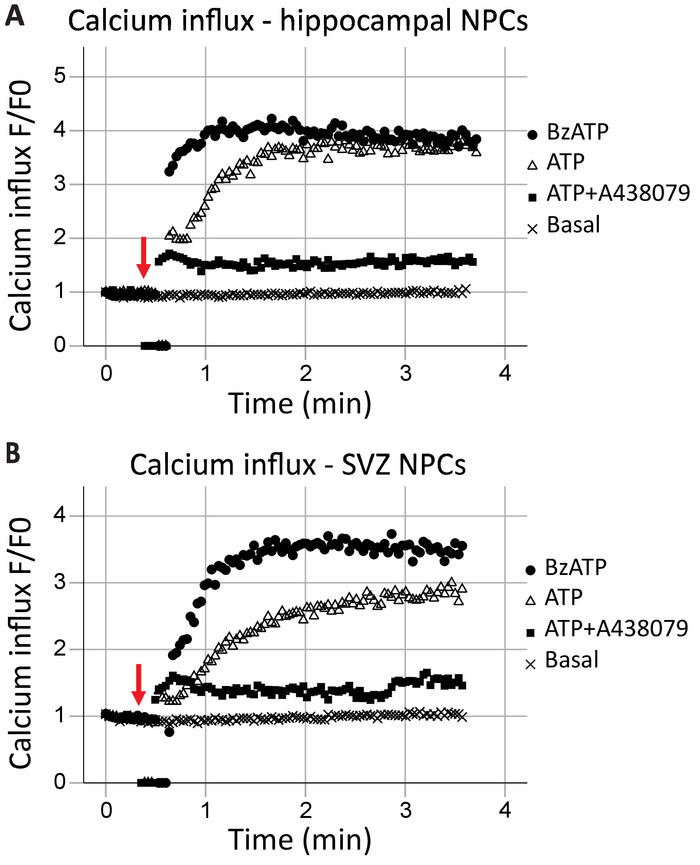
Figure 2 : influx de calcium des cellules vivantes dans les cellules progénitrices neurales de l’hippocampe et la SVZ. Fonction de canal du calcium récepteur P2X7 a été démontrée en (A) hippocampe et (B) des cellules progénitrices SVZ dérivés par des changements de fluorescence Fluo-8. Application de l’agoniste de P2X générale ATP et l’agoniste P2X7 BzATP entraîner canaux ioniques P2X7 ouverture, permettant aux influx calcique. L’afflux a été bloqué par les inhibiteurs spécifiques P2X7 A438079 ou AZ10606120 (données non présentées). F = fluorescence ; F0 = fluorescence au point de temps zéro. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Formation des pores par cytométrie en flux de cellules vivantes
Formation de pore transmembranaire est une fonction canonique des récepteurs P2X7, résultats en échange de la macromolécule et peut conduire à la mort cellulaire. + D’éthidium est une grosse molécule (314 Da) exclue de cellules saines ; son absorption et intercalation subséquente avec l’ADN se traduit par des émissions fluorescentes et peut être utilisé pour évaluer la capacité des récepteurs P2X7 pour former des pores transmembranaires. Suite à la demande des agonistes ATP (ATP 1 mM) et BzATP (100 μM) à 40 s (indiqué par la flèche), résolution temporelle cytométrie capte le bromure d’éthidium entrant dans les cellules en temps réel (Figure 3 a). Cet effet a été atténué par l’inhibiteur spécifique P2X7 AZ10606120. Le dosage de l’absorption de bromure d’éthidium montre un récepteur fonctionnel de P2X7 extrémité C-terminale17 et existe des preuves suffisantes pour l’expression des récepteurs P2X7 pleine longueur. Tests de concentration-réponse ATP illustrent les effets de la concentration d’agoniste sur P2X7 pore formation, à l’aide de changement dans la fluorescence du bromure d’éthidium au fil du temps (Figure 3 b). Courbes de concentration dose agoniste avec inhibiteurs de récepteurs spécifiques fournissent des preuves solides pour l’activation du récepteur.
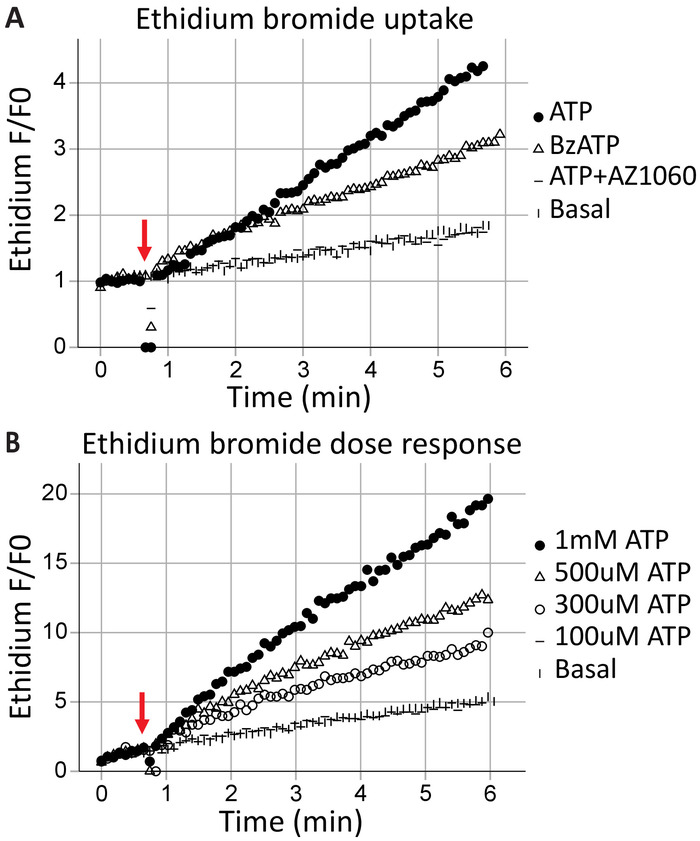
Figure 3 : formation des pores transmembranaires P2X7 mesurée par absorption d’éthidium. L’ajout des moments de bromure d’éthidium avant le début de l’acquisition est utilisé pour mesurer la formation des pores transmembranaires P2X7. Des concentrations élevées d’ATP et BzATP le résultat dans le récepteur P2X7 (A) pore formation, ce qui permet d’entrer dans la cellule du bromure d’éthidium. L’inhibiteur P2X7 AZ10606120 atténue ce phénomène et constitue une preuve pour les récepteurs P2X7 fonctionnels. (B), ATP concentration-réponse essais ont démontré pore importante formation à 500 μM et 1 mM, mais pas à des concentrations plus faibles. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Phagocytose par les cellules vivantes cytométrie en flux
Notre groupe a démontré précédemment que l’ATP extracellulaire inhibe la phagocytose médiée par P2X7 en dissociant P2X7 C-terminus du cytosquelette, plus précisément, non musculaires myosine IIA18,19. Cette méthode développe sur ces résultats pour démontrer l’implication du récepteur P2X7 phagocytose par hippocampe et les cellules progénitrices neurales SVZ en temps réel (Figure 4, un exemple de phagocytose hippocampique). Niveaux de phagocytose désinhibé (contrôle) de billes de latex YG 1 µm ont été établis comme contrôle positif. ATP inhibe la phagocytose des perles YG dans la même mesure que les inhibiteurs non spécifiques, à savoir la fixation de l’IFP et l’actine polymérisation inhibiteur cytochalasine D, tandis que 5 % de sérum aboli toutes phagocytose innée20.
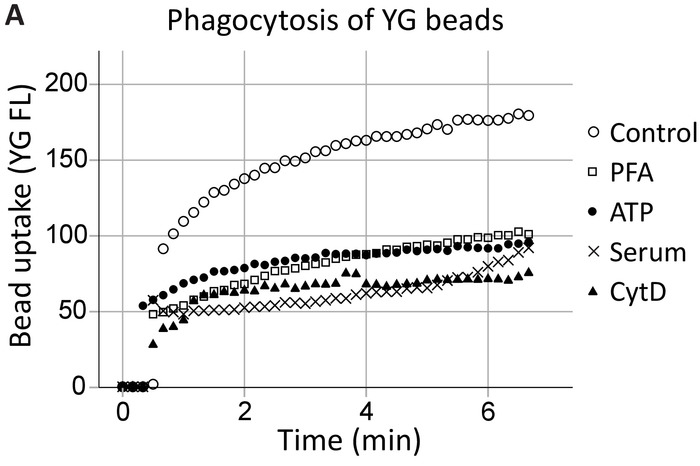
Figure 4 : absorption de perle YG démontrant la capacité phagocytaire des progéniteurs neurones via des récepteurs P2X7. YG perle absorption par les cellules progénitrices neurales est observable à l’aide de cellules vivantes cytométrie en flux en temps réel. Contrôle des niveaux de phagocytose sont établis au départ et si le nombre de cellules permet, reconfirmés à la fin de la course. Implication des récepteurs P2X7 est indiquée par l’inhibition de la phagocytose en présence d’ATP, comme cela dissocie de l’extrémité C-terminale du cytosquelette membranaire, empêchant P2X7 médiée par des réarrangements du cytosquelette. L’application de l’ATP bloquée phagocytose dans la même mesure que l’utilisation d’inhibiteurs non spécifiques de la phagocytose, y compris la paraformaldéhyde (PFA) et la cytochalasine D (CytD). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Cet article présente un protocole détaillé pour l’analyse de la fonction des récepteurs P2X7 dans les cultures de cellules progénitrices neurales dérivés des niches adultes neurogènes. Les applications potentielles pour progénitrices neurales adultes cellules vont de la recherche à des fins thérapeutiques, et donc la méthode de culture doit être robustes et reproductibles. Il y a un certain nombre d’aspects essentiels au présent protocole qui peuvent influer sur la qualité de la culture de point de terminaison. Une fois retirée du crâne, le cerveau ne puissent pas sécher et la dissection doit être effectuée aussi rapidement que possible. En particulier avec l’hippocampe, des précautions supplémentaires prises pour éliminer tous les vaisseaux sanguins ou le tissu membraneux seront traduira par rendements cellules progénitrices supérieure. Le processus de dissociation et la trituration peut influer fortement sur le nombre de sphères obtenues dans une culture ; agiter le tissu pendant l’incubation avec la trypsine-EDTA se traduira par une solution plus homogène. L’utilisation d’un verre poli feu Tunney pipette sur une P1000 de pipette en plastique est fortement recommandé de réduire la mort cellulaire et améliorer la culture qui en résulte. Éviter les overtriturating. Malgré ces précautions, la procédure peut créer beaucoup de débris dans la culture de P0, et pour éviter de perdre des cellules progénitrices, de lavage ou de nourrir la culture devrait être évitée jusqu'à ce que les sphères sont formées.
Un certain nombre de différences entre l’hippocampe et cultures SVZ sera évidents à P0. Hippocampe cultures donnent moins de sphères, et ceux-ci adhèrent généralement. Utiliser un embout de la pipette pour soulever doucement les sphères pour le passage initial. Sphères adhérentes n’ont pas été observés dans les passages suivants. Différentes marques de flacons de culture de tissus peuvent provoquer les sphères, sphères particulièrement hippocampiques, d’adhérer et de grandir en tant que colonies sur le fond du plat. C’était pas pour modifier aucun résultat en aval de ce protocole, mais doit être surveillé, et cohérence devrait être maintenue lorsque c’est possible.
Méthodes précédentes utilisés pour mesurer la fonction des récepteurs P2X7, tels que les patch de serrage pour enregistrer l’influx de calcium, sont longues et laborieuses et peuvent seulement fournir des informations sur une seule cellule. Ce protocole présente une méthode rapide et reproductible pour analyser tous les trois principales fonctions des récepteurs P2X7 à l’aide d’une machine. Cytométrie en flux de cellules vivantes résolue dans le temps permettant l’analyse de l’ensemble de la population et fournit au chercheur de renseignements sur la cinétique de l’influx calcique, la formation de pores, et/ou fonction phagocytaire. En outre, cytométrie permet facilement comme une méthode d’évaluation des modèles d’expression de marqueurs et analyse de la population basée sur les niveaux d’expression de taille ou de protéines cellulaires.
Dans le cadre de ces expériences, différence d’influx calcique maximale, l’absorption d’éthidium ou taux de phagocytose peut être observée entre répétitions. Pour cela, la taille de la sphère, minimiser les conditions de culture et alimentation régime doit être respectée, comme la santé des cellules auront un impact significatif sur les résultats obtenus. Le temps sur la glace peut également influencer les données, donc s’assurer que tout est préparé en avance afin que le temps sur la glace est minime. Veiller à ce que le colorant indicateur de calcium temps de chargement est conforme. Un autre facteur qui peut mener à grandes contradictions dans les enregistrements de calcium maximale est la variation entre les lots de l’ATP. La préparation des stocks d’ATP est cruciale, et l’utilisation de lots différents pour les mêmes expériences devrait être évitée. Est également recommandé de comparer les anciens et les nouveaux lots pour garantir que l’ATP est cohérente. L’efficacité de P2X7 antagonistes peut également être dépendant de lignée cellulaire et lot, donc l’optimisation du temps d’incubation et les concentrations peut-être être nécessaire.
Il est à noter qu’afflux/flux calcique est une des fonctions cellulaires plus fondamentales et complexes et peut être médiée par les récepteurs beaucoup. L’influx de calcium induite par l’ATP, comme une mesure classique pour fonction de canal/pore P2X7, ne reflètent pas fidèlement la véritable fonction des récepteurs P2X7, comme l’ATP peut également activer les récepteurs P2Y pour libérer le calcium intracellulaire. Dans ce cas, le baryum peut être un cation mieux à utiliser au lieu du calcium comme son afflux est unidirectionnel16. Pour différencier la contribution des récepteurs P2Y à l’influx de calcium, des conditions où l’EDTA 1 mM ou éthylène glycol-bis(β-aminoethyl ether)-N, N, N′, N′-tétraacétique (EGTA) est ajouté au milieu K+ au lieu de CaCl2 peuvent être utilisées dans ce dosage.
Ce protocole peut également être facilement adapté aux autres types de cellules et peut être utile pour étudier la fonctionnalité de récepteurs de canal ionique de rechange ou de récepteurs qui participent à la phagocytose. Cette méthode peut également être adaptée à une machine de cytométrie de flux sans un module temps. À titre d’exemple, phagocytose des essais peuvent être effectués où des perles de YG sont ajoutés 7 à 8 min avant l’analyse par cytométrie en flux classiques. Garder les cellules à 37 ° C et agiter continuellement leur. Cela ne fournira pas d’informations en temps réel, mais des différences dans la fluorescence finale moyenne informera toujours le chercheur concernant la fonctionnalité des récepteurs P2X7.
Intérêt pour les récepteurs P2X7 car un médicament cible21,22 , ou même comme une livraison de drogue itinéraire23,24 est en pleine croissance, et donc les méthodes pour étudier ce récepteur énigmatique doivent être en permanence adapté et amélioré à faciliter ces études. Ce protocole décrit les méthodes qui peuvent être utilisés pour explorer la fonction P2X7 chez des cellules progénitrices neurales adultes, et il est à espérer que parvenir à une meilleure compréhension des récepteurs P2X7 dans les niches neurogènes peut conduire à des progrès dans le traitement des accidents vasculaires cérébraux et autres lésions ischémiques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs aimeraient remercier Maria Kasherman et Xin Huang pour leur contribution à cette recherche. Ce travail a été soutenu par des subventions de la fondation de recherche médicale Rebecca L. Cooper à M.W., T.C.L. et M.L. et à T.C.L. de la National Health and Medical Research Council (NHMRC) de l’Australie (571100 et 1048082) et la fondation de bienfaisance de Baxter ( Sydney, Australie). B.G. a été soutenue par l’Australian Research Council (ARC) avenir Fellowship (FT120100581), subventions de projet du NHMRC (1048082, 1061419 et 1120095) et Infrastructure opérationnelle subvention du gouvernement victorien à l’Institut de Florey. M.L. a été soutenu par une bourse postdoctorale du Charles D. Kelman, M.D. (2010) de l’International rétinienne Research Foundation (USA).
matériels
| Name | Company | Catalog Number | Comments |
| A438079 | Tocris | 2972/10 | |
| ATP | Sigma-Aldrich | A2383 | |
| AZ10606120 | Tocris | 3323/10 | |
| bzATP | Sigma-Aldrich | B6396 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| FACSCalibur | Becton Dickinson | ||
| Fluo-8AM | AAT-Bioquest | 21080 | Fluo-4AM and Fura-Red AM have also been used successfully |
| Fluoresbrite YG Microspheres | Polysciences Inc | 17154-10 | 1.00 µm, yellow-green |
| Glutamine | ThermoFisher Scientific | 25030081 | 200 mM |
| HBSS | ThermoFisher Scientific | 14170112 | |
| Heparin | Sigma-Aldrich | H3149 | |
| NeuroCult Basal Medium | Stemcell Technologies | 5700 | Mouse and rat |
| NeuroCult Proliferation Supplement | Stemcell Technologies | 5701 | Mouse and rat |
| Oxidized ATP | Sigma-Aldrich | A6779 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | pluronic acid |
| Recombinant Murine EGF | Peprotech | 315-09 | |
| Recombinant Murine FGF-basic | Peprotech | 450-33 | |
| Tetramethylammonium Hydroxide | Sigma-Aldrich | T7505 | |
| Time Zero Module | Cytek Biosciences | ||
| Tissue culture flasks | BD Falcon (Corning) | 353108 (T25), 353136 (T75) | Blue vented screw cap |
| TrypLE Express | Gibco | 12604013 | |
| Trypsin-EDTA (0.25%) | ThermoFisher Scientific | 25200056 | with phenol red |
| UltraPure Ethidium Bromide | ThermoFisher Scientific | 15585011 | 10 mg/mL |
Références
- Sperlagh, B., Illes, P. P2X7 receptor: an emerging target in central nervous system diseases. Trends in Pharmacological Sciences. 35 (10), 537-547 (2014).
- Liang, X., et al. Quantifying Ca2+ current and permeability in ATP-gated P2X7 receptors. Journal of Biological Chemistry. 290 (12), 7930-7942 (2015).
- Rat, P., Olivier, E., Tanter, C., Wakx, A., Dutot, M. A fast and reproducible cell- and 96-well plate-based method for the evaluation of P2X7 receptor activation using YO-PRO-1 fluorescent dye. Journal of Biological Methods. 4 (1), 64(2017).
- Gu, B. J., et al. A quantitative method for measuring innate phagocytosis by human monocytes using real-time flow cytometry. Journal of Quantitative Cell Science: Cytometry Part A. 85 (4), 313-321 (2014).
- Jursik, C., et al. A quantitative method for routine measurement of cell surface P2X7 receptor function in leucocyte subsets by two-colour time-resolved flow cytometry. Journal of Immunological Methods. 325 (1-2), 67-77 (2007).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272 (5262), 735-738 (1996).
- Delarasse, C., et al. Neural progenitor cell death is induced by extracellular ATP via ligation of P2X7 receptor. Journal of Neurochemistry. 109 (3), 846-857 (2009).
- North, R. A. Molecular physiology of P2X receptors. Physiological Reviews. 82 (4), 1013-1067 (2002).
- Leeson, H. C., et al. P2X7 Receptors Regulate Phagocytosis and Proliferation in Adult Hippocampal and SVZ Neural Progenitor Cells: Implications for Inflammation in Neurogenesis. Stem Cells. , (2018).
- Glaser, T., et al. Modulation of mouse embryonic stem cell proliferation and neural differentiation by the P2X7 receptor. PLoS One. 9 (5), e96281(2014).
- Papp, L., Vizi, E. S., Sperlagh, B. Lack of ATP-evoked GABA and glutamate release in the hippocampus of P2X7 receptor-/- mice. Neuroreport. 15 (15), 2387-2391 (2004).
- Wiley, J. S., Gu, B. J. A new role for the P2X7 receptor: a scavenger receptor for bacteria and apoptotic cells in the absence of serum and extracellular ATP. Purinergic Signalling. 8 (3), 579-586 (2012).
- Lovelace, M. D., et al. P2X7 receptors mediate innate phagocytosis by human neural precursor cells and neuroblasts. Stem Cells. 33 (2), 526-541 (2015).
- Walker, T. L., Kempermann, G. One mouse, two cultures: isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of Visualized Experiments. (84), e51225(2014).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Frontiers in Neuroscience. 5, 89(2011).
- Gu, B. J., Wiley, J. S. Broad applications of mulit-colour time-resolved flow cytometry. Flow Cytometry - Recent Perspectives. , (2012).
- Cheewatrakoolpong, B., Gilchrest, H., Anthes, J. C., Greenfeder, S. Identification and characterization of splice variants of the human P2X7 ATP channel. Biochemical and Biophysical Research Communications. 332 (1), 17-27 (2005).
- Gu, B. J., Saunders, B. M., Jursik, C., Wiley, J. S. The P2X7-nonmuscle myosin membrane complex regulates phagocytosis of nonopsonized particles and bacteria by a pathway attenuated by extracellular ATP. Blood. 115 (8), 1621-1631 (2010).
- Gu, B. J., Rathsam, C., Stokes, L., McGeachie, A. B., Wiley, J. S. Extracellular ATP dissociates nonmuscle myosin from P2X(7) complex: this dissociation regulates P2X(7) pore formation. American Journal of Physiology-Cell Physiology. 297 (2), C430-C439 (2009).
- Gu, B. J., et al. P2X7 receptor-mediated scavenger activity of mononuclear phagocytes toward non-opsonized particles and apoptotic cells is inhibited by serum glycoproteins but remains active in cerebrospinal fluid. Journal of Biological Chemistry. 287 (21), 17318-17330 (2012).
- Bhattacharya, A. Recent Advances in CNS P2X7 Physiology and Pharmacology: Focus on Neuropsychiatric Disorders. Frontiers in Pharmacology. 9 (30), (2018).
- Burnstock, G., Knight, G. E. The potential of P2X7 receptors as a therapeutic target, including inflammation and tumour progression. Purinergic Signalling. 14 (1), 1-18 (2018).
- Alves, L. A., et al. Pore forming channels as a drug delivery system for photodynamic therapy in cancer associated with nanoscintillators. Oncotarget. 9 (38), 25342-25354 (2018).
- Pacheco, P. A., et al. P2X7 receptor as a novel drug delivery system to increase the entrance of hydrophilic drugs into cells during photodynamic therapy. Journal of Bioenergetics and Biomembranes. 48 (4), 397-411 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon