Method Article
使用毛细血管电泳免疫测定来寻找人类血小板肌萎缩性侧索硬化的潜在生物标志物
摘要
用于神经退行性疾病的基于血液的生物标志物对于实施大规模临床研究至关重要。可靠且经过验证的血液测试应需要少量样本量,以及侵入性较小的采样方法,价格合理且可重现。本文证明,高通量毛细血管电泳免疫测定符合潜在生物标志物开发标准。
摘要
毛细血管电泳免疫测定(CEI),也称为毛细血管西方技术,正在成为临床试验中筛选疾病相关蛋白质和药物的一种选择方法。可重复性、灵敏度、小样品体积要求、同一样品中多个蛋白质标签的多路复用抗体、可分析多达 24 个单独样品的自动化高通量能力,以及短时间要求,使 CEI优于经典的西方斑点免疫测定。这种方法有一些局限性,例如无法使用梯度凝胶(4%~20%)基质、高背景、未精制生物样品以及个别试剂的商业不可用。本文介绍了一种在多重测定设置下运行CEI、在一个检测板中优化蛋白质浓度和初级抗体滴定以及提供用户友好的样品制备模板的有效方法。还介绍了测量板状溶酶酸细胞醇中的泛TDP-43和磷酸化TDP-43衍生物的方法,作为神经退行性疾病基于血液的生物标志物开发倡议的一部分。
引言
此处描述的CEI的总体目标是为分析人血小板中的目标蛋白提供更新的逐步方案。在人类神经退行性疾病(如阿尔茨海默氏病(AD)、肌萎缩性侧索硬化症(ALS)、前额叶巴等生物标志物发育领域,基于血液的签名分子的分配是最重要的任务之一。退化 (FTLD),帕金森病 (PD),包含体肌炎 (IBM), 和其他蛋白质聚集相关的病理条件.在大量血液中检测微量此类特征蛋白,并带有许多干扰剂是一项挑战。因此,所选方法的特异性、灵敏度、处理大量样品的能力以及可重复性至关重要。
人类血小板可以作为一个环境来识别和分配潜在的生物标志蛋白的神经退行性疾病。血小板提供了作为代理主细胞模型的机会,该模型反映了神经元细胞1、2、3的某些特征。有一些特性使血小板成为分析生物标志物候选蛋白及其化学衍生物的首选方法之一。首先,通过从献血者(即静脉穿刺)或从社区血库大量采集血液,可以使用侵入性较低的方法轻松获得血小板。其次,在设备简约的实验室4、5中,只需极少的准备工作,就可以轻松从全血中分离出来。第三,血小板没有核;因此,它们是研究代谢变化的一个很好的模型细胞,没有转录调节。第四,对血小板的生物分子含量进行封装;因此,血小板微环境保护其内容物免受血清干扰物质(即蛋白酶)。第五,富含血小板的血浆可在室温下储存7~8天,而不会失去代谢活性。因此,血小板提供了一个工作模型,其中外部因素最小化和控制。
传统的免疫测定技术,如免疫印迹(例如,西方印迹)和酶连结免疫吸附测定(ELISA)在特定蛋白质分析中应用更为广泛。然而,这两种方法有几个缺点,包括多个检测步骤、危险化学品和试剂的需求、大样本大小、检测可重复性问题以及运行间数据变异性。这促使人们开发一种方法,该方法简单,步骤更少,在相对较短的时期内可以实现。虽然传统的西方污点技术仍将是一种流行的实验室方法,但其多步骤程序、供应、有毒废物(即丙烯酰胺、甲醇等)和测定时间在进行高通量定量时越来越不受欢迎。蛋白质分析。
自动化CEI方法正逐渐成为进行高通量蛋白测定6的实验室的首选方法。CEI 消除了对凝胶、凝胶电泳装置、膜、电泳和电转移装置以及更多物理处理的需求。如果设计良好,CEI 测定应在大约 3.5 小时内完成,包括定量数据分析、出版物质量电表图和带统计分析的图形。CEI系统的另一个优势是要求蛋白质浓度降低10x~20倍,是临床试验7、8中用于人体样品的理想选择。
CEI 最关键的部分是优化从不同供应商购买的每个抗体的测定条件、抗体类型(单克隆与多克隆)、最佳蛋白质浓度、样品制备、样品变性温度以及施加在毛细血管上的电泳电压。我们为CEI开发了单一检测格式优化方法,该方法应在任何新的检测之前实现,这将节省时间和资源。之后,对转活反应DNA/RNA结合蛋白(TARDP)的总量和磷酸化衍生物进行自动定量评估。由于其大小(43 kDa),首字母缩写TDP-43将在本文中使用。在这里,从ALS患者获得的人类血小板解结物中的TDP-43蛋白被评估,以帮助开发预测磷酸化值(PPV)作为潜在的预后生物标志物。
TDP-43 是 ALS 的新的潜在疾病生物标志物候选物。TDP-43是所有核细胞中无所不在的蛋白质;因此,TDP-43在各种正常细胞事件和神经退行性疾病中的功能已被调查为9,10,11,12,13,14。虽然TDP-43是核蛋白15,但由于存在核定位和核输出序列16、17、18、19,它有能力在核和细胞质之间穿梭。细胞质TDP-43参与各种细胞事件,如mRNA稳定性和传输,应激反应,线粒体功能,自噬体20。然而,除了参与神经退行性疾病的发病机制外,对TDP-43磷酸化衍生物的作用知之甚少。
该协议说明了如何利用CEI方法优化测定条件,分析TDP-43及其磷酸化衍生物在血小板中的含量。由于磷酸化TDP-43尚未上市,因此建议使用预测磷酸化值(PPV)来评估ALS患者的TDP-43型材。此 CEI 系统采用少量样品混合物(每个毛细管 2.5±3.0 μL)。根据制造商的协议,每个毛细管的总测定量设置为 8.0 μL;因此,研究人员可以利用一个样品混合物制备两个单独的运行。制造商设计了测定协议,以便将任何移液错误降至最低(如果不是完全消除的话)。24个单独的人血小板裂解剂样品混合物被分成半体积(即,每个样品2.5~3.0 μL),并在±7小时内通过两种不同的抗体连续分析。此处描述的 CEI 系统提供了理想的高通量测定模式。在进行大规模筛选之前,用户需要测试来自不同供应商的抗体和靶蛋白的样品制备方式。
研究方案
所有有关人类血小板处理的协议都遵循堪萨斯大学医学中心和堪萨斯城医学和生物科学大学IRB委员会的指导方针。
1. 制备缓冲液和试剂
注:根据制造商的指南准备所有样品。在此过程中,请佩戴个人防护设备(实验室外套、手套和护目镜)。
- 通过组合 0.941 g 蔗糖(11 mM 最终浓度)、6.4 m L 的 5 M NaCl(128 mM 最终),5.4 mL 的 0.2 M NaH 2 PO4(4.3m)制备青石洗涤缓冲液 M 决赛,9.4 mL 0.2 M Na2PHO4 (7.5 mM 决赛),0.352 g 柠檬酸钠 (4.8 mM 决赛), 和 0.115 g 柠檬酸 (2.4 mM 决赛)。通过 0.45 μm 滤波器磁盘将总音量调整到 250 mL,使用 ddH2O. 过滤器,并将 pH 调整到 6.5。在 4°C 下储存长达 1 年。使用前将溶液室温(RT)用于22。
- 在 100 mL 最终体积中组合 250 mM 蔗糖、1 mM EDTA 和 10 mM Tris-Cl (pH 7.4) 来准备破裂缓冲液。在 4°C 下储存长达 1 年。加入2μL磷酸酶抑制剂鸡尾酒(1:1000最终)和1μL蛋白酶抑制剂鸡尾酒(1:2000最终)到2mL的破裂缓冲液。保持冰上,直到使用。丢弃未使用的破裂缓冲液。
2. 血小板隔离
- 在含酸-柠檬酸-葡萄糖(ACD)溶液(75 mM柠檬酸、124 mM葡萄糖和38 mM柠檬酸、pH = 7.4)的黄帽血液收集管中收集8~10 mL的人体血液;ACD:血 = 1:9)。用手轻轻混合管内含量 5x×6x 反转。
- 在 RT 下,在摆动铲斗转子中以 200 x g的托管离心 20 分钟。
- 将富含血小板的等离子体 (PRP) (±3⁄4 mL) 收集到 15 mL 锥形底管中,并从布漆(看起来朦胧的馏分)中保留约 0.5 mL 的 PRP,以避免污染。如果发生任何红细胞污染,请重复此步骤。
- 在 RT 处将 PRP 样品在 1,200 x g下离心 15 分钟。
- 在 1 mL 的锡酸盐洗涤缓冲液中温和再悬浮液,在 1,200 x g下离心,在 RT 处轻轻重新悬浮 15 分钟,从而洗净血小板颗粒 (P1)。
- 保存纯血小板颗粒。丢弃上清液。
- 在含有抑制剂鸡尾酒的破裂缓冲液的600μL中重新悬浮血小板颗粒。
- 使用声波器对血小板悬浮液进行声波。将样品放入迷你冰桶中。在连续模式下将声波器设置为设置为 20 s 的 3。
注:确保用10%漂白剂清洁探头,然后用蒸馏水清洁探头。 - 在20,000 x g下将声波样品在4°C下离心30分钟,以去除膜状分数。在 60 μL 中与压质超生,并储存在 -80°C。避免血小板细胞分馏的重复解冻/冻结循环。
3. 中欧国际会议的筹备工作
注:100 μL的人类血小板莱沙(由ALS患者(n = 8+10)组合,健康受试者(n = 8~10)分别汇集并用于测定优化。
- 填写CEI布局的内部生成的模板(表1)和样品制备(表2)。样品混合物制备表是动态的,将自动计算需要从源中移除多少体积。
注: 当在动态表-2 中输入所需源卷时,将自动计算 0.1 X 采样缓冲区卷。 - 预贴标 25 0.2 mL PCR 管,带毛细管#1#25并将其放入 PCR 机架中。放在冰上
- 预贴标签 0.6 mL 微离心管:一个用于每个初级抗体和稀释(如果需要),一个用于 0.1x 样品缓冲液,一个用于灯具-S/过氧化物,一个用于稀释每个样品(如果需要)。把它们放在管架上的冰上。
- 拿出 CEI 分离 12-230 kDa 主套件分离模块中提供的样品缓冲液、洗涤缓冲液、一个板和墨盒。
- 从4°C冰箱中,拿出抗体稀释缓冲液、原发抗体、二级抗体、灯具、过氧化氢和标准包装。将所有试剂放在冰上,标准包装除外,该试剂盒仍保留在 RT 处。
注:标准包装中的试剂通过冻干,用铝箔盖密封。在打开之前,应使用微型离心机短暂旋转,以减少产品损失。要打开,试剂管可以由移液器尖端穿孔或从角落拉回来。 - 要准备 400 mM DTT,在含有 DTT 的透明管中加入 40 μL 的去离子水。
- 要制备 40 μL 的荧光 5x 主混合,将 10x 样品缓冲液的 20 μL 和制备的 400 mM DTT 溶液的 20 μL 添加到套件中提供的粉红色管中。
- 要制备生物浸化梯,在试剂盒中提供的白色管中加入16 μL的去离子水、2 μL的10x样品缓冲液和2μL制备的400 mM DTT溶液。轻轻混合并转移到 0.2 mL PCR 管中进行变性。
- 在0.6 mL微离心管中加入1.5μL的10x样品缓冲液和148.5μL的去离子水,制备0.1x样品缓冲液。漩涡混合并放置在冰上。
- 准备所需的抗体稀释。在每个预标记的微离心管中加入抗体稀释剂。如果体积相同,请使用反向移液技术23;如果没有,在点胶前先先冲洗移液器尖端。
注:在此测定中,使用a-TDP-43泛抗体和a-p(S409/410-2)TDP-43抗体。抗ERK抗体用于内部控制,以确保测定成分工作。 - 执行抗体稀释的反向移液,如下所述。或者,可以在文献24中找到其他信息。
注:在分配小序体积溶液23时,首选反向移液技术。该技术具有一些优点:(i) 提供精确的体积,(ii) 消除尖端孔中的试剂发泡,以及 (iii) 小体积 (<5 μL) 试剂、粘性溶液、表面活性剂溶液和高蒸汽压力溶液的理想选择。- 将适当的吸头放入移液器中,并将柱塞向下压到第二个停止(步骤 2)。将移液头浸入溶液中几毫米。缓慢松开柱塞,在吸头仍浸入溶液中时,用溶液填充移液器尖端。从溶液中取出尖端,轻轻触摸试剂储液罐的边缘,以便去除尖端外侧残留的多余液体。
- 将柱塞向下按至第一个停止(步骤-1),分配溶液。请勿在尖端中分配剩余的溶液。
- 将柱塞压到第二个停止(步骤-2),将尖端中的剩余溶液倒入试剂盒。将柱塞释放到下一个移液步骤的准备位置。
- 将所需的抗体加入指定至每个预标记微离心管(表1)的体积中,不要预冲洗移液头:将其直接添加到稀释剂中,并多次冲洗尖端以去除抗体。把管子放在冰上。
- 要准备 CEI 样品混合,请执行下面列出的 PCR 管的步骤,这些步骤标记为 Cap_2 到 cap_25:其顺序与表1所示的顺序相同。
- 打开所有管,使用反向移液技术向每根管中加入1.6 μL等分荧光5倍样品缓冲液,然后在添加5x缓冲液时关闭每个PCR管,以尽量减少样品损失。
- 打开所有管,将表 2中指定的体积中的 0.1 倍样品缓冲液添加到每个管中,然后立即关闭。如果卷相同,请使用反向移液技术。如果没有,在分配 0.1x 样品缓冲液之前,先先冲洗移液器尖端。
- 打开所有管,将表2中指定的体积中的蛋白质样品添加到每个管中,然后立即关闭。如果卷相同,请使用反向移液技术。如果没有,在分配 0.1x 样品缓冲液之前,先先冲洗移液器尖端。
- 在台式离心机(13,000 x g 为 30 s)中短暂离心所有 PCR 管(13,000 x g,30 s),轻弹/旋涡 PCR 管进行混合,然后重复离心。
- 将所有 PCR 管转移到带加热盖的热循环器中。在规定温度和持续时间下变性样品(即 95 °C 5 分钟;70°C 10 分钟)。
注:变性温度和持续时间需要针对目标蛋白进行优化。 - 重复步骤 3.12.4。
- 将所有 PCR 管返回到管架并放在冰上。
- 在变性步骤中,制备开发溶液(1:1氧化铝-S:过氧化物溶液),然后加入200μL的氧化铝-S和200μL的过氧化物。放在冰上。
- 要装载带有上述样品的CEI预填充板,将试剂和样品分配到测定布局所示的检测板中(图1)。避免引入气泡。
注:如果体积和溶液相同,请使用反向移液技术。如果没有,在点胶前预先冲洗移液器尖端,不要使用移液器上的第二个卡舌止步将剩余液吸头排入板孔。12*230 kDa 分离模块可能包含颜色编码的板加载导板。将本指南放在板下,同时向井中添加试剂和样品,这在样品装载时在视觉上很有帮助。板加载指南也可以从公司网站下载。- 在E排中,在每个井中加入15μL的发光醇:过氧化物混合物。
注意:理想情况下,在使用前准备此试剂,并添加到每个井中。如果不方便,此混合物可在板加载前不超过 30 分钟准备。 - 在 D 行中,要井 D1,添加 10 μL 的链球菌-HRP。
- 在D行中,到D2_D25井中,添加10μL的指定二级抗体。
- 在B排,每口井添加10μL的抗体稀释剂。
- 在C行中,要井C1,添加10μL的抗体稀释剂。
- 在C排,到井C2+C25,添加10μL的指定原抗体。
- 在A排,为了井A1,从PCR管#1添加5μL的生物浸酯梯。
- 在A排,为了油井A2_A25,添加3μL的样品,PCR管#2+#25到相应的井#2#25。
- 在每个指定的洗涤缓冲液中加入500μL的洗涤缓冲液。
- 在 RT 处,在 1,000 x g下将板离心 5 分钟。
- 在E排中,在每个井中加入15μL的发光醇:过氧化物混合物。
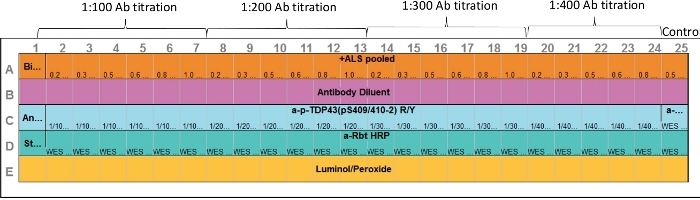
图 1:测定布局。主抗体和目标蛋白样品优化可在一次测定中进行。毛细管 2⁄7、8*13、14*19 和 20*24 代表各种蛋白质浓度和原发抗体范围。毛细管 25 表示正控制。使用抗ERK抗体;但是,可以包括任何适当的正控制。请点击此处查看此图的较大版本。
4. 在 1 板上执行 CEI
- 首先,打开CEI(材料表)分析仪,然后打开计算机。打开软件 (材料表)
- 将分析仪连接到联机系统 (材料表)。这是为故障排除和数据恢复收集运行数据的必要步骤。
- 单击左上角菜单中的"乐器",然后单击"连接"。选择显示为弹出式菜单的仪器序列号。单击"连接"。
- 选择""Assay"选项卡并选择"新"或选择保存的模板。
- 输入测定参数 (表 1) 或修改模板当前.保存文件名和位置。
- 确保分析器中闪烁的蓝色指示器保持稳定蓝色。
- 触摸橙色门顶部的银色金属按钮以打开。
- 小心地从包装中取出毛细管盒。如制造商协议所述,插入毛细管盒。如果安装正确,内部指示灯将变为"蓝色"。
- 从测定板上拆下保护密封。目视观察预填充的井有气泡。如果观察到,用小移液头弹出它们(长轴 P10 移液器尖端工作良好)。
- 放置测定板并关闭门,以装载板支架。在计算机中,单击"开始"按钮。
- 将含有温度敏感试剂和样品的冰盘置于4°C的黑暗中,直到准备好准备第二个预填充板。
- 将试剂/供应品放在室温下,用于第二个板。
5. 在 2 板上执行 CEI
注:此板用于分析磷酸化 TDP-43 水平。
- 取出储存在 4°C 下的冰盘,并将其放在工作台上,比第一个板的估计完成时间长 1 小时。取回第二个板和墨盒。
- 准备第二次跑步所需的任何抗体稀释液,并将其储存在冰上。准备新鲜的 1:1 发光-S:过氧化物溶液(上文步骤 3.12.8)。
- 重新混合并短暂重新分离装载预填充板所需的样品混合物和试剂。根据图 1加载第二个板。在 C 排井中加载 a-p(S409-410-2)TDP-43 抗体溶液。
- 第一次运行完成后,丢弃第一个板和墨盒。取出墨盒,放入锐化容器中进行处理。将贴纸从板和墨盒中保留,以便参考。
- 关闭软件文件并重新选择同一模板。软件将记住上一次运行中的设置。根据需要对注释进行任何更改(即更改原抗体)。
- 重复步骤 4.8~4.10。收起所有 12*230 kDa 主套件分离模块试剂和耗材
- 根据大学规定,丢弃CEI样品混合物、抗体稀释、0.1倍样品缓冲液和明醇-S:过氧化物混合物。
6. 数据分析
- 运行完成后,确保执行以下质量检查。
- 在软件中,选择"显示标准"图标和图形视图选项卡。检查所有 25 个毛细血管,了解峰值对齐与内部荧光标记大小。通过选择"强制标准"或右键单击不正确的峰值,然后选择"非标准"来纠正错位。对每个新毛细管执行此检查。
- 单击"示例"和"单视图"图标。在实验选项卡中选择毛细管#1(生物酸酯梯),查看与分子量标记的峰值对齐。如果软件对峰值的选数不正确,请单击图形视图中的峰值并选择"删除峰值"。
注: 例如,12-230 KDa 生物仿当梯将显示 12 kDa、40 kDa、66 kDa、116 kDa、180 kDa 和 230 kDa 时大小峰值。如果不执行此步骤,则采样峰值的尺寸大小将不正确,并会产生不准确的结果。 - 查看电泳短片,并注意运行过程中是否发生异常迁移。
- 派生数据(例如,峰值表,包括分子量、峰值面积、峰值高度和信噪 [S/N]),以便进一步计算。图形注释工具位于图形窗口的右上角,用于提供有关图形的详细信息。
结果
血小板细胞蛋白浓度和原发抗体滴定优化
在测定中建立血小板细胞蛋白的线性动态范围非常重要,因为信号的变化与血小板细胞醇中蛋白质的变化成正比。在测定中使用整个血小板变脂混合物可降低靶蛋白(TDP-43和P(S409-412)TDP-43的信号强度,并有助于产生高背景信号。因此,在此测定中,在血小板破裂后使用了透明上清液(细胞分段)(图2)。
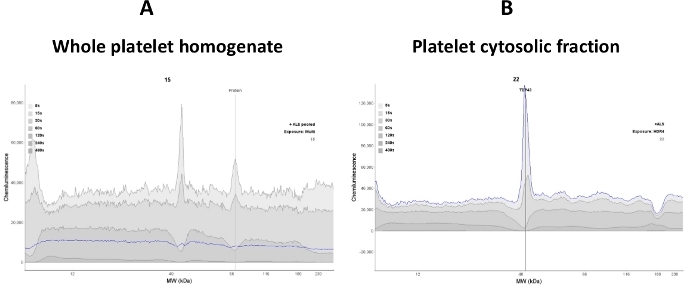
图 2:信号清晰度取决于样品质量。(A) 全血小板解结物均质干扰抗TDP-43抗体结合;因此,观察到一个嘈杂的电图。(B) 血小板细胞分体是使整个莱糖离心(16,000 x g为30分钟)而获得的。大多数膜蛋白被去除;因此,抗TDP-43抗体结合TDP-43蛋白增强(蓝线痕迹)。请点击此处查看此图的较大版本。
血小板细胞醇蛋白浓度的线性动态范围为0.2~0.8mg/mL。采用测定模板,使蛋白质浓度和原发抗体滴定都能在一次测定中进行(图3)。
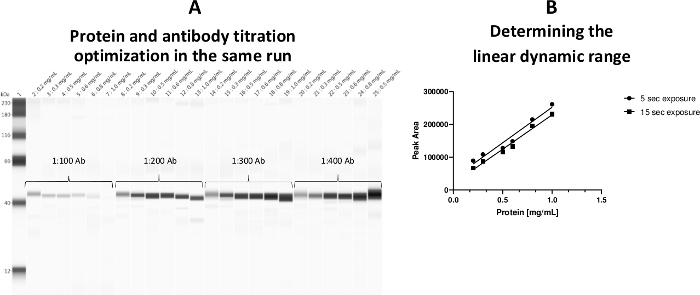
图3:血小板细胞醇蛋白浓度的线性动态范围。(A) 在同一运行期间,蛋白质浓度和抗体定位在一个板中进行了优化。(B) 蛋白质的线性工作范围(0.2~0.8mg/mL)已建立。a-ERK 抗体将 0.5 mg/mL 蛋白质负载标记为正对照(毛细管 25)。请点击此处查看此图的较大版本。
需要注意的是,样品制备管中的甘油含量应小于20%(最终),否则高甘油浓度会对原抗体结合产生不利影响。
确定最佳曝光时间
在旧版本的软件中,必须根据蛋白质浓度(mg/mL)绘制峰值区域来确定最佳暴露时间。新版本提供了一个名为高动态范围 (HDR) 检测配置文件的新工具 (图 4)。使用图像面板提供了一起查看所有曝光时间(即 5 s、15 s、30 s、60 s、120 s、240 s、480 s)的选项。计算机软件分析所有暴露时间,并自动识别最佳暴露时间 (HDR)。由于 CEI 的灵敏度更高,HDR 检测配置文件提供了更宽得多的动态范围,这意味着在更大的样品浓度范围内更好地检测和定量。但是,用户仍可以选择满足实验目标的任何曝光时间。利用此功能,发现TDP-43蛋白的最佳暴露时间。峰值表示最佳暴露时间(图4A)。在审查了所有9次暴露时间(图4B)后,为该抗体定义了一次单次暴露时间(4 s)。

图4:目标蛋白的高动态范围(HDR)检测配置文件。(A) TDP-43 蛋白峰值代表目标蛋白的最佳暴露时间.a-TDP-43 Ab 滴定为1:300,血小板细胞醇蛋白浓度为0.5mg/mL。软件定义的蓝线表示最佳曝光时间。(B) 此图表示用户定义的单次暴露时间(4 s),在查看所有九次暴露时间后,范围为1至512s。请点击此处查看该图的较大版本。
ALS患者人血小板细胞醇中的TDP-43水平
进行了血基生物标志物开发。使用优化的测定条件,使用两组抗体(即抗TDP-43[Pan]抗体,一种识别TDP-43蛋白磷酸化衍生物的抗体)对从ALS患者获得的血小板解毒细胞分量进行了分析;这里使用了a-P[S409/410-2]TDP-43)。在本演示中,介绍了疾病特异性TDP-43及其磷酸化衍生物(图5)。
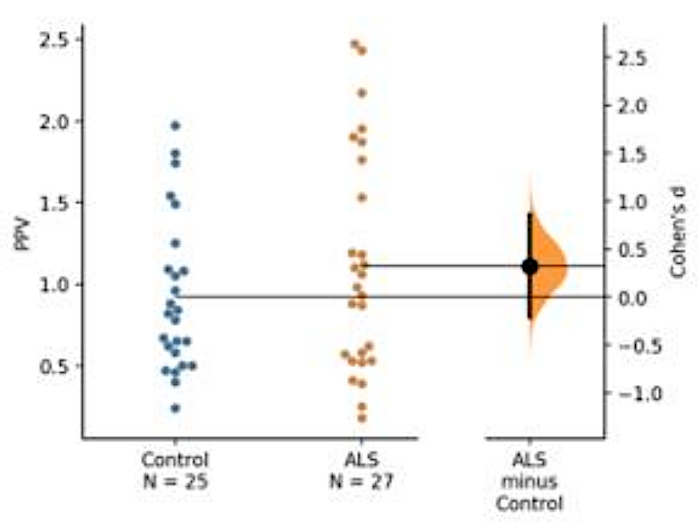
图5:TDP-43预测磷酸化值(PPV)的表示形式。单单磷酸化TDP-43和泛TDP-43的绝对量在ALS和对照组之间没有太大的差别。然而,PPV表明ALS组别略有增加,尽管由于受试者数量不足,两组之间没有统计差异(ALS = 25,对照=27)。由于样本量较小(控制 = 25,ALS = 27),ALS 和对照组之间的低 Cohen d 值显示两组之间的效应大小较低。请点击此处查看此图的较大版本。
使用校准曲线对 TDP-43 总计进行量化 (图 6)

图 6:标准校准曲线。商业购买的重组TDP-43蛋白质浓度用于构建标准曲线。每个数据表示三元数的平均值。蛋白质带强度取决于浓度(内分)。请点击此处查看此图的较大版本。
由于这种蛋白质在商业上不可用,因此无法定量磷酸化TDP-43蛋白。相反,建立了一个预测的磷酸化值(PPV),该值定义了TDP-43磷酸化物种的百分比。PPV 是使用以下方程从同一样本的两个连续CEI测定中确定的。

在集合的人类ALS血小板细胞分馏中测试了运行内和运行间测定变异性(图7)
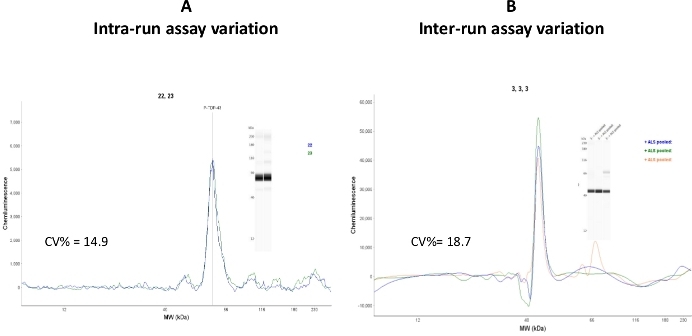
图 7:测定变体。(A) CEI 对装有同一样本的两个毛细血管进行了分析,运行内测定变异计算为 CV% = 14.9。(B) 同一样本在三个不同的测定日和三个不同的测定运行中进行分析。运行间测定变异计算为 CV% = 18.7。请点击此处查看此图的较大版本。
尽管运行内(毛细管到毛细管变异)系数变化值在可接受的范围内(CV% = 14.9),但运行间测定值相对较高(CV% = 18.7)。据解释,这种变化可能是由于使用毛细管盒和来自不同批次的样品板。建议在具有相同批号的 CEI 组件中执行可重复性研究。
表1:CEI测定板加载模板。请点击此处下载此表。
表2:交互式样品混合物制备模板。从未知样品输入库存蛋白浓度后,交互式细胞将自动计算准备样品混合物需要多少体积。请点击此处下载此表。
讨论
毛细血管电泳免疫测定是目前高通量样品分析和药物筛选的首选方法25。小样本量、优化良好的检测组件、用户友好的测定平台和仪器、试剂支出和低CV百分比是主要优势26,27。虽然有几种方法可以分离不同测定方式的蛋白质,但此处描述的基于抗体的CEI可以由从事血液生物标志物开发的小型实验室进行改造。此处使用的CEI测定技术为TDP-4328及其磷酸化导数5提供可靠、可重复和灵敏的测量。
CEI 系统还提供多路复用选择,可同时分析 TDP-43 及其磷酸化衍生物,并提供目标蛋白的直接定量(如果可用)纯化或重组靶蛋白。全长重组TDP-43蛋白市售;然而,重组磷酸化TDP-43导数不是。由于磷酸化TDP-43尚未上市,因此实施了预测磷酸化值(PPV),以评估ALS患者的TDP-43特征。Pan TDP-43 和磷酸化 TDP-43 量永久贴上荧光剂标签;因此,TDP-43 型材与定量单位(即 ng/mL、pg/mL 等)保持相同。虽然确定TDP-43及其磷酸化衍生物的绝对量(即P[S409-410-12]TDP-43)提供了更定量的测量,但计算PPV消除了重组磷酸化TDP-43标准化的必要性,因为它没有商业上。
CEI 在测定平台中提供了多个检查点,以在测定失败的情况下准确识别问题。这消除了障碍,并提供了更好的实验设计。除填充样品板外,检测过程是完全自动化的。与标准的西方印迹分析相比,这是一个重要特征。此功能提供从运行到运行的一致性。尽管每个实验室都有独特的标准操作程序,但坚持将人为错误降至最低的做法非常重要。例如,在板加载之前制备明醇-S/过氧化物混合物至关重要,因为向灯具中加入过氧化物会启动酶反应并消耗灯具基质。在没有气泡的情况下将样品和初级/二级抗体装载到板孔中也是至关重要的步骤。
此外,由于板井体积小,井之间没有空间,用户在移液时应谨慎,这是最重要的一步,因为其他所有工作都是自动化的。样品、抗体和其他试剂的加载顺序对测定的一致性非常重要(图1)。板制备过程大约需要 40–45 分钟。因此,建议首先使用所需的测定成分装载板材,并在移液前制备明醇-S/过氧化物混合物。这样,有一个一致的试剂添加序列,并将达到一致的发光信号强度。不建议使用过期的明醇-S/过氧化物试剂,因为它主要影响过氧化物的强度。最近,在引入分缓冲器系统(包括化学和洗涤剂兼容性范围)方面的进展提高了测定质量,并产生了更可重复和可预测的结果。现在,来自同一制造商的新型组合分析仪具有分析同一运行中标有化学发光和荧光结合抗体的样品的功能。此新功能无需连续运行两个单独的板,并消除了运行到运行的变化。
检测板应储存在环境温度下。如果选择将检测板保存在 4°C 的冰箱中,则必须在测定前一天晚上取出测试板并带到环境温度。在添加正确的样品之前,需要用试剂盒中提供的缓冲液广泛(4⁄5次)清洗未正确加载的样品井。每种原抗体和生物样本都是独特的;因此,在分析生物流体中目标蛋白的样品之前,应先进行抗体/蛋白质优化。
在这里,主抗体的孵育时间被设定为30分钟默认。如果信号较弱,用户应考虑增加原抗体孵育时间,直到达到所需的信号强度,而不会产生荧光信号烧坏。对于人类血小板,从患者的池样本准备,并用于优化测定。样品池更好地表示目标生物分子之间的变异。建议对CEI使用透明上生物,而不是完全的液化或完全均质。
全血小板酶酸混合物中蛋白质的高浓度可能会降低信噪比(图2)。应避免样品的重复冻-冻循环,因为这将对原抗体结合产生不利影响。赖沙缓冲液的成分很重要,因为有些试剂与CEI29不兼容。建议在样品制备前核对制造商网站上提供的兼容试剂列表。这是系统的限制,不允许样品制备的高严格性条件。建议使用集合样品优化测定运行参数(即原抗体稀释、蛋白质浓度、原抗体孵育时间等),以便随后分析各个样本。
披露声明
作者宣布,除了蛋白简单公司支付本手稿的出版成本外,没有相互竞争的财务利益。
致谢
这项研究是由授予A.A.的校内补助金赞助的。这项工作得到了NCATS授予堪萨斯大学前沿医学中心:心脏地带临床和转化研究所(#UL1TR606381)的CTSA资助。其内容完全由作者负责,不一定代表国家卫生研究院或国家卫生研究院的官方观点。我们感谢堪萨斯大学医学中心ALS诊所个人获得IRB批准从健康志愿者和ALS患者的血液样本采集。作者感谢埃姆雷·阿格巴斯对手稿的校对。
材料
| Name | Company | Catalog Number | Comments |
| 12-230 kDa Separation kit | ProteinSimple | SM-W004 | Contains pre-filled assay plate and 25-channel capillary cartridge |
| 3000G Thermocycler | Techne | FTC3G/02 | We used this thermocylcer for heating the sample mix |
| Anti-Mouse detection kit | ProteinSimple | 042-205 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-P(S409-410) TDP-43 antibody | ProteinTech | 22309-1-AP | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-P(S409-412) TDP-43 antibody | CosmoBio-USA | TIP-PTD-P02 | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-Rabbit detection kit | ProteinSimple | DM-001 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-TDP-43 (pan) antibody | ProteinTech | 10782-2-AP | Primary antibody that recognizes whole TDP-43 protein |
| Compass for SimpleWestern (SW) | ProteinSimple | Ver.4.0.0. | Compass for SW is the control and data analysis application for SimpleWestern instruments |
| Sonic Dismembrator; Model100 | Fisher Scientific | Sonicator. Used to rupture the cell membrane. This model is discontinued (Model XL2000-350) | |
| Table top centrifuge | Eppendorf | 22625004 | Model# 5810 with swinging plate bucket |
| Wes analyzer | ProteinSimple | 55892-WS-2203 | Performs the capillary gel electrophoresis |
参考文献
- Blair, P., Flaumenhaft, R. Platelet alpha-granules: basic biology and clinical correlates. Blood Reviews. 23 (4), 177-189 (2009).
- Mercado, C. P., Kilic, F. Molecular mechanisms of SERT in platelets: regulation of plasma serotonin levels. Molecular Interventions. 10 (4), 231-241 (2010).
- Goubau, C., et al. Regulated granule trafficking in platelets and neurons: a common molecular machinery. European Journal of Paediatric Neurology. 17 (2), 117-125 (2013).
- Basu, S. S., et al. Human platelets as a platform to monitor metabolic biomarkers using stable isotopes and LC-MS. Bioanalysis. 5 (24), 3009-3021 (2013).
- Wilhite, R., et al. Platelet phosphorylated TDP-43: an exploratory study for a peripheral surrogate biomarker development for Alzheimer's disease. Future Science OA. 3 (4), 238(2017).
- Worth, A. J., et al. LC-MS Analysis of Human Platelets as a Platform for Studying Mitochondrial Metabolism. Journal of Visualized Experiments. (110), e53941(2016).
- Statland, J. M., et al. Rasagiline for amyotrophic lateral sclerosis: A randomized, controlled trial. Muscle and Nerve. 59 (2), 201-207 (2019).
- Charytan, D. M., et al. Safety and cardiovascular efficacy of spironolactone in dialysis-dependent ESRD (SPin-D): a randomized, placebo-controlled, multiple dosage trial. Kidney International. 95 (4), 973-982 (2019).
- Ugras, S. E., Shorter, J. RNA-Binding Proteins in Amyotrophic Lateral Sclerosis and Neurodegeneration. Neurology Research International. , 432780(2012).
- Amador-Ortiz, C., et al. TDP-43 immunoreactivity in hippocampal sclerosis and Alzheimer's disease. Annal of Neurology. 61 (5), 435-445 (2007).
- Baloh, R. H. TDP-43: the relationship between protein aggregation and neurodegeneration in amyotrophic lateral sclerosis and frontotemporal lobar degeneration. FEBS Journal. 278 (19), 3539-3549 (2011).
- Buratti, E., Baralle, F. E. The molecular links between TDP-43 dysfunction and neurodegeneration. Advances in Genetics. 66, 1-34 (2009).
- Guo, W., et al. An ALS-associated mutation affecting TDP-43 enhances protein aggregation, fibril formation and neurotoxicity. Nature Structural Molecular Biology. 18 (7), 822-830 (2011).
- Geser, F., et al. Motor neuron disease clinically limited to the lower motor neuron is a diffuse TDP-43 proteinopathy. Acta Neuropathologica. 121 (4), 509-517 (2011).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Buratti, E., Baralle, F. E. TDP-43: gumming up neurons through protein-protein and protein-RNA interactions. Trends in Biochemical Sciences. 37 (6), 237-247 (2012).
- Fallini, C., Bassell, G. J., Rossoll, W. The ALS disease protein TDP-43 is actively transported in motor neuron axons and regulates axon outgrowth. Human Molecular Genetics. 21 (16), 3703-3718 (2012).
- Ayala, Y. M., et al. Structural determinants of the cellular localization and shuttling of TDP-43. Journal of Cell Sciences. 121, Pt 22 3778-3785 (2008).
- Fiesel, F. C., Kahle, P. J. TDP-43 and FUS/TLS: cellular functions and implications for neurodegeneration. FEBS Journal. 278 (19), 3550-3568 (2011).
- Birsa, N., Bentham, M. P., Fratta, P. Cytoplasmic functions of TDP-43 and FUS and their role in ALS. Seminars in Cell and Development Biology. , (2019).
- Liachko, N. F., et al. CDC7 inhibition blocks pathological TDP-43 phosphorylation and neurodegeneration. Annals of Neurology. 74 (1), 39-52 (2013).
- Qureshi, A. H., et al. Proteomic and phospho-proteomic profile of human platelets in basal, resting state: insights into integrin signaling. PLoS One. 4 (10), 7627(2009).
- Suominen, I., Koivisto, S. Increasing Precision When Pipetting Protein Samples: Assessing Reliability of the Reverse Pipetting Technique. American Laboratory. , (2011).
- Pipetting tool box for life sciences. , https://www.mt.com/us/en/home/library/guides/laboratory-division/life-science/pipetting-toolbox-for-life-sciences.html (2019).
- Hale, L. J., et al. 3D organoid-derived human glomeruli for personalised podocyte disease modelling and drug screening. Nature Communication. 9 (1), 5167(2018).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. Journal of Translational Medicine. 13, 182(2015).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Fourier, A., et al. Development of an automated capillary nano-immunoassay-Simple Western assay-to quantify total TDP43 protein in human platelet samples. Analytical and Bioanalytical Chemistry. 411 (1), 267-275 (2019).
- Compatibility, S.W.S.A.B. , https://www.proteinsimple.com/technical_library.html (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。