Method Article
인간 혈소판에서 근위축성 측삭 경화증의 잠재적인 바이오마커를 검색하기 위해 모세관 전기 영동 면역 분석사용
요약
신경 퇴행성 질환에 대한 혈액 기반 바이오 마커는 대규모 임상 연구를 구현하는 데 필수적입니다. 신뢰할 수 있고 검증된 혈액 검사는 작은 샘플 부피뿐만 아니라 덜 침습적 샘플링 방법, 저렴하고 재현성이 있어야 합니다. 이 논문은 고처리량 모세관 전기 영동 면역 분석이 잠재적인 바이오마커 개발을 위한 기준을 충족한다는 것을 보여줍니다.
초록
모세관 전기 동면 면역 분석 (CEI), 또한 모세관 서쪽 기술로 알려진, 임상 시험에서 질병 관련 단백질 및 약물을 선별하기위한 선택의 방법이되고있다. 재현성, 감도, 작은 시료 량 요구 사항, 동일한 샘플에서 다중 단백질 라벨링을 위한 다중 항체, 최대 24개의 개별 시료를 분석하는 자동화된 고처리량 능력 및 짧은 시간 요구 사항으로 CEI 고전 서양 얼룩 면역 분석보다 유리합니다. 이 방법의 몇 가지 제한이 있다, 그라데이션 젤을 활용 하는 무 능력 등 (4%-20%) 매트릭스, 정제되지 않은 생물학적 샘플이 있는 높은 배경, 개별 시약의 상업적 가용성. 이 백서는 여러 분석 설정에서 CEI를 실행하고, 하나의 분석 판에서 단백질 농도 및 1 차 항체 적정을 최적화하고, 시료 준비를 위한 사용자 친화적인 템플릿을 제공하는 효율적인 방법을 설명합니다. 또한 신경퇴행성 질환에 대한 혈액 기반 바이오마커 개발의 일환으로 혈소판 용해 시토졸에서 팬 TDP-43 및 인산화 TDP-43 유도체를 측정하는 방법이 기술되어 있다.
서문
여기에 설명된 바와 같이 CEI의 전반적인 목표는 인간 혈소판에서 표적 단백질을 분석하기 위한 업데이트된 단계별 프로토콜을 제공하는 것입니다. 혈액 기반 서명 분자의 할당은 알츠하이머 병 (AD), 근위축성 측삭 경화증 (ALS), 전두엽 과 같은 인간 신경 퇴행성 질환의 바이오 마커 개발 분야에서 가장 중요한 작업 중 하나입니다. 변성 (FTLD), 파 킨 슨 병 (PD), 포함 신체 근염 (IBM), 그리고 다른 단백질 응집 관련 병 리 조건. 많은 방해에이전트를 가진 혈액의 대량에 있는 그 같은 서명 단백질의 미량의 검출은 도전입니다. 따라서 많은 수의 샘플을 처리할 수 있는 특이성, 감도, 및 선택된 방법의 재현성이 중요합니다.
인간 혈소판은 신경 퇴행성 질환에 대한 잠재적인 바이오마커 단백질을 식별하고 할당하는 군대역할을 할 수 있다. 혈소판은 신경 세포1,2,3의일부 특징을 반영하는 대리 1 차 세포 모델로서 역할을 할 수있는 기회를 제공한다. 혈소판을 바이오마커 후보 단백질 및 이들의 화학적 유도체를 분석하는 바람직한 수단 중 하나로 만드는 특정 특징이 있다. 첫째, 혈소판은 기증자 (즉, venipuncture)에서 또는 지역 사회 혈액 은행에서 대량으로 혈액을 수집하여 덜 침습적 인 접근법을 사용하여 쉽게 획득 할 수 있습니다. 둘째, 혈소판은 최소한의 장비가 설치된 실험실4,5에서최소한의 준비 작업으로 전혈으로부터 쉽게 분리 될 수 있습니다. 셋째, 혈소판에는 핵이 없습니다. 그러므로, 그(것)들은 전사 규칙 없이 물질 대사에 있는 변경을 공부하기 위하여 좋은 모형 세포입니다. 넷째, 혈소판의 생체 분자 함량은 캡슐화; 따라서 혈소판 미세 환경은 혈청 간섭 물질 (즉, 프로테아제)으로부터 내용물보호합니다. 다섯째, 혈소판이 풍부한 혈장은 대사 활동을 잃지 않고 7-8 일 동안 실온에서 저장할 수 있습니다. 따라서 혈소판은 외부 요인을 최소화하고 제어하는 작동 모델을 제공합니다.
면역블로팅(예를 들어, 서쪽 블로팅) 및 효소 연계 면역흡착 분석법(ELISA)과 같은 전통적인 면역 분석 기술은 특정 단백질 분석에서 더 널리 사용된다. 그러나 이러한 두 가지 방법은 여러 분석 단계, 유해 화학 물질 및 시약의 요구 사항, 큰 샘플 크기, 분석 재현성 문제 및 실행 간 데이터 가변성 등 여러 가지 단점이 있습니다. 이러한 방법으로 는 비교적 짧은 기간에 더 적은 단계로 더 간단하고 달성 가능한 메서드의 개발을 촉발시켰습니다. 고전 웨스턴 블롯 기술은 인기있는 실험실 방법으로 남아 있지만, 그 다단계 절차, 공급, 독성 폐기물 (즉, 아크릴아미드, 메탄올 등) 및 분석 시간은 높은 처리량 정량적 수행 할 때 덜 바람직해지고있다 단백질 분석.
자동화된 CEI 접근법은 고처리량 단백질 검법을 수행하는 실험실에서 점차 적으로 선택 방법이 되고있습니다 6. CEI는 겔, 겔 전기 영동 장치, 멤브레인, 전기 영동 및 전기 전달 장치 및 더 많은 물리적 취급 관련에 대한 필요성을 제거합니다. 잘 설계된 경우, CEI 분석은 정량적 데이터 분석, 출판 품질 전기 전형체 및 통계 분석그래프를 포함하여 약 3.5 시간 내에 완료되어야합니다. CEI 시스템의 또 다른 우수성은 10x-20x 적은 단백질 농도의 요구 사항이며, 임상 시험7,8에사용되는 인간 샘플에 사용하기에 이상적입니다.
CEI의 가장 중요한 부분은 다른 공급 업체에서 구입 한 각 항체에 대한 분석 조건을 최적화하는 것입니다, 항체의 유형 (단일 클론 대 폴리 클로날), 최적의 단백질 농도, 샘플 준비, 샘플 변성 온도, 모세 혈관에 적용 된 전기 동공 전압. 우리는 시간과 자원을 절약 할 수있는 새로운 분석 전에 구현해야 CEI에 대한 단일 분석 형식 최적화 방법을 개발했다. 이러한 최적화 단계는 트랜스활성화 반응 DNA/RNA 결합 단백질(TARDP)의 총 및 인산화 유도체 모두에 대한 자동화된 정량적 평가에 이어 진행된다. 크기(43 kDa)로 인해 이 백서 전체에서 TDP-43약어가 사용됩니다. 여기서, ALS 환자로부터 수득된 인간 혈소판 용해제에서 TDP-43 단백질은 잠재적인 예후 바이오마커로서 예측 인산화 값(PPV)을 개발하는 데 도움을 주기 위해 평가된다.
TDP-43은 ALS에 대한 새로운 잠재적 질병 바이오마커 후보이다. TDP-43은 모든 핵세포에서 전방위 단백질이다; 따라서, 다양한 정상 세포 이벤트 및 신경 퇴행성 질환 동안 TDP-43의 기능은9,10,11, 12,13,14를조사되었다. TDP-43은 핵 단백질15이지만,핵 국소화 및 핵 수출 서열의 존재로 인해 핵과 세포질 사이를 왕복하는 능력을 가지고있다 16,17,18,19. 세포질 TDP-43은 mRNA 안정성 및 수송, 스트레스 반응, 미토콘드리아 기능, 자가식기20과같은 다양한 세포 이벤트에 관여한다. 그러나, TDP-43의 인산화 유도체의 역할에 대해서는 알려져 있지않으며, 신경퇴행성 질환(21)의병인에 이들의 개입이 있다.
이 프로토콜은 CEI 접근법을 사용하여 혈소판에서 TDP-43 및 그의 인산화 유도체의 함량을 분석하기 위해 분석 조건을 최적화하는 방법을 보여 준다. 인산화된 TDP-43은 시판되지 않기 때문에, ALS 환자에서 TDP-43 프로파일을 평가하기 위해 예측 인산화 값(PPV)을 사용하는 것이 제안된다. 이 CEI 시스템은 소량의 샘플 혼합물(모세관당 2.5-3.0 μL)을 사용합니다. 총 분석 부피 설정은 제조업체의 프로토콜에 따라 모세관 당 8.0 μL입니다. 따라서, 연구원은 두 개의 별도 실행에 대한 하나의 샘플 혼합물 준비를 활용할 수 있습니다. 제조업체는 완전히 제거되지 는 않더라도 파이펫팅 오류를 최소화할 수 있도록 분석 프로토콜을 설계했습니다. 24개의 개별 인간 혈소판 용해 샘플 혼합물은 반부피(즉, 샘플당 2.5-3.0 μL)로 나누어지고 ~ 7시간 내에 2개의 상이한 항체에 의해 연속적으로 분석된다. 여기서 설명된 CEI 시스템은 바람직한 고처리량 분석 양식입니다. 사용자는 대규모 스크리닝을 수행하기 전에 표적 단백질에 대한 다른 공급 업체 및 샘플 준비 양식의 항체를 테스트해야합니다.
프로토콜
인간 혈소판의 처리에 관한 모든 프로토콜은 캔자스 대학 의료 센터와 캔자스 시티 의과 대학 IRB 위원회의 지침을 따릅니다.
1. 완충제 및 시약 의 준비
참고: 제조업체의 지침에 따라 모든 샘플을 준비합니다. 이 시술 중에 개인 보호 장비(실험실 코트, 장갑 및 고글)를 착용하십시오.
- 자당 0.941 g(최종 농도 11m), 5M NaCl(최종 128mM 결승), 5.4 mL 0.2 M NaH2PO 4(4.3 mm)를 결합하여 구연산 세척 버퍼를 준비합니다. M 결승), 9.4 mL 의 0.2 M Na2PHO4 (7.5 mM 최종), 0.352 g의 구연산 나트륨 (4.8 mM 최종), 및 구연산 0.115 g (2.4 mM 최종). 0.45 μm 필터 디스크를 통해 ddH2O. 필터로 총 부피를 250 mL로 조정하고 pH를 6.5로 조정합니다. 4 °C에서 최대 1년 동안 보관하십시오. 22를사용하기 전에 용액 실온 (RT)을 가져온다.
- 100 mL 최종 부피에 250 mM 수당, 1 mM EDTA 및 10 mM Tris-Cl (pH 7.4)을 결합하여 파열 완충을 준비하십시오. 4 °C에서 최대 1년 동안 보관하십시오. 2 μL의 인산염 억제제 칵테일 (1:1000 최종) 및 프로테아제 억제제 칵테일 1 μL (1:2000 최종) 파열 완충제 2 mL에 추가합니다. 사용할 때까지 얼음을 유지하십시오. 사용하지 않은 파열 버퍼를 폐기합니다.
2. 혈소판 격리
- 산 구연산-덱스트로스(ACD) 용액(75 mM 트리나트륨 구연산, 124 mM 덱스트로오스 및 38mMM구연산, pH=7.4)을 함유하는 황색 캡 혈액 수집 튜브에서 8-10 mL의 인간 혈액을 수집; ACD:혈액 = 1:9). 튜브 함량을 5x-6x 손으로 부드럽게 섞습니다.
- RT에서 20 분 동안 스윙 버킷 로터에서 튜브를 200 x g로 원심 분리합니다.
- 혈소판이 풍부한 혈장 (PRP) (~3-4 mL)을 15 mL 원점 하부 튜브로 수집하고 오염을 피하기 위해 버피 코트 (흐릿해 보이는 분획)에서 PRP의 약 0.5 mL을 둡니다. 적혈구 오염이 발생하면이 단계를 반복하십시오.
- PRP 샘플을 RT에서 15분 동안 1,200 x g에서 원심분리합니다.
- RT에서 1,200 x g에서 원심분리하여 구연산 세척 버퍼 및 펠릿 1 mL에서 부드러운 재서스펜션으로 혈소판 펠릿(P1)을 세척합니다.
- 순수한 혈소판 펠릿을 저장합니다. 상급제는 버리십시오.
- 억제제 칵테일을 함유하는 파열 완충제의 600 μL에서 혈소판 펠릿을 다시 중단한다.
- 초음파 처리기로 혈소판 현탁액을 초음파 처리합니다. 샘플을 미니 얼음 양동이에 놓습니다. 연속 모드에서 20s에 대한 설정 3에서 초음파를 설정합니다.
참고: 10% 표백제와 증류수로 프로브를 청소하십시오. - 초음파 처리된 샘플을 20,000 x g에서 4°C에서 30분 동안 원심분리하여 밈분획을 제거합니다. 60 μL의 알리쿼트 상피제와 -80°C에서 보관하십시오. 혈소판 세포질 분획에 대해 반복적인 해동/동결 주기를 피하십시오.
3. CEI 준비
참고: 인간 혈소판 용해물의 100 μL은 ALS 환자로부터 결합되었고(n= 8-10), 건강한 피험자(n=8-10)를 별도로 풀화하고 분석 최적화를 위해 사용되었다.
- CEI레이아웃(표 1)및 샘플 준비(표 2)에 대해 사내에서 생성된템플릿을 작성합니다. 샘플 혼합물 준비 테이블은 동적이며 소스에서 제거해야 하는 볼륨을 자동으로 계산합니다.
참고: 동적 Table-2에 필요한 소스 볼륨을 입력하면 0.1 X 샘플 버퍼 볼륨이 자동으로 계산됩니다. - 모세 혈관이 #1 있는 25 0.2mL PCR 튜브를 #25 #25 PCR 랙에 미리 라벨을 부착합니다. 얼음 위에 놓습니다.
- 사전 라벨 0.6 mL 미세 원심 분리튜브: 각 기본 항체 및 희석(필요한 경우)에 대해 하나씩, 0.1x 샘플 버퍼용, 루미놀-S/과산화물에 대해 하나, 각 시료에 대해 하나씩 희석합니다(필요한 경우). 튜브 랙에 얼음에 놓습니다.
- CEI 분리 12-230 kDa 마스터 키트 분리 모듈에 제공된 샘플 버퍼, 세척 버퍼, 1플레이트 및 카트리지를 꺼낸다.
- 4°C 냉장고로부터, 항체 희석 완충제, 1차 항체, 이차 항체, 루미놀, 과산화수소 및 표준 팩을 꺼낸다. RT에 남아있는 표준 팩을 제외한 모든 시약을 얼음 위에 놓습니다.
참고 : 표준 팩의 시약은 동약화되고 호일 커버로 밀봉됩니다. 이들은 제품 손실을 줄이기 위해 열기 전에 미니 원심 분리기를 사용하여 잠시 아래로 분사해야합니다. 시약 튜브를 열려면 파이펫 팁으로 관통하거나 모서리에서 다시 당길 수 있습니다. - 400 mM DTT를 준비하려면 DTT를 포함하는 투명 튜브에 40 μL의 탈이온수를 추가합니다.
- 형광 5x 마스터 믹스 40 μL을 준비하려면, 키트에 제공된 분홍색 튜브에 제조된 400 mM DTT 용액의 10x 샘플 버퍼 20 μL 및 20 μL을 추가합니다.
- 생체측 사다리를 제조하기 위해, 키트에 제공된 백색 튜브에 16 μL의 탈이온수, 10x 샘플 완충액의 2 μL 및 제조된 400 mM DTT 용액의 2 μL을 첨가한다. 부드럽게 혼합하고 변성0.2 mL PCR 튜브로 옮김.
- 0.6 mL 마이크로 원심분리튜브에 1.5 μL의 시료 버퍼와 148.5 μL의 탈이온수를 추가하여 0.1x 샘플 버퍼를 준비합니다. 소용돌이가 섞어서 얼음 위에 놓습니다.
- 원하는 항체 희석을 준비합니다. 미리 표지된 각 마이크로 원심분리관에 지정된 부피로 희석항체를 추가합니다. 볼륨이 동일한 경우 역파이팅 기술23을사용하십시오. 그렇지 않은 경우, 분배하기 전에 파이펫 팁을 미리 헹구어 두지 않도록 하십시오.
참고:이 분석에서, A-TDP-43 팬 항체 및 a-p(S409/410-2) TDP-43 항체를 사용하였다. 항 ERK 항체는 분석 성분이 작동하는지 확인하기 위해 내부 제어를 위해 사용되었다. - 아래에 설명된 바와 같이 항체 희석을 위한 역파이펫팅을 수행한다. 대안적으로, 추가 정보는 문헌24에서찾을 수 있다.
참고: 소량의 순차적 인솔루션(23)을디스펜싱할 때 역파이팅 기술이 바람직하다. 이 기술은 (i) 정확한 부피를 제공하고, (ii) 팁 오리피스에서 시약 발포를 제거하고, (iii) 소량(&5 μL) 시약, 점성 용액, 계면 활성제 용액 및 높은 증기압을 가진 용액에 이상적입니다.- 적절한 팁을 파이펫에 넣고 플런저를 두 번째 정류장(2단계)까지 누릅니다. 파이펫 팁을 용액에 몇 밀리미터 에 담급전시. 팁이 용액에 잠긴 상태에서 파이펫 팁을 용액으로 채우기 위해 플런저를 천천히 놓습니다. 용액에서 팁을 제거하고 시약 저장소의 가장자리에 부드럽게 닿아 팁 외부에 남은 여분의 액체가 제거되도록 합니다.
- 플런저를 첫 번째 정지(Step-1)로 눌러 용액을 분배합니다. 팁에 남은 용액을 분배하지 마십시오.
- 팁에 남은 용액을 시약 저장소에 비우고 플런저를 제2 스톱(Step-2)으로 누른다. 플런저를 다음 파이펫팅 스텝의 준비 위치로 놓습니다.
- 각 미리 표지된 미세원심지튜브(표 1)에지정된 부피로 필요한 항체를 첨가하여 파이펫 팁을 미리 헹구지 마십시오: 희석제에 직접 첨가하고 팁을 여러 번 플러시하여 항체를 제거한다. 튜브를 얼음 위에 놓습니다.
- CEI 샘플 믹스를 준비하려면 캡 #2를 통해 캡 #25로 표시된 PCR 튜브에 대해 아래에 나열된 단계를 수행하십시오: 표 1에표시된 순서와 동일합니다.
- 모든 튜브를 열고 역피리 파이펫팅 기술을 사용하여 각 튜브에 형광 5x 샘플 버퍼의 1.6 μL aliquots를 추가한 다음 5x 버퍼를 추가하면 각 PCR 튜브를 닫아 시료 손실을 최소화합니다.
- 모든 튜브를 열고 표 2에 지정된 부피가 0.1x 샘플 버퍼를 각 튜브에 추가한 다음 즉시 닫습니다. 볼륨이 동일한 경우 역파이팅 기법을 사용합니다. 그렇지 않은 경우 0.1x 샘플 버퍼를 디스펜싱하기 전에 파이펫 팁을 미리 헹구어 보소입니다.
- 모든 튜브를 열고 표 2에 지정된 부피가 있는 단백질 샘플을 각 튜브에 추가한 다음 즉시 닫습니다. 볼륨이 동일한 경우 역파이팅 기법을 사용합니다. 그렇지 않은 경우 0.1x 샘플 버퍼를 디스펜싱하기 전에 파이펫 팁을 미리 헹구어 보소입니다.
- 벤치탑 원심분리기의 모든 PCR 튜브(30초동안 13,000 x g)에 있는 모든 PCR 튜브를 간단히 원심분리기, 플릭/와류 PCR 튜브를 섞은 다음 원심분리를 반복합니다.
- 모든 PCR 튜브를 가열된 뚜껑으로 열전자전거로 옮김을 옮니다. 정의된 온도 및 지속 시간에서 변성 시료(즉, 5분 동안 95°C, 10분 동안 70°C).
참고: 변성 온도와 지속 시간은 표적 단백질에 최적화되어야 합니다. - 3.12.4단계를 반복합니다.
- 모든 PCR 튜브를 튜브 랙에 반납하고 얼음 위에 놓습니다.
- 변성 단계에서 개발 용액 (1 : 1 루미놀 -S : 과산화수소 용액)을 준비한 다음 루미놀-S 200 μL과 과산화수소 200 μL을 추가합니다. 얼음 위에 놓습니다.
- 위에 준비된 샘플로 CEI 미리 충전된 플레이트를 로드하려면 시약 및 샘플을 분석 레이아웃에 표시된 분석 판에 분배합니다(그림1). 기포를 도입하지 마십시오.
주: 체적과 용액이 동일한 경우 역파이팅 기법을 사용합니다. 그렇지 않은 경우, 분배하기 전에 파이펫 팁을 미리 헹구고 파이펫의 두 번째 탭 정지를 사용하여 나머지를 플레이트에 잘 배출하지 마십시오. 12-230 kDa 분리 모듈은 색상 코드 플레이트 로딩 가이드를 포함할 수 있다. 시약과 샘플을 웰에 추가하면서 이 가이드를 플레이트 아래에 놓으면 시료 로딩 시 시각적으로 도움이 됩니다. 플레이트 로딩 가이드는 회사 웹 사이트에서도 다운로드할 수 있습니다.- 행 E에서 루미놀 15 μL: 과산화수소 혼합물을 각 우물에 추가합니다.
참고: 이상적으로는 사용하기 직전에 이 시약을 준비하고 각 웰에 추가하십시오. 이것이 편리하지 않은 경우, 이 혼합물은 플레이트 로딩 30분 전에 제조될 수 있다. - 행 D에서, 잘 D1, 스트렙타비딘 -HRP의 10 μL을 추가합니다.
- 행 D에서, 웰 D2-D25에, 지정된 이차 항체의 10 μL을 추가한다.
- 행 B에서, 각각의 우물에, 희석항체의 10 μL을 추가한다.
- 행 C에서, 잘 C1, 희석 항체의 10 μL을 추가합니다.
- 행 C에서, 우물 C2-C25에, 지정된 1차 항체의 10 μL을 첨가한다.
- 행 A에서, 잘 A1, PCR 튜브 #1 생물 학적 사다리의 5 μL을 추가합니다.
- 행 A에서, 우물 A2-A25, 샘플의 3 μL을 추가, PCR 튜브 #2-#25 해당 웰에 #2-#25.
- 지정된 각 세척 버퍼에 500 μL의 세척 버퍼를 잘 추가하십시오.
- RT에서 1,000 x g에서 5 분 동안 플레이트를 원심 분리합니다.
- 행 E에서 루미놀 15 μL: 과산화수소 혼합물을 각 우물에 추가합니다.
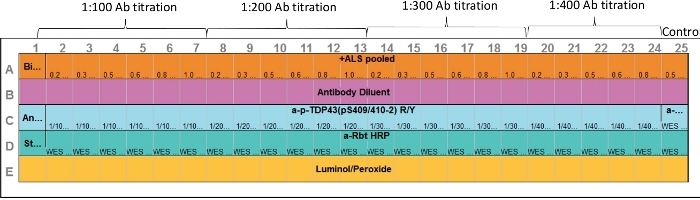
그림 1: 분석 레이아웃. 1차 항체 및 표적 단백질 샘플 최적화는 모두 하나의 분석에서 수행될 수 있다. 모세혈관 2-7, 8-13, 14-19 및 20-24는 다양한 단백질 농도 및 1차 항체 범위를 나타낸다. 모세관(25)은 양성 대조군을 나타낸다. 항-ERK 항체를 사용하; 그러나 적절한 포지티브 컨트롤이 포함될 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 플레이트 1에서 CEI 수행
- 먼저 CEI(재료표)분석기를 켜고 컴퓨터를 켭니다. 소프트웨어 열기(재료 표)
- 분석기를 온라인 시스템(재료표)에연결합니다. 이는 문제 해결 및 데이터 복구를 위해 실행 데이터를 수집하는 데 필요한 단계입니다.
- 왼쪽 상단 메뉴에서 악기를 클릭한 다음 연결을클릭합니다. 팝업 메뉴로 표시되는 악기 일련 번호를 선택합니다. 연결을 클릭합니다.
- "분석"탭을 선택하고 새 분석(New Assay)을 선택하거나 저장된 템플릿을 선택합니다.
- 입력 분석 매개 변수(표 1)또는 현재 수정 템플릿. 파일 이름과 위치를 저장합니다.
- 분석기의 깜박이는 파란색 표시등이 파란색으로 고정되어 있는지 확인합니다.
- 주황색 도어 상단의 실버 메탈 버튼을 터치하여 엽니다.
- 포장에서 모세관 카트리지를 조심스럽게 제거하십시오. 제조업체의 프로토콜에 설명된 대로 모세관 카트리지를 삽입합니다. 올바르게 설치하면 내부 표시등이 "파란색"으로 바뀝니다.
- 분석 판에서 보호 씰을 제거합니다. 기포에 대한 미리 채워진 우물을 시각적으로 관찰합니다. 관찰되면 작은 파이펫 팁으로 팝하십시오 (긴 샤프트 P10 파이펫 팁이 잘 작동합니다).
- 분석 판을 배치하여 플레이트 홀더를 적재하고 문을 닫습니다. 컴퓨터에서 시작 버튼을 클릭합니다.
- 온도에 민감한 시약과 시료를 함유한 얼음 트레이를 4°C에서 두 번째 미리 채워진 플레이트를 준비할 준비가 될 때까지 어두운 곳에 놓습니다.
- 두 번째 플레이트의 경우 시약/소모품을 실온에서 빼내십시오.
5. 플레이트 2에서 CEI 수행
참고 :이 플레이트는 인산화 된 TDP-43 수준을 분석하기 위해 설정됩니다.
- 4°C에서 보관되는 얼음 트레이를 제거하고 제1 플레이트의 예상 완료 시간 전에 1시간 전에 벤치에 놓습니다. 두 번째 접시와 카트리지를 검색합니다.
- 두 번째 실행에 필요한 항체 희석을 준비하고 얼음에 저장합니다. 신선한 1:1 루미놀-S:과산화수소 용액을 준비합니다(위 3.12.8단계).
- 미리 채워진 플레이트를 로딩하는 데 필요한 샘플 믹스 와 시약을 리믹스하고 잠시 다시 원심 분리합니다. 그림 1에따라 두 번째 플레이트를 로드합니다. A-p(S409-410-2) TDP-43 항체 용액을 행 C 웰에 로드합니다.
- 첫 번째 실행이 완료되면 첫 번째 플레이트와 카트리지를 폐기합니다. 카트리지를 분리하고 날카로운 용기에 놓아 폐기하십시오. 참고를 위해 접시와 카트리지에서 스티커를 보관하십시오.
- 소프트웨어 파일을 닫고 동일한 템플릿을 다시 선택합니다. 소프트웨어는 이전 실행의 설정을 기억합니다. 필요에 따라 부포를 변경합니다(즉, 1차 항체 를 변경).
- 4.8-4.10 단계를 반복합니다. 12-230 kDa 마스터 키트 분리 모듈 시약 및 소모품을 모두 버리세요.
- 대학 규정에 따라 CEI 샘플 믹스, 항체 희석, 0.1x 샘플 버퍼 및 루미놀-S:과산화물 혼합물에 남은 것을 폐기하십시오.
6. 데이터 분석
- 실행이 완료되면 다음과 같은 품질 검사가 수행되었는지 확인합니다.
- 소프트웨어에서 표준 표시 아이콘 및 그래프 보기 탭을 선택합니다. 내부 형광 마커 크기에 대한 피크 정렬에 대한 25개의 모세혈관을 모두 확인합니다. 힘 표준을 선택하거나 잘못된 피크를 마우스 오른쪽 단추로 클릭한 다음 표준이 아님을 선택하여 정렬 불량을 수정합니다. 각 새로운 모세관에 대해 이 검사를 수행합니다.
- 샘플 및 단일 보기 아이콘을 클릭합니다. 실험 탭에서 모세관 #1(생체 태극기 사다리)을 선택합니다. 그래프 보기에서 피크를 클릭하고 피크 제거를선택합니다.
참고 : 예를 들어, 12-230 KDa 생체 공학 사다리는 12 kDa, 40 kDa, 66 kDa, 116 kDa, 180 kDa 및 230 kDa에서 크기 조정 피크를 보여줍니다. 이 단계가 수행되지 않고 부정확한 결과를 생성하는 경우 샘플 피크의 크기가 올바르지 않습니다. - 전기 동극 영화를 보고 실행 중에 비정상적인 마이그레이션이 발생했는지 확인합니다.
- 추가 계산을 위해 필요에 따라 데이터(예: 분자량, 피크 면적, 피크 높이 및 신호 대 잡음[S/N]를 포함한 피크 테이블)를 파생합니다. 그래프 창의 오른쪽 위 모서리에 그래프에 대한 자세한 정보를 제공하는 그래프 부호 도구가 있습니다.
결과
혈소판 시토졸 단백질 농도 및 1차 항체 적정 최적화
신호의 변화는 혈소판 시토졸의 단백질 변화에 정비례하기 때문에 분석에서 혈소판 세포실 단백질의 선형 동적 범위를 설정하는 것이 중요합니다. 분석에서 전체 혈소판 용해 혼합물의 사용은 표적 단백질(TDP-43 및 P(S409-412) TDP-43)의 신호 강도를 감소시키고 높은 배경 신호에 기여할 수 있다. 따라서, 이러한 분석에서, 선명한 상월체(cytosolic 분획)를 혈소판을 파열한 후 사용하였다(도2).
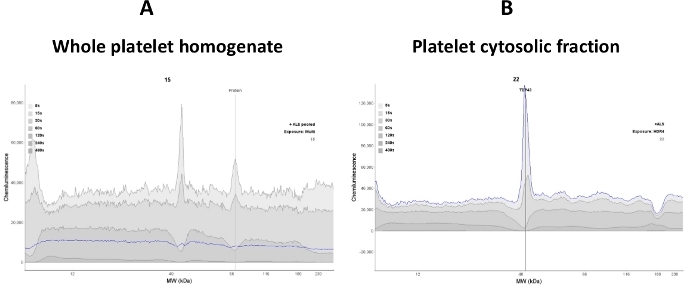
그림 2: 신호 선명도는 샘플 품질에 따라 달라집니다. (a)전체 혈소판 용해 균질화항-TDP-43 항체 결합을 방해; 따라서, 시끄러운 전기 전보람이 관찰되었다. (B)혈소판 시토솔릭 분획은 전체 용해액을 원심분리(30분 동안 16,000 x g)로 적용하여 수득하였다. 대부분의 밈성 단백질은 제거되었다; 따라서, TDP-43 단백질에 결합하는 항-TDP-43 항체가 강화되었다(청선 트레이스). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
혈소판 시토졸 단백질 농도에 대한 선형 동적 범위는 0.2-0.8 mg/mL로 확립되었다. 단백질 농도 및 원발성 항체 적정을 모두 하나의 분석으로 수행할 수 있도록 분석 템플릿을 채택하였다(도3).
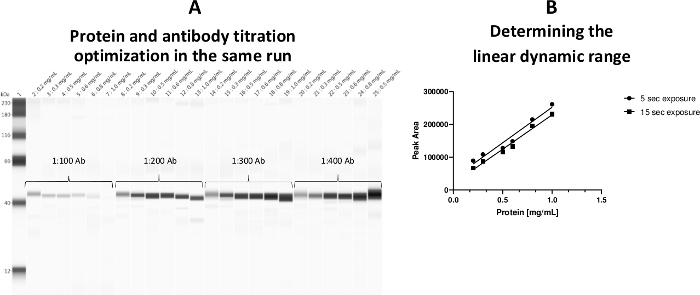
그림 3: 혈소판 시토졸 단백질 농도에 대한 선형 동적 범위. (a)단백질 농도 와 항체 적정 둘 다 동일한 실행 동안 한 플레이트에서 최적화되었다. (B)단백질에 대한 선형 작업 범위 (0.2-0.8 mg / mL)가 확립되었습니다. 0.5 mg/mL 단백질 부하를 양성 대조군으로서 a-ERK 항체에 의해 표지하였다(모세관 25). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
시료 제제 튜브의 글리세롤 함량은 20% 미만이어야 하며 그렇지 않으면 높은 글리세롤 농도가 1차 항체 결합에 악영향을 미칩니다.
최적의 노출 시간 결정
이전 버전의 소프트웨어에서는 단백질 농도(mg/mL)에 대해 피크 영역을 플로팅하여 최적의 노출 시간을 결정해야 했습니다. 새 버전은 HDR(높은 동적 범위) 감지 프로파일이라는 새 도구를제공합니다(그림 4). 이미지 패널을 사용하여 모든 노출 시간(즉, 5s, 15s, 30s, 60s, 120s, 240s, 480s)을 함께 볼 수 있는 옵션을 제공했습니다. 컴퓨터 소프트웨어는 모든 노출 시간을 분석하고 자동으로 최적의 노출 시간(HDR)을 식별했습니다. HDR 검출 프로파일은 CEI의 감도가 높아서 훨씬 더 넓은 동적 범위를 제공하므로 더 큰 샘플 농도 범위에서 더 나은 검출 및 정량화를 의미합니다. 그러나 사용자는 여전히 실험 목표를 달성하는 노출 시간을 선택할 수 있습니다. 이 기능을 사용하여, TDP-43 단백질에 대한 최적의 노출 시간이 발견되었다. 피크는 최적 노출 시간을나타낸다(도 4A). 단일 노출 시간(4 s)은 1-512s(도 4B)에이르는 모든 9개의 노출 시간을 검토한 후 본 항체에 대해 정의되었다.

그림 4: 표적 단백질에 대한 높은 동적 범위(HDR) 검출 프로파일. (a)TDP-43 단백질 피크는 표적 단백질에 대한 최적의 노출 시간을 나타낸다. a-TDP-43 Ab 적정은 1:300이었고, 혈소판 시토졸 단백질 농도는 0.5 mg/mL이었다. 소프트웨어 정의 파란색 선은 최적의 노출 시간을 나타냅니다. (B)이 수치는 1-512s 에 이르는 9개의 노출 시간을 모두 검토한 후 사용자 정의 단일 노출 시간(4초)을 나타내며, 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
ALS 환자의 인간 혈소판 시토솔에서 TDP-43 수준
혈액 염기 바이오마커 개발이 수행되었다. 최적화된 분석 조건을 사용하여, ALS 환자로부터 수득된 혈소판 용해 세포질 분획은 2세트의 항체(즉, 항-TDP-43[Pan] 항체, TDP-43 단백질의 인산화 유도체를 인식하는 항체) 및 A-P[S409/410-2] TDP-4P-4를 사용하여 분석하였다. 본 데모에서는, 질병 특이적 TDP-43 및 그의 인산화 유도체가 제시된다(도5).
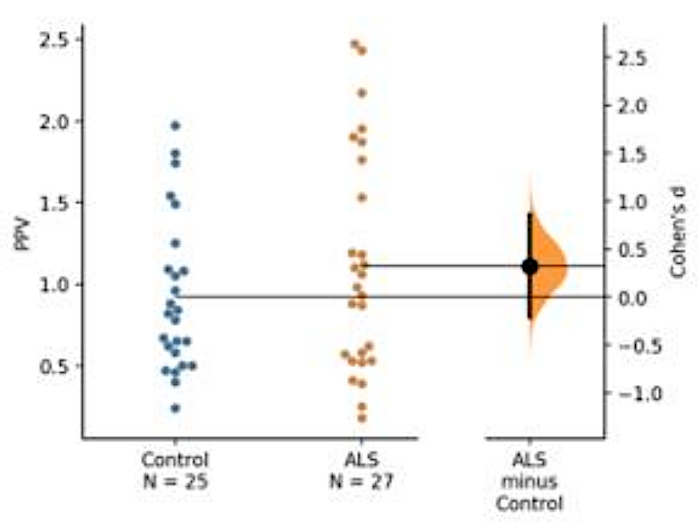
도 5: TDP-43의 예측 인산화 값(PPV)의 표현. 절대량의 인산화 된 TDP-43 및 팬 TDP-43 단독으로ALS 및 대조군 사이에 많은 차이를 나타내지 않았다. 그러나, PPV는 ALS 코호트에서 약간의 증가를 나타내었지만, 피험자의 수가 부족하여 두 그룹 간에 통계적 차이가 없었다(ALS =25, 대조군 =27). ALS와 대조군 의 평균 사이의 낮은 코헨의 d 값은 작은 샘플 크기로 인해 두 그룹 사이의 낮은 효과 크기를 보였다 (대조군 = 25, ALS = 27). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
교정 곡선을 사용하여 총 TDP-43을 정량화했습니다(그림6)

그림 6: 표준 교정 곡선. 상업적으로 구입한 재조합 TDP-43 단백질 농도는 표준 곡선을 구성하는 데 사용되었다. 각 데이터는 삼중분의 평균을 나타냅니다. 단백질 밴드 강도는 농도 의존적(Inset)이었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
인산화된 TDP-43 단백질의 정량화는 이 단백질의 상업적 가용성으로 인해 불가능했습니다. 대신, TDP-43의 인산화 종의 백분율을 정의하는 예측 된 인산화 값 (PPV)이 확립되었습니다. PPV는 다음 방정식을 사용하여 동일한 샘플에 대한 2개의 순차적 CEI 검문결과에서 결정되었다.

인트라-및 인터런 분석가변성은 풀린 인간 ALS 혈소판 세포질 분획에서 시험하였다(그림7)
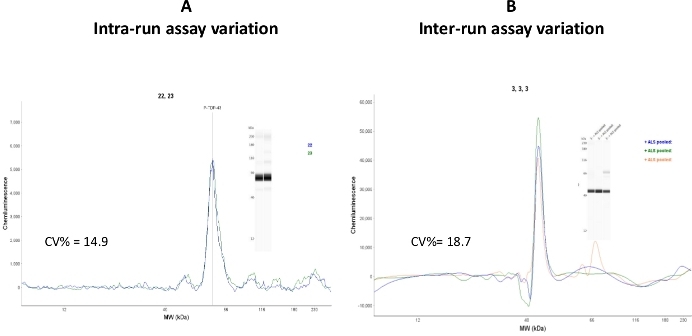
그림 7: 분석 변형. (a)동일한 시료로 적재된 2개의 모세혈관을 CEI에 의해 분석하였고, 실행 내 분석기 변이를 CV% = 14.9로 계산하였다. (B)동일한 샘플을 3개의 상이한 분석일 및 3개의 상이한 분석 실행에서 분석하였다. 간 실행 분석 변형은 CV% = 18.7로 계산되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
인트라런(모세관-모세관 변동) 계수 변동 값이 허용 범위(CV% = 14.9)에서 떨어졌지만, 실행 간 분석 값은 상대적으로 높았다(CV% = 18.7). 이러한 변화는 다른 제비의 모세관 카트리지 및 샘플 플레이트를 사용하기 때문일 수 있다고 해석됩니다. 재현성 연구는 동일한 로트 번호를 가진 CEI 구성 요소에서 수행되어야 합니다.
표 1: CEI 분석 판 로딩 템플릿. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 대화형 샘플 혼합물 준비 템플릿. 알 수 없는 샘플에서 스톡 단백질 농도를 입력한 후, 대화형 세포는 샘플 혼합을 준비하기 위해 얼마나 많은 부피를 사용해야 하는지 자동으로 계산합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
모세관 전기영동계 면역분석은 이제 고처리량 시료 분석 및 약물스크리닝(25)을위한 선택방법이다. 작은 샘플 볼륨, 잘 최적화 된 분석 구성 요소, 사용자 친화적 인 분석 플랫폼 및 계측, 시약 지출 및 낮은 CV 백분율은 주요 장점26,27입니다. 상이한 분석 양식에서 단백질을 분리하는 몇 가지 방법이 있지만, 여기에 기술된 항체 기반 CEI는 혈액 기반 바이오마커 개발에 종사하는 작은 실험실에 의해 적응될 수 있다. 여기에 사용된 CEI 분석 기술은 TDP-4328 및 인산화 유도체5에대한 신뢰할 수 있고 재현 가능하며 민감한 측정을 제공합니다.
CEI 시스템은 또한 TDP-43 및 그 인산화 유도체를 동시에 분석하고 정제 또는 재조합 표적 단백질이 가능한 경우 표적 단백질의 직접 정량화를 제공하는 다중선택을 제공한다. 전체 길이 재조합 TDP-43 단백질은 시판되고; 그러나, 재조합 인산화 된 TDP-43 유도체는 아니다. 인산화된 TDP-43은 시판되지 않기 때문에 ALS 환자에서 TDP-43 프로파일을 평가하기 위해 예측 인산화 값(PPV)이 구현되었습니다. 팬 TDP-43 및 인산화 된 TDP-43 양은 영구적으로 형광포로 표지되었다; 따라서 TDP-43 프로파일은 정량적 단위(예: ng/mL, pg/mL 등)의 유무에 관계없이 동일하게 유지됩니다. TDP-43 및 그 인산화 유도체(즉, P[S409-410-12] TDP-43)의 절대량을 결정하지만, PPV를 계산하면 표준화를 위한 재조합 인산화 TDP-43의 필요성이 없어지지만, 상용화되지 않았기 때문에.
CEI는 분석 플랫폼에서 여러 검사점을 제공하여 분석이 실패하는 경우 문제를 정확하게 식별합니다. 이것은 장애물을 제거하고 더 나은 실험 설계를 제공합니다. 분석 절차는 샘플 플레이트를 채우는 것을 제외하고는 완전히 자동화됩니다. 이것은 표준 웨스턴 블로팅 해석에 비해 중요한 기능입니다. 이 기능은 실행부터 실행까지 일관성을 제공합니다. 모든 실험실에는 고유한 표준 작동 절차가 있지만 사람의 실수를 최소화하는 관행을 준수하는 것이 중요합니다. 예를 들어, 루미놀에 과산화물을 첨가하면 효소 반응을 시작하고 루미놀 기판을 소비하기 때문에 플레이트 로딩 직전에 루미놀-S/과산화물 혼합물을 준비하는 것이 중요합니다. 기포없이 플레이트 웰에 샘플 및 1 차 / 이차 항체를 로딩하는 것도 매우 중요한 단계입니다.
또한, 플레이트 웰의 부피가 작고 우물 사이에 공간이 없기 때문에, 사용자는 다른 모든 것이 자동화되기 때문에 가장 중요한 단계인 파이펫팅 하는 동안주의를 기울여야합니다. 시료, 항체 및 기타 시약의 로딩 순서는 분석의 일관성을 위해중요하다(그림 1). 플레이트 준비 과정은 약 40-45 분이 소요됩니다. 따라서 먼저 필요한 분석 성분으로 플레이트를 로드하고 파이펫팅 직전에 루미놀-S/과산화물 혼합물을 준비하는 것이 좋습니다. 이와 같은 방법으로, 시약 첨가의 일관된 서열이 있고, 일관된 발광 신호 강도가 달성될 것이다. 그것은 주로 과산화물의 강도에 영향을 미치기 때문에 만료 된 루미놀-S / 과산화수소 시약을 사용하지 않는 것이 좋습니다. 최근 분할 버퍼 시스템을 도입하고 화학 및 세제 호환성 범위를 포함하여 분석 품질을 향상시키고 보다 재현 가능하고 예측 가능한 결과를 생성했습니다. 이제 동일한 제조업체의 새로운 콤보 분석기는 동일한 실행에서 화학 발광 및 형광 결합 항체로 표지된 샘플을 분석하는 기능을 가지고 있습니다. 이 새로운 기능은 두 개의 개별 플레이트를 연속적으로 실행할 필요가 없으며 실행 대 실행 변형을 제거합니다.
분석 판은 주변 온도에 저장해야합니다. 4 °C 냉장고에 분석 판을 유지하기 위해 선택된 경우, 플레이트는 분석 전날 밤에 꺼내 주변 온도로 가져와야합니다. 잘못 로드된 시료 웰은 올바른 샘플을 추가하기 전에 키트에 제공된 버퍼로 광범위하게 세척(4-5회)해야 합니다. 각각의 1차 항체 및 생물학적 샘플은 독특합니다. 따라서 생물학적 유체에서 표적 단백질에 대한 샘플을 분석하기 전에 항체/단백질 최적화를 수행해야 합니다.
여기서, 1차 항체 배양 시간은 기본적으로 30분 동안 설정되었다. 신호가 약한 경우, 사용자는 형광 신호 소진없이 원하는 신호 강도에 도달 할 때까지 기본 항체 배양 시간을 증가 고려해야한다. 인간 혈소판의 경우, 환자로부터의 풀화 된 샘플을 제조하고 최적화 분석에 사용하였다. 시료 풀링은 표적 생체 분자 간의 변이를 더 잘 나타낸다. CEI에 대한 총 용해 또는 총 균질화보다는 명확한 과민제를 사용하는 것이 좋습니다.
전체 혈소판 용해 혼합물에서 단백질의 고농도는 신호 대 잡음 비를 감소시킬 수있다(도 2). 샘플의 반복된 동결 해동 주기는 1 차적인 항체 결합에 악영향을 미치기 때문에 피해야 합니다. 일부 시약은 CEI29와호환되지 않기 때문에 라이세트 버퍼의 성분이 중요합니다. 샘플 준비 전에 제조업체의 웹 사이트에 제공된 호환 시약 목록을 교차 확인하는 것이 좋습니다. 이는 샘플 준비를 위한 높은 엄격성 조건을 허용하지 않는 시스템의 한계입니다. 분석 실행 파라미터(즉, 1차 항체 희석, 단백질 농도, 1차 항체 배양 시간 등)를 풀린 샘플을 사용하여 개별 샘플을 분석하는 것이 좋습니다.
공개
저자는 ProteinSimple, Inc.가이 원고의 출판 비용을 커버제외하면 경쟁적인 금전적 이익을 선언하지 않습니다.
감사의 말
이 연구는 A.A.에 수여 된 교내 보조금에 의해 후원되었다. 이 작품은 NCATS에서 CTSA 교부금에 의해 지원되었다 국경에 대한 캔자스 의료 센터의 대학에 수여: 임상 및 번역 연구를위한 하트 랜드 연구소 (#UL1TR606381). 내용은 전적으로 저자의 책임이며 반드시 NIH 또는 NCATS의 공식 견해를 나타내는 것은 아닙니다. 우리는 건강한 자원 봉사자와 ALS 환자에게서 혈액 샘플 수집을 위한 IRB 승인을 얻기위한 캔자스 대학 의료 센터 ALS 클리닉 개인에 감사드립니다. 저자는 원고의 교정에 대한 엠레 아그바에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 12-230 kDa Separation kit | ProteinSimple | SM-W004 | Contains pre-filled assay plate and 25-channel capillary cartridge |
| 3000G Thermocycler | Techne | FTC3G/02 | We used this thermocylcer for heating the sample mix |
| Anti-Mouse detection kit | ProteinSimple | 042-205 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-P(S409-410) TDP-43 antibody | ProteinTech | 22309-1-AP | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-P(S409-412) TDP-43 antibody | CosmoBio-USA | TIP-PTD-P02 | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-Rabbit detection kit | ProteinSimple | DM-001 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-TDP-43 (pan) antibody | ProteinTech | 10782-2-AP | Primary antibody that recognizes whole TDP-43 protein |
| Compass for SimpleWestern (SW) | ProteinSimple | Ver.4.0.0. | Compass for SW is the control and data analysis application for SimpleWestern instruments |
| Sonic Dismembrator; Model100 | Fisher Scientific | Sonicator. Used to rupture the cell membrane. This model is discontinued (Model XL2000-350) | |
| Table top centrifuge | Eppendorf | 22625004 | Model# 5810 with swinging plate bucket |
| Wes analyzer | ProteinSimple | 55892-WS-2203 | Performs the capillary gel electrophoresis |
참고문헌
- Blair, P., Flaumenhaft, R. Platelet alpha-granules: basic biology and clinical correlates. Blood Reviews. 23 (4), 177-189 (2009).
- Mercado, C. P., Kilic, F. Molecular mechanisms of SERT in platelets: regulation of plasma serotonin levels. Molecular Interventions. 10 (4), 231-241 (2010).
- Goubau, C., et al. Regulated granule trafficking in platelets and neurons: a common molecular machinery. European Journal of Paediatric Neurology. 17 (2), 117-125 (2013).
- Basu, S. S., et al. Human platelets as a platform to monitor metabolic biomarkers using stable isotopes and LC-MS. Bioanalysis. 5 (24), 3009-3021 (2013).
- Wilhite, R., et al. Platelet phosphorylated TDP-43: an exploratory study for a peripheral surrogate biomarker development for Alzheimer's disease. Future Science OA. 3 (4), 238(2017).
- Worth, A. J., et al. LC-MS Analysis of Human Platelets as a Platform for Studying Mitochondrial Metabolism. Journal of Visualized Experiments. (110), e53941(2016).
- Statland, J. M., et al. Rasagiline for amyotrophic lateral sclerosis: A randomized, controlled trial. Muscle and Nerve. 59 (2), 201-207 (2019).
- Charytan, D. M., et al. Safety and cardiovascular efficacy of spironolactone in dialysis-dependent ESRD (SPin-D): a randomized, placebo-controlled, multiple dosage trial. Kidney International. 95 (4), 973-982 (2019).
- Ugras, S. E., Shorter, J. RNA-Binding Proteins in Amyotrophic Lateral Sclerosis and Neurodegeneration. Neurology Research International. , 432780(2012).
- Amador-Ortiz, C., et al. TDP-43 immunoreactivity in hippocampal sclerosis and Alzheimer's disease. Annal of Neurology. 61 (5), 435-445 (2007).
- Baloh, R. H. TDP-43: the relationship between protein aggregation and neurodegeneration in amyotrophic lateral sclerosis and frontotemporal lobar degeneration. FEBS Journal. 278 (19), 3539-3549 (2011).
- Buratti, E., Baralle, F. E. The molecular links between TDP-43 dysfunction and neurodegeneration. Advances in Genetics. 66, 1-34 (2009).
- Guo, W., et al. An ALS-associated mutation affecting TDP-43 enhances protein aggregation, fibril formation and neurotoxicity. Nature Structural Molecular Biology. 18 (7), 822-830 (2011).
- Geser, F., et al. Motor neuron disease clinically limited to the lower motor neuron is a diffuse TDP-43 proteinopathy. Acta Neuropathologica. 121 (4), 509-517 (2011).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Buratti, E., Baralle, F. E. TDP-43: gumming up neurons through protein-protein and protein-RNA interactions. Trends in Biochemical Sciences. 37 (6), 237-247 (2012).
- Fallini, C., Bassell, G. J., Rossoll, W. The ALS disease protein TDP-43 is actively transported in motor neuron axons and regulates axon outgrowth. Human Molecular Genetics. 21 (16), 3703-3718 (2012).
- Ayala, Y. M., et al. Structural determinants of the cellular localization and shuttling of TDP-43. Journal of Cell Sciences. 121, Pt 22 3778-3785 (2008).
- Fiesel, F. C., Kahle, P. J. TDP-43 and FUS/TLS: cellular functions and implications for neurodegeneration. FEBS Journal. 278 (19), 3550-3568 (2011).
- Birsa, N., Bentham, M. P., Fratta, P. Cytoplasmic functions of TDP-43 and FUS and their role in ALS. Seminars in Cell and Development Biology. , (2019).
- Liachko, N. F., et al. CDC7 inhibition blocks pathological TDP-43 phosphorylation and neurodegeneration. Annals of Neurology. 74 (1), 39-52 (2013).
- Qureshi, A. H., et al. Proteomic and phospho-proteomic profile of human platelets in basal, resting state: insights into integrin signaling. PLoS One. 4 (10), 7627(2009).
- Suominen, I., Koivisto, S. Increasing Precision When Pipetting Protein Samples: Assessing Reliability of the Reverse Pipetting Technique. American Laboratory. , (2011).
- Pipetting tool box for life sciences. , https://www.mt.com/us/en/home/library/guides/laboratory-division/life-science/pipetting-toolbox-for-life-sciences.html (2019).
- Hale, L. J., et al. 3D organoid-derived human glomeruli for personalised podocyte disease modelling and drug screening. Nature Communication. 9 (1), 5167(2018).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. Journal of Translational Medicine. 13, 182(2015).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Fourier, A., et al. Development of an automated capillary nano-immunoassay-Simple Western assay-to quantify total TDP43 protein in human platelet samples. Analytical and Bioanalytical Chemistry. 411 (1), 267-275 (2019).
- Compatibility, S.W.S.A.B. , https://www.proteinsimple.com/technical_library.html (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유