Method Article
Uso dell'elettroforesi capillare Immunoasis Immunoassay per la ricerca di potenziali biomarcatori della sclerosi laterale amiotrofica nelle piastrine umane
In questo articolo
Riepilogo
I biomarcatori a base di sangue per le malattie neurodegenerative sono essenziali per l'implementazione di studi clinici su larga scala. Un esame del sangue affidabile e convalidato dovrebbe richiedere un piccolo volume di campione, nonché essere un metodo di campionamento meno invasivo, conveniente e riproducibile. Questo documento dimostra che l'elettroforesi capillare ad alto rendimento immunoforesi soddisfa i criteri per il potenziale sviluppo di biomarcatori.
Abstract
L'immunoassay (CEI) di elettroforesi capillare, nota anche come tecnologia capillare occidentale, sta diventando un metodo di scelta per lo screening delle proteine e dei farmaci rilevanti per la malattia negli studi clinici. Riproducibilità, sensibilità, requisito di piccolo volume di campioni, multiplexing anticorpi per l'etichettatura di più proteine nello stesso campione, capacità automatizzata ad alta produttività di analizzare fino a 24 campioni individuali e requisito di breve tempo rendono CEI vantaggioso rispetto alla classica immunoasposizione delle macchie occidentali. Ci sono alcune limitazioni di questo metodo, come l'impossibilità di utilizzare un gel a gradiente (4%-20%) matrice, alto background con campioni biologici non raffinati, e indisponibilità commerciale di singoli reagenti. Questo documento descrive un metodo efficiente per l'esecuzione della CEI in un'impostazione di analisi multipla, ottimizzando la concentrazione delle proteine e la titolazione dell'anticorpo primario in una piastra di analisi e fornendo modelli user-friendly per la preparazione del campione. Sono inoltre descritti i metodi per misurare pan TDP-43 e il derivato del TDP-43 fosforo nel citosol di liscito piastrinico come parte dell'iniziativa nello sviluppo di biomarcatori a base di sangue per le malattie neurodegenerative.
Introduzione
L'obiettivo generale della CEI come descritto qui è quello di fornire un protocollo graduale aggiornato per l'analisi delle proteine bersaglio nelle piastrine umane. L'assegnazione di una molecola firmata dal sangue è uno dei compiti più importanti nel campo dello sviluppo di biomarcatori nelle malattie neurodegenerative umane, come il morbo di Alzheimer (AD), la sclerosi laterale amiotrofica (SLA), lobar frontotemporale degenerazione (FTLD), malattia di Parkinson (PD), miossidia del corpo di inclusione (IBM) e altre condizioni patologiche rilevanti per l'aggregazione delle proteine. Il rilevamento di piccole quantità di tali proteine firmate in grandi volumi di sangue con molti agenti interferenti è una sfida. Pertanto, la specificità, la sensibilità, la capacità di gestire un gran numero di campioni e la riproducibilità del metodo selezionato sono cruciali.
Le piastrine umane possono fungere da ambiente per identificare e assegnare potenziali proteine biomarcatori per le malattie neurodegenerative. Le piastrine offrono l'opportunità di fungere da modello di cellula primaria surrogata, che riflettono alcune caratteristiche delle cellule neuronali1,2,3. Ci sono alcune caratteristiche che fanno delle piastrine uno dei mezzi preferiti per analizzare le proteine candidate dei biomarcatori e i loro derivati chimici. In primo luogo, le piastrine possono essere facilmente acquisite utilizzando un approccio meno invasivo raccogliendo sangue dai donatori (cioè la venipuntura) o in grandi volumi dalle banche del sangue della comunità. In secondo luogo, le piastrine possono essere facilmente isolate dall'intero sangue con il minimo lavoro preparatorio nei laboratori minimamente attrezzati4,5. In terzo luogo, le piastrine non hanno nuclei; pertanto, sono una buona cellula modello per studiare le alterazioni del metabolismo senza regolazione trascrizionale. In quarto luogo, il contenuto di biomolecola delle piastrine è incapsulato; pertanto, il microambiente piastrico protegge il suo contenuto da sostanze interferenti al siero (cioè proteasi). Quinto, il plasma arricchito con piastrine può essere conservato a temperatura ambiente per 7-8 giorni senza perdere l'attività metabolica. Pertanto, le piastrine forniscono un modello di lavoro in cui i fattori esterni sono ridotti al minimo e controllati.
Le tecniche di immunoanalisi tradizionali come l'immunoblotting (ad esempio, il gonfiore occidentale) e il saggio immunosorbent legato agli enzimi (ELISA) sono più ampiamente utilizzate nell'analisi specifica delle proteine. Tuttavia, questi due metodi presentano diversi svantaggi, tra cui più fasi di analisi, requisiti di sostanze chimiche e reagenti pericolosi, grandi dimensioni del campione, problemi di riproducibilità del saggio e variabilità dei dati intergestiti. Ciò ha spinto lo sviluppo di un metodo più semplice con meno passi e realizzabile in un periodo relativamente breve. Anche se la classica tecnica western blot rimarrà un metodo di laboratorio popolare, la sua procedura a più fasi, forniture, rifiuti tossici (cioè acrilammide, metanolo, ecc.) e il tempo di analisi stanno diventando meno desiderabili quando si esegue quantitativamente ad alto rendimento analisi delle proteine.
Un approccio automatico CEI sta gradualmente diventando un metodo di scelta per i laboratori che conducono analisi proteiche ad alto throughput6. CEI elimina la necessità di gel, apparati di elettroforesi gel, membrane, elettroforesi e dispositivi di elettrotrasferimento, e più coinvolgimento di manipolazione fisica. Se progettato bene, un test CEI dovrebbe essere completato entro circa 3,5 h, tra cui l'analisi quantitativa dei dati, l'elettroferogramma di qualità della pubblicazione e grafici con analisi statistiche. Un'altra superiorità del sistema CEI è il suo fabbisogno di concentrazione di proteine 10x-20x in meno, che lo rende ideale per l'uso in campioni umani utilizzati negli studi clinici7,8.
La parte più critica della CEI è l'ottimizzazione delle condizioni di analisi per ogni anticorpo acquistato da diversi fornitori, il tipo di anticorpo (monoclonal vs policlonal), le concentrazioni proteiche ottimali, la preparazione del campione, la temperatura di denaturazione del campione e la tensione dell'elettroforesi applicata sui capillari. Abbiamo sviluppato un metodo di ottimizzazione del formato di prova singola per la CEI che dovrebbe essere implementato prima di qualsiasi nuovo analisi, che farà risparmiare tempo e risorse. Questa fase di ottimizzazione è seguita da una valutazione quantitativa automatizzata del derivato totale e fosforodella proteina legante DNA/RNA di risposta di trasattivazione (TARDP). Grazie alle sue dimensioni (43 kDa), l'acronimo TDP-43 verrà utilizzato in tutta questa carta. Qui, la proteina TDP-43 nel lisa lesarmo umana ottenuta da pazienti affetti da SLA viene valutata per aiutare a sviluppare il valore di fosfororylazione predittiva (PPV) come potenziale biomarcatore prognostico.
TDP-43 è un nuovo potenziale candidato per il biomarcatore della malattia per la SLA. Il TDP-43 è una proteina onnipresente in tutte le cellule nucleate; pertanto, le funzioni di TDP-43 durante vari eventi cellulari normali e nella malattia neurodegenerativa sono state studiate9,10,11,12,13,14. Anche se TDP-43 è una proteina nucleare15, ha la capacità di fare spoglie dentro e fuori tra il nucleo e il citoplasma a causa della presenza di localizzazione nucleare e sequenze di esportazione nucleare16,17,18,19. Il TDP-43 citoplasmaico è coinvolto in vari eventi cellulari, come la stabilità e il trasporto dell'mRNA, la risposta allo stress, la funzione mitocondriale, l'autofagosome20. Tuttavia, non si sa molto sul ruolo dei derivati fosforililati del TDP-43 oltre al loro coinvolgimento nella patogenesi della malattia neurodegenerativa21.
Questo protocollo illustra come ottimizzare le condizioni di analisi per analizzare il contenuto del TDP-43 e il suo derivato fosforelato nelle piastrine utilizzando l'approccio CEI. Poiché il TDP-43 fosforolato non è disponibile in commercio, si propone di utilizzare un valore predittivo di fosforo (PPV) per valutare i profili TDP-43 nei pazienti affetti da SLA. Questo sistema CEI utilizza un piccolo volume di miscela campione (2,5–3,0 L per capillare). La configurazione del volume totale del volume di analisi è di 8,0 gradi l per capillare in base al protocollo del produttore; quindi, i ricercatori possono utilizzare una preparazione di miscela campione per due piste separate. Il produttore ha progettato il protocollo di analisi in modo che eventuali errori di pipettaggio siano ridotti al minimo, se non completamente eliminati. Le 24 miscele individuali di campione di lisminato umano sono suddivise in mezzi volumi (ad es. 2,5–3,0 l per campione) e analizzate consecutivamente da due diversi anticorpi entro i 7 h. Il sistema CEI descritto qui fornisce una modalità di analisi ad alto e veloce desiderabile. Gli utenti devono testare gli anticorpi di diversi fornitori e campionare le modalità di preparazione per la proteina bersaglio prima di eseguire lo screening su larga scala.
Protocollo
Tutti i protocolli relativi alla lavorazione delle piastrine umane seguono le linee guida dei comitati IRB dell'Università del Kansas Medical Center e della Kansas City University of Medicine e Biosciences.
1. Preparazione di buffer e reagenti
NOTA: Preparare tutti i campioni in base alle linee guida del produttore. Indossare attrezzature di protezione personale (cappotti da laboratorio, guanti e occhiali) durante questa procedura.
- Preparare il tampone di lavaggio citrato combinando 0,941 g di saccarosio (11 mM di concentrazione finale), 6,4 mL di 5 M NaCl (finale 128 mM), 5,4 mL di 0,2 M NaH2PO4 (4,3 mM finale), 9,4 mL di 0,2 M Na2PHO4 (7,5 mm finale), 0,352 g di citrato di sodio (finale di 4,8 mm) e 0,115 g di acido citrico (2,4 m finali). Regolare il volume totale a 250 mL con ddH2O. Filtrare attraverso un disco di filtro da 0,45 m e regolare il pH a 6,5. Conservare fino a 1 anno a 4 gradi centigradi. Portare la temperatura ambiente della soluzione (RT) prima di utilizzareil 22.
- Preparare il buffer di rottura combinando 250 mM di saccarosio, 1 mM EDTA e 10 mM Tris-Cl (pH 7.4) in un volume finale di 100 mL. Conservare fino a 1 anno a 4 gradi centigradi. Aggiungete 2 - L di asinori di fosforo (1:1000 finale) e 1 -L di cocktail inibitori della proteasi (1:2000 finale) in 2 mL di tampone di rottura. Tenere sul ghiaccio fino all'uso. Eliminare il buffer di rottura inutilizzato.
2. Isolamento piastriche
- Raccogliere 8-10 mL di sangue umano nel tubo di raccolta del sangue giallo-cap contenente soluzione acido-citrato-dextrose (ACD) (75 mM trisodium citrate, 124 mM dextrose e 38 mM di acido citrico, pH 7,4; ACD:sangue : 1:9). Mescolare delicatamente a mano il contenuto del tubo 5x-6x.
- Centrifugare i tubi a 200 x g in un rotore a benna oscillante per 20 min a RT.
- Raccogliere il plasma ricco di piastrine (PRP) in un tubo inferiore conico da 15 mL e lasciare circa 0,5 mL del PRP dal cappotto buffy (frazione dall'aspetto nebuloso) per evitare la contaminazione. Se si verifica una contaminazione da globuli rossi, ripetere questo passaggio.
- Centrifugare i campioni di PRP a 1.200 x g per 15 min a RT.
- Lavare i pellet piastriche (P1) con una leggera sospensione in 1 mL di tampone e pellet di citrate con centrifugazione a 1.200 x g per 15 min a RT.
- Salvare il pellet piastrino puro. Scartare il super-attardato.
- Risospendere i pellet piastriche in 600 gradi del tampone di rottura contenenti cocktail inibitori.
- Sonicare la sospensione piastriniera utilizzando un sonicatore. Mettere il campione in un mini secchio di ghiaccio. Impostare il sonicatore all'impostazione 3 per 20 s in modalità continua.
NOTA: Assicurarsi di pulire la sonda con il 10% di candeggina seguita da acqua distillata. - Centrifugare i campioni sonori a 20.000 x g per 30 min a 4 gradi centigradi per rimuovere le frazioni smembranose. Aliquote in 60 l e conservare a -80 gradi centigradi. Evitare ripetuti cicli di scongelamento/congelamento per le frazioni citosoliche piastriche.
3. Preparazione per CEI
N: 100 luna di lispetto di piastrine umane è stato combinato da pazienti affetti da SLA (n - 8-10) e soggetti sani (n - 8-10) sono stati raggruppati separatamente e utilizzati per l'ottimizzazione del saggio.
- Compilare i modelli generati internamente per il layout CEI (Tabella 1) e la preparazione di esempio (Tabella 2). La tabella di preparazione della miscela di esempio è dinamica e calcolerà automaticamente la quantità di volume da rimuovere dalla sorgente.
NOTA: se il volume di origine richiesto immesso nella tabella dinamica 2, il volume del buffer campione 0,1 X verrà calcolato automaticamente. - Preetichetta 25 tubi PCR da 25 mL con capillari #1 #25 e metterli in un rack PCR. Situato sul ghiaccio.
- Preetichettare i tubi di microcentrifuga da 0,6 mL: uno per ogni anticorpo primario e diluizione (se necessario) da utilizzare, uno per il buffer del campione da 0,1x, uno per il luminolo-S/perossido e uno per ogni campione da diluire (se necessario). Metteteli sul ghiaccio nel rack del tubo.
- Estrarre il buffer di campionamento, il buffer di lavaggio, una piastra e una cartuccia forniti nel modulo di separazione del kit master CEI 12–230 kDa.
- Dal frigorifero a 4 gradi centigradi, estrarre il buffer di diluizione degli anticorpi, gli anticorpi primari, gli anticorpi secondari, il luminol, il perossido di idrogeno e il pacchetto standard. Posizionare tutti i reagenti sul ghiaccio, ad eccezione del pacchetto standard, che rimane a RT.
NOTA: I reagenti delle confezioni standard sono liofilizzati e sigillati con una copertura di lamina. Questi devono essere filati brevemente utilizzando una mini centrifuga prima dell'apertura per ridurre la perdita di prodotto. Per aprire, i tubi del reagente possono essere forati da una punta della pipetta o tirati indietro dall'angolo. - Per preparare il DTT da 400 mM MM, aggiungere 40 L di acqua diionizzata al tubo trasparente contenente il DTT.
- Per preparare 40 l di miscela master fluorescente 5x, aggiungere 20 l del buffer di campionamento 10x e 20 l della soluzione DTT da 400 mM preparata al tubo rosa fornito nel kit.
- Per preparare la scala biotinylata, aggiungere 16 L di acqua deionizzata, 2 L di 10x buffer di campione e 2 L della soluzione DTT preparata da 400 mM al tubo bianco fornito nel kit. Mescolare delicatamente e trasferire in un tubo PCR da 0,2 mL per la denatura.
- Preparare il buffer del campione 0,1x aggiungendo 1,5 lofun di 10x di buffer di campione e 148,5 l'l di acqua deionizzata a un tubo di microcentriera da 0,6 mL. Vortice per mescolare e mettere sul ghiaccio.
- Preparare le diluizioni anticorpali desiderate. Aggiungere il diluente anticorpo nei volumi designati a ciascun tubo microcentrico pre-etichettato. Se i volumi sono identici, utilizzare la tecnica di reversepipetta23; in caso contrario, pre-risciacquare la punta della pipetta prima dell'erogazione.
NOTA: In questo saggio, sono stati utilizzati anticorpi pan a-TDP-43 e a-p(S409/410-2) TDP-43. Anticorpi anti-ERK è stato utilizzato per un controllo interno per assicurarsi che i componenti di analisi stanno lavorando. - Eseguire il reverse pipetting per la diluizione degli anticorpi come descritto di seguito. In alternativa, ulteriori informazioni possono essere trovate nella letteratura24.
NOTA: La tecnica di pipettaggio inverso è preferibile quando si distribuiscono piccoli volumi sequenziali di soluzioni23. Questa tecnica offre alcuni vantaggi: (i) fornendo un volume preciso, (ii) eliminando la schiuma reagente nell'orifizio della punta e (iii) ideale per reagenti di piccole dimensioni (<5 , l'uomo), soluzioni viscose, soluzioni surfactant e soluzioni ad alta pressione di vapore.- Mettere una punta adeguata in una pipetta e premere lo stantuffo fino alla seconda fermata (Step-2). Immergere la punta del tubo di qualche millimetro nella soluzione. Rilasciare lentamente lo stantuffo per riempire la punta del tubo con la soluzione mentre la punta è ancora immersa nella soluzione. Rimuovere la punta dalla soluzione e toccare delicatamente contro il bordo del serbatoio del reagente in modo che il liquido in eccesso rimanente all'esterno della punta venga rimosso.
- Dispensare la soluzione premendo lo stantuffo verso il basso fino alla prima fermata (Step-1). Non erogare la soluzione rimanente nella punta.
- Svuotare la soluzione rimanente nella punta al serbatoio del reagente premendo lo stantuffo fino alla seconda fermata (Step-2). Rilasciare lo stantuffo nella posizione pronta per la fase di pipettaggio successiva.
- Aggiungere l'anticorpo richiesto nei volumi designati a ciascun tubo di microcentrifuga pre-etichettato (Tabella 1) Non pre-rinseacquare la punta del pipet: aggiungerlo direttamente al diluente e lavare la punta più volte per rimuovere l'anticorpo. Posizionare i tubi sul ghiaccio.
- Per preparare il modello di miscela CEI, eseguire i passaggi elencati di seguito per i tubi PCR con l'etichetta da 2 a tappo 25: questo è lo stesso ordine in cui appare nella tabella 1.
- Aprire tutti i tubi, aggiungere 1,6 l'll di buffer di campione fluorescente 5x ad ogni tubo utilizzando una tecnica di tubiinvere, quindi chiudere ogni tubo PCR dopo l'aggiunta del buffer 5x per ridurre al minimo la perdita del campione.
- Aprire tutti i tubi, aggiungere 0,1x buffer campione in volumi designati nella tabella 2 per ogni tubo, quindi chiudere immediatamente dopo. Se i volumi sono identici, utilizzare una tecnica di reverse pipetta. In caso contrario, pre-risciacquare la punta del pipet prima di erogare il buffer campione 0,1x.
- Aprire tutti i tubi, aggiungere il campione di proteine nei volumi designati nella tabella 2 per ogni tubo, quindi chiudere immediatamente dopo. Se i volumi sono identici, utilizzare la tecnica di reverse pipetta. In caso contrario, pre-risciacquare la punta del pipet prima di erogare il buffer campione 0,1x.
- Centrifugabrevemente tutti i tubi PCR in una centrifuga da banco (13.000 x g per 30 s), tubi PCR flick/vortice per mescolare, quindi ripetere la centrifugazione.
- Trasferire tutti i tubi PCR nel termociclore con un coperchio riscaldato. Campioni di denatura a temperatura e durata definite (cioè 95 gradi centigradi per 5 min; 70 gradi centigradi per 10 min).
NOTA: la temperatura di denaturazione e la durata devono essere ottimizzate per le proteine bersaglio. - Ripetere il passaggio 3.12.4.
- Riportare tutti i tubi PCR al rack dei tubi e posizionarli sul ghiaccio.
- Durante la fase di denatura, preparare la soluzione di sviluppo (soluzione 1:1 luminol-S:peroxide), quindi aggiungere 200 l di luminol-S e 200 -L di perossido. Mettere sul ghiaccio.
- Per caricare una piastra pre-riempita CEI con il campione preparato in precedenza, dispensare reagenti e campioni nella piastra di analisi mostrata nel layout di analisi (Figura 1). Evitare di introdurre bolle d'aria.
NOTA: se i volumi e la soluzione sono identici, utilizzare una tecnica di pipettaggio inverso. In caso contrario, presciacquare la punta del tubo prima dell'erogazione e non espellere bene il resto nella piastra utilizzando la seconda tabulazione sulla pipetta. Un modulo di separazione da 12-230 kDa può contenere una guida al caricamento delle piastre codificate a colori. Posizionare questa guida sotto la piastra mentre si aggiungono reagenti e campioni al pozzo, che aiuta visivamente durante il caricamento del campione. La guida al caricamento delle lastre può essere scaricata anche dal sito web dell'azienda.- Nella riga E, aggiungere 15 l of luminol:perossido in ogni pozzo.
NOTA: Idealmente, preparare questo reagente appena prima dell'uso e aggiungerlo a ciascun pozzo. Se questo non è conveniente, questa miscela può essere preparata non più di 30 min prima del caricamento della piastra. - Nella riga D, a ben D1, aggiungere 10 -L di streptavidin-HRP.
- Nella riga D, nei pozzi D2–D25, aggiungere 10 -L di anticorpo secondario designato.
- Nella riga B, ad ogni pozzo, aggiungere 10 - L di anticorpo diluente.
- Nella riga C, nel pozzo C1, aggiungere 10 - L di anticorpo diluente.
- Nella riga C, ai pozzi C2–C25, aggiungere 10 L di anticorpo primario designato.
- Nella fila A, a pozzo A1, aggiungere 5 ll di scala biotinylata dal tubo PCR #1.
- Nella riga A, ai pozzi A2–A25, aggiungere 3 Ll del campione, i tubi PCR #2 #25 nei pozze corrispondenti #2-#25.
- Aggiungere 500 l di tampone di lavaggio in ogni tampone di lavaggio designato.
- Centrifugare la piastra per 5 min a 1.000 x g a RT.
- Nella riga E, aggiungere 15 l of luminol:perossido in ogni pozzo.
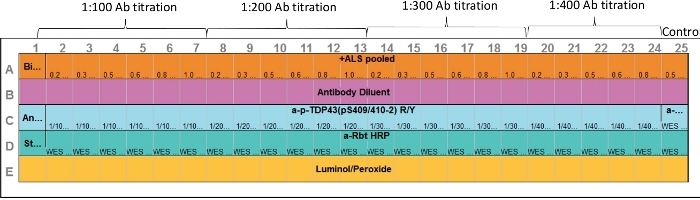
Figura 1: Layout di esempio. Sia l'anticorpo primario che l'ottimizzazione del campione proteico bersaglio possono essere eseguite in un unico analisi. I capillari 2–7, 8–13, 14–19 e 20–24 rappresentano varie concentrazioni proteiche e gamma di anticorpi primari. Capillary 25 rappresenta il controllo positivo. È stato utilizzato l'anticorpo anti-ERK; tuttavia, è possibile includere qualsiasi controllo positivo appropriato. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Esecuzione del CEI sulla piastra 1
- In primo luogo, attivare l'analizzatore CEI (Table of Materials), quindi accendere il computer. Aprire il software (Tabella dei materiali)
- Collegare l'analizzatore al sistema online (Tabella dei materiali). Questo è un passaggio necessario per raccogliere i dati di esecuzione per scopi di risoluzione dei problemi e recupero dei dati.
- Fare clic su Strumento dal menu in alto a sinistra, quindi fare clic su Connetti. Selezionare il numero di serie dello strumento che appare come menu a comparsa. Fare clic su Connetti.
- Selezionare la scheda "Assay" e selezionare Nuovo assay o selezionare un modello salvato.
- Immettere i parametri di qualità (Tabella 1) o modificare il modello attualmente. Salvare il nome e il percorso del file.
- Assicurarsi che l'indicatore di colore blu lampeggiante nell'analizzatore rimanga blu a tinta unita.
- Toccare il pulsante metallo d'argento sulla parte superiore della porta arancione per aprire.
- Rimuovere con cura la cartuccia capillare dal suo imballaggio. Inserire la cartuccia capillare come descritto dal protocollo del produttore. Se installata correttamente, la luce interna diventa "blu".
- Rimuovere il sigillo protettivo dalla piastra del saggio. Osservare visivamente i pozzi pre-riempiti per le bolle d'aria. Se osservati, pop con una piccola punta pipet (long-albero P10 pipet punta funziona bene).
- Caricare il supporto della piastra posizionando la piastra di esempio e chiudendo la porta. Nel computer, fare clic sul pulsante Start.
- Mettere la botteghe di ghiaccio contenente reagenti sensibili alla temperatura e i campioni al buio a 4 gradi centigradi fino a quando non è pronto per preparare la seconda piastra pre-riempita.
- Lasciare i reagenti/i rifornimenti a temperatura ambiente per la seconda piastra.
5. Esecuzione della CEI sulla piastra 2
NOTA: questa piastra è impostata per l'analisi dei livelli di TDP-43 fosforolati.
- Rimuovere la tegola di ghiaccio immagazzinata a 4 gradi centigradi e posizionarla sul banco, 1 h prima del tempo di completamento stimato della prima piastra. Recuperare una seconda piastra e cartuccia.
- Preparare eventuali diluizioni anticorpali necessarie per la seconda corsa e conservarle sul ghiaccio. Preparare la soluzione fresca 1:1 luminol-S:perossido (passaggio 3.12.8 sopra).
- Remixare e ri-centrifugare brevemente il mix di campioni e i reagenti necessari per caricare la piastra pre-riempita. Caricare la seconda piastra secondo figura 1. Caricare una soluzione anticorpale TDP-43 a-p(S409-410-2) nei pozzetti di fila C.
- Al termine della prima concorsa, scartare la prima piastra e la cartuccia. Rimuovere la cartuccia e metterla in un contenitore affilato per lo smaltimento. Conservare gli adesivi dalla piastra e dalla cartuccia a scopo di riferimento.
- Chiudere il file del software e riselezionare lo stesso modello. Il software ricorderà le impostazioni dell'esecuzione precedente. Apportare le modifiche necessarie all'annotazione (ad esempio, modificando l'anticorpo primario).
- Ripetere i passaggi da 4.8 a 4.10. Stocca tutti i reagenti e i materiali di consumo del modulo di separazione del kit master da 12 a 230 kDa
- Scartare il campione-mix CEI, le diluizioni degli anticorpi, il buffer del campione 0,1x e le miscele di luminol-S:perossido in conformità con le normative universitarie.
6. Analisi dei dati
- Una volta completata l'esecuzione, assicurarsi che vengano eseguiti i seguenti controlli di qualità.
- Nel software, selezionare l'icona Mostra standard e la scheda Vista grafico. Correggere i disallineamenti selezionando Imponi standard o facendo clic con il pulsante destro del mouse sul picco errato, quindi selezionando Non standard. Eseguire questo controllo per ogni nuovo capillare.
- Fare clic su Esempi e sull'icona Vista singola. Selezionare #1 capillari (scala biotinylata) nella scheda dell'esperimento. Fare clic sul picco nella vista grafico e selezionare Rimuovi picco, se una selezione errata del picco viene eseguita dal software.
NOTA: Ad esempio, la scala biotinylat a 12-230 KDa mostrerà picchi di dimensionamento a 12 kDa, 40 kDa, 66 kDa, 116 kDa, 180 kDa e 230 kDa. Il dimensionamento dei picchi di campionamento non sarà corretto se questo passaggio non viene eseguito e genererà risultati imprecisi. - Visualizzare il filmato elettroforetico e notare se si è verificata una migrazione anomala durante l'esecuzione.
- Derivare i dati (ad esempio, tabella picchi, tra cui peso molecolare, area di picco, altezza di picco e segnale-rumore [S/N]) in base alle esigenze per ulteriori calcoli. Nell'angolo superiore destro della finestra Grafico sono disponibili strumenti di annotazione del grafico per fornire ulteriori informazioni sul grafico.
Risultati
Ottimizzazione della concentrazione di proteine citosoliche piastriche e titolazione dell'anticorpo primario
È importante stabilire una gamma dinamica lineare di proteine citosoliche piastriche nel saggio, poiché i cambiamenti nel segnale sono direttamente proporzionali ai cambiamenti delle proteine nel citosol piastrinico. L'uso di miscela di lispetto di piastrine intere nell'analisi può ridurre l'intensità del segnale delle proteine bersaglio (TDP-43 e P(S409-412) TDP-43) e contribuire a un segnale di fondo elevato. Pertanto, in questo saggio, è stato utilizzato il chiaro supernatante (frazione citosolica) dopo larotturadelle piastrine ( Figura 2 ).
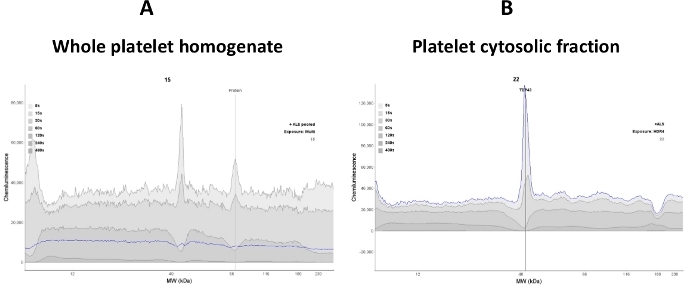
Figura 2: La chiarezza del segnale dipende dalla qualità del campione. (A) Il lisato a piastrine intere interferisce con il legame anticorpo anti-TDP-43; quindi, è stato osservato un elettrofererogramma rumoroso. (B) La frazione citosolica piastrinica è stata ottenuta sottoponendo l'intero lismiato alla centrifugazione (16.000 x g per 30 min). La maggior parte delle proteine membranose sono state rimosse; quindi, il legame degli anticorpi anti-TDP-43 alla proteina TDP-43 è stato migliorato (traccia linea blu). Fare clic qui per visualizzare una versione più grande di questa figura.
Una gamma dinamica lineare per la concentrazione di proteine del citosol piastriso è stata stabilita a 0,2–0,8 mg/mL. È stato adottato un modello di analisi in modo che sia la concentrazione di proteine che la titolazione primaria degli anticorpi fossero in grado di essere eseguite in un unico analisi (Figura 3).
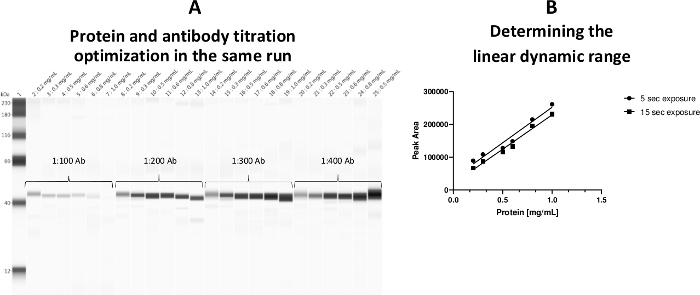
Figura 3: Gamma dinamica lineare per la concentrazione di proteine del citosol piastrinico. (A) Sia le concentrazioni proteiche che le titrazioni degli anticorpi sono state ottimizzate in una piastra durante lo stesso ciclo. (B) È stata stabilita la gamma di lavoro lineare (0,2–0,8 mg/mL) per le proteine. Un carico di proteine da 0,5 mg/mL è stato etichettato con un anticorpo a-ERK come il controllo positivo (capillare 25). Fare clic qui per visualizzare una versione più grande di questa figura.
Va notato che il contenuto di glicerolo nel tubo di preparazione del campione dovrebbe essere inferiore al 20% (finale), altrimenti l'alta concentrazione di glicerolo influenzerà negativamente il legame dell'anticorpo primario.
Determinazione del tempo di esposizione ottimale
Nella versione precedente del software, il tempo di esposizione ottimale doveva essere determinato tracciando l'area di picco contro la concentrazione di proteine (mg/mL). La nuova versione fornisce un nuovo strumento denominato profilo di rilevamento High Dynamic Range (HDR) (Figura 4). L'utilizzo del pannello immagini ha fornito la possibilità di visualizzare tutti i tempi di esposizione (ad es. 5 s, 15 s, 30 s, 60 s, 120 s, 240 s, 480 s) insieme. Il software informatico ha analizzato tutti i tempi di esposizione e identificato automaticamente il miglior tempo di esposizione (HDR). Il profilo di rilevamento HDR ha fornito una gamma dinamica significativamente più ampia grazie alla maggiore sensibilità della CEI, il che significa una migliore rilevazione e quantificazione su un intervallo di concentrazione del campione più ampio. Tuttavia, gli utenti hanno ancora la possibilità di scegliere qualsiasi tempo di esposizione che soddisfi l'obiettivo sperimentale. Utilizzando questa funzione, è stato trovato un tempo di esposizione ottimale per la proteina TDP-43. Il picco rappresenta il tempo di esposizione ottimale (Figura 4A). Un tempo di esposizione unico (4 s) è stato definito per questo anticorpo dopo aver esaminato tutti e nove i tempi di esposizione compresi tra 1 e 512 s (Figura 4B).

Figura 4: Profilo di rilevamento ad alta gamma dinamica (HDR) per una proteina bersaglio. (A) Il picco proteico TDP-43 rappresenta il tempo di esposizione ottimale per la proteina bersaglio. A-TDP-43 L'abtotrazione era 1:300, e la concentrazione di proteine del citosol piastrinico era di 0,5 mg/mL. La linea blu definita dal software indica il tempo di esposizione ottimale. (B) Questa cifra rappresenta un tempo di esposizione singola definito dall'utente (4 s) dopo aver esaminato tutti e nove i tempi di esposizione compresi tra 1 e 512 s. Fare clic qui per visualizzare una versione più ampia di questa cifra.
Livelli di TDP-43 nel citosol delle piastrine umane dei pazienti affetti da SLA
È stato eseguito uno sviluppo di biomarcatori della base sanguigna. Utilizzando condizioni di analisi ottimizzate, le frazioni citosoliche di liscito piassotico ottenute dai pazienti affetti da SLA sono state analizzate utilizzando due serie di anticorpi (ad esempio, anticorpi anti-TDP-43 [Pan], un anticorpo che riconosce derivati fosforilici della proteina TDP-43; qui è stato utilizzato a-P [S409/410-2]. In questa dimostrazione vengono presentati il TDP-43 specifico della malattia e il relativo derivato fosforato (Figura 5).
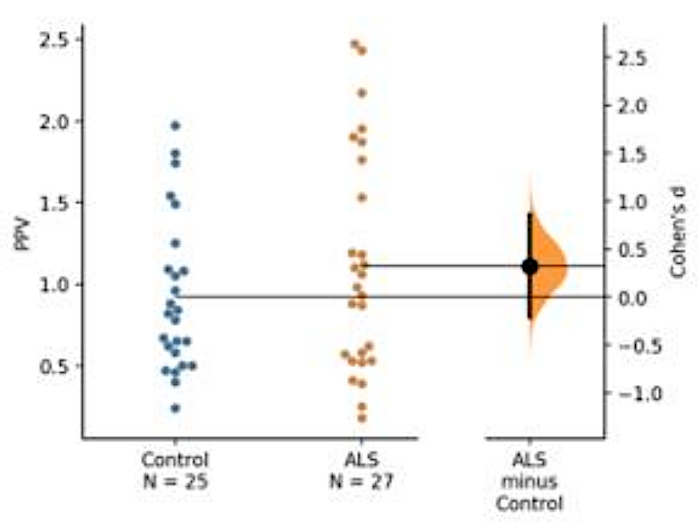
Figura 5: Rappresentazione del valore predittivo di fosforo (PPV) di TDP-43. La quantità assoluta di TDP-43 e pan TDP-43 da sola non ha mostrato molta differenza tra la SLA e i gruppi di controllo. Tuttavia, la PPV ha indicato un leggero aumento della coorte di SLA, anche se non vi è stata alcuna differenza statistica tra i due gruppi a causa di un numero insufficiente di soggetti (SLA - 25, controllo 27). Un basso valore d di Cohen tra i mezzi di SLA e gruppo di controllo ha mostrato una bassa dimensione dell'effetto tra i due gruppi a causa della piccola dimensione del campione (controllo : 25, SLA e 27). Fare clic qui per visualizzare una versione più grande di questa figura.
Il TDP-43 totale è stato quantificato utilizzando la curva di calibrazione (Figura 6)

Figura 6: Curva di calibrazione standard. Le concentrazioni di proteine TDP-43 acquistate commercialmente sono state utilizzate per costruire una curva standard. Ogni dato rappresenta la media dei triplicati. Le intensità della banda proteica erano dipendenti dalla concentrazione (Inset). Fare clic qui per visualizzare una versione più grande di questa figura.
La quantificazione della proteina TDP-43 fosforifilata non era possibile a causa dell'indisponibilità commerciale di questa proteina. Invece, è stato stabilito un valore di fosfororylazione previsto (PPV) che definisce la percentuale delle specie fosforelate di TDP-43. PPV è stato determinato da due analisi CEI sequenziali per lo stesso campione utilizzando l'equazione seguente.

La variabilità del saggio intra e interrun è stata testata in frazioni di citosoliche umane della SLA umane raggruppate (Figura 7)
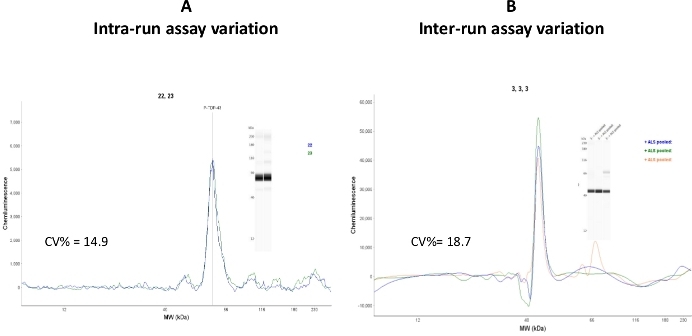
Figura 7: Variazioni di saggio. (A) Due capillari carichi dello stesso campione sono stati analizzati dalla CEI, e la variazione di analisi intra-corsa è stata calcolata come CV% - 14,9. (B) Lo stesso campione è stato analizzato in tre diversi giorni di analisi e in tre diverse prove. La variazione del saggio inter-run è stata calcolata come CV% - 18,7. Fare clic qui per visualizzare una versione più grande di questa figura.
Sebbene i valori di variazione del coefficiente intra-run (variazione capillare-capillare) siano diminuiti nell'intervallo accettabile (CV% - 14,9), il valore del saggio interattorseguito è stato relativamente alto (CV% - 18,7). Si interpreta che questa variazione può essere dovuta all'uso di cartucce capillari e piastre campione provenienti da lotti diversi. Si raccomanda di eseguire studi di riproducibilità nei componenti CEI che hanno lo stesso numero di lotto.
Tabella 1: modello di caricamento della piastra di analisi CEI. Fare clic qui per scaricare questa tabella.
Tabella 2: Modello di preparazione interattivo della miscela di campioni. Dopo aver inserito la concentrazione di proteine di riserva da campioni sconosciuti, le cellule interattive calcoleranno automaticamente quanto volume deve essere utilizzato per preparare il mix di campioni. Fare clic qui per scaricare questa tabella.
Discussione
L'immunoanalisi a base elettroforetica capillare è ora il metodo di scelta per l'analisi dei campioni ad alta produttività e gli screening farmacologici25. Piccoli volumi di campioni, componenti di analisi ben ottimizzati, piattaforma e strumentazione di analisi user-friendly, spese di reagente e bassa percentuale di CV sono vantaggi primari26,27. Anche se ci sono diversi metodi per separare le proteine in diverse modalità di analisi, la CEI a base di anticorpi qui descritta può essere adattata da piccoli laboratori che sono impegnati nello sviluppo di biomarcatori a base di sangue. La tecnologia di analisi CEI utilizzata qui fornisce misurazioni affidabili, riproducibili e sensibili per TDP-4328 e il suo derivato fosforolato5.
Il sistema CEI fornisce anche una scelta multiplexante di analizzare simultaneamente Il TDP-43 e i suoi derivati fosforizzati e di fornire la quantificazione diretta della proteina bersaglio, se è disponibile una proteina bersaglio purificata o ricombinante. La proteina TDP-43 ricombinante a lunghezza intera è disponibile in commercio; tuttavia, il derivato TDP-43 ricombinante non è. Poiché il TDP-43 fosforolato non è disponibile in commercio, è stato implementato un valore predittivo di fosforo (PPV) per valutare il profilo DiPS-43 nei pazienti affetti da SLA. Le quantità di TDP-43 e di TDP-43 sono state etichettate in modo permanente con un fluoroforo; pertanto, il profilo TDP-43 rimane lo stesso con o senza un'unità quantitativa (ad esempio, ng/mL, pg/mL, ecc.). Sebbene determinare la quantità assoluta di TDP-43 e i suoi derivati fosforilati (cioè, P [S409-410-12] TDP-43) fornisca una misurazione più quantitativa, il calcolo del PPV elimina la necessità del fosforo ricombinante TDP-43 per la standardizzazione, poiché non è disponibile commercialmente.
LA CEI fornisce diversi checkpoint nella piattaforma di analisi per identificare con precisione il problema nel caso in cui un saggio abbia esito negativo. Questo elimina gli ostacoli e fornisce una migliore progettazione sperimentale. La procedura di analisi è completamente automatizzata tranne che per il riempimento della piastra campione. Questa è una caratteristica significativa rispetto all'analisi standard del blotting occidentale. Questa funzionalità garantisce la coerenza dall'esecuzione all'esecuzione. Anche se ogni laboratorio ha procedure operative standard uniche, è importante aderire a pratiche che minimizzano l'errore umano. Ad esempio, è fondamentale preparare la miscela di luminol-S/perossido appena prima del caricamento della piastra, poiché l'aggiunta di perossido nel luminol avvia la reazione enzimatica e consuma il substrato luminolo. Anche il caricamento di campioni e anticorpi primari/secondari in pozzi di lamiere senza bolle d'aria sono passi di importanza critica.
Inoltre, dal momento che i pozzi di piastra sono piccoli in volume e non c'è spazio tra i pozzi, gli utenti dovrebbero usare cautela durante la pipettatura, che è il passo più importante dal momento che tutto il resto è automatizzato. L'ordine di caricamento dei campioni, degli anticorpi e di altri reagenti è importante per la coerenza del test (Figura 1). Il processo di preparazione della piastra dura circa 40-45 min. Pertanto, si consiglia di caricare prima la piastra con i componenti di test necessari e preparare la miscela luminol-S/perossido poco prima del pipettaggio. In questo modo, c'è una sequenza coerente di aggiunta di reagente, e la potenza costante del segnale di luminescenza sarà raggiunta. Non è consigliabile utilizzare un reagente luminol-S/perossido scaduto, in quanto influisce principalmente sulla forza del perossido. I recenti progressi nell'introduzione del sistema split-buffer e nella gamma di compatibilità chimica e detergente hanno migliorato la qualità del test e prodotto risultati più riproducibili e prevedibili. Ora, un nuovo analizzatore combinato dello stesso produttore possiede una caratteristica per analizzare i campioni etichettati con chemiluminescenza e fluorescenza ha coniugato anticorpi nella stessa corsa. Questa nuova funzionalità elimina la necessità di eseguire consecutivamente due piastre individuali ed elimina le variazioni run-to-run.
Le piastre di saggio devono essere conservate a temperatura ambiente. Se si è scelto di conservare le piastre di prova in un frigorifero a 4 gradi centigradi, le piastre devono essere tolte la notte prima del saggio e portate a temperatura ambiente. I pozzi campione caricati in modo non corretto devono essere lavati ampiamente (4-5 volte) con buffer fornito nel kit prima di aggiungere il campione corretto. Ogni anticorpo primario e campioni biologici sono unici; pertanto, l'ottimizzazione anticorpo/proteina deve essere eseguita prima di analizzare i campioni per le proteine bersaglio nei fluidi biologici.
Qui, il tempo primario di incubazione degli anticorpi è stato fissato per 30 min per impostazione predefinita. Se il segnale è debole, gli utenti dovrebbero considerare di aumentare il tempo primario di incubazione degli anticorpi fino a raggiungere la forza del segnale desiderata senza burnout del segnale di fluorescenza. Per le piastrine umane, sono stati preparati e utilizzati campioni raggruppati da pazienti per un test di ottimizzazione. Il pooling del campione rappresenta meglio la variazione tra le biomolecole bersaglio. Si raccomanda di utilizzare supernatanti chiari piuttosto che lisato totale o omogeneo totale per la CEI.
L'alta concentrazione di proteine nella miscela di lisatura a piastrina intera può diminuire il rapporto segnale-rumore (Figura 2). I cicli di congelamento ripetuti dei campioni dovrebbero essere evitati, in quanto ciò influisce negativamente sul legame dell'anticorpo primario. Gli ingredienti del buffer di lysato sono importanti, in quanto alcuni reagenti non sono compatibili con CEI29. Si consiglia di controllare l'elenco dei reagenti compatibili fornito sul sito Web del produttore prima della preparazione del campione. Si tratta di una limitazione del sistema che non tollera condizioni di elevata rigorosezza per la preparazione del campione. Si raccomanda di ottimizzare i parametri di esecuzione della analisi (ad esempio, la diluizione degli anticorpi primari, la concentrazione delle proteine, il tempo di incubazione degli anticorpi primari, ecc.) utilizzando campioni raggruppati per analizzare successivamente i singoli campioni.
Divulgazioni
Gli autori dichiarano nessun interesse finanziario concorrente tranne ProteinSimple, Inc.
Riconoscimenti
Questa ricerca è stata sponsorizzata da una sovvenzione intramurale assegnata per A.A. Questo lavoro è stato sostenuto da una borsa di studio CTSA di NCATS assegnata al Centro Medico per Frontiere: The Heartland Institute for Clinical and Translational Research (#UL1TR606381). I contenuti sono di esclusiva responsabilità degli autori e non rappresentano necessariamente le opinioni ufficiali della NIH o del NCATS. Siamo grati per la clinica ALS dell'Università del Kansas Medical Center personal per aver ottenuto l'approvazione iRB per la raccolta di campioni di sangue da pazienti sani volontari e SLA. Gli autori ringraziano Emre Agbas per la correzione di bozze del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 12-230 kDa Separation kit | ProteinSimple | SM-W004 | Contains pre-filled assay plate and 25-channel capillary cartridge |
| 3000G Thermocycler | Techne | FTC3G/02 | We used this thermocylcer for heating the sample mix |
| Anti-Mouse detection kit | ProteinSimple | 042-205 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-P(S409-410) TDP-43 antibody | ProteinTech | 22309-1-AP | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-P(S409-412) TDP-43 antibody | CosmoBio-USA | TIP-PTD-P02 | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-Rabbit detection kit | ProteinSimple | DM-001 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-TDP-43 (pan) antibody | ProteinTech | 10782-2-AP | Primary antibody that recognizes whole TDP-43 protein |
| Compass for SimpleWestern (SW) | ProteinSimple | Ver.4.0.0. | Compass for SW is the control and data analysis application for SimpleWestern instruments |
| Sonic Dismembrator; Model100 | Fisher Scientific | Sonicator. Used to rupture the cell membrane. This model is discontinued (Model XL2000-350) | |
| Table top centrifuge | Eppendorf | 22625004 | Model# 5810 with swinging plate bucket |
| Wes analyzer | ProteinSimple | 55892-WS-2203 | Performs the capillary gel electrophoresis |
Riferimenti
- Blair, P., Flaumenhaft, R. Platelet alpha-granules: basic biology and clinical correlates. Blood Reviews. 23 (4), 177-189 (2009).
- Mercado, C. P., Kilic, F. Molecular mechanisms of SERT in platelets: regulation of plasma serotonin levels. Molecular Interventions. 10 (4), 231-241 (2010).
- Goubau, C., et al. Regulated granule trafficking in platelets and neurons: a common molecular machinery. European Journal of Paediatric Neurology. 17 (2), 117-125 (2013).
- Basu, S. S., et al. Human platelets as a platform to monitor metabolic biomarkers using stable isotopes and LC-MS. Bioanalysis. 5 (24), 3009-3021 (2013).
- Wilhite, R., et al. Platelet phosphorylated TDP-43: an exploratory study for a peripheral surrogate biomarker development for Alzheimer's disease. Future Science OA. 3 (4), 238(2017).
- Worth, A. J., et al. LC-MS Analysis of Human Platelets as a Platform for Studying Mitochondrial Metabolism. Journal of Visualized Experiments. (110), e53941(2016).
- Statland, J. M., et al. Rasagiline for amyotrophic lateral sclerosis: A randomized, controlled trial. Muscle and Nerve. 59 (2), 201-207 (2019).
- Charytan, D. M., et al. Safety and cardiovascular efficacy of spironolactone in dialysis-dependent ESRD (SPin-D): a randomized, placebo-controlled, multiple dosage trial. Kidney International. 95 (4), 973-982 (2019).
- Ugras, S. E., Shorter, J. RNA-Binding Proteins in Amyotrophic Lateral Sclerosis and Neurodegeneration. Neurology Research International. , 432780(2012).
- Amador-Ortiz, C., et al. TDP-43 immunoreactivity in hippocampal sclerosis and Alzheimer's disease. Annal of Neurology. 61 (5), 435-445 (2007).
- Baloh, R. H. TDP-43: the relationship between protein aggregation and neurodegeneration in amyotrophic lateral sclerosis and frontotemporal lobar degeneration. FEBS Journal. 278 (19), 3539-3549 (2011).
- Buratti, E., Baralle, F. E. The molecular links between TDP-43 dysfunction and neurodegeneration. Advances in Genetics. 66, 1-34 (2009).
- Guo, W., et al. An ALS-associated mutation affecting TDP-43 enhances protein aggregation, fibril formation and neurotoxicity. Nature Structural Molecular Biology. 18 (7), 822-830 (2011).
- Geser, F., et al. Motor neuron disease clinically limited to the lower motor neuron is a diffuse TDP-43 proteinopathy. Acta Neuropathologica. 121 (4), 509-517 (2011).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Buratti, E., Baralle, F. E. TDP-43: gumming up neurons through protein-protein and protein-RNA interactions. Trends in Biochemical Sciences. 37 (6), 237-247 (2012).
- Fallini, C., Bassell, G. J., Rossoll, W. The ALS disease protein TDP-43 is actively transported in motor neuron axons and regulates axon outgrowth. Human Molecular Genetics. 21 (16), 3703-3718 (2012).
- Ayala, Y. M., et al. Structural determinants of the cellular localization and shuttling of TDP-43. Journal of Cell Sciences. 121, Pt 22 3778-3785 (2008).
- Fiesel, F. C., Kahle, P. J. TDP-43 and FUS/TLS: cellular functions and implications for neurodegeneration. FEBS Journal. 278 (19), 3550-3568 (2011).
- Birsa, N., Bentham, M. P., Fratta, P. Cytoplasmic functions of TDP-43 and FUS and their role in ALS. Seminars in Cell and Development Biology. , (2019).
- Liachko, N. F., et al. CDC7 inhibition blocks pathological TDP-43 phosphorylation and neurodegeneration. Annals of Neurology. 74 (1), 39-52 (2013).
- Qureshi, A. H., et al. Proteomic and phospho-proteomic profile of human platelets in basal, resting state: insights into integrin signaling. PLoS One. 4 (10), 7627(2009).
- Suominen, I., Koivisto, S. Increasing Precision When Pipetting Protein Samples: Assessing Reliability of the Reverse Pipetting Technique. American Laboratory. , (2011).
- Pipetting tool box for life sciences. , https://www.mt.com/us/en/home/library/guides/laboratory-division/life-science/pipetting-toolbox-for-life-sciences.html (2019).
- Hale, L. J., et al. 3D organoid-derived human glomeruli for personalised podocyte disease modelling and drug screening. Nature Communication. 9 (1), 5167(2018).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. Journal of Translational Medicine. 13, 182(2015).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Fourier, A., et al. Development of an automated capillary nano-immunoassay-Simple Western assay-to quantify total TDP43 protein in human platelet samples. Analytical and Bioanalytical Chemistry. 411 (1), 267-275 (2019).
- Compatibility, S.W.S.A.B. , https://www.proteinsimple.com/technical_library.html (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon