Method Article
ヒト血小板における筋萎縮性側索硬化症の潜在的バイオマーカーを探索するためのキャピラリー電気泳動免疫学的研究法の使用
要約
大規模な臨床研究を実施するためには、神経変性疾患の血液ベースのバイオマーカーが不可欠です。信頼性と検証済みの血液検査は、少量のサンプル量を必要とするだけでなく、より低侵襲のサンプリング方法、手頃な価格、再現性が必要です。本論文は、ハイスループットキャピラリー電気泳動免疫アッセイが、潜在的なバイオマーカー開発の基準を満たしていることを実証する。
要約
キャピラリー・ウェスタン技術としても知られるキャピラリー電気泳動免疫測定法(CEI)は、臨床試験における疾患関連タンパク質および薬物のスクリーニング方法になりつつあります。再現性、感度、小さいサンプル容量要件、同じサンプルにおける複数のタンパク質標識に対する多重抗体、最大24個のサンプルを分析する自動ハイスループット能力、および短時間の要件によりCEI古典的なウェスタンブロット免疫測定法よりも有利である。この方法には、勾配ゲルを利用できない(4%~20%)など、いくつかの制限があります。マトリックス、未精製の生物学的サンプルを有する高い背景、および個々の試薬の商業的利用不能。本論文では、複数のアッセイ設定でCEIを実行する効率的な方法、1つのアッセイプレートにおけるタンパク質濃度と一次抗体滴定を最適化し、サンプル調製のための使いやすいテンプレートを提供する方法について説明する。また、血液ベースのバイオマーカー開発における神経変性疾患の一環として、血小板リセートサイトゾル中のパンTDP-43およびリン酸化TDP-43誘導体を測定する方法も記載されている。
概要
ここで説明するCEIの全体的な目標は、ヒト血小板中の標的タンパク質を分析するための更新された段階的プロトコルを提供することです。血液型シグネチャー分子の割り当ては、アルツハイマー病(AD)、筋萎縮性側索硬化症(ALS)、前頭側頭葉などのヒト神経変性疾患におけるバイオマーカー開発の分野における最も重要な課題の1つです。変性症(FTLD)、パーキンソン病(PD)、封入体筋炎(IBM)、およびその他のタンパク質凝集関連病理状態。多くの干渉剤を用いて大量の血液中のこのようなシグネチャータンパク質の微量の検出は課題である。従って、特異性、感度、多数のサンプルを扱う能力、および選択された方法の再現性が重要である。
ヒト血小板は、神経変性疾患の潜在的なバイオマーカータンパク質を同定し、割り当てるミリューとして機能することができます。血小板は、神経細胞1、2、3のいくつかの特徴を反映する代理一次細胞モデルとして機能する機会を提供します。血小板をバイオマーカー候補タンパク質およびその化学誘導体を分析する好ましい手段の1つにする特定の特徴があります。第一に、血小板は、ドナー(すなわち、静脈穿刺)から血液を採取することによって、またはコミュニティの血液バンクから大量に血液を採取することによって、より侵襲性の低いアプローチを使用して容易に獲得することができる。第二に、血小板は、最小限の設備の実験室4、5で最小限の準備作業で全血から容易に分離することができます。第三に、血小板は核を持たない。したがって、それらは転写調節なしに代謝の変化を研究する良いモデル細胞である。第4に、血小板の生体分子含有量がカプセル化される。したがって、血小板マイクロ環境は、血清干渉物質(すなわちプロテアーゼ)からその内容物を保護する。第5に、血小板富化血漿は代謝活性を失うことなく7~8日間室温で貯蔵することができる。したがって、血小板は、外部因子を最小化し、制御する作業モデルを提供します。
免疫ブロット法(例えば、ウェスタンブロッティング)および酵素結合免疫吸着アッセイ(ELISA)などの従来の免疫測定法は、特定のタンパク質分析においてより広く使用されています。ただし、これらの 2 つの方法には、複数のアッセイ手順、有害な化学物質および試薬の要件、大きなサンプル サイズ、アッセイの再現性に関する問題、およびデータ変動の実行に関する問題など、いくつかの欠点があります。これらは、より少ないステップでより簡単で、比較的短期間で達成可能な方法の開発を促しました。古典的なウェスタンブロット法は依然として一般的な実験方法であるが、その多段階手順、供給、有毒廃棄物(すなわち、アクリルアミド、メタノールなど)およびアッセイ時間は、ハイスループット定量を行う際には望ましくなくなってきているタンパク質分析。
自動化されたCEIアプローチは、ハイスループットタンパク質アッセイ6を行うラボのための選択の方法になりつつあります。CEIはゲル、ゲル電気泳動装置、膜、電気泳動および電気伝達装置、およびより多くの物理的な取り扱いの関与のための必要性を除去する。適切に設計されている場合、CEIアッセイは、定量的なデータ分析、公表品質のエレクトロフェログラム、統計分析を用いたグラフなど、約3.5時間以内に完了する必要があります。CEI システムのもう 1 つの優れた優位性は、10x–20x 少ないタンパク質濃度の要件であり、臨床試験 7、8で使用されるヒトサンプルでの使用に最適です。
CEIの最も重要な部分は、異なるベンダーから購入した抗体の種類、抗体の種類(モノクローナル対ポリクローナル)、最適なタンパク質濃度、サンプル調製、試料変性温度、およびキャピラリーに適用される電気泳動電圧のアッセイ条件を最適化することです。新しいアッセイの前に実装する必要があるCEIの単一アッセイ形式の最適化方法を開発し、時間とリソースを節約しました。この最適化ステップの後、トランス活性化応答DNA/RNA結合タンパク質(TARDP)の総リン酸化誘導体とリン酸化誘導体の両方の自動定量評価が行われます。そのサイズ(43 kDa)により、頭字語のTDP-43はこの論文全体で使用されます。ここで、ALS患者から得られたヒト血小板ライセート中のTDP-43タンパク質は、予測リン酸化値(PPV)を潜在的な予後バイオマーカーとして開発するのに役立つ評価を行う。
TDP-43は、ALSの新しい潜在的な疾患バイオマーカー候補である。TDP-43は全ての有核細胞における全存在タンパク質である;したがって、様々な正常な細胞イベント中および神経変性疾患におけるTDP-43の機能は、9、10、11、12、13、14で調べられてきた。TDP-43は核タンパク質15であるが、核局在配列及び核輸出配列16、17、18、19の存在に起因して核と細胞質の間を往復する能力を有する。細胞質TDP-43は、mRNAの安定性や輸送、ストレス応答、ミトコンドリア機能、オートファゴソーム20などの様々な細胞イベントに関与している。しかしながら、神経変性疾患21の病因に関与するTDP-43のリン酸化誘導体の役割については、あまり知られていない。
このプロトコルは、CEIアプローチを用いてTDP-43およびその血小板中のリン酸化誘導体の内容物を分析するためにアッセイ条件を最適化する方法を示しています。リン酸化されたTDP-43は市販されていないので、ALS患者におけるTDP-43プロファイルを評価するために予測リン酸化値(PPV)を用いることが提案されている。このCEIシステムは、少量のサンプル混合物(キャピラリーあたり2.5~3.0 μL)を使用します。アッセイの総音量設定は、製造業者のプロトコルに基づいてキャピラリーあたり8.0 μLです。したがって、研究者は2つの別々の実行のために1つのサンプル混合物調製を利用することができます。メーカーは、完全に排除されていない場合でも、ピペットエラーが最小限に抑えるようにアッセイプロトコルを設計しました。24個のヒト血小板ライセートサンプル混合物を半量(すなわち、サンプル当たり2.5~3.0 μL)に分割し、~7時間以内に2種類の抗体によって連続的に分析した。ここで説明するCEIシステムは、望ましい高スループットアッセイモダリティを提供する。ユーザーは、大規模なスクリーニングを行う前に、さまざまなベンダーからの抗体と標的タンパク質のサンプル調製モダリティをテストする必要があります。
プロトコル
ヒト血小板の処理に関するすべてのプロトコルは、カンザス大学医療センターとカンザスシティ医科大学とバイオサイエンスIRB委員会の両方のガイドラインに従います。
1. バッファーおよび試薬の調製
メモ:メーカーのガイドラインに従って、すべてのサンプルを準備してください。この手順では、個人用保護装置(ラボコート、手袋、ゴーグル)を着用してください。
- 0.941 gのスクロース(11 mM最終濃度)、6.4 mLの5 M NaCl(128 mM決勝)、5.4 mL0.2M NaH 2 PO 4(4.3 m)を組み合わせてクエン酸洗浄バッファーを調製します。 Mファイナル)、0.2 M Na2PHO4(7.5 mM決勝)、0.352gのクエン酸ナトリウム(4.8mM決勝)、0.115gのクエン酸(2.4mM決勝)の9.4mL。0.45 μm フィルターディスクを使用して ddH2O. フィルターを使用して総体積を 250 mL に調整し、pH を 6.5 に調整します。4°Cで1年まで保管してください。使用する前に、溶液室温(RT)を22にしてください。
- 100 mL の最終ボリュームで 250 mM スクロース、1 mM EDTA、10 mM Tris-Cl (pH 7.4) を組み合わせて、破裂バッファーを準備します。4°Cで1年まで保管してください。2 μL のホスファターゼ阻害剤カクテル (1:1000 最終) と 1 μL のプロテアーゼ阻害剤カクテル (1:2000 最終) を 2 mL の破裂バッファーに加えます。使用するまで氷の上に保管してください。未使用の破裂バッファを破棄します。
2. 血小板分離
- 酸クエン酸デキストロース(ACD)溶液(75 mMクエン酸三ナトリウム、124 mMデキストロース、38 mMクエン酸、pH = 7.4)を含むイエローキャップ採血チューブで8~10 mLのヒト血液を採取。ACD:血液 = 1:9)。チューブの内容を 5x~6x の反転を手で軽く混ぜます。
- RTで20分間スイングバケットローターで200 x gでチューブを遠心分離します。
- 血小板が豊富なプラズマ(PRP)(約3~4mL)を15mLの円錐形の底管に集め、汚染を避けるために、バフィーコート(かすんだ画分)から約0.5mLのPRPを残します。赤血球の汚染が発生した場合は、この手順を繰り返します。
- RTで15分間、1,200 x gでPRPサンプルを遠心分離します。
- 血小板ペレット(P1)をクエン酸洗浄緩衝液1mLで穏やかに再懸濁し、RTで15分間1,200 x gで遠心分離してペレットを洗浄します。
- 純粋な血小板ペレットを保存します。上清を捨てます。
- 阻害剤カクテルを含む破裂バッファーの600μLで血小板ペレットを再懸濁する。
- ソネケーターを使用して血小板懸濁液を超音波処理します。サンプルをミニアイスバケツに入れる。連続モードで20 sの設定3でソニエーターを設定します。
注:プローブを10%漂白剤で洗浄し、その後に蒸留水を必ずおきます。 - 超音波処理されたサンプルを4°Cで30分間20,000 x gで遠心分離し、膜分画を除去します。アリコート上清は60μLで、-80°Cで保存します。血小板細胞の分画の繰り返しの解凍/凍結サイクルを避ける.
3. CEIの準備
注:ALS患者(n=8-10)から100μLのヒト血小板ライセートを組み合わせ、健康な被験者(n =8-10)を別々にプールし、アッセイの最適化に使用した。
- CEI レイアウト用の社内で生成されたテンプレート (表 1) およびサンプル準備 ( 表2) を記入します。サンプル混合調製テーブルは動的で、ソースから除去する必要があるボリュームの量を自動的に計算します。
注: 動的 Table-2 に入力された必要なソースボリュームの場合、0.1 X サンプルバッファボリュームが自動的に計算されます。 - キャピラリーを備えた25 0.2 mL PCRチューブをプリラベル#1-#25し、PCRラックに入れられます。氷の上に置く。
- 前ラベル0.6 mLマイクロ遠心チューブ:使用する一次抗体および希釈(必要な場合)ごとに1つ、0.1xサンプルバッファー用に1つ、ルミノール-S/ペルオキシド用に1つ、および各サンプルに1つずつ希釈する(必要な場合)。チューブラックの氷の上に置きます。
- CEI分離12~230kDaマスターキット分離モジュールに備えたサンプルバッファー、洗浄バッファー、1プレート、カートリッジを取り出します。
- 4°C冷却装置から、抗体希釈バッファー、一次抗体、二次抗体、ルミノール、過酸化水素、および標準パックを取り出す。RTに残っている標準パックを除くすべての試薬を氷の上に置きます。
注:標準パックの試薬は凍結乾燥され、ホイルカバーで密封されています。これらは、製品の損失を減らすために開く前に、ミニ遠心分離機を使用して短時間スピンダウンする必要があります。開くには、試薬チューブはピペット先端で突き刺すか、コーナーから引き戻すことができます。 - 400 mM DTT を準備するには、DTT を含む透明なチューブに 40 μL の脱イオン水を加えます。
- 40 μL の蛍光 5x マスターミックスを準備するには、キットに用意されたピンクのチューブに、10x サンプル バッファーの 20 μL と準備した 400 mM DTT 溶液の 20 μL を加えます。
- ビオチン化ラダーを準備するために、16 μLの脱イオン水、2μLの10xサンプルバッファ、およびキットに用意された白いチューブに調製した400mM DTT溶液の2μLを加えます。穏やかに混ぜ、変性のために0.2 mL PCRの管に移す。
- 1.5 μLの10μLのサンプルバッファと148.5 μLの脱イオン水を0.6 mLマイクロ遠心管に加えて、0.1xサンプルバッファを調製します。氷の上に混ぜて置くために渦。
- 所望の抗体希釈液を調製する。事前標識されたマイクロ遠心チューブに指定された量に抗体希釈剤を添加します。ボリュームが同じ場合は、逆ピペット化テクニック23を使用します。そうでなければ、分配する前にピペットチップを事前にすすいでください。
注:このアッセイでは、a-TDP-43パン抗体およびa-p(S409/410-2)TDP-43抗体が使用されました。抗ERK抗体は、アッセイ成分が働いていることを確認するために内部制御に使用されました。 - 後述する抗体希釈に対して逆ピペッティングを行う。あるいは、追加情報は文献24に記載されている。
注:逆ピペット法は、ソリューション23の小さな連続ボリュームを分配する場合に適しています。この技術は、(i)正確な容積を提供し、(ii)先端オリフィスの試薬発泡を排除し、(iii)少量(<5 μL)試薬、粘性溶液、界面活性剤、高蒸気圧を有する溶液に最適です。- ピペットに適切なチップを入れ、プランジャーを2番目のストップまで押します(ステップ-2)。ピペットチップを数ミリメートル浸して溶液に入します。チップが溶液に浸漬されている間、ゆっくりとプランジャーを放してピペットチップを溶液で満たします。溶液から先端を取り出し、試薬貯蔵所の端にそっと触れ、先端の外側に残った余分な液体を除去します。
- プランジャを押して最初のストップにして溶液を分配します(ステップ-1)。先端に残りの溶液を分配しないでください。
- プランジャーを第2の停止に押し込んで、試薬貯留層への先端の残りの溶液を空にします(ステップ-2)。プランジャを次のピペッティングステップの準備完了位置に放します。
- 事前標識されたマイクロ遠心チューブに指定されたボリュームに必要な抗体を追加する (表 1)ピペット先端を前リンスしないでください: 希釈剤に直接追加し、チップを複数回フラッシュして抗体を除去します。チューブを氷の上に置きます。
- CEI サンプルミックスを準備するには、cap#2 から cap#25 までのラベルが付いた PCR チューブに対して以下の手順を実行します。
- すべてのチューブを開き、逆ピペット法を用いて各チューブに蛍光5xサンプルバッファーの1.6 μLアリコートを加え、5xバッファーを加えた際に各PCRチューブを閉じてサンプル損失を最小限に抑えます。
- すべてのチューブを開き、表2に示すボリュームで0.1xサンプルバッファを各チューブに追加し、その後すぐに閉じます。ボリュームが同じ場合は、逆ピペッティング手法を使用します。そうでなければ、0.1xサンプルバッファを分配する前にプリリンスピップチップ。
- すべてのチューブを開き、表2に指定された量のタンパク質サンプルを各チューブに加え、その後すぐに閉じます。ボリュームが同じ場合は、逆ピペット法を使用します。そうでなければ、0.1xサンプルバッファを分配する前にプリリンスピップチップ。
- ベンチトップ遠心分離機(13,000 x g、30 s)ですべてのPCRチューブを簡単に遠心分離し、フリック/ボルテックスPCRチューブを混合し、遠心分離を繰り返します。
- すべての PCR チューブを熱い蓋でサーモサイクラーに移します。定義された温度と持続時間(すなわち、5分間95°C、10分間70°C)でサンプルを変性させる。
注:変性温度と持続時間は、標的タンパク質に最適化する必要があります。 - 手順 3.12.4 を繰り返します。
- すべての PCR チューブをチューブ ラックに戻し、氷の上に置きます。
- 変性工程の間に、現像液(1:1ルミノール-S:過酸化物溶液)を調製し、ルミノール-Sの200μLと過酸化物の200μLを加えます。氷の上に置きます。
- 上記で準備したサンプルを備えたCEIプリフィルプレートをロードするには、試薬およびサンプルをアッセイレイアウトに示すアッセイプレートに分配します(図1)。気泡の導入は避けてください。
注: ボリュームとソリューションが同一の場合は、逆ピペット法を使用します。そうでなければ、分配する前にピペット先端を前にすすい、ピペットの2番目のタブストップを使用してプレートによく残りを排出しないでください。12~230 kDaの分離モジュールには、色分けされたプレートローディングガイドが含まれている場合があります。このガイドをプレートの下に置き、試薬やサンプルをウェルに加え、サンプルのロード時に視覚的に役立ちます。プレートローディングガイドは、会社のウェブサイトからもダウンロードできます。- 行Eに、各ウェルに15μLのルミノール:過酸化物ミックスを加えます。
注:理想的には、使用の直前にこの試薬を準備し、各ウェルに追加します。これが都合が悪い場合、この混合物はプレートローディングの前に30分以内に調製されてもよい。 - 行 D に、よく D1 に、ストレプトアビジン-HRP の 10 μL を追加します。
- 行Dに、ウェルD2〜D25に、指定された二次抗体の10 μLを加える。
- 行Bに、各ウェルに、10μLの抗体希釈剤を加える。
- 行Cに、よくC1に、10μLの抗体希釈剤を加える。
- 行Cで、ウェルC2〜C25に、指定された一次抗体の10 μLを加える。
- 行Aに、よくA1に、PCRチューブから5μLのビオチン化ラダーを#1加える。
- A 行 A で、A2 –A25 をウェルするために、3 μL のサンプルを加えて、PCR チューブ #2 - #25を対応するウェル #2 - #25に追加します。
- 各指定の洗浄バッファーウェルに 500 μL の洗浄バッファーを追加します。
- RTで1,000 x gで5分間プレートを遠心分離します。
- 行Eに、各ウェルに15μLのルミノール:過酸化物ミックスを加えます。
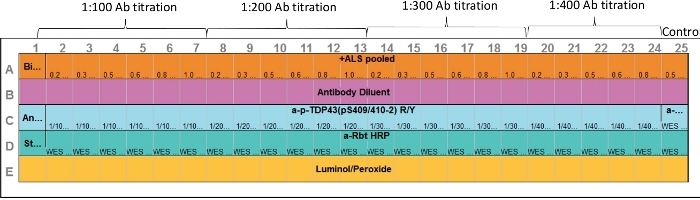
図1:アッセイレイアウト。一次抗体と標的タンパク質サンプルの両方の最適化は、1つのアッセイで行うことができる。毛細血管2~7、8–13、14-19、および20-24は、様々なタンパク質濃度および一次抗体範囲を表します。毛細管25は陽性対照を表す。抗ERK抗体を使用した;ただし、適切な正の制御を含めることができます。この図の大きなバージョンを表示するには、ここをクリックしてください。
4. CEI をプレート 1 で実行する
- まず、CEI (材料表) アナライザーをオンにしてから、コンピュータの電源を入れます。ソフトウェアを開く (資料のテーブル)
- アナライザーをオンラインシステムに接続します (マテリアルのテーブル)。これは、トラブルシューティングやデータ復旧のトラブルのために実行データを収集するために必要な手順です。
- 左上のメニューから[インストゥルメント]をクリックし、[接続]をクリックします。ポップアップメニューとして表示される計測器シリアル番号を選択します。[接続] をクリックします。
- 「アッセイ」タブを選択し、「新規アッセイ」を選択するか、保存したテンプレートを選択します。
- 入力アッセイパラメータ (表1)または現在テンプレートを変更します。ファイル名と場所を保存します。
- アナライザーの青い点滅インジケータが青色の点灯を確認します。
- オレンジ色のドアの上にある銀色の金属ボタンをタッチして開きます。
- 乳管カートリッジを慎重に取り外します。製造元のプロトコルの説明に従ってキャピラリーカートリッジを挿入します。正しく取り付ければ、内部ライトが「青」に変わります。
- アッセイプレートから保護シールを取り外します。気泡の充填済み井戸を目視で観察します。観察された場合は、小さなピペットチップでそれらをポップ(ロングシャフトP10ピペットチップがうまく動作します)。
- アッセイプレートを置いてプレートホルダーを積み込み、ドアを閉めます。コンピュータで、[スタート]ボタンをクリックします。
- 温度に敏感な試薬とサンプルを入れた氷トレイを、2番目のプリフィルプレートを準備する準備ができるまで、4°Cの暗闇の中に置きます。
- 試薬/供給物は、2番目のプレートの室温で放置します。
5. CEIをプレート2で行う
注:この版はリン酸化されたTDP-43のレベルを分析するために設定される。
- 4°Cで保存されている氷トレイを取り外し、ベンチに1時間、最初のプレートの推定完了時間の前に置きます。2 番目のプレートとカートリッジを取り出します。
- 2回目の走行に必要な抗体希釈液を準備し、氷の上に保管します。新鮮な1:1ルミノール-S:過酸化物溶液を準備します(上記のステップ3.12.8)。
- サンプルミックスとプリフィルプレートを装填するために必要な試薬をリミックスし、一時的に再遠心分離します。図 1に従って 2 番目のプレートをロードします。a-p(S409-410-2) TDP-43抗体溶液を行Cウェルにロードします。
- 最初の実行が完了したら、最初のプレートとカートリッジを破棄します。カートリッジを取り外し、削り取った容器に入れ、廃棄します。参照目的のために、プレートとカートリッジからステッカーを保管してください。
- ソフトウェア ファイルを閉じて、同じテンプレートを再度選択します。ソフトウェアは、以前の実行からの設定を記憶します。必要に応じて注釈を変更します(つまり、一次抗体を変更します)。
- 手順 4.8 ~ 4.10 を繰り返します。12~230 kDaのマスターキット分離モジュールの試薬と消耗品をすべて片付ける
- CEIサンプルミックス、抗体希釈、0.1xサンプルバッファー、ルミノール-S:ペルオキシドの残りは大学の規制に従って廃棄されます。
6. データ分析
- 実行が完了したら、次の品質チェックが実行されていることを確認します。
- ソフトウェアで、[標準を表示]アイコンとグラフ表示タブを選択します。[標準を強制]を選択するか、誤ったピークを右クリックして[標準ではない]を選択して、不整列を修正します。新しいキャピラリーごとにこのチェックを実行します。
- サンプルとシングルビューアイコンをクリックします。実験タブで毛細管#1(ビオチン化されたはしご)を選択します。ソフトウェアによってピークの選択が正しくない場合は、グラフビューでピークをクリックし、[ピークを削除]を選択します。
注: 例として、12-230 KDa ビオチン化されたラダーは、12 kDa、40 kDa、66 kDa、116 kDa、180 kDa、および 230 kDa でサイジングピークを示します。この手順を実行しないと、サンプルピークのサイズが正しく設定されず、不正確な結果が生成されます。 - 電気泳動ムービーを表示し、実行中に異常な移動が発生したかどうかを確認します。
- 必要に応じて、必要に応じてデータ(たとえば、分子量、ピーク面積、ピーク高さ、信号対ノイズ[S/N]を含むピーク表)を導出します。グラフの詳細を表示するためのグラフ注釈ツールは、グラフウィンドウの右上隅にあります。
結果
血小板細胞質タンパク質濃度の最適化と一次抗体滴定
シグナルの変化は血小板細胞質のタンパク質の変化に直接比例するため、血小板細胞質タンパク質の線形ダイナミックレンジを確立することが重要です。アッセイで血小板ライセート混合物全体を使用すると、標的タンパク質(TDP-43およびP(S409-412)TDP-43)のシグナル強度が低下し、高いバックグラウンドシグナルに寄与する可能性があります。したがって、このアッセイでは、血小板破裂後に透明上清(細胞性画分)を使用した(図2)。
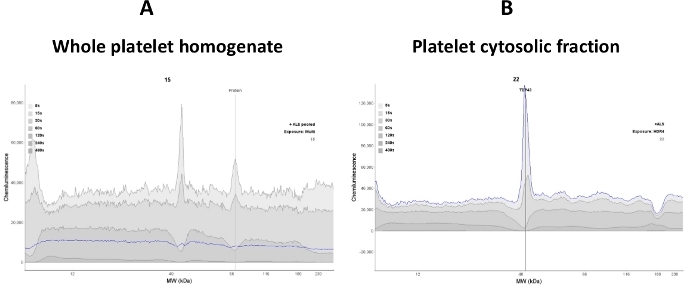
図2:信号の明瞭さは、サンプルの品質に依存します。(A) 血小板全体のライセートホモジネートは抗TDP-43抗体結合を妨害する。したがって、騒がしいエレクトロフェログラムが観察された。(B)血小板細胞分離分は、全体のライセートを遠心分離(16,000 x g 30分間)に供することから得られた。ほとんどの膜タンパク質は除去された。それゆえ、TDP-43タンパク質に対する抗TDP-43抗体結合が増強された(青色線トレース)。この図の大きなバージョンを表示するには、ここをクリックしてください。
血小板細胞質タンパク質濃度の線形動的範囲は0.2~0.8 mg/mLで確立した。タンパク質濃度と一次抗体滴定の両方を1つのアッセイで行うことができるように、アッセイテンプレートを採用しました(図3)。
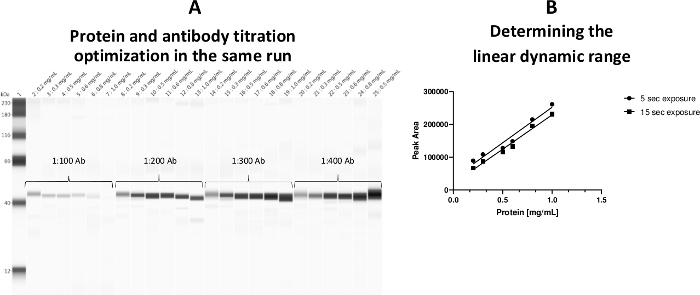
図3:血小板細胞質タンパク質濃度の線形ダイナミックレンジ(A) タンパク質濃度と抗体滴定は、同じ走行中に1つのプレートに最適化した。(B) タンパク質の線形働き範囲(0.2~0.8 mg/mL)を確立しました。0.5 mg/mLタンパク質負荷を陽性対照としてa-ERK抗体によって標識した(キャピラリー25)。この図の大きなバージョンを表示するには、ここをクリックしてください。
なお、試料調製管中のグリセロール含有量は20%未満(最終)でなければならないが、そうでなければ高いグリセロール濃度は一次抗体結合に悪影響を及ぼす。
最適な露光時間の決定
ソフトウェアの古いバージョンでは、最適な露光時間は、タンパク質濃度(mg/mL)に対してピーク領域をプロットすることによって決定する必要がありました。新しいバージョンでは、ハイ ダイナミック レンジ (HDR) 検出プロファイルという新しいツールが提供されます (図 4)。画像パネルを使用して、すべての露光時間(すなわち、5s、15s、30s、60s、120s、240 s、480 s)を一緒に表示するオプションを提供しました。コンピュータソフトウェアは、すべての暴露時間を分析し、自動的に最良の暴露時間(HDR)を特定しました。HDR検出プロファイルはCEIの感度が高いため、ダイナミックレンジが大幅に広がっており、より大きなサンプル濃度範囲でより優れた検出と定量を実現します。しかし、ユーザーは、実験目標を満たす露出時間を選択するオプションをまだ持っています。この特徴を用いて、TDP-43タンパク質に対して最適な露光時間が見られた。ピークは最適な露光時間を表します(図4A)。1~512 s(図4B)の範囲で全9回の露光時間を確認した後、この抗体に対して単一の暴露時間(4s)を定義した。

図4:標的タンパク質に対する高ダイナミックレンジ(HDR)検出プロファイル(A)TDP-43タンパク質ピークは、標的タンパク質に対する最適な露光時間を表す。a-TDP-43 Ab滴定は1:300であり、血小板細胞質タンパク質濃度は0.5mg/mLであった。ソフトウェア定義の青い線は、最適な露光時間を示します。(B) この図は、1~ 512 s の範囲の 9 回の露出時間をすべて確認した後のユーザー定義の単一露光時間 (4 s) を表します。
ALS患者のヒト血小板細胞質におけるTDP-43レベル
血液ベースバイオマーカーの開発を行った。最適化されたアッセイ条件を用いて、ALS患者から得られた血小板ライセート細胞質画分を2組の抗体を用いて分析した(すなわち、抗TDP-43[Pan]抗体、TDP-43タンパク質のリン酸化誘導体を認識する抗体;ここで、A-P[S409/410-2]TDP-43を用いた)。このデモンストレーションでは、疾患特異的TDP-43およびそのリン酸化誘導体を提示します(図5)。
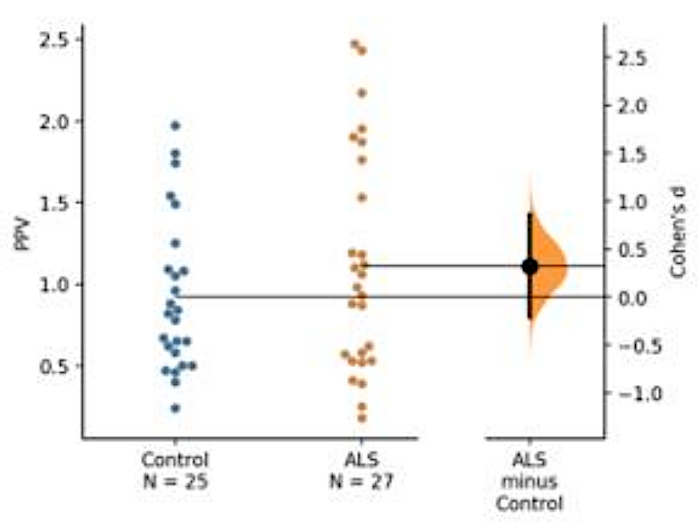
図5:TDP-43の予測リン酸化値(PPV)の表現。リン酸化されたTDP-43とパンTDP-43の絶対量は、ALSと対照群との間に大きな差を示さなかった。しかし、PPVはALSコホートのわずかな増加を示したが、被験者数が不足しているため2つの群の間に統計的な差はなかったが(ALS=25、対照=27)。ALSと対照群の手段との間の低いCohenのd値は、小さいサンプルサイズのために2つの群間の低い効果サイズを示した(制御=25、ALS=27)。この図の大きなバージョンを表示するには、ここをクリックしてください。
合計TDP-43を較正曲線を用いて定量した(図6)

図6:標準キャリブレーション曲線市販の組換えTDP-43タンパク質濃度を用い、標準的な曲線を構築した。各データは、3 つ平均を表します。タンパク質バンド強度は濃度依存性(インセット)であった。この図の大きなバージョンを表示するには、ここをクリックしてください。
リン酸化TDP-43タンパク質の定量は、このタンパク質の商業的に利用できないことにより不可能であった。その代わりに、TDP-43のリン酸化種の割合を定義する予測リン酸化値(PPV)が確立された。PPVは、以下の式を用いて同一サンプルについて2つのシーケンシャルCEIアッセイから決定した。

プールされたヒトALS血小板細胞分裂画における変動性のイントラおよびインターランアッセイを試験した(図7)
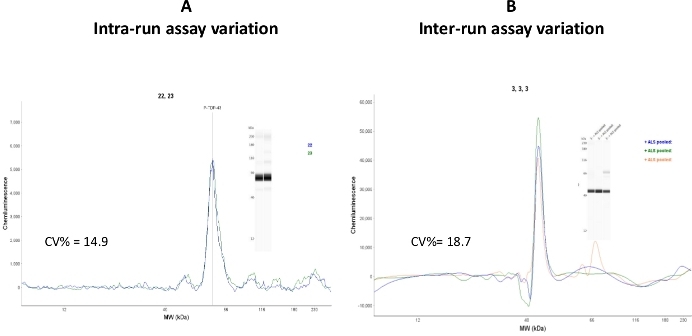
図7:アッセイのバリエーション。(A) 同じサンプルを搭載した2本の毛細管をCEIで分析し、実行内アッセイの変動をCV%=14.9と計算した。(B) 同じサンプルを3つの異なるアッセイ日および3つの異なるアッセイランで分析した。ラン間アッセイの変動は、CV% = 18.7と計算した。この図の大きなバージョンを表示するには、ここをクリックしてください。
ラン内(キャピラリーからキャピラリーへの変動)係数の変動値は許容範囲(CV%= 14.9)に低下しましたが、ラン間アッセイ値は比較的高かった(CV%= 18.7)。この変動は、キャピラリーカートリッジと異なるロットのサンプルプレートを使用しているためであると解釈されます。再現性の調査は、同じロット番号を持つ CEI コンポーネントで実行することをお勧めします。
表1:CEIアッセイプレートローディングテンプレートこちらをクリックして、このテーブルをダウンロードしてください。
表 2: インタラクティブなサンプル混合物調製テンプレート。未知のサンプルからストックタンパク質濃度を入力した後、インタラクティブ細胞は、サンプルミックスを調製するために使用する必要がある量を自動的に計算します。こちらをクリックして、このテーブルをダウンロードしてください。
ディスカッション
毛管電気泳動系免疫測定法は、ハイスループットのサンプル分析および薬物スクリーニング25に対して現在選択の方法である。小さいサンプル容積、よく最適化されたアッセイコンポーネント、使いやすいアッセイプラットフォームおよび計装、試薬費、および低CVパーセントは、主な利点26、27である。異なるアッセイモダリティでタンパク質を分離するためのいくつかの方法がありますが、ここで説明する抗体ベースのCEIは、血液ベースのバイオマーカーの開発に従事している小さな研究所によって適応することができます。ここで使用されるCEIアッセイ技術は、TDP-4328とそのリン酸化誘導体5に対して、信頼性が高く、再現性があり、高感度な測定値を提供します。
CEIシステムはまた、TDP-43とそのリン酸化誘導体を同時に分析し、精製または組み換え標的タンパク質が利用可能である場合に標的タンパク質の直接定量を提供するという多重選択を提供する。完全長組換え TDP-43 タンパク質は市販されています。しかしながら、組換えリン酸化TDP-43誘導体はそうではない。リン酸化されたTDP-43は市販されていないので、ALS患者におけるTDP-43プロファイルを評価するために予測リン酸化値(PPV)を実施した。パンTDP-43およびリン酸化TDP-43量は、フルオロフォアで永久にラベル付けされた;したがって、TDP-43 プロファイルは、定量単位 (つまり、ng/mL、pg/mL など) の有無にかかわらず同じままです。TDP-43およびそのリン酸化誘導体の絶対量を決定する(すなわち、P[S409-410-12]TDP-43)より定量的な測定を提供するが、PPVの算出は、標準化のための組換えリン酸化TDP-43の必要性を排除し、商業的に利用できないからである。
CEIは、アッセイが失敗した場合に問題を正確に特定するために、アッセイプラットフォーム内のいくつかのチェックポイントを提供します。これにより、障害を排除し、より良い実験設計を提供します。アッセイ手順は、サンプルプレートを充填する以外は完全に自動化されています。これは、標準的なウェスタンブロッティング解析と比較して重要な特徴です。この機能は、実行から実行への一貫性を提供します。すべての研究室には独自の標準的な操作手順がありますが、人為的ミスを最小限に抑えるプラクティスに従うことが重要です。例えば、ルミノールに過酸化物を添加すると酵素反応が始まり、ルミノール基質を消費するため、プレートローディングの直前にルミノール-S/過酸化物混合物を調製することが重要です。サンプルと一次/二次抗体を気泡なしでプレートウェルにロードすることも非常に重要なステップです。
さらに、プレートウェルは容積が小さく、井戸間にスペースがないため、他のすべてが自動化されているため、最も重要なステップであるピペッティング中は注意が必要です。サンプル、抗体、およびその他の試薬の積載順序は、アッセイの一貫性のために重要である(図1)。プレート調製のプロセスは約40〜45分かかります。したがって、まず必要なアッセイ成分をプレートにロードし、ピペット処理の直前にルミノール-S/過酸化物混合物を準備することをお勧めします。このようにして、一貫した一連の試薬添加があり、かつ一貫した発光信号強度が達成される。それは主に過酸化物の強度に影響を与えるため、期限切れのルミノール-S/過酸化物試薬を使用することは推奨されません。スプリットバッファシステムを導入し、化学および洗剤の適合範囲を含む最近の進歩は、アッセイの品質を高め、より再現性と予測可能な結果を生み出しました。現在、同じメーカーの新しいコンボアナライザーは、化学発光と蛍光共役抗体で標識されたサンプルを同じ実行で分析する機能を備えています。この新機能により、2つの個別のプレートを連続して実行する必要がなくなり、実行間の変動が排除されます。
アッセイプレートは、周囲温度で保存する必要があります。アッセイプレートを4°Cの冷蔵庫に保管するように選択した場合、プレートはアッセイの前夜に取り出し、周囲温度に持ち込む必要があります。誤ってサンプルウェルをロードした場合は、適切なサンプルを追加する前に、キットに用意されたバッファで広範囲に洗浄(4~5回)する必要があります。各一次抗体および生物学的サンプルはユニークです。したがって、抗体/タンパク質の最適化は、生物学的液体中の標的タンパク質のサンプルを分析する前に行う必要があります。
ここでは、一次抗体インキュベーション時間をデフォルトで30分間設定した。シグナルが弱い場合、ユーザは、蛍光シグナルバーンアウトなしで所望のシグナル強度に達するまで、一次抗体インキュベーション時間を増加することを検討する必要があります。ヒト血小板の場合、患者からのプールされたサンプルを調製し、最適化アッセイに使用した。サンプルプーリングは、標的生体分子間の変動をより良く表す。CEIには、総ライセートまたは総ホモジネートではなく、明確な上清を使用することをお勧めします。
血小板全体のライセート混合物中の高濃度のタンパク質は、シグナル対ノイズ比を低下させる可能性があります(図2)。これは、一次抗体結合に悪影響を及ぼすため、サンプルの繰り返し凍結解凍サイクルは避けるべきです。いくつかの試薬はCEI29と互換性がないため、ライセートバッファーの成分は重要です。サンプル調製前に、メーカーのウェブサイトに用意されている互換性のある試薬のリストをクロスチェックすることをお勧めします。これは、サンプル調製のための高いストリンジェンシー条件を許容しないシステムの制限である。個々のサンプルを分析するためにプールされたサンプルを使用してアッセイランパラメータ(すなわち、一次抗体希釈、タンパク質濃度、一次抗体インキュベーション時間など)を最適化することをお勧めします。
開示事項
著者らは、プロテインシンプル社がこの原稿の出版費用をカバーした以外は、競合する金銭的利益はないと宣言している。
謝辞
この研究は、A.A.に授与された壁内助成金によって後援されました。この研究は、カンザス大学フロンティア医療センター:ハートランド臨床・トランスレーショナル研究研究所(#UL1TR606381)に授与されたNCATSからのCTSA助成金によって支えられた。内容は著者の責任であり、必ずしもNIHまたはNCATSの公式見解を表すものではありません。私たちは、健康なボランティアとALS患者から血液サンプル採取のためのIRB承認を得たカンザス大学医療センターALSクリニックに個人的に感謝しています。著者らは、原稿の校正に対するエムレ・アグバスに感謝している。
資料
| Name | Company | Catalog Number | Comments |
| 12-230 kDa Separation kit | ProteinSimple | SM-W004 | Contains pre-filled assay plate and 25-channel capillary cartridge |
| 3000G Thermocycler | Techne | FTC3G/02 | We used this thermocylcer for heating the sample mix |
| Anti-Mouse detection kit | ProteinSimple | 042-205 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-P(S409-410) TDP-43 antibody | ProteinTech | 22309-1-AP | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-P(S409-412) TDP-43 antibody | CosmoBio-USA | TIP-PTD-P02 | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-Rabbit detection kit | ProteinSimple | DM-001 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-TDP-43 (pan) antibody | ProteinTech | 10782-2-AP | Primary antibody that recognizes whole TDP-43 protein |
| Compass for SimpleWestern (SW) | ProteinSimple | Ver.4.0.0. | Compass for SW is the control and data analysis application for SimpleWestern instruments |
| Sonic Dismembrator; Model100 | Fisher Scientific | Sonicator. Used to rupture the cell membrane. This model is discontinued (Model XL2000-350) | |
| Table top centrifuge | Eppendorf | 22625004 | Model# 5810 with swinging plate bucket |
| Wes analyzer | ProteinSimple | 55892-WS-2203 | Performs the capillary gel electrophoresis |
参考文献
- Blair, P., Flaumenhaft, R. Platelet alpha-granules: basic biology and clinical correlates. Blood Reviews. 23 (4), 177-189 (2009).
- Mercado, C. P., Kilic, F. Molecular mechanisms of SERT in platelets: regulation of plasma serotonin levels. Molecular Interventions. 10 (4), 231-241 (2010).
- Goubau, C., et al. Regulated granule trafficking in platelets and neurons: a common molecular machinery. European Journal of Paediatric Neurology. 17 (2), 117-125 (2013).
- Basu, S. S., et al. Human platelets as a platform to monitor metabolic biomarkers using stable isotopes and LC-MS. Bioanalysis. 5 (24), 3009-3021 (2013).
- Wilhite, R., et al. Platelet phosphorylated TDP-43: an exploratory study for a peripheral surrogate biomarker development for Alzheimer's disease. Future Science OA. 3 (4), 238(2017).
- Worth, A. J., et al. LC-MS Analysis of Human Platelets as a Platform for Studying Mitochondrial Metabolism. Journal of Visualized Experiments. (110), e53941(2016).
- Statland, J. M., et al. Rasagiline for amyotrophic lateral sclerosis: A randomized, controlled trial. Muscle and Nerve. 59 (2), 201-207 (2019).
- Charytan, D. M., et al. Safety and cardiovascular efficacy of spironolactone in dialysis-dependent ESRD (SPin-D): a randomized, placebo-controlled, multiple dosage trial. Kidney International. 95 (4), 973-982 (2019).
- Ugras, S. E., Shorter, J. RNA-Binding Proteins in Amyotrophic Lateral Sclerosis and Neurodegeneration. Neurology Research International. , 432780(2012).
- Amador-Ortiz, C., et al. TDP-43 immunoreactivity in hippocampal sclerosis and Alzheimer's disease. Annal of Neurology. 61 (5), 435-445 (2007).
- Baloh, R. H. TDP-43: the relationship between protein aggregation and neurodegeneration in amyotrophic lateral sclerosis and frontotemporal lobar degeneration. FEBS Journal. 278 (19), 3539-3549 (2011).
- Buratti, E., Baralle, F. E. The molecular links between TDP-43 dysfunction and neurodegeneration. Advances in Genetics. 66, 1-34 (2009).
- Guo, W., et al. An ALS-associated mutation affecting TDP-43 enhances protein aggregation, fibril formation and neurotoxicity. Nature Structural Molecular Biology. 18 (7), 822-830 (2011).
- Geser, F., et al. Motor neuron disease clinically limited to the lower motor neuron is a diffuse TDP-43 proteinopathy. Acta Neuropathologica. 121 (4), 509-517 (2011).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Buratti, E., Baralle, F. E. TDP-43: gumming up neurons through protein-protein and protein-RNA interactions. Trends in Biochemical Sciences. 37 (6), 237-247 (2012).
- Fallini, C., Bassell, G. J., Rossoll, W. The ALS disease protein TDP-43 is actively transported in motor neuron axons and regulates axon outgrowth. Human Molecular Genetics. 21 (16), 3703-3718 (2012).
- Ayala, Y. M., et al. Structural determinants of the cellular localization and shuttling of TDP-43. Journal of Cell Sciences. 121, Pt 22 3778-3785 (2008).
- Fiesel, F. C., Kahle, P. J. TDP-43 and FUS/TLS: cellular functions and implications for neurodegeneration. FEBS Journal. 278 (19), 3550-3568 (2011).
- Birsa, N., Bentham, M. P., Fratta, P. Cytoplasmic functions of TDP-43 and FUS and their role in ALS. Seminars in Cell and Development Biology. , (2019).
- Liachko, N. F., et al. CDC7 inhibition blocks pathological TDP-43 phosphorylation and neurodegeneration. Annals of Neurology. 74 (1), 39-52 (2013).
- Qureshi, A. H., et al. Proteomic and phospho-proteomic profile of human platelets in basal, resting state: insights into integrin signaling. PLoS One. 4 (10), 7627(2009).
- Suominen, I., Koivisto, S. Increasing Precision When Pipetting Protein Samples: Assessing Reliability of the Reverse Pipetting Technique. American Laboratory. , (2011).
- Pipetting tool box for life sciences. , https://www.mt.com/us/en/home/library/guides/laboratory-division/life-science/pipetting-toolbox-for-life-sciences.html (2019).
- Hale, L. J., et al. 3D organoid-derived human glomeruli for personalised podocyte disease modelling and drug screening. Nature Communication. 9 (1), 5167(2018).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. Journal of Translational Medicine. 13, 182(2015).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Fourier, A., et al. Development of an automated capillary nano-immunoassay-Simple Western assay-to quantify total TDP43 protein in human platelet samples. Analytical and Bioanalytical Chemistry. 411 (1), 267-275 (2019).
- Compatibility, S.W.S.A.B. , https://www.proteinsimple.com/technical_library.html (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved