Method Article
Использование капиллярного электрофореза иммуноанализ для поиска потенциальных биомаркеров бокового амиотрофического склероза в тромбоцитах человека
В этой статье
Резюме
Биомаркеры на основе крови для нейродегенеративных заболеваний необходимы для проведения крупномасштабных клинических исследований. Надежный и проверенный анализ крови должен требовать небольшого объема выборки, а также быть менее инвазивным методом отбора проб, доступным и воспроизводимым. Данная статья демонстрирует, что высокопроизводительный капиллярный электрофорез иммуноанализ удовлетворяет критериям для потенциального развития биомаркеров.
Аннотация
Капиллярный электрофорасиммуноз (CEI), также известный как капиллярная западная технология, становится методом выбора для скрининга заболеваний соответствующих белков и препаратов в клинических испытаниях. Воспроизводимость, чувствительность, небольшое требование объема выборки, мультиплексирующие антитела для маркировки нескольких белков в одном образце, автоматизированная высокопроизводительная способность анализировать до 24 отдельных образцов и требование короткого времени делают CEI выгодно над классическим западным иммуноанализом помот. Есть некоторые ограничения этого метода, такие как невозможность использовать градиент гель (4%-20%) матрицы, высокий фон с нерафинированными биологическими образцами и коммерческая недоступность отдельных реагентов. В этой статье описывается эффективный метод запуска CEI в нескольких параметрах анализов, оптимизация концентрации белка и первичного титрования антител в одной пластине асссе, а также предоставление удобных шаблонов для подготовки образцов. Также описаны методы измерения pan TDP-43 и фосфорилированного производного TDP-43 в цитозоле тромбоцитов в рамках инициативы по разработке биомаркеров на основе крови для нейродегенеративных заболеваний.
Введение
Общая цель CEI, как описано здесь, заключается в предоставлении обновленного поэтапного протокола для анализа целевых белков в человеческих тромбоцитов. Назначение молекулы подписи на основе крови является одной из важнейших задач в области развития биомаркеров при нейродегенеративных заболеваниях человека, таких как болезнь Альцгеймера (АД), боковой амиотрофический склероз (ALS), фронтотемпоральный лобар дегенерации (FTLD), болезни Паркинсона (PD), включение тела миозит (IBM), и другие белковые агрегации соответствующих патологических условий. Обнаружение мельчайших количеств таких фирменных белков в больших объемах крови со многими интерферинговыми агентами является сложной задачей. Поэтому специфичность, чувствительность, способность обрабатывать большое количество образцов и воспроизводимость выбранного метода имеют решающее значение.
Человеческие тромбоциты могут служить средой для выявления и присвоения потенциальных биомаркерных белков для нейродегенеративных заболеваний. Тромбоциты предоставляют возможность служить суррогатной первичной клеточной моделью, которая отражает некоторые особенности нейрональных клеток1,2,3. Есть определенные особенности, которые делают тромбоциты одним из предпочтительных средств для анализа биомаркеров кандидатов белков и их химических производных. Во-первых, тромбоциты можно легко приобрести с помощью менее инвазивного подхода путем сбора крови от доноров (т.е. венипунктура) или в больших объемах из общинных банков крови. Во-вторых, тромбоциты можно легко изолировать от всей крови с минимальными подготовительными работами в минимально оборудованных лабораториях4,5. В-третьих, тромбоциты не имеют ядер; поэтому, они являются хорошей моделью ячейки для изучения изменений в метаболизме без транскрипционной регуляции. В-четвертых, содержание биомолекулы тромбоцитов инкапсулировано; таким образом, микросреда тромбоцитов защищает свое содержимое от веществ, мешающих сыворотке(т.е. протеаз). В-пятых, обогащенная тромбоцитами плазма может храниться при комнатной температуре в течение 7-8 дней, не теряя метаболической активности. Таким образом, тромбоциты обеспечивают рабочую модель, в которой внешние факторы минимизированы и контролируются.
Традиционные методы иммуноанализа, такие как иммуноблоттинг (например, западный промотирование) и связанный с ферментами иммуносорбент (ELISA), более широко используются в специфическом анализе белка. Однако эти два метода имеют ряд недостатков, включая несколько шагов анализа, потребность в опасных химических веществах и реагентах, большой размер выборки, проблемы с воспроизводимостью анализа и межзапускные различия в данных. Это побудило к разработке метода, который является более простым с меньшим количеством шагов и достижимым в относительно короткий период. Хотя классическая западная техника поместья останется популярным лабораторным методом, ее многоступенчатая процедура, поставки, токсичные отходы (т.е. акриламид, метанол и т.д.) и время исследования становятся менее желательными при выполнении высокопроизводительных количественных анализ белка.
Автоматизированный подход CEI постепенно становится методом выбора для лабораторий, которые проводят высокопроизводительные белковые анализы6. CEI устраняет необходимость в гелях, гелеэлектрофореза аппаратов, мембран, электрофорезиза и электро-передачи устройств, и более физического поражения обработки. Если разработан хорошо, анализ CEI должен быть завершен в пределах примерно 3,5 ч, включая количественный анализ данных, электроферограмму качества публикации и графики со статистическим анализом. Еще одним превосходством системы CEI является ее требование 10x-20x меньше концентрации белка, что делает его идеальным для использования в человеческих образцах, используемых в клинических испытаниях7,8.
Наиболее важной частью CEI является оптимизация условий ассеа для каждого антитела, приобретенного у различных поставщиков, тип антител (моноклональные против поликлональных), оптимальные концентрации белка, подготовка образца, температура денатурации образцов и электрофорезное напряжение, наносимое на капилляры. Мы разработали метод оптимизации формата единого асссеа для CEI, который должен быть реализован до проведения новых анализов, что позволит сэкономить время и ресурсы. Этот шаг оптимизации сопровождается автоматизированной количественной оценкой как общей, так и фосфорилированной производной трансактивации реакции ДНК/РНК связывающего белка (TARDP). Из-за своих размеров (43 kDa), аббревиатуру TDP-43 будет использоваться на всей этой бумаге. Здесь, TDP-43 белка в человека цизат тромбоцитов, полученных от больных ALS оцениваются, чтобы помочь развивать прогностические фосфорилирование значение (PPV) в качестве потенциального прогностического биомаркера.
TDP-43 является новым потенциальным кандидатом биомаркеров болезни для ALS. TDP-43 является вездесущим белком во всех нуклеадных клетках; Таким образом, функции TDP-43 во время различных нормальных клеточных событий и при нейродегенеративных заболеваниях были исследованы9,10,11,12,13,14. Хотя TDP-43 является ядерным белком15, он имеет возможность шаттла в и между ядром и цитоплазмой из-за присутствия ядерной локализации и ядерных последовательностей экспорта16,17,18,19. Цитоплазмический TDP-43 участвует в различных клеточных событиях, таких как стабильность мРНК и транспорт, стрессовая реакция, митохондриальная функция, аутофагосома20. Однако о роли фосфорилированных производных ТДП-43 известно не так много, кроме их участия в патогенезанейронейронии нейродегенеративного заболевания21.
Этот протокол иллюстрирует, как оптимизировать условия анализа для анализа содержимого TDP-43 и его фосфорилированной производной в тромбоцитах с использованием подхода CEI. Поскольку фосфорилированный TDP-43 не доступен на коммерческой основе, предлагается использовать прогностический фосфорилирование значение (PPV) для оценки профилей TDP-43 у пациентов с ОРВИ. Эта система CEI использует небольшой объем образцовой смеси (2,5-3,0 л на капилляр). Общая настройка объема асссена составляет 8,0 л на капилляр на основе протокола производителя; следовательно, исследователи могут использовать один образец смеси подготовки для двух отдельных работает. Производитель разработал протокол ассеа так, чтобы любые ошибки трубаций были сведены к минимуму, если не полностью устранены. 24 отдельных человека тромбоцитов лизат образца смеси делятся на половину объемов (т.е., 2,5-3,0 л на образец) и последовательно проанализированы те, два различных антител в течение 7 ч. Описанная здесь система CEI обеспечивает желаемую систему высокопроизводительных асссеа. Пользователи должны проверить антитела от различных поставщиков и образцы подготовки условий для целевого белка, прежде чем выполнять крупномасштабный скрининг.
протокол
Все протоколы, касающиеся обработки человеческих тромбоцитов следовать руководящим принципам как Университета Канзаса медицинский центр и Канзас-Сити университета медицины и бионауки IRB комитетов.
1. Подготовка буферов и реагентов
ПРИМЕЧАНИЕ: Подготовьте все образцы в рамках руководящих принципов производителя. Носите личное защитное оборудование (лабораторные пальто, перчатки и очки) во время этой процедуры.
- Подготовка цитрат мыть буфера путем объединения 0,941 г сахарозы (11 мм окончательной концентрации), 6,4 мл 5 M NaCl (128 мм финала), 5,4 мл 0,2 м2PO4 (4,3 м Финал), 9,4 мл 0,2 М Na2PHO4 (финал 7,5 мм), 0,352 г цитрата натрия (финал 4,8 м/с) и 0,115 г лимонной кислоты (2,4 мм финала). Отрегулируйте общий объем до 250 мл с помощью фильтра ddH2O. Фильтр с помощью фильтра 0,45 мкм и отрегулируйте рН до 6,5. Хранить до 1 года при 4 градусах Цельсия. Принесите раствор комнатной температуры (RT) перед использованием22.
- Подготовьте буфер разрыва, объединив сахарозу 250 мМ, 1 мМ EDTA и 10 мМ Tris-Cl (pH 7.4) в 100 мл конечного объема. Хранить до 1 года при 4 градусах Цельсия. Добавьте 2 зЛ коктейля ингибиторов фосфатазы (1:1000 финала) и 1 кЛ ингибиторов протеазы (1:2000 финала) в 2 мл буфера разрыва. Держите на льду до использования. Откажитесь от неиспользуемого буфера разрыва.
2. Изоляция тромбоцитов
- Сбор 8-10 мл человеческой крови в желтой крышке трубки сбора крови, содержащей кислотно-цитрат-декстроз (ACD) раствор (75 мМ тринатрия цитрат, 124 мм декстрозы, и 38 мм лимонной кислоты, рН 7,4; ACD:кровь 1:9). Аккуратно перемешайте содержимое трубки 5x-6x инвертирование вручную.
- Центрифуга труб на 200 х г в размахивая ротор ведро в течение 20 минут на RT.
- Соберите богатую тромбоцитами плазму (PRP) (3-4 мл) в коническую нижнюю трубку объемом 15 мл и оставьте около 0,5 мл PRP из буйного пальто (туманно выглядящая фракция), чтобы избежать загрязнения. Если происходит загрязнение красных кровяных телец, повторите этот шаг.
- Centrifuge образцы PRP на 1200 х г в течение 15 минут на RT.
- Вымойте гранулы тромбоцитов (P1) нежной перезагрузки в 1 мл цитрата мыть буфера и гранулы центрифугирование на 1200 х г в течение 15 минут на RT.
- Сохраните чистые гранулы тромбоцитов. Отбросьте супернатант.
- Отрежь гранулы тромбоцитов в 600 л буфера разрыва, содержащего ингибиторные коктейли.
- Сноуксите подвеску тромбоцитов с помощью звукового анатора. Поместите образец в мини-ведро со льдом. Установите звуковой ореол при установке 3 на 20 с в непрерывном режиме.
ПРИМЕЧАНИЕ: Убедитесь в том, чтобы очистить зонд с 10% отбеливателя следуют дистиллированной воды. - Centrifuge sonicated образцов на 20000 х г в течение 30 мин при 4 кв С, чтобы удалить membranous фракций. Аликвотные супернатанты в 60 qL и хранить при -80 градусах по Цельсию. Избегайте повторных циклов оттаивания/замораживания цитозолических фракций.
3. Подготовка к CEI
ПРИМЕЧАНИЕ: 100 л человеческого лизата тромбоцитов было объединено с пациентами СЗС (n No 8-10), а здоровые предметы (n No 8-10) были отдельно объединены и использованы для оптимизации асссея.
- Заполните внутренние шаблоны для макета CEI(таблица 1)и подготовки образца(таблица 2). Таблица подготовки образца смеси является динамической и автоматически вычисляет, сколько объем должен быть удален из источника.
ПРИМЕЧАНИЕ: При требуемом объеме источника, введенном в динамическую таблицу-2, автоматически рассчитывается объем буфера 0,1 X. - Предварительно обозначите 25 0,2 мл ПЦР-трубки с капиллярами #1-#25 и поместите их в стойку ПЦР. Установить на льду.
- Предварительно метка 0,6 мл микроцентрифуговых труб: по одному для каждого первичного антитела и разбавления (при необходимости), один для буфера образца 0,1x, один для люминола-S/перекиси, и один для каждого образца, который будет разбавлен (при необходимости). Поместите их на лед в трубе стойки.
- Выняйте образец буфера, мыть буфер, одна пластина, и картридж, предусмотренных в CEI разделения 12-230 kDa мастер комплект разделения модуля.
- Из холодильника 4 кК, вынуть антитела разбавления буфера, первичные антитела, вторичные антитела, люминол, перекись водорода, и стандартный пакет. Поместите все реагенты на лед, кроме стандартной упаковки, которая остается на RT.
ПРИМЕЧАНИЕ: Реагенты из стандартных пакетов лиофилизированы и запечатаны крышкой из фольги. Они должны быть вращаться вниз кратко с помощью мини-центрифуги перед открытием, чтобы уменьшить потерю продукта. Чтобы открыть, реагент трубы могут быть пронзили кончиком пипетки или вытащил из угла. - Чтобы подготовить 400 мМ DTT, добавьте 40 qL деионизированной воды в прозрачую трубку, содержащую DTT.
- Чтобы подготовить 40 л/с флуоресцентного 5x мастер-микса, добавьте 20 qL 10x буфера образца и 20 qL подготовленного раствора DTT 400 мм к розовой трубке, представленной в комплекте.
- Для подготовки биотинилатированной лестницы добавьте 16 qL деионизированной воды, 2 зл и 10x буфер айберс атакжем готовый 400 мМ DTT к белой трубке, представленной в комплекте. Смешайте осторожно и передать в 0,2 мл ПЦР трубку для денатурирования.
- Подготовьте буфер образца 0,1x, добавив 1,5 л 10-х образцового буфера и 148,5 л деионизированной воды к микроцентрифуге 0,6 мл. Вихрь смешать и разместить на льду.
- Подготовьте желаемые разбавления антител. Добавьте разбавитель антител в объемах, обозначенных для каждой предварительно обозначенной микроцентрифуговой трубки. Если объемы идентичны, используйте технику обратного пипетки23; если нет, предварительно промыть кончик пипетки перед раздачей.
ПРИМЕЧАНИЕ: В этом ассее были использованы антитела a-TDP-43 и a-p (S409/410-2) TDP-43. Анти-ERK антитела были использованы для внутреннего контроля, чтобы убедиться, что ассеа компоненты работают. - Выполните обратный пайпеттинг для разбавления антител, как описано ниже. Кроме того, дополнительную информацию можно найти в литературе24.
ПРИМЕЧАНИЕ: Обратный метод пипетки является предпочтительным при распределении небольших последовательных объемов решений23. Этот метод предлагает некоторые преимущества: (i) обеспечение точного объема, (ii) устранение реагента, вспеняющегося в наконечнике, и (iii) идеально подходит для реагентов небольшого объема (Злт;5 л), вязких растворов, сурфактантных решений и растворов с высоким давлением пара.- Положите правильный наконечник в пипетку и нажмите поршень до второй остановки (Шаг-2). Погрузите кончик трубы на несколько миллиметров в раствор. Медленно отпустите поршень, чтобы заполнить кончик трубы с раствором, в то время как кончик все еще погружен в раствор. Удалите кончик из раствора и осторожно прикоснитесь к краю резервуара реагента, чтобы избыток жидкости, оставшейся на внешней стороне кончика, был удален.
- Распределите раствор, нажав поршень до первой остановки (Шаг-1). Не распределяйте оставшийся раствор в кончике.
- Опустошить оставшийся раствор в наконечнике к резервуару реагента, прижав поршень ко второй остановке (Шаг-2). Отпустите поршень в готовое положение для следующего шага трубач.
- Добавить необходимые антитела в объемах, предназначенных для каждой предварительно помечены микроцентрифуговых трубки (Таблица 1) Не предварительно промыть кончик трубы: добавить его непосредственно в разбавитель и промыть кончик несколько раз, чтобы удалить антитела. Поместите трубки на лед.
- Чтобы подготовить образец-микс CEI, выполните шаги, перечисленные ниже для пЦР-труб с надписью cap no2 через крышку 25: Это происходит в том же порядке, что и в таблице 1.
- Откройте все трубки, добавьте 1,6 qL aliquots флуоресцентного 5x образец буфера для каждой трубки с помощью обратного метода pipetting, а затем закрыть каждую трубку ПЦР при добавлении 5x буфера, чтобы свести к минимуму потерю образца.
- Откройте все трубки, добавьте 0.1x буфер образца в томах, обозначенных в таблице 2 для каждой трубки, а затем закройте сразу же после этого. Если объемы идентичны, используйте технику обратного пипетки. Если нет, предварительно промыть наконечник пипетки перед распределением 0.1x буфера образца.
- Откройте все трубки, добавьте образец белка в объемах, обозначенных в таблице 2 для каждой трубки, а затем закройте сразу же после этого. Если объемы идентичны, используйте технику обратного пипетки. Если нет, предварительно промыть наконечник пипетки перед распределением 0.1x буфера образца.
- Кратко центрифуга все ПЦР трубки в скамейке центрифуги (13000 х г на 30 с), Флик / вихрь ПЦР трубки для смешивания, а затем повторить центрифуги.
- Перенесите все пЦР-трубки в термоциклс с нагретой крышкой. Образцы денатурации при определенной температуре и продолжительности (т.е. 95 градусов по Цельсию в течение 5 мин; 70 градусов по Цельсию в течение 10 мин).
ПРИМЕЧАНИЕ: Температура денатурации и продолжительность должны быть оптимизированы для целевого белка. - Повторите шаг 3.12.4.
- Верните все пЦР-трубки в стойку трубки и поместите на лед.
- Во время денатурирования шага подготовьте раствор разработки (1:1 люминол-S: пероксидный раствор), затем добавьте 200 л люминола-S и 200 л перекиси. Место на льду.
- Чтобы загрузить предварительно заполненную пластину CEI с подготовленным выше образцом, распределите реагенты и образцы в пластину ассея, показанную в макете ассеа(рисунок 1). Избегайте введения пузырьков воздуха.
ПРИМЕЧАНИЕ: Если объемы и раствор идентичны, используйте технику обратного трубачирования. Если нет, предварительно промыть наконечник пипетки перед дозированием и не изгонять остаток в пластине хорошо, используя вторую остановку вкладки на пипетке. Модуль разделения 12-230 kDa может содержать цветное руководство по загрузке пластин. Поместите это руководство под пластиной, добавляя реагенты и образцы в колодец, что визуально помогает при загрузке образца. Руководство по загрузке тарелок также можно загрузить с веб-сайта компании.- В строке E добавьте 15 л люминола: перекись смеси к каждому колодцу.
ПРИМЕЧАНИЕ: В идеале, подготовить этот реагент непосредственно перед использованием и добавить к каждому хорошо. Если это не удобно, эта смесь может быть подготовлена не более чем за 30 минут до загрузки пластины. - В строке D, к хорошо D1, добавьте 10 Зл стрептавидина-HRP.
- В строке D, к скважинам D2-D25, добавьте 10 зЛ назначенных вторичных антител.
- В строке B, к каждому колодцу, добавьте 10 зл антител разбавителя.
- В строке C, к хорошо C1, добавить 10 зл антитела разбавитель.
- В строке C, к скважинам C2-C25, добавьте 10 зЛ назначенных первичных антител.
- В строке А, к колодцу A1, добавьте 5 зЛ биотинилатной лестницы из трубки ПЦР #1.
- В строке А, к скважинам A2-A25, добавьте 3 цЛ образца, пЦР-трубки #2-#25 в соответствующие скважины #2-#25.
- Добавьте 500 юаней буфера для мытья к каждому назначенному буферу мытья хорошо.
- Центрифуга пластины в течение 5 мин на 1000 х г на RT.
- В строке E добавьте 15 л люминола: перекись смеси к каждому колодцу.
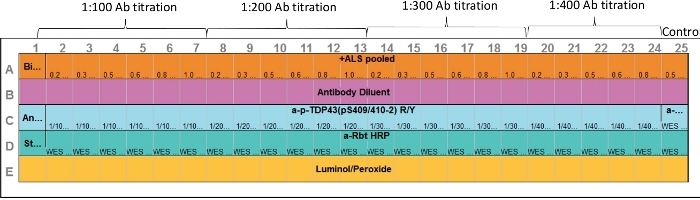
Рисунок 1: Планировка ассеев. Как первичные антитела, так и оптимизация образца белка в цель могут быть выполнены в одном анализе. Капилляры 2-7, 8-13, 14-19 и 20-24 представляют различные концентрации белка и первичного диапазона антител. Капилляр 25 представляет собой положительный контроль. Использовалось анти-ERK антитела; однако, любой соответствующий положительный контроль может быть включен. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
4. Выполнение CEI на тарелке 1
- Сначала включите анализатор CEI(Таблица материалов),затем включите компьютер. Откройте программное обеспечение (Таблица материалов)
- Подключите анализатор к онлайн-системе(Таблица материалов). Это необходимый шаг для сбора данных о запуске для целей съемки проблем и восстановления данных.
- Нажмите на инструмент из верхнего левого меню, а затем нажмите Connect. Выберите серийный номер инструмента, который отображается как всплывающее меню. Нажмите Подключите.
- Выберите вкладку«Assay»и выберите New Assay или выберите сохраненный шаблон.
- Параметры ввода -см. Параметры(таблица 1)или изменение шаблона в настоящее время. Сохраните имя и местоположение файла.
- Убедитесь, что индикатор мигающего синего цвета в анализаторе остается сплошным синим.
- Коснитесь кнопки серебряного металла поверх оранжевой двери, чтобы открыть.
- Тщательно удалите капиллярный картридж из упаковки. Вставьте капиллярный картридж, как описано в протоколе производителя. Если правильно установлен, внутренний свет превращается в "синий".
- Снимите защитную печать с пластины для ассеа. Визуально наблюдайте за предварительно заполненными колодцами для пузырьков воздуха. При наблюдении, поп их с небольшой наконечник пипетки (Длинный вал P10 трубчатый наконечник работает хорошо).
- Загрузите держатель пластины, поместив пластину ассеи и закройте дверь. В компьютере нажмите кнопку «Пуск».
- Поместите поднос содержащего чувствительные к температуре реагенты и образцы в темноте при температуре 4 градусов по Цельсию до готовности к подготовке второй предварительно заполненной пластины.
- Оставьте реагенты/поставкы при комнатной температуре для второй пластины.
5. Выполнение CEI на тарелке 2
ПРИМЕЧАНИЕ: Эта пластина установлена для анализа фосфорилированных уровней TDP-43.
- Удалите ледяной поднос, хранящийся при 4 градусах По Цельсию, и поместите его на скамейку, 1 ч до предполагаемого времени завершения первой пластины. Извлеките вторую тарелку и картридж.
- Подготовьте любые разбавления антител, необходимые для второго запуска, и храните их на льду. Приготовьте свежий раствор люминола-S: перекись (шаг 3.12.8 выше).
- Ремикс и кратко re-центрифуги образца смеси и реагентов, необходимых для загрузки предварительно заполненные пластины. Загрузите вторую пластину в соответствии с рисунком 1. Загрузите раствор антител TDP-43 в рядных скважинах С.- P (S409-410-2).
- Когда первый запуск будет завершен, отбросьте первую пластину и картридж. Снимите картридж и поместите в острый контейнер для утилизации. Храните наклейки с пластины и картриджа для справочных целей.
- Закройте файл программного обеспечения и переберите тот же шаблон. Программное обеспечение будет запоминать настройки из предыдущего запуска. Вносить любые изменения в аннотацию по мере необходимости (т.е. изменяя первичное антитело).
- Повторите шаги 4.8-4.10. Убрать все 12-230 kDa мастер комплект разделения модуля реагентов и поставок
- Отбросьте оставшийся образец-микс CEI, разбавления антител, буфер образца 0.1x и люминол-S: перекись смешивается в соответствии с правилами университета.
6. Анализ данных
- После завершения выполнения убедитесь, что следующие проверки качества выполняются.
- В программном обеспечении выберите значок Show Standards и вкладку Graph View. Проверьте все 25 капилляров на пиковые выравнивания к внутренним размерам флуоресцентных маркеров. Исправьте несоответствия, выбрав Force Standard или правое нажатие на неправильный пик, а затем выбрав Not a Standard. Выполните эту проверку для каждого нового капилляра.
- Нажмите на «Образцы» и значок «Одно- представление». Выберите капиллярную #1 (биотинилатированную лестницу) во вкладке эксперимента. Нажмите на пик в Graph View и выберите Удалить пик, если неправильный выбор пика выполняется программным обеспечением.
ПРИМЕЧАНИЕ: В качестве примера, 12-230 KDa биотинилатной лестнице будет показывать размер пики на 12 kDa, 40 kDa, 66 kDa, 116 kDa, 180 kDa, и 230 kDa. Размер пиков образца будет неверным, если этот шаг не будет выполнен и будет генерировать неточные результаты. - Просмотр электрофоретической киноики и обратите внимание, если во время выполнения произошла какая-либо ненормальная миграция.
- Полученные данные (например, таблица пиков, включая молекулярный вес, пиковую зону, пиковую высоту и сигнал к шуму (S/N), необходимые для дальнейших расчетов. В верхнем правом углу окна Graph имеется инструменты аннотации графиков для предоставления дополнительной информации о графике.
Результаты
Оптимизация концентрации цитосолика цитосоликического белка и первичного титрирования антител
Важно установить линейный динамический диапазон цитозолических белков тромбоцитов в анализе, так как изменения в сигнале прямо пропорциональны изменениям белка в цитозоле тромбоцитов. Использование цельной смеси цизата тромбоцитов в анализе может снизить интенсивность сигнала целевых белков (TDP-43 и P (S409-412) TDP-43) и способствовать высокому фоновому сигналу. Таким образом, в этом ассее, ясный супернатант был использован (цитозолическая фракция) после разрыва тромбоцитов(рисунок 2).
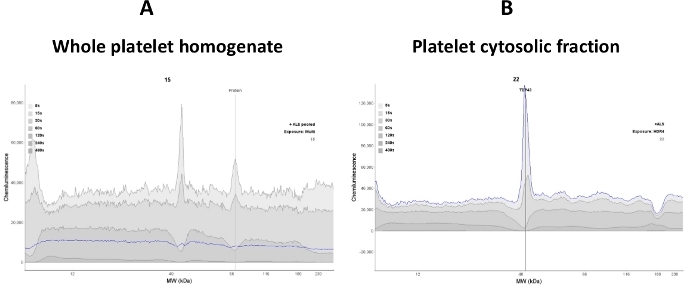
Рисунок 2: Ясность сигнала зависит от качества образца. (A) Целый тромбоциты лизат ногоменат мешает анти-TDP-43 связывания антител; поэтому наблюдалась шумная электроферограмма. (B) Тромбоцитциосочная фракция была получена от подвергания всего лисата центрифугации (16000 х г в течение 30 мин). Большинство мембранных белков были удалены; следовательно, анти-TDP-43 антитела связывания с tDP-43 белка была повышена (синяя линия след). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Линейный динамический диапазон концентрации цитозоля цитозоля был установлен на уровне 0,2-0,8 мг/мл. Шаблон ассея был принят таким образом, что как концентрация белка и первичного титротела были в состоянии быть выполнены в одном анализе(Рисунок 3).
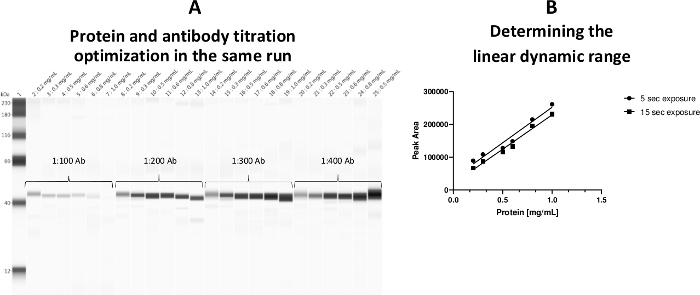
Рисунок 3: Линейный динамический диапазон концентрации цитозоля цитозоля. (A) И концентрации протеина и titrations антитела были оптимизированы в одной плите во время такого же бега. (B) Линейный рабочий диапазон (0,2-0,8 мг/мл) для белка был установлен. Нагрузка протеина 0.5 мг/мл была помечена антителами a-ERK как положительный контроль (капилляр 25). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Следует отметить, что содержание глицерола в пробной подготовительной трубке должно быть менее 20% (окончательный), в противном случае высокая концентрация глицерола отрицательно скажется на первичном связывании антител.
Определение оптимального времени экспозиции
В более старой версии программного обеспечения оптимальное время воздействия должно было быть определено путем построения пиковой зоны против концентрации белка (мг/мл). Новая версия предоставляет новый инструмент под названием высокий динамический диапазон (HDR) профиль обнаружения(рисунок 4). Использование панели изображений предоставило возможность просмотреть все время экспозиции (т.е. 5 с, 15 с, 30 с, 60 с, 120 с, 240 с, 480 с) вместе. Компьютерное программное обеспечение проанализировало все время экспозиции и автоматически определило лучшее время экспозиции (HDR). Профиль обнаружения HDR обеспечил значительно более широкий динамический диапазон из-за большей чувствительности CEI, что означает более лучшее обнаружение и количественную оценку по сравнению с большим диапазоном концентрации выборки. Тем не менее, пользователи по-прежнему имеют возможность выбрать любое время экспозиции, которое удовлетворяет экспериментальной цели. Используя эту функцию, было найдено оптимальное время воздействия белка TDP-43. Пик представляет собой оптимальное время экспозиции(рисунок 4A). Одно время экспозиции (4 с) было определено для этого антитела после рассмотрения всех девяти раз экспозиции в диапазоне от 1-512 с (Рисунок 4B).

Рисунок 4: Профиль обнаружения высокого динамического диапазона (HDR) для целевого белка. (A)Пик белка TDP-43 представляет собой оптимальное время воздействия для целевого белка. a-TDP-43 Ab титрация была 1:300, а концентрация цитозоля цитозоля была 0,5 мг/мл. Программно-определяемая синяя линия указывает на оптимальное время экспозиции. (B) Эта цифра представляет собой пользователь-определенный один времени экспозиции (4 с) после рассмотрения всех девяти раз экспозиции в диапазоне от 1-512 с. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Уровень TDP-43 у человека цитозолтром тромбоцитов больных ОРВ
Проведено развитие биомаркера базы крови. Используя оптимизированные условия анализа, тромбоциты лизат цитозолические фракции, полученные от больных ALS были проанализированы с помощью двух наборов антител (т.е. анти-TDP-43 "Pan" антитела, антитела, которое распознает фосфорилированные производные белка TDP-43; здесь, a-P S409/410-2" TD-3). В этой демонстрации представлены специфические заболевания TDP-43 и его фосфорилированая производная(рисунок 5).
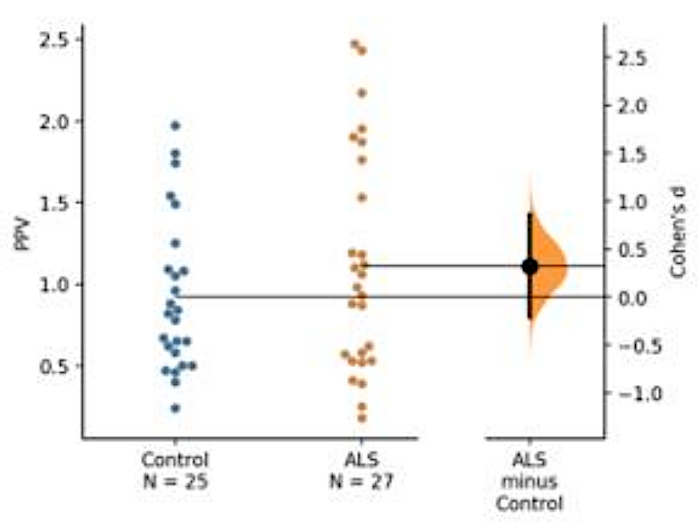
Рисунок 5: Представление значения прогнозного фосфорилирования (PPV) TDP-43. Абсолютное количество фосфорилированного TDP-43 и пан TDP-43 только не показали большой разницы между БАС и контрольных групп. Тем не менее, PPV указал на небольшое увеличение когорты ALS, хотя не было статистической разницы между этими двумя группами из-за недостаточного числа испытуемых (ALS No 25, контроль No 27). Низкое значение коэна между средствами ALS и контрольной группой показало низкий размер эффекта между двумя группами из-за небольшого размера выборки (контроль No 25, ALS No 27). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Общий tDP-43 был количественно с помощью кривой калибровки(рисунок 6)

Рисунок 6: Стандартная кривая калибровки. Коммерчески закупленные рекомбинантные концентрации белка TDP-43 использовались для построения стандартной кривой. Каждая из данных представляет собой среднее значение трипликов. Интенсивность протеиновых полос была зависима концентрацией (Inset). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Количественная оценка фосфорилированного белка TDP-43 была невозможна из-за коммерческой недоступности этого белка. Вместо этого было установлено прогнозируемое значение фосфорилирования (PPV), определяющее процент фосфорилированных видов TDP-43. PPV был определен из двух последовательных анализов CEI для одного и того же образца с использованием следующего уравнения.

Внутри- и межзапуске вариативность асссея были протестированы в объединенных человеческих тарциосоцитов ALS цитосолико фракций(рисунок 7)
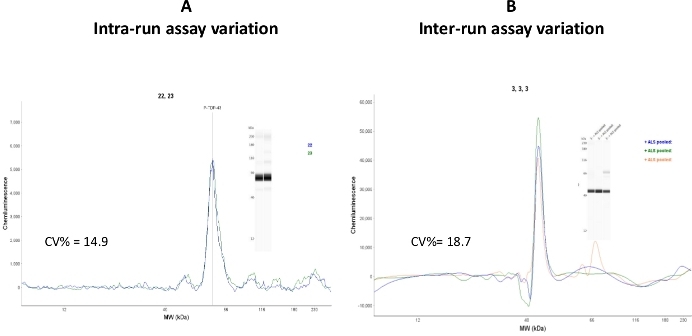
Рисунок 7: Вариации асссея. (A) Два капилляра, загруженные одним и тем же образцом, были проанализированы CEI, и внутризапуск анализа был рассчитан как CV% и 14,9. (B) Один и тот же образец был проанализирован на трех различных дней анализа и в трех различных асссеа работает. Межзапускная вариация асссеа была рассчитана как CV% и 18,7. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Несмотря на то, что внутриперспективевые значения коэффициента (капиллярные значения) коэффициента снизились в приемлемом диапазоне (CV% - 14,9), значение межпробега было относительно высоким (CV% - 18,7). Это интерпретируется, что это изменение может быть связано с использованием капиллярных картриджей и образца пластин из разных партий. Рекомендуется, чтобы исследования воспроизводства были выполнены в компонентах CEI, которые имеют один и тот же номер лота.
Таблица 1: шаблон загрузки пластин CEI. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Интерактивный шаблон подготовки к смеси образца. После ввода в запас концентрации белка из неизвестных образцов, интерактивные клетки будут автоматически вычислять, сколько объем должен быть использован для подготовки образца смеси. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Капиллярный электрофоретический иммуноанализ в настоящее время является методом выбора для анализа образцов с высокой пропускной стоимостью и скрининга лекарственных препаратов25. Небольшие объемы выборки, хорошо оптимизированные компоненты асссе, удобная для пользователя платформа и приборы, расходы реагентов и низкий процент резюме являются основными преимуществами26,27. Хотя существует несколько методов разделения белков в различных условиях анализа, описанный здесь CEI на основе антител может быть адаптирован небольшими лабораториями, которые занимаются разработкой биомаркеров на основе крови. Используемая здесь технология асссеирования CEI обеспечивает надежные, воспроизводимые и чувствительные измерения для TDP-4328 и его фосфорилированной производной5.
Система CEI также обеспечивает мультиплексный выбор анализа TDP-43 и его фосфорилированных производных одновременно и обеспечения прямой количественной оценки целевого белка, если имеется очищенный или рекомбинантный целевой белок. Полнометражный рекомбинантный белок TDP-43 доступен на коммерческой основе; однако рекомбинантный фосфорилированный производный TDP-43 не является. Поскольку фосфорилированный TDP-43 не является коммерчески доступным, для оценки профиля TDP-43 у пациентов с ОРВив было внедрено значение прогнозного фосфорилирования (PPV). Пан TDP-43 и фосфорилированные количества TDP-43 постоянно маркировались флюорофором; таким образом, профиль TDP-43 остается неизменным с количественной единицей или без нее (т.е. ng/mL, pg/mL и т.д.). Хотя определение абсолютного количества TDP-43 и его фосфорилированных производных (т.е. P (S409-410-12) TDP-43 обеспечивает более количественное измерение, расчет PPV устраняет необходимость рекомбинантного фосфорилированного TDP-43 для стандартизации, так как он не является коммерчески доступным.
CEI предоставляет несколько контрольно-пропускных пунктов на платформе ассеидля для точного определения проблемы в случае сбоя в ассе. Это устраняет препятствия и обеспечивает лучший экспериментальный дизайн. Процедура асссеа полностью автоматизирована, за исключением заполнения образца пластины. Это существенная особенность по сравнению со стандартным западным анализом промотирования. Эта функция обеспечивает согласованность от запуска к перспективе. Хотя каждая лаборатория имеет уникальные стандартные операционные процедуры, важно придерживаться практики, которые сводят к минимуму человеческие ошибки. Например, очень важно подготовить люминол-S/ перекись смеси непосредственно перед пластиной нагрузки, так как добавление перекиси в люминол начинает ферментативную реакцию и потребляет субстрат люминола. Загрузка образцов и первичных/вторичных антител в плитные колодцы без пузырьков воздуха также являются критически важными шагами.
Кроме того, поскольку пластины скважины малы по объему и нет места между скважинами, пользователи должны соблюдать осторожность во время pipetting, который является наиболее важным шагом, поскольку все остальное автоматизировано. Порядок загрузки образцов, антител и других реагентов важен для согласованности асссеа(рисунок 1). Процесс приготовления пластины занимает около 40-45 мин. Поэтому рекомендуется сначала загрузить пластину необходимыми компонентами ассеиума и подготовить люминол-S/перекись смеси непосредственно перед пипеткой. Таким образом, существует последовательная последовательность добавления реагента, и последовательная сила сигнала люминесценции будет достигнута. Не рекомендуется использовать просроченный люминол-S/перекись, так как это в первую очередь влияет на прочность перекиси. Недавний прогресс в внедрении системы сплит-буфера, включая диапазон совместимость химических веществ и моющих средств, повысил качество анализов и дал более воспроизводимые и предсказуемые результаты. Теперь, новый комбо-анализатор от того же производителя обладает функцией для анализа образцов помечены хемилюминесценции и флуоресценции конъюгированных антител в том же запуске. Эта новая функция устраняет необходимость последовательного запуска двух отдельных пластин и устраняет забегов.
Пластины ассеа должны храниться при температуре окружающей среды. Если он выбран, чтобы держать ассеа пластины в холодильнике 4 кв, пластины должны быть вывезены в ночь перед проверкой и доведены до температуры окружающей среды. Неправильно загруженные образец скважины должны быть широко (4-5 раз) промываются с буфером, предусмотренным в комплекте, прежде чем добавить правильный образец. Каждый первичный антитела и биологические образцы уникальны; поэтому, антитела / оптимизация белка должна быть выполнена перед анализом образцов для целевых белков в биологических жидкостях.
Здесь основное время инкубации антител было установлено в течение 30 минут по умолчанию. Если сигнал слабый, пользователи должны рассмотреть вопрос об увеличении времени первичной инкубации антител до достижения желаемой силы сигнала без флуоресценции сигнала выгорания. Для человеческих тромбоцитов были подготовлены и использованы объединенные образцы пациентов для оптимизации. Объединение образцов лучше представляет собой вариацию между целевыми биомолекулами. Для CEI рекомендуется использовать четкие супернатанты, а не тотальный лизат или тотальный гоменат.
Высокая концентрация белка в цельной смеси лизата тромбоцитов может уменьшить соотношение сигнала к шуму(рисунок 2). Следует избегать повторных циклов замораживания-оттепели образцов, так как это отрицательно сказывается на первичных связываниях антител. Ингредиенты лизатного буфера имеют важное значение, так как некоторые реагенты не совместимы с CEI29. Перед подготовкой образца рекомендуется перепроверить перечень совместимых реагентов, представленных на сайте производителя. Это ограничение системы, которая не допускает высоких условий строгости для подготовки образца. Рекомендуется оптимизировать параметры бега анализа (т.е. первичного разбавления антител, концентрации белка, времени инкубации первичных антител и т.д.) с использованием объединенных образцов для последующего анализа отдельных образцов.
Раскрытие информации
Авторы заявляют, что никаких конкурирующих финансовых интересов, кроме ProteinSimple, Inc., покрывали стоимость публикации этой рукописи.
Благодарности
Это исследование было организовано интрамуральным грантом, присуждаемым А.А. Эта работа была поддержана грантом CTSA от NCATS, присужденным Медицинскому центру по граньрам Университета Канзаса: Институту клинических и трансляционных исследований Хартленда (#UL1TR606381). Содержание исключительно несет ответственность авторов и не обязательно отражает официальные взгляды NIH или NCATS. Мы благодарны за Университет Канзаса Медицинский центр ALS клиники личного для получения IRB утверждения для сбора образцов крови от здоровых добровольцев и больных ALS. Авторы благодарят Эмре Агбаса за коррективы рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 12-230 kDa Separation kit | ProteinSimple | SM-W004 | Contains pre-filled assay plate and 25-channel capillary cartridge |
| 3000G Thermocycler | Techne | FTC3G/02 | We used this thermocylcer for heating the sample mix |
| Anti-Mouse detection kit | ProteinSimple | 042-205 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-P(S409-410) TDP-43 antibody | ProteinTech | 22309-1-AP | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-P(S409-412) TDP-43 antibody | CosmoBio-USA | TIP-PTD-P02 | Primary antibody that recognizes phosphorylated TDP-43 |
| Anti-Rabbit detection kit | ProteinSimple | DM-001 | Includes HRP-conjugated secondary antibody, buffer, luminol reagent, molecular weight marker |
| Anti-TDP-43 (pan) antibody | ProteinTech | 10782-2-AP | Primary antibody that recognizes whole TDP-43 protein |
| Compass for SimpleWestern (SW) | ProteinSimple | Ver.4.0.0. | Compass for SW is the control and data analysis application for SimpleWestern instruments |
| Sonic Dismembrator; Model100 | Fisher Scientific | Sonicator. Used to rupture the cell membrane. This model is discontinued (Model XL2000-350) | |
| Table top centrifuge | Eppendorf | 22625004 | Model# 5810 with swinging plate bucket |
| Wes analyzer | ProteinSimple | 55892-WS-2203 | Performs the capillary gel electrophoresis |
Ссылки
- Blair, P., Flaumenhaft, R. Platelet alpha-granules: basic biology and clinical correlates. Blood Reviews. 23 (4), 177-189 (2009).
- Mercado, C. P., Kilic, F. Molecular mechanisms of SERT in platelets: regulation of plasma serotonin levels. Molecular Interventions. 10 (4), 231-241 (2010).
- Goubau, C., et al. Regulated granule trafficking in platelets and neurons: a common molecular machinery. European Journal of Paediatric Neurology. 17 (2), 117-125 (2013).
- Basu, S. S., et al. Human platelets as a platform to monitor metabolic biomarkers using stable isotopes and LC-MS. Bioanalysis. 5 (24), 3009-3021 (2013).
- Wilhite, R., et al. Platelet phosphorylated TDP-43: an exploratory study for a peripheral surrogate biomarker development for Alzheimer's disease. Future Science OA. 3 (4), 238 (2017).
- Worth, A. J., et al. LC-MS Analysis of Human Platelets as a Platform for Studying Mitochondrial Metabolism. Journal of Visualized Experiments. (110), e53941 (2016).
- Statland, J. M., et al. Rasagiline for amyotrophic lateral sclerosis: A randomized, controlled trial. Muscle and Nerve. 59 (2), 201-207 (2019).
- Charytan, D. M., et al. Safety and cardiovascular efficacy of spironolactone in dialysis-dependent ESRD (SPin-D): a randomized, placebo-controlled, multiple dosage trial. Kidney International. 95 (4), 973-982 (2019).
- Ugras, S. E., Shorter, J. RNA-Binding Proteins in Amyotrophic Lateral Sclerosis and Neurodegeneration. Neurology Research International. , 432780 (2012).
- Amador-Ortiz, C., et al. TDP-43 immunoreactivity in hippocampal sclerosis and Alzheimer's disease. Annal of Neurology. 61 (5), 435-445 (2007).
- Baloh, R. H. TDP-43: the relationship between protein aggregation and neurodegeneration in amyotrophic lateral sclerosis and frontotemporal lobar degeneration. FEBS Journal. 278 (19), 3539-3549 (2011).
- Buratti, E., Baralle, F. E. The molecular links between TDP-43 dysfunction and neurodegeneration. Advances in Genetics. 66, 1-34 (2009).
- Guo, W., et al. An ALS-associated mutation affecting TDP-43 enhances protein aggregation, fibril formation and neurotoxicity. Nature Structural Molecular Biology. 18 (7), 822-830 (2011).
- Geser, F., et al. Motor neuron disease clinically limited to the lower motor neuron is a diffuse TDP-43 proteinopathy. Acta Neuropathologica. 121 (4), 509-517 (2011).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Buratti, E., Baralle, F. E. TDP-43: gumming up neurons through protein-protein and protein-RNA interactions. Trends in Biochemical Sciences. 37 (6), 237-247 (2012).
- Fallini, C., Bassell, G. J., Rossoll, W. The ALS disease protein TDP-43 is actively transported in motor neuron axons and regulates axon outgrowth. Human Molecular Genetics. 21 (16), 3703-3718 (2012).
- Ayala, Y. M., et al. Structural determinants of the cellular localization and shuttling of TDP-43. Journal of Cell Sciences. 121, 3778-3785 (2008).
- Fiesel, F. C., Kahle, P. J. TDP-43 and FUS/TLS: cellular functions and implications for neurodegeneration. FEBS Journal. 278 (19), 3550-3568 (2011).
- Birsa, N., Bentham, M. P., Fratta, P. Cytoplasmic functions of TDP-43 and FUS and their role in ALS. Seminars in Cell and Development Biology. , (2019).
- Liachko, N. F., et al. CDC7 inhibition blocks pathological TDP-43 phosphorylation and neurodegeneration. Annals of Neurology. 74 (1), 39-52 (2013).
- Qureshi, A. H., et al. Proteomic and phospho-proteomic profile of human platelets in basal, resting state: insights into integrin signaling. PLoS One. 4 (10), 7627 (2009).
- Suominen, I., Koivisto, S. Increasing Precision When Pipetting Protein Samples: Assessing Reliability of the Reverse Pipetting Technique. American Laboratory. , (2011).
- . Pipetting tool box for life sciences Available from: https://www.mt.com/us/en/home/library/guides/laboratory-division/life-science/pipetting-toolbox-for-life-sciences.html (2019)
- Hale, L. J., et al. 3D organoid-derived human glomeruli for personalised podocyte disease modelling and drug screening. Nature Communication. 9 (1), 5167 (2018).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. Journal of Translational Medicine. 13, 182 (2015).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Fourier, A., et al. Development of an automated capillary nano-immunoassay-Simple Western assay-to quantify total TDP43 protein in human platelet samples. Analytical and Bioanalytical Chemistry. 411 (1), 267-275 (2019).
- . Compatibility, S.W.S.A.B Available from: https://www.proteinsimple.com/technical_library.html (2017)
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены